Биохимия СТ.ppt
- Количество слайдов: 25

Биохимия соединительной ткани Лекция № 34 Дмн, проф. А. И. Грицук

Виды СТ n См гистологию

Особенности строения СТ Относительно мало клеток n Много межклеточного вещества n Наличие специфических волокнистых структур - коллаген - эластин - ретикулин n

Межклеточный матрикс (ММ) n n Межклеточный матрикс – сложный комплекс связанных между собой макромолекул (белки, ГАГ) секретируемых клетками и образующих упорядоченную сеть Межклеточный матрикс вместе с различными клетками (фибробласты, хондро- и остеобласты, тучные клетки, макрофаги и др. ) находящимися в нем образует СТ

Функции межклеточного матрикса n n Образует каркас органов и тканей Является универсальным биологическим «клеем» Участвует в регуляции водно-солевого обмена Образует высокоспециализированные структуры – кости, зубы. хрящи. сухожилия, базальные мембраны и др.

Коллаген n n Коллаген основной структурный белок ММ, составляет 25 -33% всего белка организма (~6% массы тела) Коллаген группа близкородственных фибриллярных Б - основу структуры кожи, костей, хряща, сухожилий, зубов, кровеносных сосудов и др.
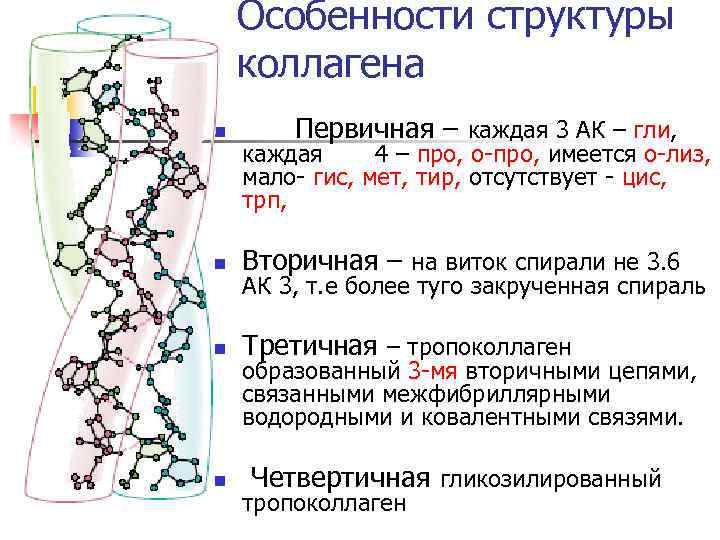
Особенности структуры коллагена n Первичная – каждая 3 АК – гли, каждая 4 – про, о-про, имеется о-лиз, мало- гис, мет, тир, отсутствует - цис, трп, n Вторичная – на виток спирали не 3. 6 n Третичная – тропоколлаген n АК 3, т. е более туго закрученная спираль образованный 3 -мя вторичными цепями, связанными межфибриллярными водородными и ковалентными связями. Четвертичная гликозилированный тропоколлаген

Ориентация волокон коллагена в тканях n – – В разных тканях ориентация коллагена различна кости и сухожилия продольная, хрящ фибриллярная сеть, в коже специфическая ориентация, в заживающей ране хаотично

Процессинг коллагена проколлаген-коллаген n n (волокно) Гидроксилирование про и лиз и образование о-про и о-лиз -Fe, O 2, аскорбат Гликозилирование о-лиз Ограниченный протеолиз – отщепление сигнального пепетида, а также N и Cконцевых пептидов Образование тройной спирали

Полиморфизм коллагена n n Ярко выраженный полиморфный белок – выделено 19 типов Вариантов а-цепей около 30 Обозначение каждого типа [а 1(I)]2 и тд Распределение по тканям различно –I тип – кожа, сухожилия, кости, плацента, артерии, печень, дентин , , IV тип – базальные мембраны, Х тип – гипертрофированные хрящи

Катаболизм коллагена n n n Тканевая коллагеназа –Zn содержащий фермент, активаторы плазмин, калликреин, катепсин В. Нарушение катаболизма ведет к фиброзу внутр органов (печени и легких). При аутоиммунных заболеваниях интенсивный б/с коллагеназы Бактериальная коллагеназа – синтезируется возбудителем газовой гангрены Скорость распада оценивают по экскреции о-про с мочой

Эластин n n n Основной белок эластических волокон, которые в большом кол-ве содержатся в коже, стенке сосудов, связках, легких Обладает резиноподобными свойствами Гликопротеид (70 k. D) 800 АК, преобладают неполярные – гли, ала, вал, много про, лиз, мало опро, нет о-лиз Лиз 3 или 4 пептидных цепей образуют десмозин или изо-десмозин, образующих поперечные сшивки Синтезируется как водорастворимый предшественник – тропоэластин, с образованием поперечных сшивок образует нерастворимую форму эластин с очень низкой скоростью обмена
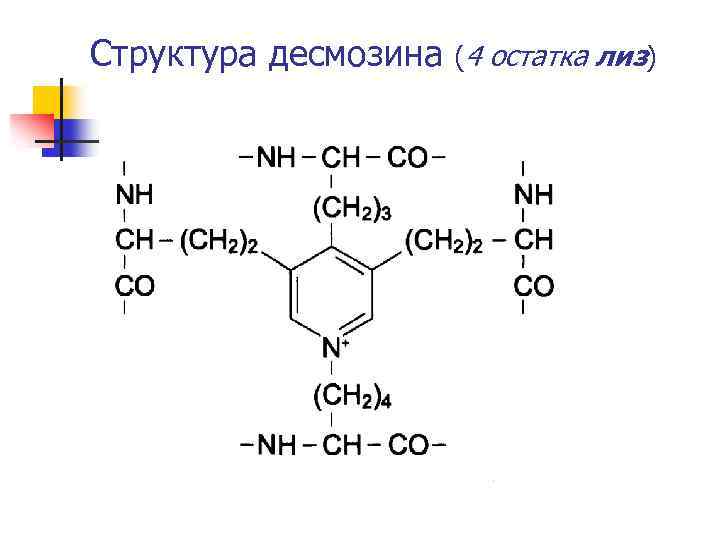
Структура десмозина (4 остатка лиз)

Цикл «растяжение-сжатие» эластина

Нарушение б/с эластина Снижение активности лизилоксидазы, формирующей десмозин наблюдается при: n 1. 2. 3. n дефиците Cu, вит В 6 наследственных заболеваниях нарушении всасывания Cu (синдром Менкеса) Манифестация: Патология ССС – аневризмы аорты, патология клапанов 2. Пневмонии и эмфизема легких 1.

Катаболизм эластина n n n В ЖКТ медленно гидролизуется эластазой (эндопептидаза) В тканях при участии эластазы нейтрофилов, которая ингибируется а-1 антитрипсином (а-1 АТ), основное кол-во которого синтезируется в печени и находятся в крови, в легких образуется в альвеолярных макрофагах При курении, дефиците а-1 АТ активируется эластаза нейтрофилов и возрастает риск развития эмфиземы легких

ГАГ (строение, метаболизм) n См учебник раздел углеводы

Протеогликаны n По форме - бутылочный ершик n Крупные протеогликаны – агрекан огромная молекула к одной ПП цепи которой присоединены до 100 цепей ХС n n В хряще основу составляет гиалуроновая к-та к которой при помощи связующего белка присоединен коровый белок Малые протеогликаны содержатся в сухожилиях, хрящах, связках, менисках – имеют небольшой коровый белок, которому присоединены 1 или 2 ГАГ
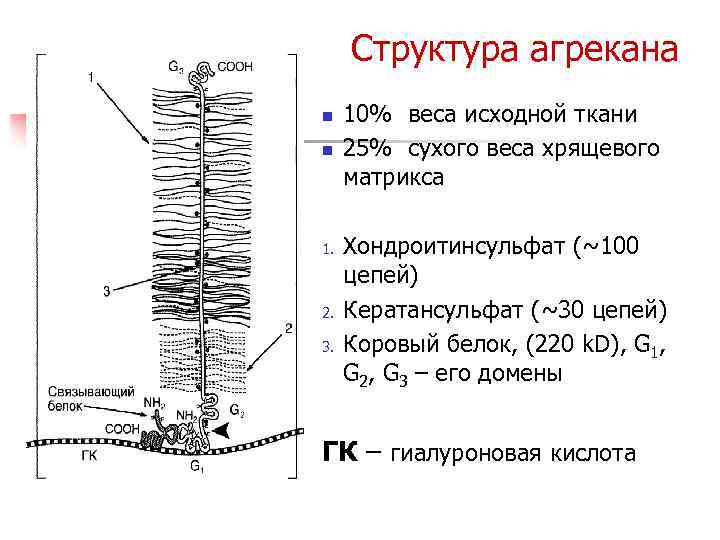
Структура агрекана n n 1. 2. 3. 10% веса исходной ткани 25% сухого веса хрящевого матрикса Хондроитинсульфат (~100 цепей) Кератансульфат (~30 цепей) Коровый белок, (220 k. D), G 1, G 2, G 3 – его домены ГК – гиалуроновая кислота

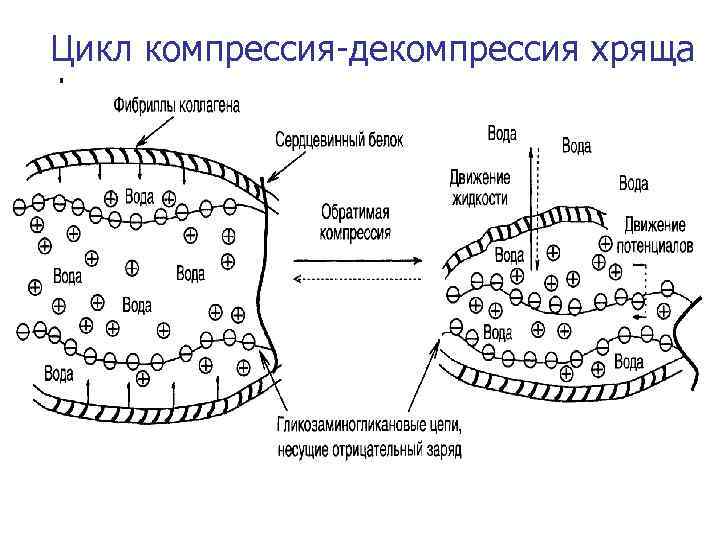
Цикл компрессия-декомпрессия хряща

Мукополисахаридозы Тяжелые наследственные болезни с нарушением деградации ГАГ в лизосомах и накоплением промежуточных продуктов В основе дефицит активности лизосомальных гликозидаз – а-L-идуронидазы (б-нь Хюрлера), β-глюкуронидазы (бнь Слая) и тд. n n n Манифестация: 1. 2. 3. 4. 5. Деформация скелета Нарушение умственного развития Поражение сосудов Помутнение роговицы Уменьшение продолжительности жизни

Специализированные белки ММ Адгезивные Б – фибронектин неколлагеновый гликопротеид, построен из 2 -х идентичных пп цепей, соединенных дисульфидными мостиками ПП цепь содержит 7 -8 доменов, специфичных к разным веществам n n коллагену, протеогликанам, гепарину и др, n выполняя интегрирующую роль Присоединяется к клеточным рецепторам – интегринам при участии белков талина, винкулина, а-актинина n В опухолевых тканях кол-во фибронектина снижено – возможная причина метастазирования


Антиадгезивные белки- играют роль в эмбриогенезе, морфогенезе, развитии ответа на повреждение n n n Остеонектин (ВМ-40, SPARC) – кислый Б, богат цис Тенасцин (антиген мышечных сухожилий) – сост из 2 -х субъединиц, похож на осьминога (гексабрахион) Тромбоспондин – связывается с Са 2+ и др. ионами, ГАГ, коллагеном, фибронектином, ламинином
Биохимия СТ.ppt