1 Уровни структ организации белков Ефременко ЕС- 15.ppt
- Количество слайдов: 33

БИОХИМИЯ, ПРЕДМЕТ И ЗАДАЧИ. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ БЕЛКОВЫХ МОЛЕКУЛ Профессор кафедры биохимии Омской ГМА, доктор мед. наук Конвай Владимир Дмитриевич

План лекции: 1. Биохимия, её предмет и задачи 2. Значение биохимии для медицины 3. Признаки и функции белков 4. Уровни структурной организации белковых молекул

Биохимия – наука о структуре химических веществ, входящих в состав живого организма, их превращениях и физикохимических процессах, лежащих в основе жизнедеятельности.

Разделы общей биохимии: 1. Статическая биохимия 2. Динамическая биохимия 3. Функциональная биохимия Объекты изучения: 1. Биохимия растений 2. Биохимия животных 3. Биохимия микроорганизмов 4. Биохимия человека – медицинская биохимия 5. Технологическая биохимия

Задачи биохимии: 1. 2. 3. 4. 5. 6. 7. 8. Изучение строения и обмена белков Изучение строения и обмена нуклеиновых кислот Изучение молекулярных механизмов наследственности Изучение биокатализа Изучение превращения углеводов Изучение обмена липидов Изучение роли биорегуляторов Изучение значения витаминов

Значение биохимии для медицины: Выяснить сущность, механизм развития заболевания 2. Улучшить эффективность диагностики заболеваний 3. Обеспечение разработки новых лекарственных средств (обоснование фармакотерапии) 4. Обосновать основы профилактики 1.

Белки – это высокомолекулярные, азотсодержащие, органические вещества, состоящие из аминокислот, соединенных в цепи с помощью пептидных связей, имеющие сложную структурную организацию.

Структурные признаки белков: 1 – содержат азот 2 – α-аминокислоты L-ряда 3 – формируют полипептидную цепь 4 – высокая молекулярная масса (от 6 тыс. до нескольких млн. дальтон) 5 – сложная структурная организация

Основные функции белков: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Структурная Каталитическая Регуляторная Рецепторная Транспортная Опорная Энергетическая Сократительная Защитная Антитоксическая Гемостатическая

Уровни структурной организации белковых молекул Первичная структура • Вторичная структура • Третичная структура • четвертичная структура •

Первичная структура – это последовательность аминокислот в полипептидной цепи, соединенных пептидными связями. Последовательность аминокислот в полипептидной цепи: 1. определяет последующие уровни структурной организации белка, 2. физико-химические, биологические свойства 3. является уникальной в каждом отдельном случае

Вторичная структура – это конфигурация полипептидной цепи в пространстве, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. Виды вторичной структуры: • -спираль • β - структура • нерегулярные вторичные структуры (кольца, изгибы, петли).
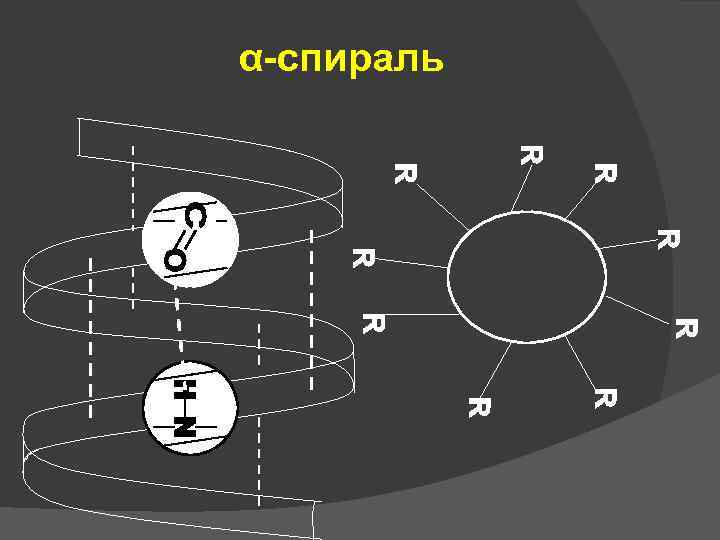
α-спираль

β – структура формируется между линейными участками одной полипептидной цепи, образуя при этом складки или между разными полипептидными цепями. Полипептидые цепи или их части могут формировать параллельные и антипаралельные β-структуры
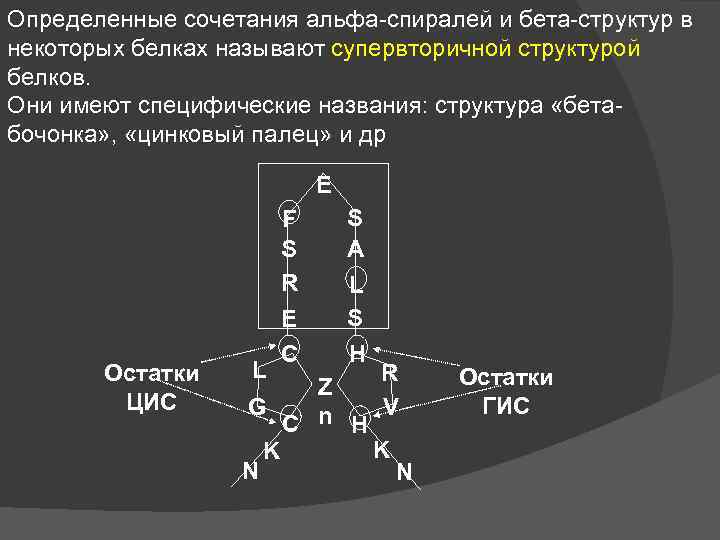
Определенные сочетания альфа-спиралей и бета-структур в некоторых белках называют супервторичной структурой белков. Они имеют специфические названия: структура «бетабочонка» , «цинковый палец» и др E F S R Остатки ЦИС L E C S A L S H R Z G n H V C K K N N Остатки ГИС

• Третичная структура - это способ укладки полипептидной цепи в пространстве в виде компактной упаковки, за счет связей между радикалами. В поддержании третичной структуры участвуют: 1. водородные связи 2. ионные связи 3. гидрофобные взаимодействия 4. дисульфидные связи.

Четвертичная структура - это высший уровень структурной организации, возможный не у всех белков. -это способ укладки в пространстве третичных структур (глобул) и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Каждая отдельно взятая глобула, получившая название протомера или субъединицы, чаще всего не обладает биологической активностью.

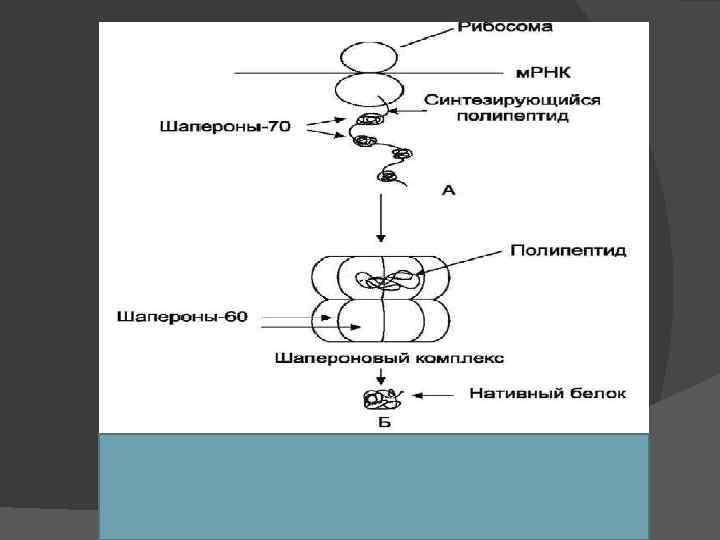
Формирование трёхмерной структуры белков от пространственной структуры белков зависит их биологическая функция. Процесс сворачивания полипептидной цепи в правильную пространственную структуру ФОЛДИНГ БЕЛКОВ

Формирование трёхмерной структуры белков Белки - продукты одного гена: имеют одинаковую аминокислотную последовательность приобретают в одинаковых условиях клетки одинаковую конформацию и функцию. фолдинг протекает при участии специальной группы белков - ШАПЕРОНЫ (от франц. shaperon няня).

Шапероны при сборке белков возникают промежуточные нестабильные конформации Шапероны: связываются с белками, находящимися в неустойчивом, склонном к агрегации состоянии. стабилизируют их конформацию,

Классификация шаперонов По молекулярной массе высокомолекулярные, с Mr от 100 до 110 к. Д; Шапероны -90 - с Mr до 90 к. Д; Шапероны -70 - с Mr от 60 до 80 к. Д; Шапероны – с Mr 60; Шапероны - с Mr 40; низкомолекулярные шапероны с молекулярной массой от 15 до 30 к. Д.

Роль шаперонов в фолдинге белков При синтезе белков N-концевая область полипептида синтезируется раньше, чем С-концевая область. Для формирования конформации белка нужна его полная аминокислотная последовательность. в период синтеза белка на рибосоме защиту реакционноспособных радикалов (особенно гидрофобных) осуществляют Шапероны -70. Ш-70 - высококонсервативный класс белков, который присутствует во всех отделах клетки В области карбоксильного конца единственной полипептидной цепи шаперонов есть участок, образованный радикалами аминокислот в форме бороздки. Он способен взаимодействовать с участками белковых молекул и развёрнутых полипептидных цепей длиной в 7 -9 аминокислот, обогащённых гидрофобными радикалами. В синтезирующейся полипептидной цепи такие участки встречают примерно через каждые 16 аминокислот.

Роль шаперонов в фолдинге белков Фолдинг многих высокомолекулярных белков, осуществляется в специальном пространстве, сформированном Шаперонами-60. Ш-60 функционируют в виде олигомернoго комплекса, состоящего из 14 субъединиц
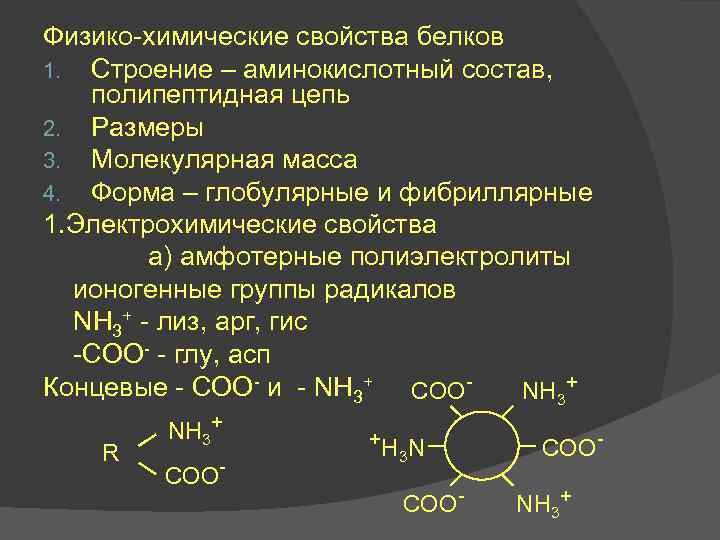
Физико-химические свойства белков 1. Строение – аминокислотный состав, полипептидная цепь 2. Размеры 3. Молекулярная масса 4. Форма – глобулярные и фибриллярные 1. Электрохимические свойства а) амфотерные полиэлектролиты ионогенные группы радикалов NН 3+ - лиз, арг, гис -СОО- - глу, асп Концевые - СОО- и - NН 3+ COONH 3+ R NH 3+ COO- +H N 3 COO- COONH 3+

б) Буферные свойства Нb – гистидин в) Общий заряд белка Соотношение ионогенных групп радикалов р. Н среды – степень ионизации кислая среда + основная среда Изоэлектрическое состояние Изоэлектрическая точка (ИЭТ) – р. J Белки цитоплазмы р. J~5, 5, белки ядер – р. J>7, 0 Электрофорез – подвижность в электрическом поле
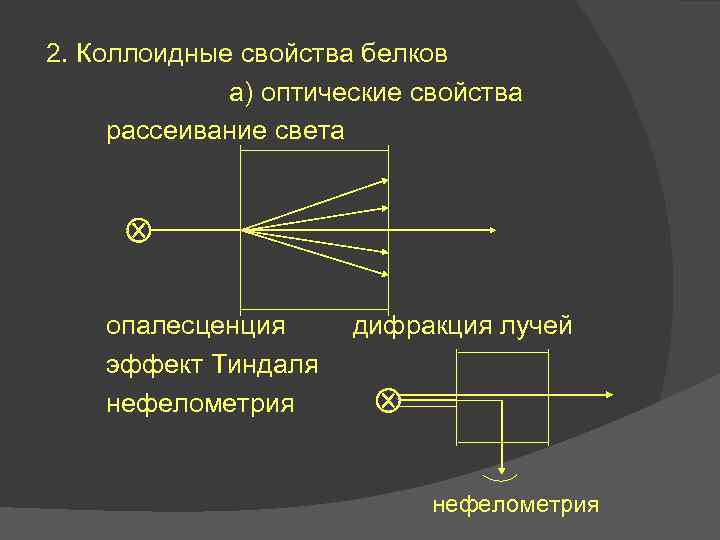
2. Коллоидные свойства белков а) оптические свойства рассеивание света опалесценция эффект Тиндаля нефелометрия дифракция лучей нефелометрия

б) малая скорость диффузии гель-фильтрация или молекулярное просеивание через зерна сефадекса диффузия крупных молекул медленнее в зерна и они быстрее выходят, а чем меньше молекулярная масса, тем медленнее выходят

в) неспособность проникать через полупроницаемые мембраны осмос диализ Высокая вязкость растворов Способность к образованию гелей Фибриллярные белки (актомиозин)

Гидратация белков Гидрофобные группы Н 2 О связывается 1 - полярными группами 2 - пептидными группами 100 г белка связывает 30 -35 г Н 2 О Гидратная оболочка
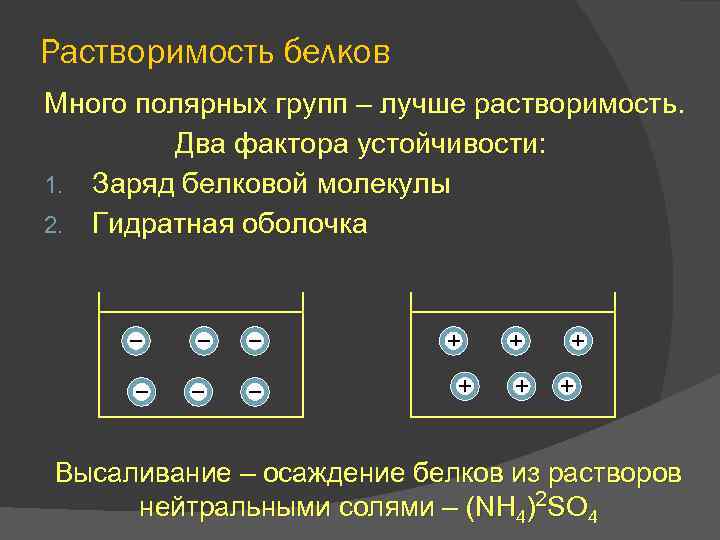
Растворимость белков Много полярных групп – лучше растворимость. Два фактора устойчивости: 1. Заряд белковой молекулы 2. Гидратная оболочка Высаливание – осаждение белков из растворов нейтральными солями – (NH 4)2 SO 4

Лабильность пространственной конформации. Денатурация – утрата нативных (природных) физико-химических свойств белка под действием физических и химических факторов, нарушающих пространственную конфигурацию (конформацию) белка при сохранении первичной структуры. Нарушаются вторичная, третичная и четвертичная структуры. Физические факторы: кислоты, щелочи, органические растворители (фенол, ацетон, спирт и т. д. ) Ренатурация.

СПАСИБО ЗА ВНИМАНИЕ
1 Уровни структ организации белков Ефременко ЕС- 15.ppt