Биохимия - Гемоглобин.ppt
- Количество слайдов: 17

Биохимия Обмен гемоглобина

n n n Потребность, содержание и метаболизм железа в организме человека Гемоглобин - основной белок крови Миоглобин тоже способен связывать кислород Молекулярные болезни гемоглобина Эффективность транспорта кислорода регулируется Газообмен происходит по градиенту концентраций Гем требуется для многих ферментов Распад гема - многостадийный процесс Токсичность билирубина состоит в его липофильности Желтухи часто встречаются у новорожденных Встречаются наследственные желтухи

Газообмен в легких Содержание газов во вдыхаемом и выдыхаемом воздухе неодинаково. Во вдыхаемом воздухе содержится почти 21% кислорода, около 79% азота, примерно 0, 03% углекислого газа, небольшое количество водяных паров и инертных газов. В выдыхаемом — 16% кислорода, 4% углекислого газа, увеличивается содержание паров, количество азота и инертных газов остается неизменным. Кровь, которая течет к легким от сердца (венозная), содержит мало кислорода и много углекислого газа; воздух в альвеолах, наоборот, содержит много кислорода и меньше углекислого газа. Вследствие этого через стенки альвеол и капилляров происходит двусторонняя диффузия —. кислород переходит в кровь, а углекислый газ поступает из крови в альвеолы. В крови кислород проникает в эритроциты и соединяется с гемоглобином. Кровь, насыщенная кислородом, становится артериальной и по легочным венам поступает в левое предсердие. У человека обмен газами завершается в несколько секунд, пока кровь проходит через альвеолы легких. Это возможно благодаря огромной поверхности легких, сообщающейся с внешней средой. Общая поверхность альвеол составляет свыше 90 м 3.

Дефицит железа есть у трети населения. n n n n Железо в организме находится в составе: - примерно 25% всего железа в запасной форме (в комплексе с белком ферритином) в селезенке, костном мозге, печени, - в составе гемоглобина – около 2/3 всего количества, - в миоглобине и других внутриклеточных гемопротеинах (каталаза, цитохромы и др. ), - только 0, 1% железа находится в плазме крови. Железосодержащие белки К железосодержащим белкам относятся: - Гемопротеины – гемоглобин, миоглобин, цитохромы, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза. - Железофлавопротеины – цитохром-с-редуктаза, сукцинатдегидрогеназа, НАДФ-оксидаза (в гранулоцитах), ацил-S-Ко. А-дегидрогеназа, ксантиноксидаза, пролил-гидроксилаза и др. - Железосвязывающие белки – трансферрин, ферритин, гемосидерин, мобилферрин, лактоферрин и др. Суточная потребность. С пищей в сутки должно поступать для мужчин 10 мг, для женщин детородного возраста в связи с регулярной кровопотерей – 20 мг, у женщин при беременности – 40 -50 мг и при лактации – 30 -40 мг. Всасывание. При попадании в желудок под действием HCl желудочного сока железо высвобождается из элементов пищи. Всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1, 0 -2, 0 мг/день (10 -15% пищевого железа). При этом железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe 3+ в Fe 2+ используется аскорбиновая кислота и соляная кислота. Только железо мясных продуктов находится в двухвалентной гемовой форме, и поэтому хорошо всасывается. Железо мясных продуктов усваивается на 20 -30%, из яиц и рыбы – на 10 -15%, из растительных продуктов – на 1 -5%. Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина и танина (чай, кофе, напитки), фосфатов, оксалатов (растительные продукты) ухудшает всасывание железа, т. к. образуются нерастворимые комплексы.

Метаболизм железа. n n n n n После всасывания железо либо откладывается в клетках кишечника в составе ферритина (Fe 3+), либо сразу попадает в кровоток и в комплексе с трансферрином (Fe 3+) переносится в клетки печени, костного мозга или других тканей, где также связывается с ферритином. Вне связи с белками железо очень токсично, так как запускает свободно-радикальные реакции с образованием активных форм кислорода. Выведение. В сутки обычные потери железа составляют 1 -2 мг и происходят несколькими путями: - с желчью - вместе со слущивающимся эпителием ЖКТ, - десквамация кожи, - у женщин детородного возраста – с месячными кровотечениями от 14 до 140 мг/месяц, - выпадение волос, срезание ногтей. Нарушение обмена железа. Избыток. Существует аутосомно-рецессивное заболевание гемохроматоз, связанное с избыточностью всасывания железа в кишечнике. Для него характерны цирроз печени, поражение сердца и поджелудочной железы, паращитовидных желез. Приобретенный избыток железа возникает при гемолитических анемиях, нарушении использования железа в метаболизме, при избыточной парентеральной терапии железодефицитных состояний. Накапливающийся ферритин преобразуется в гемосидерин, в результате резко снижается использование железа. Такое состояние называется гемосидероз. Потребление препаратов железа per os не приводит к интоксикации, так как возможности транспорта металла из кишечника ограничены свойствами трансферрина. Избыток железа в этом случае задерживается в эпителии кишечника и выводится со слущивающимися клетками. Дефицит. При недостаточности железа в организме (железодефицит) мобилизация резервов происходит в следующем порядке: сначала используется железо из депо (ферритин), затем в клетках (кроме эритроидных) снижается количество гемопротеинов до жизнеспособного минимума, далее истощаются запасы сывороточного железа (трансферрин), в последнюю очередь страдает синтез гемоглобина. Таким образом, железодефицитная анемия является проявлением крайнего дефицита железа и нормальная концентрация гемоглобина крови не должна быть критерием обеспеченности организма железом!

Причины дефицита железа: - недостаток его в пище, - заболевания ЖКТ со снижением всасывания (гастриты), - потери железа с кровью при менструальных, кишечных или иных кровотечениях, - у новорожденных и грудных детей недостаток железа связан в первую очередь с недополучением его при внутриутробном развитии, и также в связи с ускоренным ростом в первый год жизни (физиологическая анемия). n Симптомы. Недостаточный синтез цитохромов, железосодержащих белков и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспецифических симптомов: - ухудшение внимания и памяти у детей и взрослых, - уплощение, волнистость и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях, - выпадающий и секущийся волос, - поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног, - мышечная слабость, общая утомляемость. n

Гемоглобин - основной белок крови. n n n Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe 2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями. Строение гемоглобина А. Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов. Нормальные формы гемоглобина. Существует несколько нормальных вариантов гемоглобина: Hb. Р – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7 -12 неделями жизни, Hb. F – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев, Hb. A – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина, Hb. A 2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи, Hb. O 2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94 -98% от всего количества гемоглобина, Hb. CO 2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15 -20% от всего количества гемоглобина.
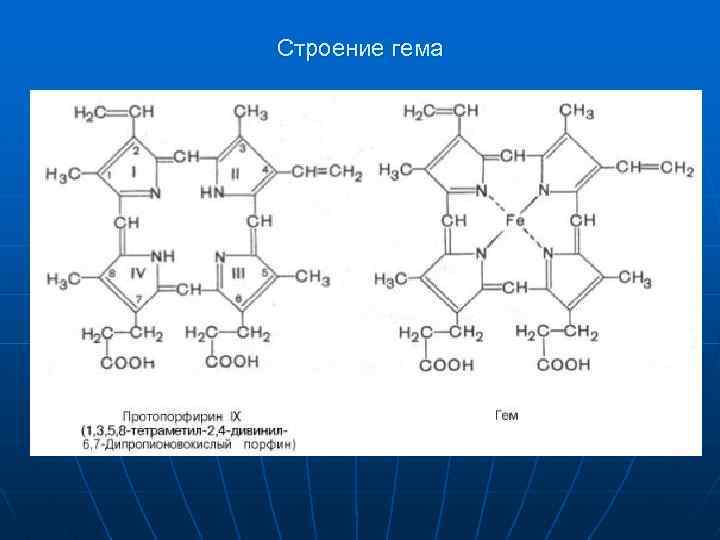
Строение гема

Молекулярные болезни гемоглобина n n n Серповидно-клеточная анемия. Hb. S – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6 -м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина "липкого" участка. При дезоксигенации гемоглобина участок "раскрывается" и связывает одну молекулу гемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцита и прохождении капилляров гемолиз. Рис. Схема отличия гемоглобина S от гемоглобина А и его полимеризация.
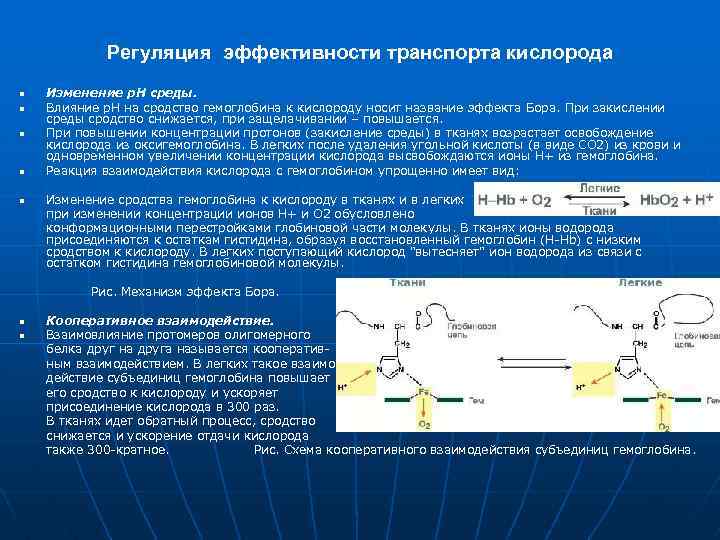
Регуляция эффективности транспорта кислорода n n n Изменение р. Н среды. Влияние р. Н на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается. При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО 2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина. Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид: Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О 2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы. Рис. Механизм эффекта Бора. n n Кооперативное взаимодействие. Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативным взаимодействием. В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300 -кратное. Рис. Схема кооперативного взаимодействия субъединиц гемоглобина.

Роль 2, 3 -дифосфоглицерата. n 2, 3 -Дифосфоглицерат образуется в эритроцитах из 1, 3 -дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта. 2, 3 -Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2, 3 -дифосфоглицерата и аминогруппами концевого валина обеих β -цепей, также аминогруппами радикалов лизина и гистидина. Рис. Реакции шунта Раппопорта. Рис. Расположение 2, 3 -дифосфоглицерата в гемоглобине. n Функция 2, 3 -дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так концентрация его относительно высока. Однако в тканях за счет 2, 3 -дифосфоглицерата отдача кислорода возрастает в 2 раза

Газообмен происходит по градиенту концентраций n n Обмен кислорода и углекислого газа в тканях. В тканях диффундирующий в кровь из клеток СО 2 большей частью (около 90%) по градиенту концентрации попадает в эритроциты. Движущей силой этого процесса является быстрая, постоянно идущая реакция превращения его в угольную кислоту при участии фермента карбоангидразы. Угольная кислота диссоциирует и подкисляет содержимое эритроцита, что улучшает отдачу оксигемоглобином кислорода (Эффект Бора). Рис. Реакции газообмена в капиллярах тканей. Одновременно с концевыми NH 2 -группами β-цепей гемоглобина связывается 10 -12% карбонат-иона с образованием карбаминогемоглобина (H-Hb. CO 2). Остальные бикарбонаты выходят в плазму крови в обмен на ионы хлора (гипохлоремический сдвиг).

Газообмен происходит по градиенту концентраций n Обмен кислорода и углекислого газа в легких. В легочных капиллярах имеется относительно низкая концентрация углекислого газа в альвеолярном воздухе: Рис. Реакции газообмена в легочных капиллярах n n n n n Происходит высокоэффективная диффузия СО 2 из плазмы через альвеолярные мембраны и его удаление с выдыхаемым воздухом, уменьшение концентрации СО 2 в плазме стимулирует его образование в карбоангидразной реакции внутри эритроцита и снижает здесь концентрацию иона HCO 3–, одновременно высокая концентрация кислорода вытесняет СО 2 из комплекса с гемоглобином с образованием оксигемоглобина – более сильной кислоты, чем угольная, диссоциирующие от оксигемоглобина ионы Н+ нейтрализуют поступающий извне ион HCO 3– с образованием угольной кислоты. После карбоангидразной реакции образуется СО 2, который выводится наружу. Гем требуется для многих ферментов. Гем является небелковой частью многих гемопротеинов: гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга, миоглобин скелетных мышц и миокарда (17%), цитохромы дыхательной цепи и P 450, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза и т. д. – менее 1%.
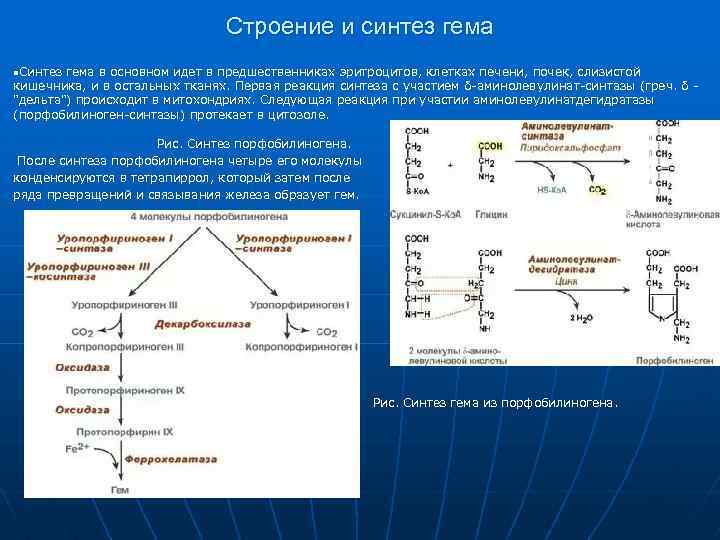
Строение и синтез гема n. Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ - "дельта") происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле. Рис. Синтез порфобилиногена. После синтеза порфобилиногена четыре его молекулы конденсируются в тетрапиррол, который затем после ряда превращений и связывания железа образует гем. Рис. Синтез гема из порфобилиногена.

Регуляция синтеза гема. Распад гема. n n n 1. Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез "своих" белков. 2. Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза. Сам гем подавляет синтез этого фермента. С другой стороны, достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. 3. Положительным модулятором аминолевулинатсинтазы служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента. 4. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) – при этом возрастает потребление гема для образования цитохрома Р 450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента. Распад гема - многостадийный процесс. За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты живут 90 -120 дней, после чего лизируются в кровеносном русле или в селезенке. При разрушении эритроцитов в кровяном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α 2 -глобулинов крови) и переносится в клетки ретикуло-эндотелиальной системы (РЭС) селезенки (главным образом), печени и костного мозга. Синтез билирубина. В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом и в последовательных реакциях происходит отщепление железа и белковой части и образование оранжевого пигмента билирубина. Рис. Реакции синтеза билирубина. Билирубин – токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
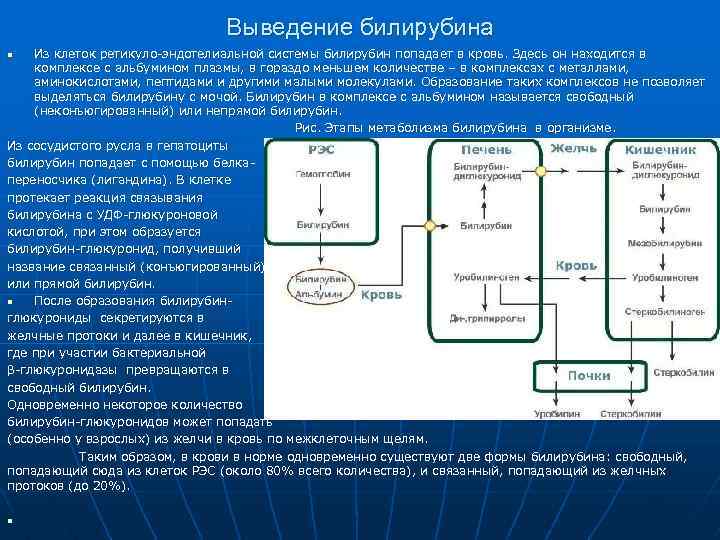
Выведение билирубина Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин. Рис. Этапы метаболизма билирубина в организме. Из сосудистого русла в гепатоциты билирубин попадает с помощью белкапереносчика (лигандина). В клетке протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуется билирубин-глюкуронид, получивший название связанный (конъюгированный) или прямой билирубин. n После образования билирубинглюкурониды секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно некоторое количество билирубин-глюкуронидов может попадать (особенно у взрослых) из желчи в кровь по межклеточным щелям. Таким образом, в крови в норме одновременно существуют две формы билирубина: свободный, попадающий сюда из клеток РЭС (около 80% всего количества), и связанный, попадающий из желчных протоков (до 20%). n n

Токсичность билирубина состоит в его липофильности. Выведение билирубина Ситуации, при которых в крови накапливается билирубин, в зависимости от причины делятся на три вида: - гемолитические – в результате гемолиза при избыточном превращении гемоглобина в билирубин, - печеночно-клеточные – когда печень не в состоянии обезвредить билирубин, - механические – если билирубин не может попасть из печени в кишечник из-за механического перекрытия желчевыводящих путей. n Накопление билирубина в крови свыше 43 мкмоль/л ведет к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется в виде желтухи. Так как свободный билирубин липофилен, то он легко накапливается в подкожном жире и нервной ткани. Последнее особенно опасно для детей, особенно для новорожденнных. Рис. Причины основных нарушений обмена билирубина. n Гемолитическая или надпеченочная желтуха – ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза. В данном случае гипербилирубинемия развивается за счет фракции непрямого (св) билирубина. n Механическая или подпеченочная желтуха развивается вследствие снижения оттока желчи при непроходимости желчного протока. Не имеющий оттока в кишечник прямой билирубин поступает в кровь, в результате развивается гипербилирубинемия. n Паренхиматозная (печеночно-клеточная) Желтуха - гипербилирубинемия развивается за счет обеих фракций, преимущественно прямого билирубина. n
Биохимия - Гемоглобин.ppt