Биохимия мышечной ткани и миокарда


Биохимия мышечной ткани и миокарда Кафедра биохимии Лектор профессор Грицук А. И. для студентов 2 -го курса

Основные функции мышечной системы n движение, n стимуляция метаболизма, n генератор проприцептивной импульсации в ретикулярную формацию n стимуляция вегетативных функций n депо белка, электролитов и др. 3

Общая характеристика мышечной ткани n 35 -50 % от массы тела n У детей – 25 %, у пожилых – 35 % n Высокий КПД: 40 -50% n Относительная автономия. 4

Относительная автономия мышечной ткани Определяется наличием: n Депо субстратов (гликоген и ЖК) n Депо О 2 (окси Мb) n Депо ~ (креатин~фосфат) n Депо Са 2+ (СР) n Система стабилизации [АТФ] n Система стабилизации р. Н (ансерин, карнозин) n Мощная АОЗ n Много БТШ 5

Сравнительная хар-ка Мb и Нb Мb: n Мономер (эволюционный предшественник Нb n Более высокое чем у Нb сродство к О 2 n Кривая насыщения О 2 - гипербола Нb n Тетрамер (2 а 2β) n Сродство к О 2 ниже чем у Мb n Кривая насыщения О 2 - сигмоидная, отражает кооперативные переходы субъединиц Нb при взаимодействии с О 2 6

Субстраты метаболизма: Гликоген мышечной ткани n В скелетных мышцах хранится около ¾ всего гликогена организма. n В печени – большая часть из оставшейся ¼. n Глюкоза не может выйти из мышц, так как в мышцах отсутствует фермент Г 6 Ф -аза. 7
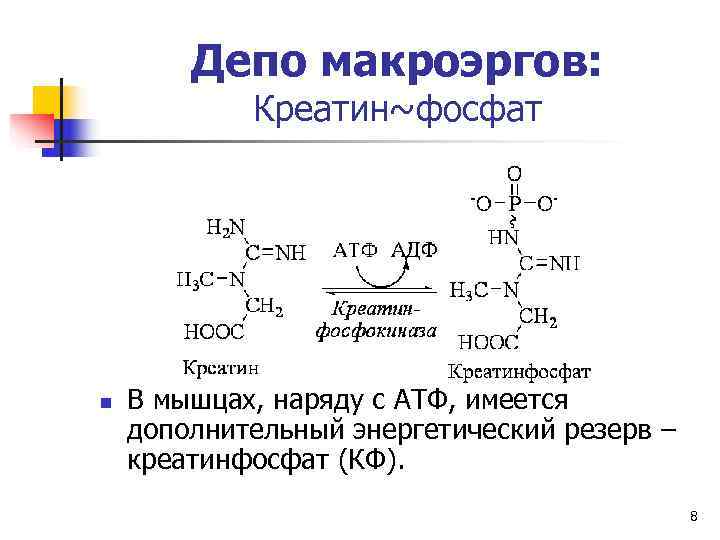
Депо макроэргов: Креатин~фосфат n В мышцах, наряду с АТФ, имеется дополнительный энергетический резерв – креатинфосфат (КФ). 8
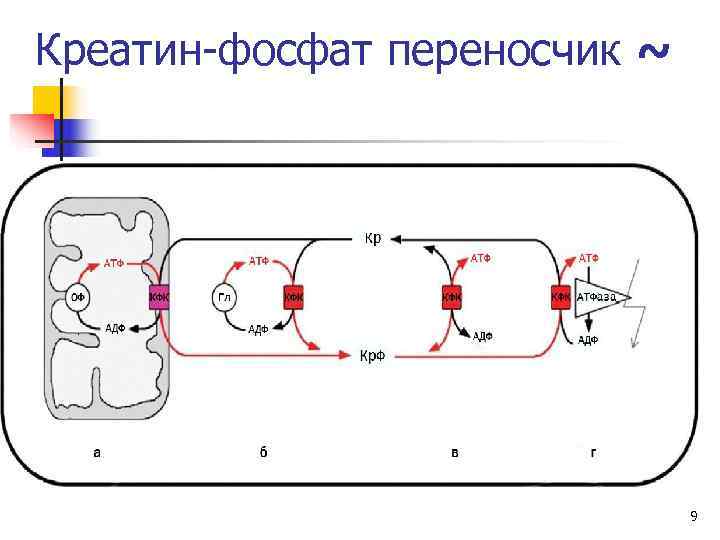
Креатин-фосфат переносчик ~ 9
![Механизмы стабилизации [АТФ] n В процессе мышечного сокращения АТФ 4– → Механизмы стабилизации [АТФ] n В процессе мышечного сокращения АТФ 4– →](https://present5.com/presentation/3/38271257_295460288.pdf-img/38271257_295460288.pdf-9.jpg)
Механизмы стабилизации [АТФ] n В процессе мышечного сокращения АТФ 4– → АДФ 3– + Фн 2 - + Н+ АДФ 3– имеет ~ которую можно использовать в аденилаткиназной реакции 2 АДФ 3– ↔ АТФ 4– + АМФ 2 -, n Для смещения реакции вправо АМФ 2 - гидролизуется АМФ-дезаминазой АМФ 2 - → ИМФ + NH 3 10

Стабилизация р. Нi Дипептиды: ансерин и карнозин n Закислению препятствуют буферные дипептиды ансерин и карнозин, содержащие гистидин. 11

Гипокинезия n Гипокинезия – существенное ограничение двигательной активности. n Объем двигательной активности за последние 100 лет уменьшился в 20 раз. n Последствия гипокинезии сказываются практически на всех органах – гипокинетический синдром (ГКС). 12

Патогенез ГКС (1 -й этап) n Дефицит проприоцептивной информации n Стресс (как реакция организма на недостаток проприоцептивной информации) n Эффекты континсулярных гормонов: катехоламинов, глюкокортикоидов, T 3, T 4 и др. n Активация гликогенолиза - гипергликемия n Активация протеолиза, липолиза, ГНГ n Увеличение концентрации ЖК в крови n Разобщение ОФ n Усиление катаболических процессов в организме n Увеличение теплопродукции 13

Механизм развития ГКС ЦНС Стресс Эндокринные железы Адреналин ТТГ, T 3, T 4, СТГ, АКТГ, кортизол Глюкоза ↑ Инсулин Жиры ГНГ Белки Глицерин АК Мы шц ы O/Ф↓ ЖК ↑ O 2 14

Патогенез ГКС (2 -й этап) n Увеличение потребления кислорода (гипокинетический парадокс) n Снижение массы мышечной ткани n Протеолиз, апоптоз n Резорбция костной ткани, остеопороз, ухудшение минерального обмена. n снижение физ. нагрузки, пьезоэлектрический эффект. n Потеря с мочой электролитов Na+, K+, Ca 2+ n Как следствие уменьшения количества клеток n Увеличение частоты спонтанных мутаций n Следствие высокой концентрации NADH генерация 15 АФК.

Патогенез ГКС (вывод) n Гипокинетический синдром – диссипативный процесс, вызывающий распад структуры и превращающий ее в тепло, рассеивающееся в окружающей среде. 16

Поперечно-полосатые мышцы 1. Скелетные мышцы 1. Белые мышцы (быстрые) 2. Красные мышцы (медленные) 2. Сердечная мышца 17

Скелетные мышцы (2 типа) n Красные мышцы, способные к продолжительной деятельности. n Богаты гемопротеидами: n Хорошее кровоснабжение –Hb. n Запас кислорода – Mb миоглобин. n Большое количество митохондрий – цитохромы. n Преобладает аэробный метаболизм, главный энергоресурс – окисление ЖК. n Белые мышцы, функционирующие в импульсном режиме (недолго и быстро). n Главный энергоресурс – запасы гликогена, анаэробный гликолиз. 18

Скелетные мышцы: белые, быстрые n большой , запас эндогенный субстратов (гликоген, кр~фосфат), хорошо развит СР, n основной энергетический процесс – анаэробный гликолиз 19

Скелетные мышцы: красные, медленные n Малый , хорошо кровоснабжаются, много Мх, СР менее развит, активна Ca 2+-АТФаза, запасы эндогенного субстрата – жир (ТГ), n Энергообеспечение – аэробные процессы 20

Характеристика красных и белых волокон Признаки Красные Белые Относ. волокон Малый Большой Тип сокращения Медленное Быстрее в 5 раз Васкуляризация Высокая Слабее Тип обмена (Мх) Много (аэробный) Мало (анаэробный) Миоглобин Много Мало Главный источник АТФ Окисление ЖК Гликолиз (процесс) Главный энергорезерв ЖК (ТГ и ФЛ) Гликоген в мышцах СР Слабо развит Хорошо развит Нервно-мышечный Слабо развит Хорошо развит синапс 21

Сердечная мышца n Сочетают свойства обоих волокон n Значительное количество Мх до 25 - 30% объема клетки. n Кардиомиоциты рано перестают делиться. n Очень быстрая замена белков, особенно сократительных n Полная замена за один месяц. 22

Особенности биохимии миокарда n Аэробный фенотип метаболизма - Аэробная ткань (7 -20% всего кислорода) аэробные изоферменты. n ЛДГ 1 и ЛДГ 2 n КФК 2 (MB-изоформа). n Высокая скорость ЦТК, b-окисления ЖК, очень низкая – анаэробного гликолиза (субсарколеммальная локализация). n На сарколемме высокая активность АТФ-аз. n Энергосубстраты – ЖК, кетоновые тела глюкоза, лактат. . n Особенно активно из крови миокард извлекает ненасыщенные ЖК – олеиновую кислоту. n Интенсивный метаболизм АМК Ал. АТ, Ас. АТ. n СР развит хорошо, однако Ca 2+ поступает из внеклеточной среды. 23

Дыхательный фенотип 24

Гликолитический фенотип 25

Субстраты метаболизма n Мышечная ткань использует разные субстраты метаболизма: глюкозу, жирные кислоты, кетоновые тела. n Скелетные мышцы различаются по энергозатратам в зависимости от их активности. n В покоящейся мышце главным энергетическим субстратом являются ЖК: n При физической нагрузке главным субстратом становится глюкоза. n Поэтому в мышцах имеется значительный запас гликогена. 26

Субстраты метаболизма: лактат, аланин, циклы Кори и Фелига n При физической нагрузке скорость анаэробного гликолиза в мышце выше, чем ЦТК лактат накапливается и выходит из клеток. n Другой продукт метаболизма –Ала образуется при переаминировании ПВК. n Лактат и Ала транспортируются с кровотоком в печень, где снова превращаются в глюкозу (ГНГ). n Глюкозо-лактатный цикл (Кори). n Глюкозо-аланиновый цикл (Фелига). 27

Субстраты метаболизма: Белки n Мышечные белки также могут использоваться для энергообеспечения. n Однако этот процесс энергетически невыгоден и вреден – снижает шансы на выживаемость организма. n Поэтому катаболизм мышечных белков в нормальном состоянии минимален, увеличивается лишь в крайнем случае (напр. при голодании). 28

Энергетический метаболизм мышц n При интенсивной мышечной работе: АТФ 4 - → АДФ 3 - + Фн 2 - + H+ n актомиозин проявляет свойства АТФ-азы; 29

Энергетический метаболизм мышц (прод. ) n Скорость гидролиза АТФ превышает скорость его синтеза. n АДФ накапливается, но не используется ни в каких реакциях, кроме аденилаткиназной: n 2 АДФ ↔ АТФ + АМФ (миоаденилаткиназа) n В ходе аденилаткиназной реакции накапливается АМФ. Снижает его концентрацию фермент АМФ-дезаминаза: n АМФ → ИМФ + NH 3 30
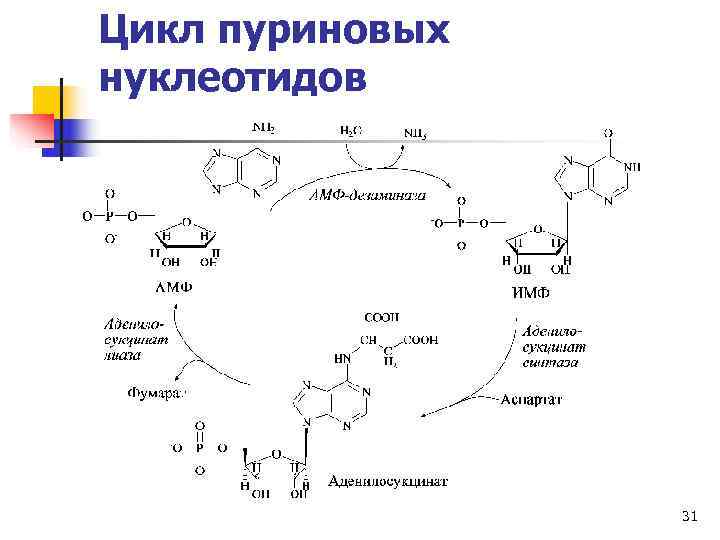
Цикл пуриновых нуклеотидов 31

Энергетический метаболизм мышц (прод. ) n Выделяющийся аммиак должен элиминировать в виде глн, асн или ала. n Глу + NH 3 + АТФ → Глн + АДФ + Фн (глутамин-синтетаза) n Асп + Глн → Асн + Глу (аспарагин-синтетаза) n ПВК + Глу ↔ Ала + a-кетоглутарат (аланин- аминотрансфераза) n Эти АК с кровотоком достигают печени, где используются как субстраты ГНГ. Т. обр. , мышцы играют важную роль в межорганном обмене субстратами (циклы Кори и Фелига). 32

Метаболизм АКРУЦ в мышцах n Мышцы – наиболее важный участок деградации АК с разветвленной углеводородной цепью (АКРУЦ): вал, иле, лей. n Эти соединения катаболизируют до сукцинил-Ко. А (иле, вал) и ацетил-Ко. А (лей). 33
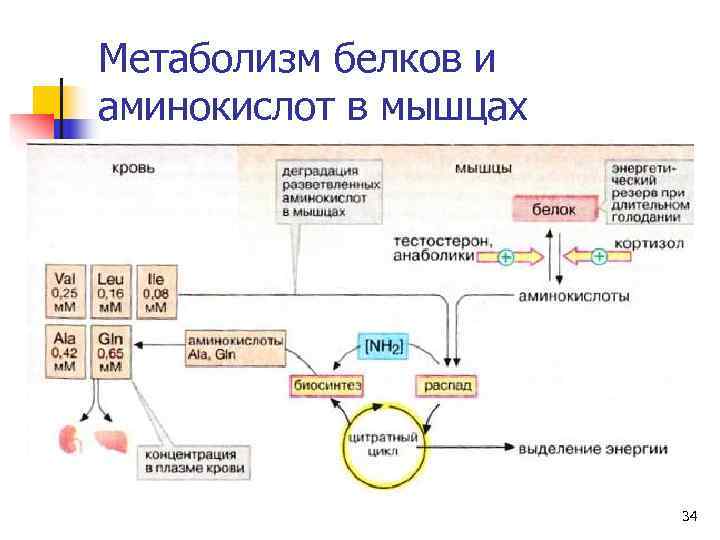
Метаболизм белков и аминокислот в мышцах 34

Пути утилизации АТФ в мышце 1. Электрическая работа составляющая АТФ- азную активность , : 1. Na+/K+-АТФ-аза – способствует поддержанию потенциала покоя; транспорт субстратов. 2. Ca 2+-АТФ-аза – мышечное расслабление, 3. Mg 2+-АТФ-аза – стабилизация АТФ, и т. д. 2. Механическая работа – АТФ-зависимый процесс (сокращение и расслабление мышц) – (распад актомиозинового комплекса и откачивание Ca 2+ из саркоплазмы) 35

Электромеханическое сопряжение (ЭМС) ЭМС - преобразование нервного импульса (электро) в мышечное (механическое) сокращение v сопряжение электрики и механики Сопрягающий фактор ЭМС - Ca 2+ 36
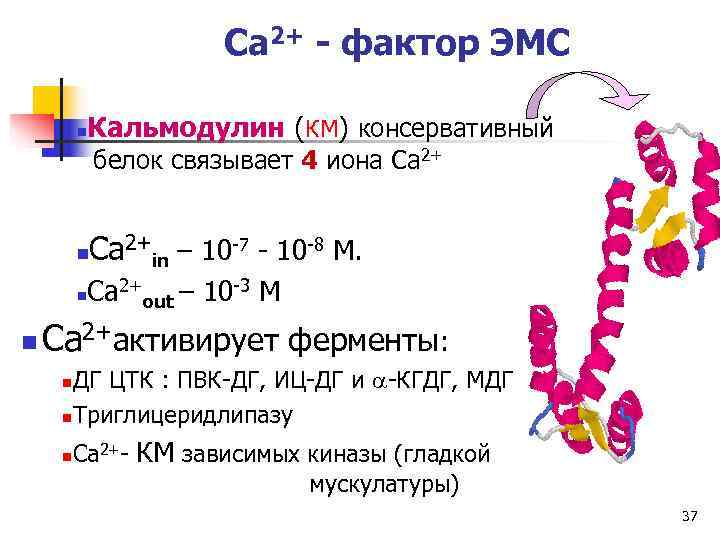
Ca 2+ - фактор ЭМС n Кальмодулин (КМ) консервативный белок связывает 4 иона Ca 2+ n Ca 2+in – 10 -7 - 10 -8 М. n Ca 2+out – 10 -3 М n Ca 2+активирует ферменты: n. ДГ ЦТК : ПВК-ДГ, ИЦ-ДГ и a-КГДГ, МДГ n. Триглицеридлипазу n Ca 2+- КМ зависимых киназы (гладкой мускулатуры) 37
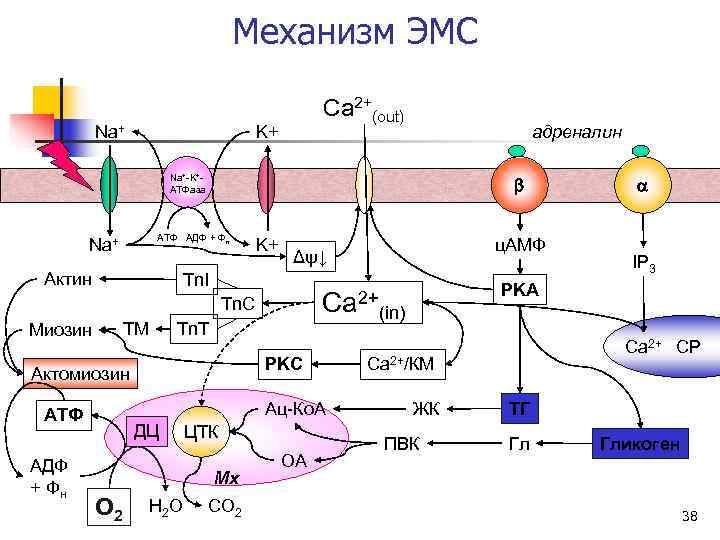
Механизм ЭМС Ca 2+(out) Na+ K+ адреналин Na+-K+- АТФаза b a АТФ АДФ + Фн Na+ K+ ц. АМФ Δψ↓ IP 3 Актин Tn. I PKA Tn. C Ca 2+ (in) Миозин TM Tn. T Ca 2+ СР PKC Ca 2+/КМ Актомиозин АТФ Ац-Ко. А ЖК ТГ ДЦ ЦТК ПВК Гликоген АДФ ОА Мх + Фн O 2 H 2 O CO 2 38

Ригорный комплекс (трупное окоченение) n Ригорный комплекс образуется в результате нарастающего дефицита кислорода АТФ↓ Ca 2+↑ актомиозиновый комплекс не диссоциирует. n Через ≈2 -3 часа ригорный комплекс разрушается (действие лизосомальных протеаз) ткани мышц снова становятся мягкими. 39

Мышечные белки n Мышцы содержат уникальный набор белков, которые можно разделить на следующие группы: n Сократительные: актин и миозин. n Регуляторные: n Основные: Тропомиозин, тропонины (I, C, T) n Минорные: Миомезин; креатинкиназа; M-, C-, F-, H-, I-белки; a-, b-, g-актинины, филамин, паратропомиозин. n Белки цитоскелета: n Тайтин-1, тайтин-2, небулин, винкулин, десмин (скелетин), виментин, синемин, Z-протеин, Z-nin, дистрофин. 40
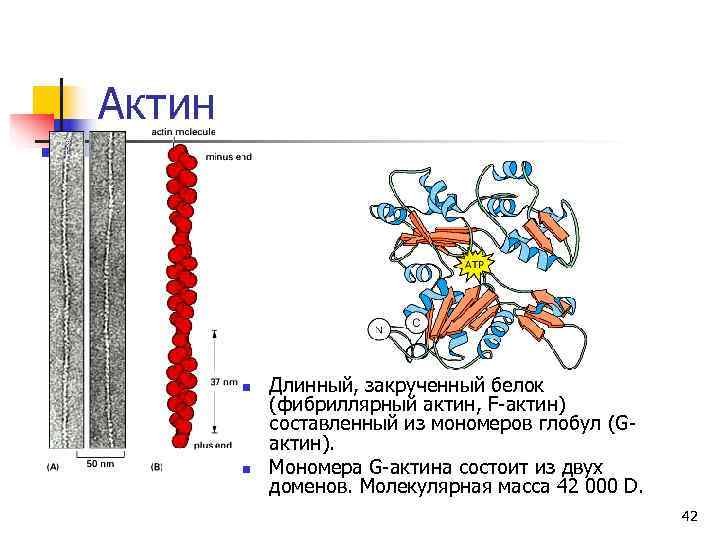
Актин n Длинный, закрученный белок (фибриллярный актин, F-актин) составленный из мономеров глобул (G- актин). n Мономера G-актина состоит из двух доменов. Молекулярная масса 42 000 D. 42

Актин (продолжение) n Связывание АТФ мономером G-актина вызывает полимеризацию (т. е. , формирование F-актина). АДФ, образующийся после гидролиза АТФ, остается связанным с актином. n F-актин образует двойную спираль. n Каждая субъединица актина в тонком филаменте содержит участок, способный связываться с миозином. 43

Строение тонкого филамента n Тонкие филаменты состоят из: n Спирали F-актина n Тропомиозина (фибриллярный димерный белок, уложенный вдоль желоба актиновой спирали) n И трех белков, называемых тропонинами I, C и T. n Тропомиозин и тропонины препятствуют связыванию актина с миозиновыми головками, пока концентрация ионов кальция меньше 10 -5 М. n В покоящейся мышце концентрация Ca 2+ ~10 -7 M. 44

Миозин n Молекула миозина состоит из 6 полипептидных цепей: n двух идентичных тяжелых цепей (M = 230, 000). n И четырех легких цепей (M = 20, 000). n Весь молекулярный комплекс имеет молекулярную массу 540, 000. 45
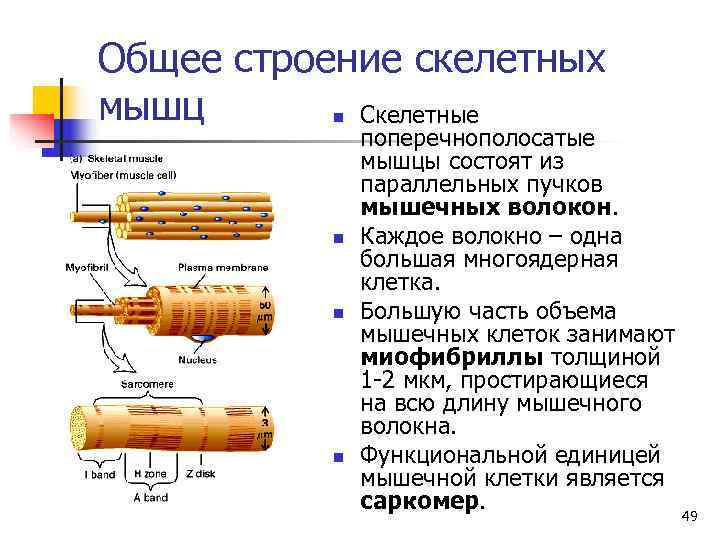
Общее строение скелетных мышц n. Скелетные поперечнополосатые мышцы состоят из параллельных пучков мышечных волокон. n Каждое волокно – одна большая многоядерная клетка. n Большую часть объема мышечных клеток занимают миофибриллы толщиной 1 -2 мкм, простирающиеся на всю длину мышечного волокна. n Функциональной единицей мышечной клетки является саркомер. 49
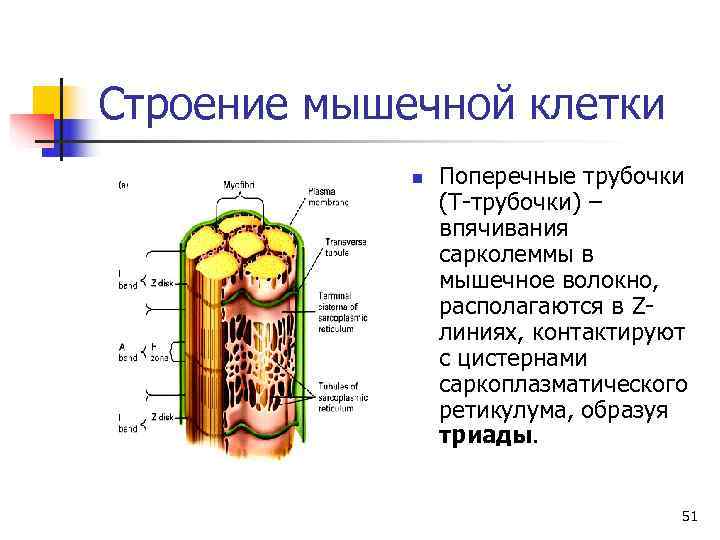
Строение мышечной клетки n Поперечные трубочки (Т-трубочки) – впячивания сарколеммы в мышечное волокно, располагаются в Z- линиях, контактируют с цистернами саркоплазматического ретикулума, образуя триады. 51
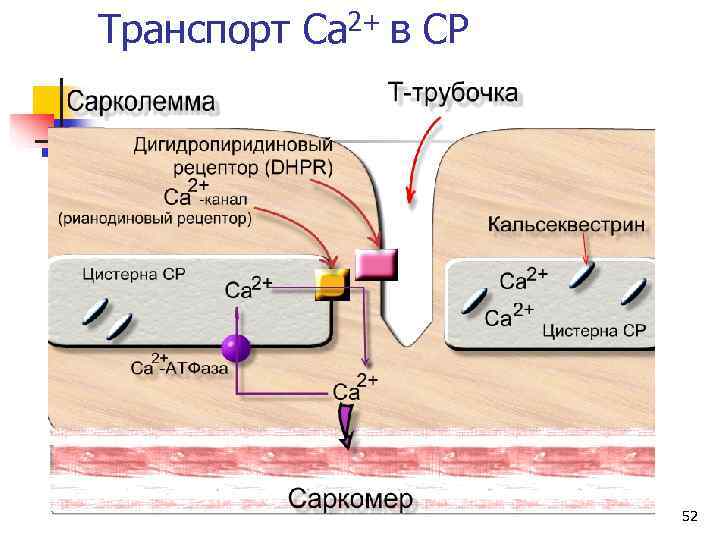
Транспорт Ca 2+ в СР 52

Потенциал-зависимые Ca 2+ каналы (дигидропиридиновые рецепторы, DHPR) n Олигомеры – 2 большие субъединицы (a-1 и a-2) и 3 малые (b, g, и d) n Выполняют ключевую роль в электромеханическом сопряжении. n Чувствительны к блокаторам кальциевых каналов (1, 4 - дигидропиридины - нифедипин). 54
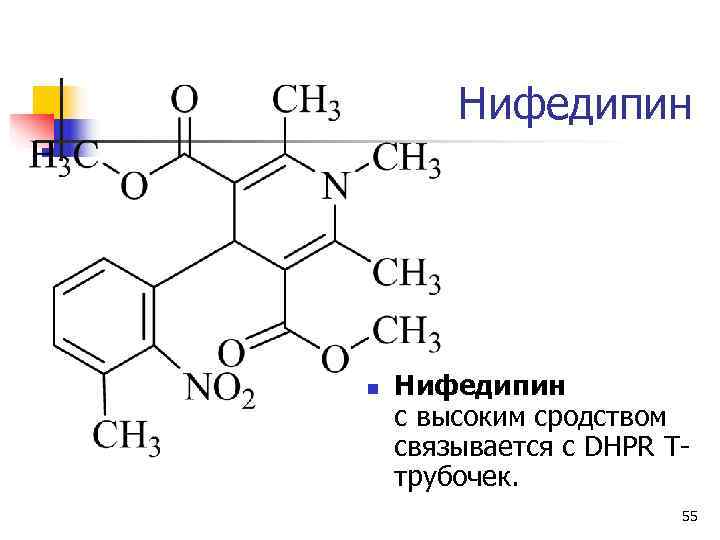
Нифедипин n Нифедипин с высоким сродством связывается с DHPR T- трубочек. 55

Патологии DHPR n Гипокалиемический периодический паралич; n Предрасположенность к тиротоксическому периодическому параличу; n Предрасположенность к злокачественной гипертермии. 56

Ca 2+ каналы – рианодиновые рецепторы n Ca 2+-каналы саркоплазматического ретикулума – рианодиновые рецепторы (RYR) – главный источник кальция для мышечного сокращения. n Известны 3 изоформы этих рецепторов: RYR 1, RYR 2 and RYR 3. n RYR 1 – в скелетной мускулатуре, n RYR 2 – в миокарде, n RYR 3 – в головном мозгу. 57

Рианодин n Рианодин – растительный алкалоид, связывается с RYR и модулирует его действие. 58

Строение RYR 59

Патологии RYR n RYR 1: n Предрасположенность к злокачественной гипертермии; n Миопатии с внешней офтальмоплегией. n RYR 2: n Желудочковая тахикардия, полиморфная стресс- индуцированная тахикардия; n Семейная аритмогенная правожелудочковая дисплазия. n При сердечной недостаточности RYR 2 гиперфосфорилирован под действием протеинкиназы А, что приводит к нарушению функции канала и повышенной чувствительности к активации кальцием. 60

Кальсеквестрин n Кальсеквестрин (CASQ) – кислый гликопротеин, находящийся в просвете терминальных цистерн СР n связывает ионы Са 2+ и выполняет запасающую функцию. n 2 изоформы: n CASQ 1 - в скелетных мышцах, n CASQ 2 - в сердечной мышце. 65

Патологии кальсеквестрина n Миссенс-мутация в гене CASQ 2 – причина аутосомального рецессивного заболевания у бедуинов Израиля катехоламин- индуцируемая полиморфная желудочковая тахикардия. 66

Кальмитин n Кальмитин – митохондриальный кальций-связывающий белок, специфичный для быстрых белых мышц. n Отсутствует у пациентов с миодистрофиями Дюшенна и Беккера. 67

Остальные белки мышц n Основные белки мышц: n Миозин и актин – 65% n Тропомиозин и тропонины – 5%. n Остальные белки -25% (выполняют важные функции в поддержании мышечной структуры и регуляции мышечного сокращения). n Регуляторные белки разделяются на: n Связанные с миозином; n Связанные с актином. 68

Белки, связанные с миозином n 3 основных белка, находящихся в области М-дисков. n Белок M (165 k. D), n Миомезин (185 k. D), n Креатин киназа (димер, субъединица 42 -k. D). n Поддерживают структурную целостность миозиновых филаментов. 69

Остальные белки, связанные с миозином n Белок C (135 k. D), n Ингибирует активность мышечной АТФазы при низкой ионной силе, и активирует при физиологических значениях. n Белок F (121 k. D), n Белок H (74 k. D), n Белок I (50 k. D). n Роль белков F, H и I пока неясна. 70

Белки, связанные с актином n Кроме тропомиозина и тропонинов с актином также связаны n a–актинин (гомодимер, субъединица 95 -k. D), n Обнаружен в области Z линий, активирует сокращение актомиозина. Предположительно, участвует в прикреплении актина к Z линиям. n b-актинин (гетеродимер, субъединицы по 37 - k. D и 34 -k. D), n g-актинин (мономер, 35 -k. D), n паратропомиозин (гомодимер, 34 -k. D). 71

Строение актининов n a-Актинин – гомодимер из антипараллельных субъединиц. n N-конец – актин- связывающий домен, n C-конец – содержит EF- hand домены. n Разделены центральным доменом, состоящим из 4 повторов по 122 аминокислотных остатка. 72

Роль актининов и паратропомиозина n Повторы в a–актинине гомологичны 106 - аминокислотным повторам в спектрине – главном структурном белке цитоскелета эритроцитов. n b-Актинин специфически связывается с концами актиновых нитей. n g-Актинин ингибирует полимеризацию актина. n Паратромомиозин похож на тропомиозин, расположен на стыке зон A и I. 73
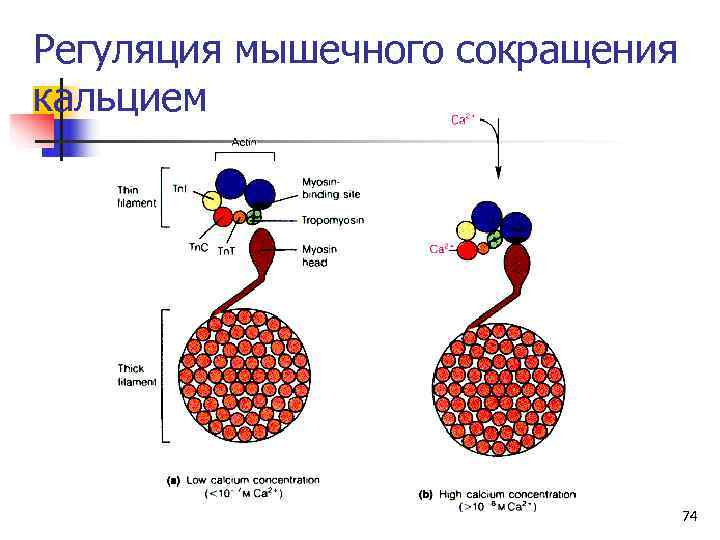
Регуляция мышечного сокращения кальцием 74

Динамика тайтина n Большие филаменты тайтина и небулина остаются связанными с толстыми и тонкими филаментами при мышечном сокращении. 75
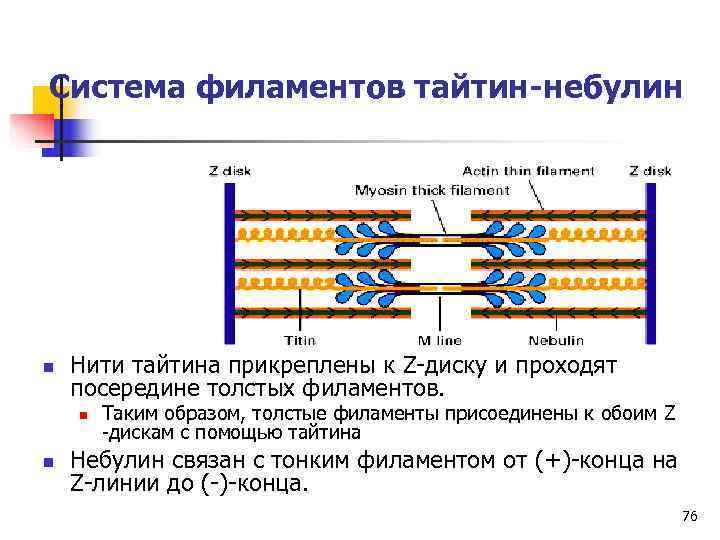
Система филаментов тайтин-небулин n Нити тайтина прикреплены к Z-диску и проходят посередине толстых филаментов. n Таким образом, толстые филаменты присоединены к обоим Z -дискам с помощью тайтина n Небулин связан с тонким филаментом от (+)-конца на Z-линии до (-)-конца. 76
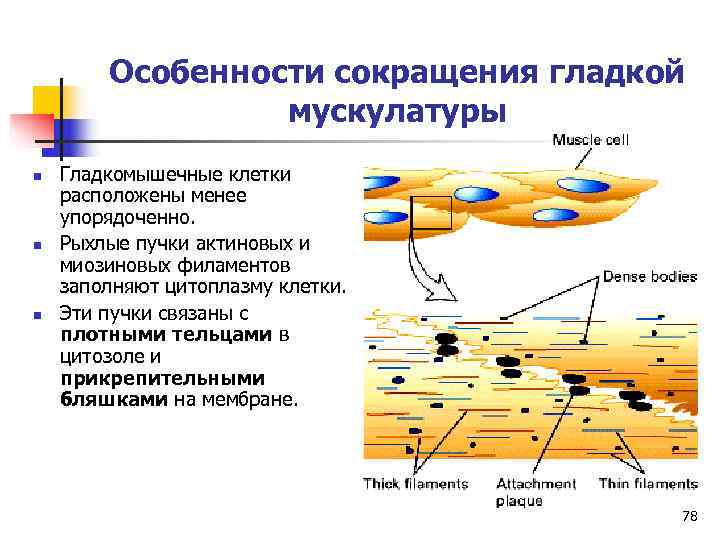
Особенности сокращения гладкой мускулатуры n Гладкомышечные клетки расположены менее упорядоченно. n Рыхлые пучки актиновых и миозиновых филаментов заполняют цитоплазму клетки. n Эти пучки связаны с плотными тельцами в цитозоле и прикрепительными бляшками на мембране. 78

Сокращение гладких мышц n Пусковой механизм в сокращении гладких мышц – повышение [Ca 2+] в клетке. n Ca 2+ связывается с кальмодулином, активирует киназу легких цепей миозина. n Фосфорилирование легких цепей миозина вызывает сокращение. n Процесс сокращения в гладких мышцах происходит значительно медленнее. 79

Биохимические основы развития сердечной недостаточности (СН) n Нарушение энергетического метаболизма. n Дефицит O 2 (ишемия, гипоксия, аноксия) n Несоответствие нагрузки функциональной воможности миокарда n Дефицит субстратов (Гл, ЖК, КТ, лактат, ПВК и др. ) n В саркоплазме накапливается Ca 2+ n Мх аккумулируют значительную часть Ca 2+ n Разобщение дыхания и фосфорилирования. 80

Разобщение дыхания и фосфорилирования Ca 2+ n Поступление Ca 2+ в МХ снижает Фн мембранный Ca 2+ потенциал (Δψ) энергодефицит. гидроксиаппатит n Гидроксиаппатит плохо растворим уменьшается резерв фосфата. 81

Формирование кислородного долга в миокарде МХ ↑ ДГ-реакции ЦТК ↑ Ca 2+(in) ↑ДЦ ΔμH+↓ ↑О 2 Кислородный голод 82
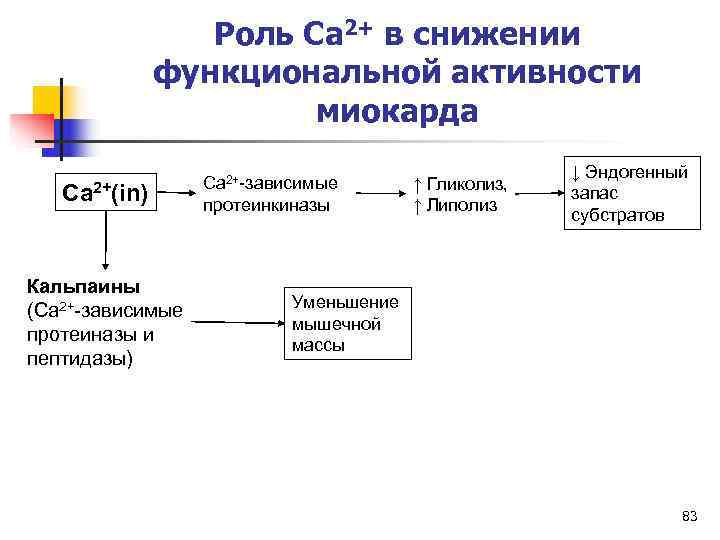
Роль Ca 2+ в снижении функциональной активности миокарда ↓ Эндогенный Ca 2+-зависимые ↑ Гликолиз, Ca 2+(in) протеинкиназы ↑ Липолиз запас субстратов Кальпаины (Ca 2+-зависимые Уменьшение мышечной протеиназы и массы пептидазы) 83

Последовательность развития СН n При сердечной недостаточности (СН): n Слабая мышечная стенка растягивается (дилатация). n Повышается синтез коллагена рубцевание миокарда препятствует дилатации снижается эластичность. n Ca 2+ ↑ анаэробный гликолиз ↑образование волокон белого типа гипертрофия миокарда усиление биосинтеза мышечных белков. n Ca 2+ активирует процессы перекисного окисления (↑ NADH). 84

Биохимические основы коррекции СН (1) 1. Аэрация миокарда 1. Нормализация кровообращения 2. Нормализация ионного и энергетического баланса 2. Источники и препараты K+ (печеный картофель, изюм, урюк и т. п. ) 3. Инъекции препаратов глюкозы, инсулина и K+ 3. Сердечные гликозиды (СГ) (наперстянки, ландыша, строфанта К) – дигитоксин, дигонин, , строфантин K, коргликон (смесь разных СГ). 4. Высокоспецифичные ингибиторы Na+/K+-АТФазы. 4. Применение ингибиторов кальциевых каналов и антагонистов Ca 2+. 85

Биохимические основы коррекции СН (2) n Препараты, увеличивающие уровень АТФ в миокарде n Рибоксин (инозин) n Аспаркам, панангин (глу, асп, K+, Mg 2+) n Инозин → ИМФ (+асп) → Аденилосукцинат → АМФ → АДФ → АТФ n L-Карнитин (Элькар®) n Осуществляет транспорт ЖК в МХ. n Антиоксиданты (компл. вит. C, A, E) n Бетаин – аналог SAM n Синтез холина в печени – нормализация липопротеидного обмена. n Синтез креатина – оптимизация энергообеспечения. 86

Воздействие 137 Cs на энергетический метаболизм мышечной ткани (1) n Инкорпорированный 137 Cs реализует свой эффект через неспецифическую систему защиты от низкоэнергетическое состояние (гипоксии). n При гипоксии ↑ NADH n Клетка продуцирует активные формы кислорода (АФК) и азота (АФА) – сигналы о гипоксии. n Миоциты сосудов при этом расслабляются, сосуды расширяются решается проблема оксигенации. n Продолжительно высокий уровень выработки АФК и АФА – угроза окружающим клеткам. n Апоптоз – элиминация несостоятельных клеток – скудение и старение популяции клеток. 87
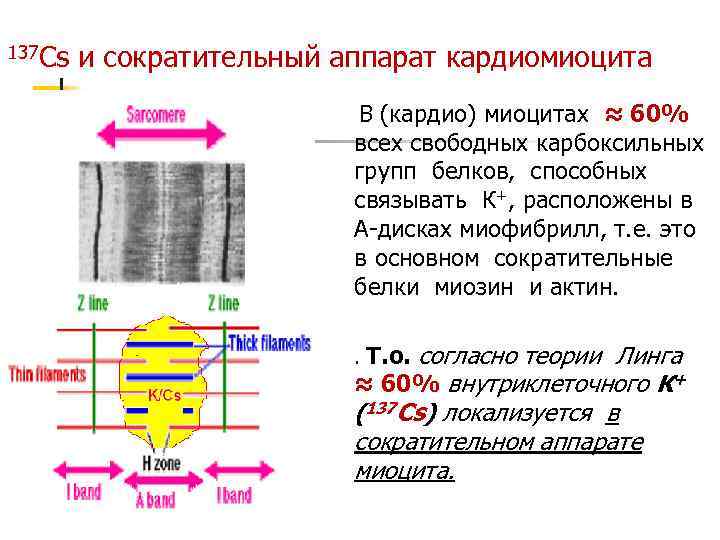
137 Cs и сократительный аппарат кардиомиоцита В (кардио) миоцитах ≈ 60% всех свободных карбоксильных групп белков, способных связывать К+, расположены в А-дисках миофибрилл, т. е. это в основном сократительные белки миозин и актин. . Т. о. согласно теории Линга ≈ 60% внутриклеточного К+ (137 Cs) локализуется в сократительном аппарате миоцита.

Воздействие 137 Cs на энергетический метаболизм мышечной ткани (2) n Инкорпорация 137 Cs (b-излучатель) ↑АФК. n ↑ Продукция АФК и АОА ведет к истощению АОЗ. n Клетки с инкорпорированным радионуклидом воспринимаются как несостоятельные и погибают путем апоптоза. n Создаются предпосылки для развития мышечных патологий. 89

137 Cs+ H+ O 2 + 1 2 3 4 - [H+] - 137 Cs+ АТФ Образование АФК Образование Активация ПОЛ лизоформ СЖК и др. Снижение H Разобщение ОФ Стимуляция дыхания и образования АТФ Деэнергизация - Набухание МХ + Повреждение клетки Усиление 1 – Электрофорез K+/ 137 Cs+ в МХ; Ослабление 2 – KATP-канал; Апоптоз 3 – K+/H+-антипортер; 4 – электронтранспортная цепь. Влияние 137 Cs на митохондрии 90

91

