
Биохимия мышц Картанбаев Б. 004 -1 к 1

Мышечная ткань • Мышечная ткань составляет 40– 42% от массы тела. Основная динамическая функция мышц – обеспечить подвижность путем сокращения и последующего расслабления. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую. 2

- мыщцы составляют 4045 % массы тела - единствен-ная система, которая превращает химическую энергию в механическую 3 типа мышечных волокон – поперечнополосатые, скелетные и гладкие

• Существует также деление на гладкие и поперечно-полосатые (исчерченные) мышцы. К поперечно-полосатым мышцам, помимо скелетных, относятся мышцы языка и верхней трети пищевода, внешние мышцы глазного яблока и некоторые другие. Морфологически миокард относится к поперечно-полосатой мускулатуре, но по ряду других признаков он занимает промежуточное положение между гладкими и поперечно-полосатыми мышцами. Поперечно-полосатая скелетная мускулатура 4

МОРФОЛОГИЧЕСКАЯ ОРГАНИЗАЦИЯ ПОПЕРЕЧНОПОЛОСАТОЙ МЫШЦЫ • Поперечно-полосатая мышца состоит из многочисленных удлиненных волокон , или мышечных клеток. Двигательные нервы входят в различных точках в мышечное волокно и передают ему электрический импульс, вызывающий сокращение. Мышечное волокно обычно рассматривают как многоядерную клетку гигантских размеров, покрытую эластичной оболочкой – сарколеммой. Диаметр функционально зрелого поперечно-полосатого мышечного волокна обычно составляет от 10 до 100 мкм, а длина волокна часто соответствует длине мышцы. 5

Ультраструктура мышечного волокна

ХИМИЧЕСКИЙ СОСТАВ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ В мышечной ткани взрослых животных и человека содержится от 72 до 80% воды. Около 20– 28% от массы мышцы приходится на долю сухого остатка, главным образом белков. Помимо белков, в состав сухого остатка входят гликоген и другие углеводы, различные липиды, экстрактивные азотсодержащие вещества, соли органических и неорганических кислот и другие химические соединения. 7

Повторяющимся элементом поперечно-полосатой миофибриллы является саркомер – участок миофибриллы, границами которого служат узкие Z-линии. Каждая миофибрилла состоит из нескольких сот саркомеров. Средняя длина саркомера 2, 5– 3, 0 мкм. В середине саркомера находится зона протяженностью 1, 5– 1, 6 мкм, темная в фазово-контрастном микроскопе. В поляризованном свете она дает сильное двойное лучепреломление. Эту зону принято называть диском А (анизотропный диск). В центре диска А расположена линия М, которую можно наблюдать только в электронном микроскопе. Среднюю часть диска А занимает зона Н более слабого двойного лучепреломления. Наконец, существуют изотропные диски, или диски I, с очень слабым двойным лучепреломлением. В фазовоконтраст-ном микроскопе они кажутся более светлыми, чем диски А. Длина дисков I около 1 мкм. Каждый из них разделен на две равные половины Z-мембраной, или Z-линией. 8

Структура миофибриллы
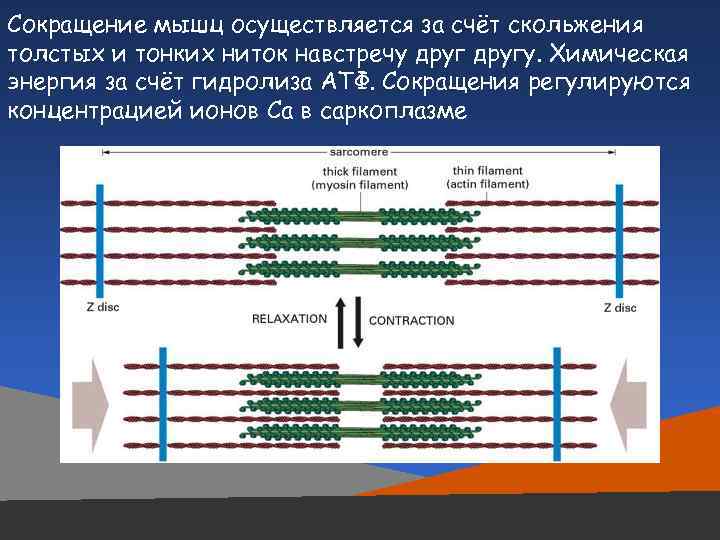
Сокращение мышц осуществляется за счёт скольжения толстых и тонких ниток навстречу другу. Химическая энергия за счёт гидролиза АТФ. Сокращения регулируются концентрацией ионов Са в саркоплазме
Белки мышц 3 вида: • Белки саркоплазмы • Белки миофибрил • Белки стромы

Белки саркоплазмы • Миогенная фракция (ферменты гликолиза и др. ) • Альбумины • Глобулины • Миоглобин (хромопротеин красного цвета, обеспечивает дыхание мышц)

К группе миофибриллярных белков относятся миозин, актин и актомиозин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
Миозин 14

Миозин составляет 50– 55% от сухой массы миофибрилл. Представление о миозине как о главном белке миофибрилл сложилось в результате работ А. Я. Данилевского, О. Фюрта, Э. Вебера и ряда других исследователей. Однако всеобщее внимание к миозину было привлечено лишь после опубликования работ В. А. Энгельгардта и М. Н. Любимовой (1939– 1942). В этих работах впервые было показано, что миозин обладает АТФазной активностью, т. е. способностью катализировать расщепление АТФ на АДФ и Н 3 РО 4. Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, превращается в механическую энергию сокращающейся мышцы. Молекулярная масса миозина скелетных мышц около 500000 (для миозина кролика 470000). Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с мол. массой 205000– 210000 и несколько коротких легких цепей, мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль ( «хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу ( «головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в «головке» миозиновой молекулы и принимающие участие в проявлении АТФазной активности миозина, гетерогенны по своему составу. Количество легких цепей в молекуле миозина у различных видов животных и в разных типах мышц неодинаково. Кратковременная обработка трипсиномрасщепляет молекулу миозина на два фрагмента. Из хвостового участка (С-концевой участок молекулы) образуется легкий меромиозин (ЛММ) - фрагмент длиной 90 нм, а из остальной части, включающей «головки» , - тяжелый меромиозин (ТММ). ЛММ, подобно миозину, образует нити, однако он не обладает АТФазной активностью и не связывает актин. ТММ катализирует гидролиз АТФ и связывает актин. ТММ можно расщепить далее путем более длительной обработки трипсином или папаином, в результате чего получается один S 2 -фрагмент длиной 40 нм с мол. массой 62000 и два S 1 -фрагмента с мол. массой 110000, представляющие собой «головки» миозина. 15
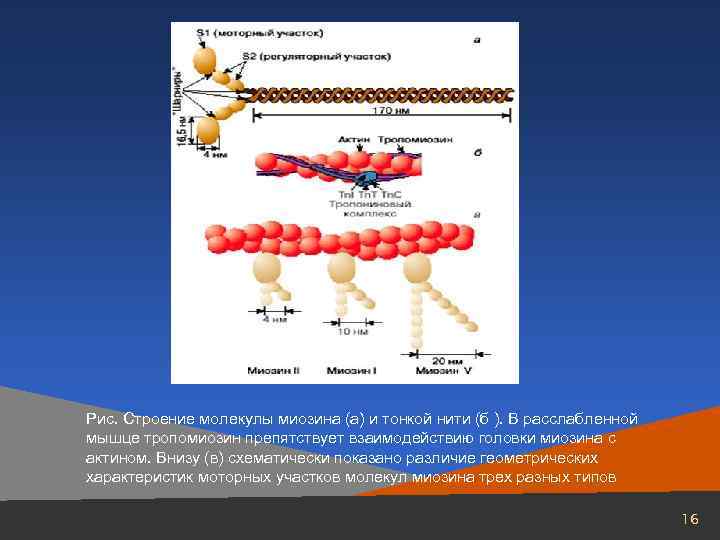
Рис. Строение молекулы миозина (а) и тонкой нити (б ). В расслабленной мышце тропомиозин препятствует взаимодействию головки миозина с актином. Внизу (в) схематически показано различие геометрических характеристик моторных участков молекул миозина трех разных типов 16
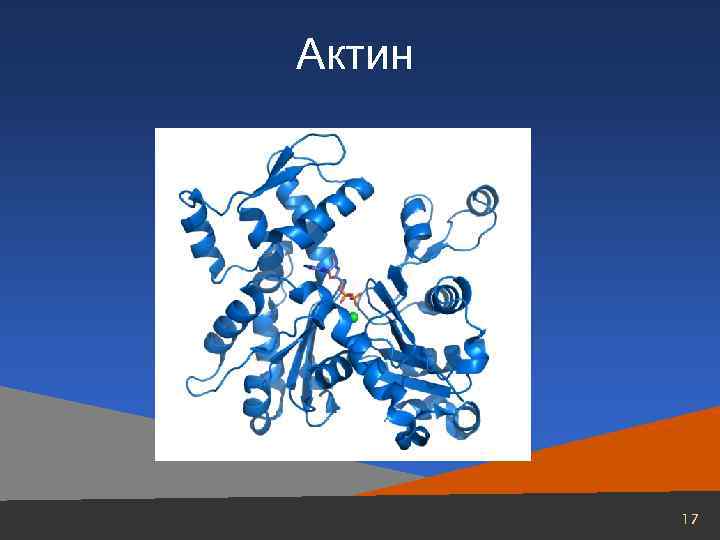
Актин 17

Актин, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Известны две формы актина: глобулярный актин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой. 18

Две формы актина: глобулярный G - актин, фибриллярный F – актин. Молекулы глобулярного актина нековалентно объединяются, образуя F- актин. Две цепи F- актина связаны в спираль

Актомиозин образуется при соединении миозина с F-актином. Актомиозин, как естественный, так и искусственный, т. е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств Fактина. Фермент актомиозин активируется ионами Mg 2+ и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg 2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения р. Н для обоих ферментов также различны. Как отмечалось, кроме рассмотренных основных белков, в миофибриллах содержатся также тропомиозин, тропонин и некоторые другие регуляторные белки. Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4– 7% всех белков миофибрилл. 20

Тропонин – глобулярный белок, открытый С. Эбаси в 1963 г. ; его мол. масса 80000. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са 2+. Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии ц. АМФ-зависимых протеинкиназ. 21

Рис. Структура тонкого филамента. 1 - актин; 2 - тропомиозин; 3 - тропонин С; 4 - тропонин I; 5 - тропонин Т. 22

23

• Белки стромы в поперечно-полосатой мускулатуре представлены в основном коллагеном и эластином. Известно, что строма скелетных мышц, остающаяся после исчерпывающей экстракции мышечной кашицы солевыми растворами с высокой ионной силой, состоит в значительной мере из соединительнотканных элементов стенок сосудов и нервов, а также сарколеммы и некоторых других структур. 24

Небелковые азотистые экстрактивные вещества В скелетных мышцах содержится ряд важных азотистых экстрактивных веществ: адениновые нуклеотиды(АТФ, АДФ и АМФ), нуклеотиды неаденинового ряда, креатинфосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др. Концентрация адениновых нуклеотидов в скелетной мускулатуре кролика (в микромолях на 1 г сырой массы ткани) составляет: АТФ – 4, 43, АДФ – 0, 81, АМФ – 0, 93. Количество нуклеотидов неаденинового ряда (ГТФ, УТФ, ЦТФ и др. ) в мышечной ткани по сравнению с концентрацией адениновых нуклеотидов очень мало. На долю креатина и креатинфосфата приходится до 60% небелкового азота мышц. Креатинфосфат и креатин относятся к тем азотистым экстрактивным веществам мышц, которые участвуют в химических процессах, связанных с мышечным сокращением. К азотистым веществам мышечной ткани принадлежат имидазолсодержащие дипептиды карнозин и ансерин. Карнозин был открыт В. С. Гулевичем в 1900 г. ; метилированное производное карнозина ансерин был обнаружен в мышечной ткани несколько позже. 25
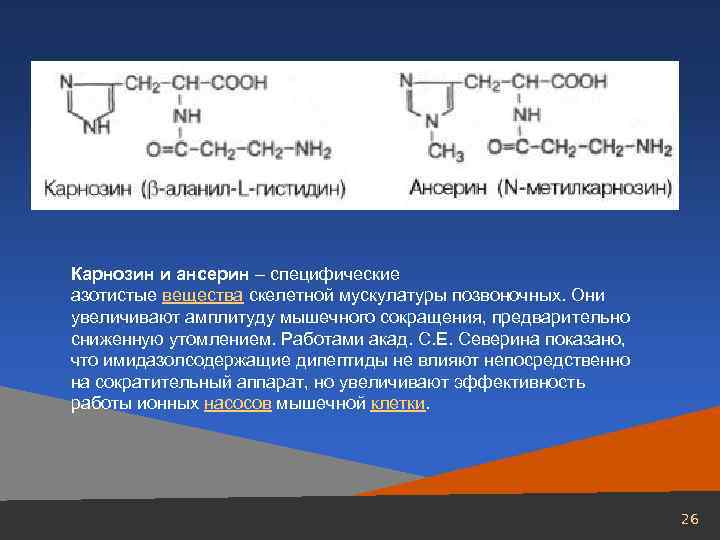
Карнозин и ансерин – специфические азотистые вещества скелетной мускулатуры позвоночных. Они увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением. Работами акад. С. Е. Северина показано, что имидазолсодержащие дипептиды не влияют непосредственно на сократительный аппарат, но увеличивают эффективность работы ионных насосов мышечной клетки. 26

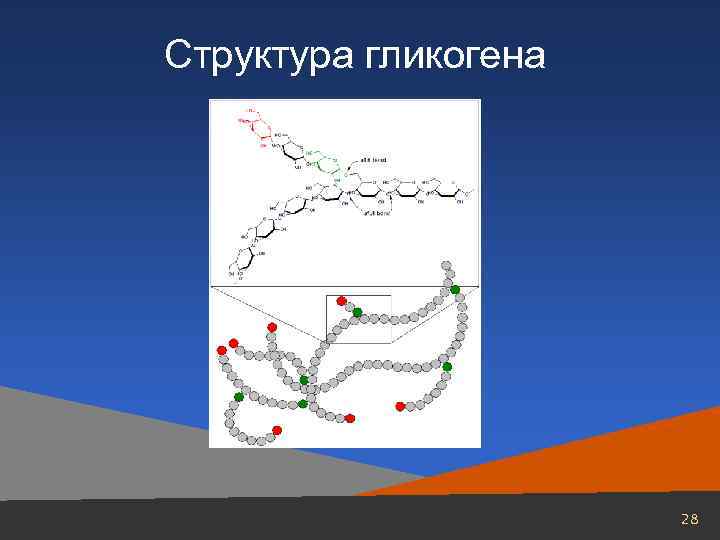
Безазотистые вещества Одним из основных представителей безазотистых органических веществ мышечной ткани является гликоген. Его концентрация колеблется от 0, 3 до 2% и выше. На долю других представителей углеводов приходятся десятые и сотые доли процента. В мышцах находят лишь следы свободной глюкозы и очень мало гексозофосфатов. В процессе метаболизма глюкозы, а также аминокислот в мышечной ткани образуются молочная, пировиноградная кислоты и много других карбоновых кислот. В том или ином количестве в мышечной ткани обнаруживаются также триглицериды и холестерин. 27
Структура гликогена 28

Состав неорганических солей в мышцах разнообразен. Из катионов больше всего калия и натрия. Калий сосредоточен главным образом внутри мышечных волокон, а натрий – преимущественно в межклеточном веществе. Значительно меньше в мышцах магния, кальция и железа. В мышечной ткани содержится ряд микроэлементов: кобальт, алюминий, никель, б ор, цинк и др. 29

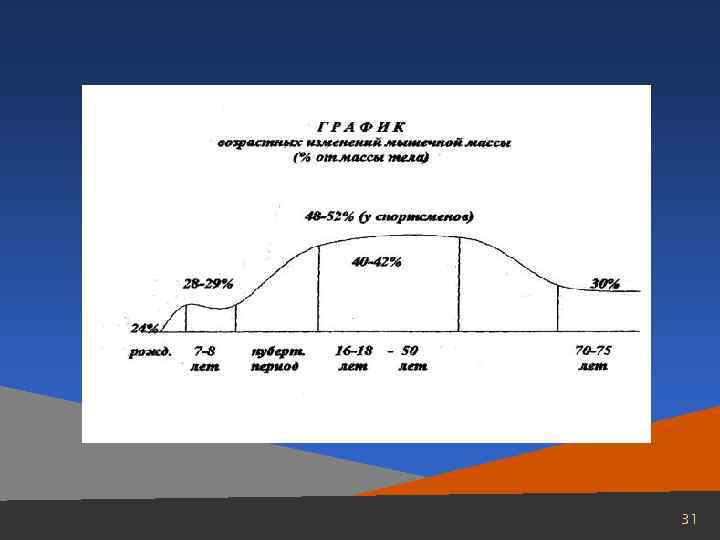
ИЗМЕНЕНИЕ ХИМИЧЕСКОГО СОСТАВА МЫШЕЧНОЙ ТКАНИ В ОНТОГЕНЕЗЕ Эмбриональная мышечная ткань по своему химическому составу значительно отличается от скелетной мускулатуры взрослых особей. В мышцах эмбрионов больше воды, чем в функционально зрелой мускулатуре. Соответственно общее содержание белка в мышечной ткани эмбрионов в пересчете на сырую ткань оказывается более низким, чем в мышцах животных того же вида в постнатальном периоде развития. По сравнению с мышцами взрослого организма в функционально незрелой мышце ниже содержание миофибриллярных белков (миозина и актомиозина) и выше – белков стромы, миоальбумина, а также глобулинов. По мере развития плода количество миофибриллярных белков увеличивается и возрастает АТФазная активность в мышечных экстрактах. Для эмбриональной мышечной ткани характерно высокое содержание нуклеопротеинов, а также РНК и ДНК. По мере развития эмбриона количество нуклеопротеинов и нуклеиновых кислот в мышечной ткани быстро уменьшается. Высокоэнергетических соединений (АТФ и креатинфосфат) в функционально незрелой мышце значительно меньше, чем в мышцах зрелых особей. Имидазолсодержащие дипептиды (ансерин и карнозин) появляются в мышечной ткани в строго определенный период онтогенеза. Время появления этих дипептидов тесно связано с мышечной функцией и совпадает с формированием рефлекторной дуги, обеспечивающей возможность двигательного рефлекса, появлением Са 2+-чувствительности актомиозина и началом работы ионных насосов. Имеются также характерные особенности в ферментных и изоферментных спектрах эмбриональной мышечной ткани. Так, установлено, что в ходе онтогенезаизменяется изоферментный спектр ЛДГ. В экстрактах из скелетных мышц 3– 5 -месячного эмбриона на долюизоферментов ЛДГ 3 и ЛДГ 2 приходится соответственно 40 и 31% от общей активности ЛДГ. В процессе эмбрионального развития в скелетной мускулатуре происходят постепенное возрастание активности катодных и снижение активности анодных изофер-ментов ЛДГ, так что у взрослых особей в скелетной мускулатуре наибольшейактивностью обладают уже изоферменты ЛДГ 5 и ЛДГ 4. В процессе развития плода изменяется также изоферментный спектр гексокиназы в мышечной ткани: повышается активность изофермента I и снижается активность изофермента. II. Приведенные данные об изменении химического состава мышечной ткани в онтогенезе относятся почти исключительно к скелетной мускулатуре. 30
31

Биохимия мышечного сокращения • Потенциал действия распространяется вдоль мышечного волокна. • Сигнал передаётся на цистерны эндоплазматической сетки • Изменяется проницаемость мембран для ионов Са и они выходят в саркоплазму

• Ионы Са присоединяются к кальцийсвязывающей субъединице тропонина тонких филаментов • Изменяется конформация белка • Молекула тропомиозина перемещается по желобку тонкого филамента • На молекулах глобулярного актина открываются центры связывания с головками миозина

• АТФ необходим для сокращения мышц и для расслабления • При недостаточности АТФ мостики между актином и миозином не разрываются • Филаменты фиксируются в соединённом положении – контрактура мышцы (трупное окоченение после смерти)

Источники энергии для мышечной работы • АТФ 5 мкмоль на 1 г ткани хватает на 2 -3 сек. • Креатинфосфат – до 10 сек • Гликолиз • Окислительное фосфорилирование

36

Энергетическое обеспечение мышечной деятельности 37

Ресинтез АТФ: • анаэробный механизм; • аэробный механизм.

Анаэробные механизмы: • креатинфосфокиназный (алактатный) механизм, обеспечивающий ресинтез АТФ за счет перефосфорилирования между креатинфосфатом и АДФ; • гликолитический (лактатный) механизм, обеспечивающий ресинтез АТФ в процессе анаэробного расщепления гликогена мышц или глюкозы крови с образованием молочной кислоты; • миокиназный механизм, осуществляющий ресинтез АТФ за счет реакции перефосфорилирования между двумя AДФ с участием миокиназы (аденилаткиназы).

Общий КПД при преобразовании энергии метаболических процессов в механическую работу (Ем) зависит от двух показателей: • эффективности преобразования выделяемой в ходе метаболических превращений энергии в энергию ресинтезируемых АТФ, т. е. эффективности фосфорилирования (Еф); • эффективности преобразования АТФ в механическую работу, т. е. эффективности электромеханического сопряжения (Ее); Ем = (Еф/Ее) ∙ 100
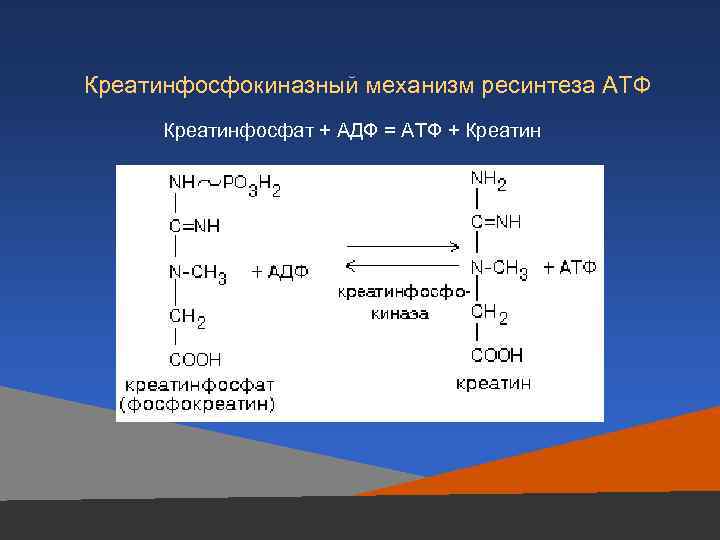
Креатинфосфокиназный механизм ресинтеза АТФ Креатинфосфат + AДФ = АТФ + Креатин
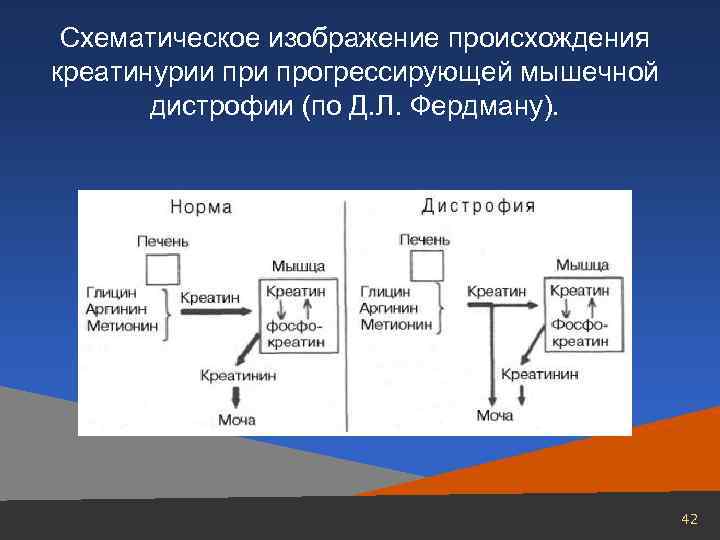
Схематическое изображение происхождения креатинурии прогрессирующей мышечной дистрофии (по Д. Л. Фердману). 42
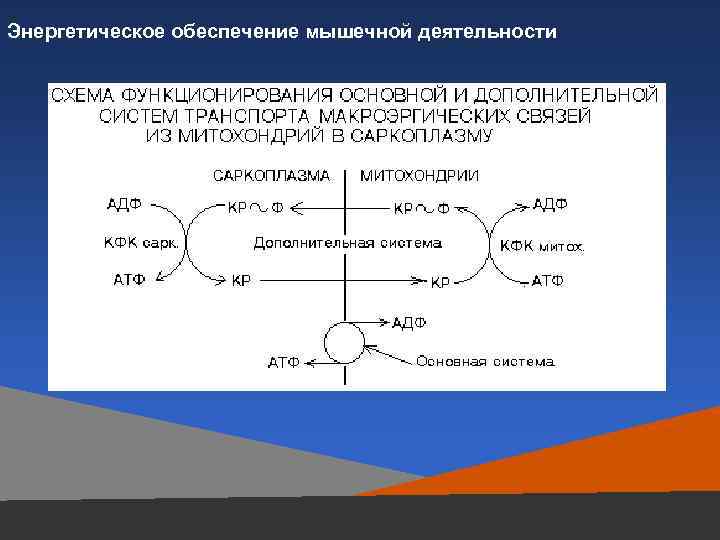
Энергетическое обеспечение мышечной деятельности

Гликолитический механизм ресинтеза АТФ Активация глюкозо-аланинового цикла при мышечной работе

Миокиназный механизм ресинтеза АТФ 2 AДФ → АТФ + АМФ

Аэробный механизм ресинтеза АТФ Скорость образования АТФ в процессе окислительного фосфорилирования зависит от: • соотношения АТФ/AДФ, при отсутствии AДФ синтез АТФ не происходит; • количества кислорода и эффективности его использования; • активности окислительных ферментов; • целостности мембран митохондрий; • количества митохондрий; • концентрации гормонов, ионов кальция и других регуляторов.

Взаимосвязь анаэробных и аэробных превращений в скелетных мышцах: энерго-транспортный «челнок» с участием миофибриллярных и митохондриальных изоферментов креатинфосфокиназы

Энергетическое обеспечение мышечной деятельности Соотношение анаэробных и аэробных механизмов ресинтеза АТФ при мышечной нагрузке Изменения скорости анаэробного и аэробного образования энергии в зависимости от предельного времени упражнения.

БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ В МЫШЦАХ ПРИ ПАТОЛОГИИ • изменениями состава белковых фракций, снижается количество миофибриллярных белков и увеличивается содержание саркоплазматического и белков стромы; • уменьшением запасов АТФ, креатинфосфата, дипептид — карнозина и анзерина; • снижением АТФазного активности миозина; • нарушением баланса фосфолипидов: концентрация фосфатидилхолина и фосфатидилэтаноламина значительно снижается, а сфингомиелина и лизофосфатидилхолину повышается; • изменением метаболизма креатина — концентрация в крови повышается, наблюдается креатинурия. При этом экскреция креатинина с мочой уменьшается, что, вероятно, обусловлено уменьшением скорости захвата креатина из крови и его фосфорилирования в мышцах; 49

• • — дисферментемиею — возрастает активность лизосомальных энзимов, снижается активность саркоплазматического и митохондриальных ферментов; — нарушением ц. АМФзалежнои системы регуляции активности ферментов. 50

Недостаточность энергии АТФ приводит к: • нарушение функционирования ионных насосов — ионы Na +, Сl поступают в клетке, К + — выходят из нее; увеличивается концентрация Са + + в цитозоле; • вследствие ацидоза ионы Са + + отщепляются от тропонина, тормозится АТФазная активность миозина, происходит диссоциация актомиозинового комплекса — снижается сократимость миокарда; • накопление в цитозоле ионов Na +, Са + +, АМФ, молочной кислоты, пирувата и других продуктов метаболизма способствует поступлению воды в клетки миокарда, их набухание и постепенное разрушение; • нарушение проницаемости мембран приводит к высвобождению из миокардиоцитов в кровь ферментов — креатинфосфокиназы (КФКМВ), гликогенфосфорилазы, аспартатаминотрансферазы (АСТ), изоферментов лактатдегидрогеназы (ЛДГ 1, ЛДГ 2). 51

Ишемическая болезнь сердца сопровождается рядом других метаболических нарушений: • • изменяется белковый спектр миокарда — количество миофибриллярных белков уменьшается, накапливаются белки стромы; • • нарушается окисления свободных жирных кислот, они ис пользуемые на синтез триглицеридов, вследствие чего развивается жировая инфильтрация сердечной мышцы; • • активируются лизосомальные протеазы, фосфолипазы, содержание фосфолипидов снижается, накапливаются продукты перекисного окисления липидов, разрушаются клеточные мембраны. 52

СПАСИБО ЗА ВНИМАНИЕ! 53