БИОХИМИЯ МЫШЦ.ppt
- Количество слайдов: 34

БИОХИМИЯ МЫШЦ и МЫШЕЧНОГО СОКРАЩЕНИЯ ТАМБОВЦЕВА Р. В. д. б. н. , профессор РГУКСМи. Т Москва

n n n n n В организме взрослого мужчины мышцы составляют более 40 % общей массы тела. У женщин – около 35 % У пожилых людей – около 30 % У детей – около 25 % У спортсменов, специализирующихся в силовых видах спорта – 50 -55 % У культуристов – 60 -70 % общей массы тела. Мышцы благодаря сократительной функции обеспечивают процессы движения. При сокращении мышц постоянно используется химическая энергия АТФ, которую они преобразуют в кинетическую (механическую) энергию. Проявление различных двигательных качеств человека, особенно силы и скорости, зависит от морфологического строения мышц, особенностей протекания биохимических процессов в них, а также от регуляторного воздействия нервной системы, т. е. от функционирования мышц.

n n n В организме человека существуют три типа мышц: скелетные, сердечные (миокард) и гладкие. Различаются они морфологическими, биологическими, функциональными особенностями и путями развития. При микроскопическом исследовании в скелетных и сердечных мышцах обнаруживается исчерченность – поперечнополосатые мышцы. В гладких мышцах исчерченность отсутствует. Сердечная мышца обладает свойствами: возбудимость, проводимость, сократимость. Сокращается ритмично с последовательно изменяющимися циклами сокращения: систола, диастола. Сокращение регулируется гормонами. Сокращение гладких мышц инициируется нервными импульсами, некоторыми гормонами и не зависит от воли человека, так как их тонус не контролируется нашим сознанием. Гладкие мышцы: мышцы внутренних органов, системы пищеварения, стенок кровеносных сосудов, кожи, матки. Скелетные мышцы прикреплены к костям. Сокращение инициируется нервными импульсами и подчиняется сознательному контролю, осуществляется произвольно.

СТРУКТУРНАЯ ОРГАНИЗАЦИЯ СКЕЛЕТНЫХ МЫШЦ ЧЕЛОВЕКА n Отдельные мышцы части тела окружены соединительной тканью и имеет сложное морфологическое строение. Каждая мышца состоит из пучка мышечных волокон, которые содержат многочисленные сократительные нити – миофибриллы.

МЫШЕЧНОЕ ВОЛОКНО n n n n n Мышечное волокно является структурной единицей скелетных мышц. Это большая многоядерная клетка – симпласт. В процессе развития мышечная клетка образуется путем слияния множества эмбриональных отдельных клеток – миобластов. Мышечное волокно покрыто плазматической мембраной – сарколеммой. Сарколемма покрыта сетью коллагеновых волокон, придающих ей прочность и эластичность. Мембрана мышечных клеток играет важную роль в возникновении и возбуждении. Длина отдельных мышечных клеток может достигать 10 см (портняжная мышца) и даже 50 см, толщина до 0, 1 мм. К мышечному волокну подходят окончания двигательных нервов и кровеносные сосуды. Двигательный нерв или мотонейрон имеет разветвленные аксоны и может иннервировать несколько мышечных волокон – это функциональная единица мышцы – нейромоторная или двигательная единица Отдельная мышца состоит из из многих двигательных единиц, которые могут неодновременно подключаться к мышечному сокращению. Сила и скорость сокращения мышцы зависит от количества участвующих в сокращении двигательных единиц, а также от частоты нервных импульсов. Мышечное волокно способно к делению за счет удвоения и за счет клеток сателлитов. В мышце количество волокон может достигать несколько тысяч.
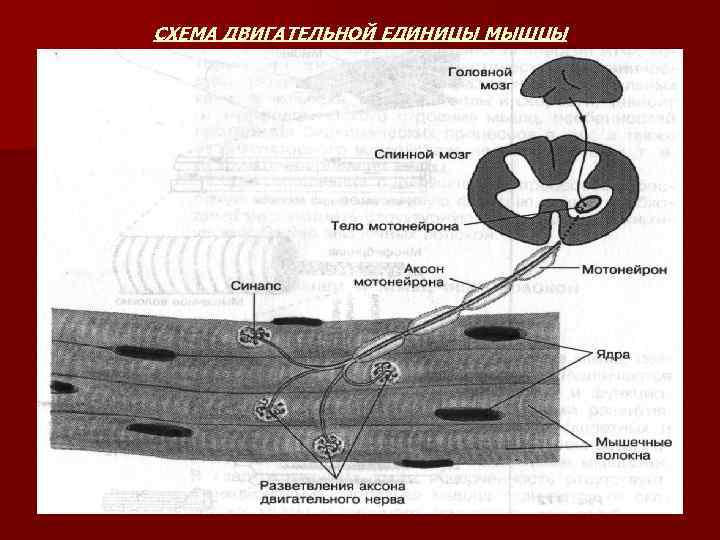
СХЕМА ДВИГАТЕЛЬНОЙ ЕДИНИЦЫ МЫШЦЫ

СТРУКТУРНАЯ ОРГАНИЗАЦИЯ МЫШЕЧНЫХ ВОЛОКОН n На сарколемме находятся места контакта с окончаниями двигательных нервов – СИНАПСЫ. Сарколемма обладает избирательной проницаемостью для различных вещейств и имеет транспортные системы, с помощью которых поддерживается разная концентрация Na+, К+, CI- внутри клетки и в межклеточной жидкости. Что приводит к возникновению мембранного потенциала

НЕРВНО-МЫШЕЧНАЯ ПЕРЕДАЧА n n n n При достижении нервным импульсом концевой веточки аксона происходит деполяризация ее мембраны, что повышает ее проницаемость и выделение некоторого количества АХ в синаптическую щель. Выделившийся АХ диффундирует через синаптическую щель и вступает в реакцию с холинрецепторами на постсинаптической мембране мышечного волокна. При образовании комплекса АХ-рецептор увеличивается ионная проницаемость мембраны концевой пластинки (постсинаптическая мембрана). Это приводит в возникновению локального электрического потенциала – ПКП – потенциал концевой пластинки. Достигнув пороговой величины (30 м. В), ПКП возбуждает соседнюю мембрану МВ и вызывает ПДМВ. Скорость распространения нервного импульса – 5 м/с. n ТРИ ЗВЕНА: Э- Х - Э Электрическое – нервный импульс Химическое - АХ с образованием комплекса «АХ – рецептор» Электрическое – потенциал действия мышечного волокна. Для проведения возбуждения через синапс – 0, 5 секунд – это время синаптическая задержка: а) время для освобождения АХ из нервного окончания, б) время диффузии АХ от пресинаптической мембраны к постсинаптической в) время для взаимодействия АХ с рецептором концевой пластинки.

Запасов АХ в нервном окончании достаточно для проведения около 10000 импульсов от мотонейрона. Запасы АХ непрерывно восполняются. 1. При длительной импульсации мотонейрона содержание АХ уменьшается – в результате нарушение в передаче возбуждения – ПРЕСИНАПТИЧЕСКИЙ НЕРВНО-МЫШЕЧНЫЙ БЛОК. 2. Комплекс «АХ-рецептор» быстро разрушается ферментом – ацетилхолинэстеразой(АХЭ). Восстанавливается исходная проницаемость постсинаптической мембраны, затухает ПКП. 3. Однако при длительной высокочастотной импульсации мотонейрона в синаптической цели может накапливаться избыток АХ, который не успевает разрушаться. 4. Развивается ПОСТСИНАПТИЧЕСКИЙ нервно-мышечный блок. 5. ОБА ТИПА НЕРВНО-МЫШЕЧНОГО БЛОКА МОГУТ БЫТЬ ПРИЧИНОЙ СНИЖЕНИЯ СОКРАТИТЕЛЬНОЙ СПОСОБНОСТИ МЫШЦ (ПЕРИФЕРИЧЕСКОЕ УТОМЛЕНИЕ) В ПРОЦЕССЕ НАПРЯЖЕННОЙ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ.

СТРОЕНИЕ МИОФИБРИЛЛЫ И САРКОМЕРА n n n n Миофибриллы – это сократительные элементы мышечного волокна, количество которых может достигать нескольких тысяч. Поперечная исчерченность – повторяющиеся темные и светлые участки. Темные участки или А-диски в центре имеют более светлую Н -зону, посредине которой проходит темная М-линия. Светлые или Iдиски в центре пересекаются узкой Z-линией (Z-мембрана). Участок миофибриллы между двумя Z-мембранами называют САРКОМЕРОМ. Это наименьшая сократительная единица мышцы. Каждая миофибрилла состоит из многочисленных параллельных толстых и тонких миофиламентов. Толстые нити находятся в А-дисках и состоят из белка миозина. Тонкие нити находятся в I-дисках и содержат белки актин, тропомиозин и тропонин. Располагаются тонкие нити вокруг толстого миозинового филамента по углам шестигранника таким образом, что каждая тонкая нить занимает симметричное положение между тремя толстыми нитями, а каждая толстая нить симметрично окружена шестью тонкими нитями. Толстые и тонкие нити миофибрилл взаимодействуют между собой посредством поперечных мостиков, расположенных вдоль толстой миозиновой нити. При сокращении мышцы длина толстых и тонких нитей не изменяется , а укорачивается расстояние между Z-мембранами в саркомерах.
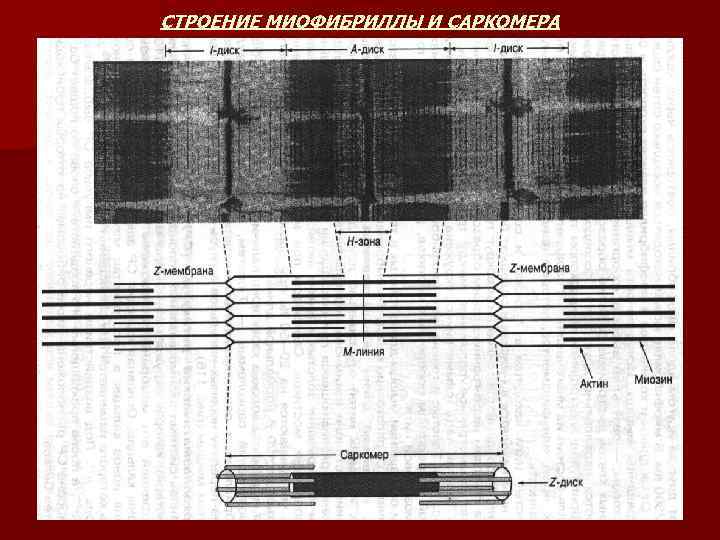
СТРОЕНИЕ МИОФИБРИЛЛЫ И САРКОМЕРА

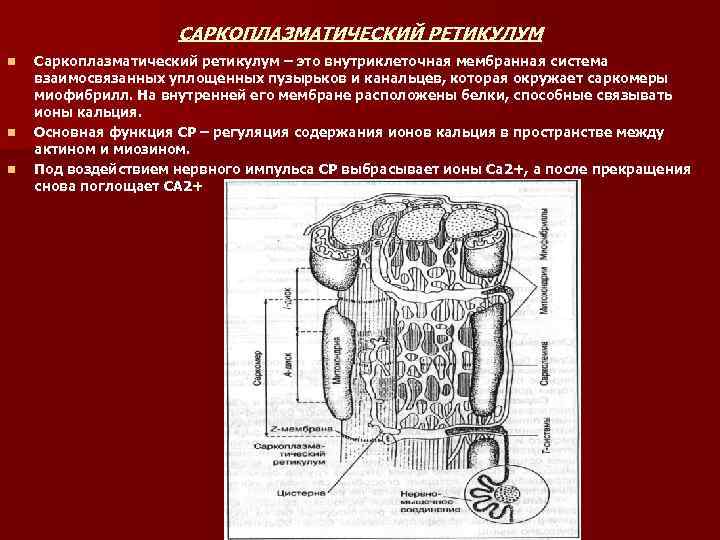
САРКОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ n n n Саркоплазматический ретикулум – это внутриклеточная мембранная система взаимосвязанных уплощенных пузырьков и канальцев, которая окружает саркомеры миофибрилл. На внутренней его мембране расположены белки, способные связывать ионы кальция. Основная функция СР – регуляция содержания ионов кальция в пространстве между актином и миозином. Под воздействием нервного импульса СР выбрасывает ионы Са 2+, а после прекращения снова поглощает СА 2+

МИТОХОНДРИИ n n n МИТОХОНДРИИ - образуется до 90 % АТФ. Имеет гладкую наружную и внутреннюю складчатую мембраны, матрикс. В матриксе находятся ферменты окисления пирувата и жирных кислот, а также в высокой концентрации растворимые ферменты цикла лимонной кислоты. Здесь же содержатся АДФ, Ко. А, НАД и все вещества обеспечивающие митохондриальный синтез белка. Наружная мембрана отделяет внутреннюю часть митохондрий от цитоплазмы клетки. Она содержит различные белки, образующие широкие каналы, по которым легко проникают молекулы веществ с mm 10000 дальтон. В ней находятся ферменты расщепляющие липиды и способствующие их последующему перемещению в матрикс митохонрий. Внутренняя мембрана образует многочисленные складки – кристы. Во внутренней мембране находятся главные ферментные комплексы, участвующие в передаче электронов на кислород (дыхательная цепь) и обеспечивающие процессы окисления. На ее поверхности, обращенной в сторону матрикса, находятся ферменты, осуществляющие синтез АТФ за счет энергии процесса окисления (АТФ-синтетазный-комплекс). Внутренняя мембрана регулирует перенос метаболитов в матрикс и выход из него АТФ, АДФ, отдельных аминокислот, жирных кислот, ионов Са 2+. Эта мембрана практически непроницаема даже для многих малых молекул, так как на ней создается электрохимический градиент протонов водорода (Н+). Пространство между наружной и внутренней мембранами - межмембранное пространство – в нем находятся ферменты, которые катализируют перенос фосфата от АТФ на другие нуклеотиды и на свободные молекулы креатина. Митохондрии могут передвигаться в клетке и находится в месте, где в большей степени используется энергия АТФ. В работающих мышцах они располагаются между миофибриллами и обеспечивают энергией процесс сокращения.
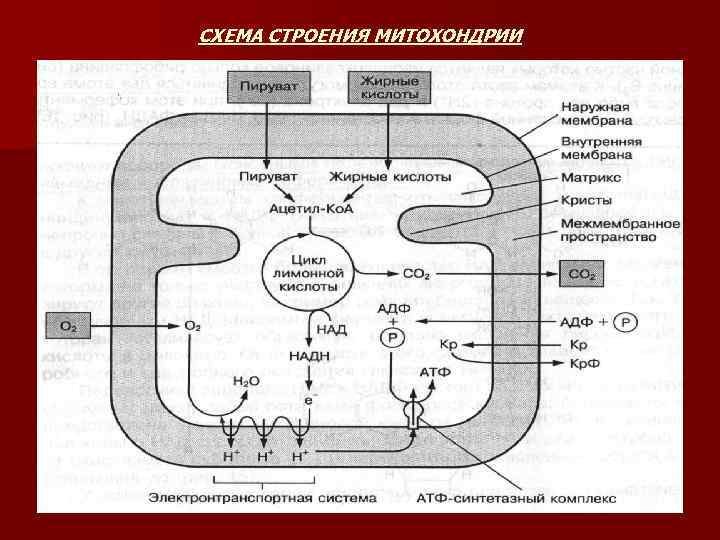
СХЕМА СТРОЕНИЯ МИТОХОНДРИИ

ХИМИЧЕСКИЙ СОСТАВ МЫШЕЧНОЙ ТКАНИ n В мышечной ткани 72 -80 % воды и 20 -28% сухого остатка от массы мышц.

ОСНОВНЫЕ БЕЛКИ МЫШЦ n n n ТРИ ГРУППЫ: Саркоплазматические белки – 35%; Миофибриллярные белки – 45 %; Белки стромы – 20% Саркоплазматические белки – растворимы в воде и слабых солевых растворах. Это белки-ферменты, локализованные в митохондриях и катализирующие процессы окислительного фосфорилирования, ферменты гликолиза, азотистого и липидного обменов, находящихся в саркоплазме. Белок миоглобин, который связывает кислород с большим сродством, чем гемоглобин и депонирует молекулярный кислород в мышцах. Саркоплазматические белки – парвальбумины, связывающие ионы Са+ МИОФИБРИЛЛЯРНЫЕ БЕЛКИ: миозин, актин и актомиозин, регуляторные белки: тропомиозин, тропонин, альфа- и бета-актинины. МИОЗИН – основной сократительный белок – 55% общего количества белков мышцы. Ьь 470000. В молекуле миозина различают длинную фибриллярную часть и глобулярные головки. Фибриллярная часть молекулы миозина имеет двуспиральную структуру. В составе молекулы выделяют 6 субъединиц: две тяжелые полипептидные цепи (мм 200000) и 4 легкие цепи (мм 1500 -2700), расположенные в глобулярной части. На головке молекулы миозина расположены активный центр АТФ-азы и актинсвязывающий центр, которые обеспечивают гидролиз АТФ и взаимодействие с актиновыми филаментами. Молекула миозина содержит большое количество глутаминовой аминокислоты и имеет большой отрицательный заряд. Это усиливает связывание свободных ионов Са 2+ и Mg 2+ и повышается АТФ-азная активность миозина и скорость гидролиза АТФ.
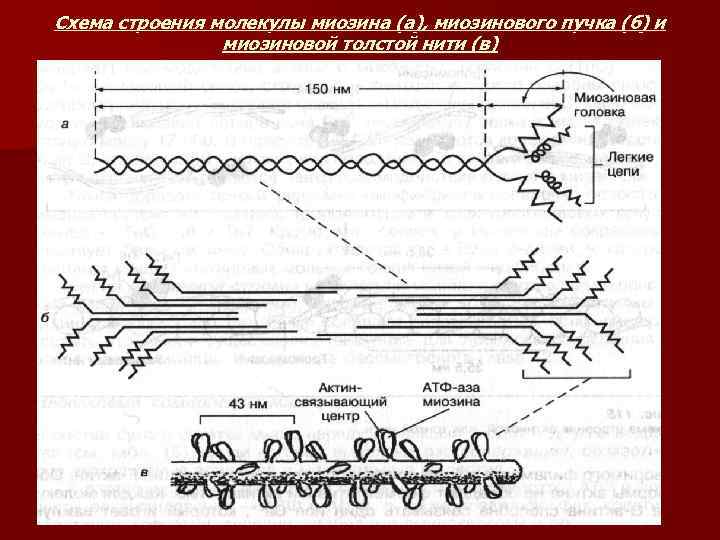
Схема строения молекулы миозина (а), миозинового пучка (б) и миозиновой толстой нити (в)

n n n АКТИН – второй сократительный белок мышц, который составляет основу тонких нитей. Две формы – глобулярный G-актин и фибриллярный F-актин. Глобулярный актин – это шарообразный белок с мм 42000. На его долю приходится 25% общей массы мышечного белка. В присутствии Mg 2+ актин подвергается нековалентной полимеризации с образованием растворимого филамента в виде спирали – F-актин. Обе формы актина не обладают ферментной активностью. Каждая молекула G-актина способная связывать один ион Са 2+, который играет важную роль в инициировании сокращения. Молекула G-актина прочно связывает одну молекулу АТФ или АДФ. Связывание АТФ с G-актином обычно сопровождается его полимеризацией с образованием F-актина и одновременным расщеплением АТФ до АДФ и фосфата. F-актин активирует АТФ-азу миозина, что создает движущую силу процессу сокращения. Актин способен взаимодействовать с миозином, образуя актомиозиновый комплекс. ТРОПОМИОЗИН (Тм) это структурный белок актиновой нити, вытянутая в виде тяжа молекула. Две его полипептидные нити обвивают актиновые нити. ТРОПОНИН (Тн) является регулаторным белком актиновой нити. Состоит из трех субъединиц – Тн. Т, Тн. I и Тн. С Тропонин Т (Тн. Т) обеспечивает связывание этих белков с тропомиозином. Тропонин I (Тн. I) блокирует взаимодействие актина с миозином. Тропонин С (Тн. С) – это Са 2+ связывающий белок. В присутствии СА 2+ изменяется конформация тропонина С, что приводит к изменению положения Тн по отношению к актину, в результате чего открывается центр взаимодействия актина с миозином.
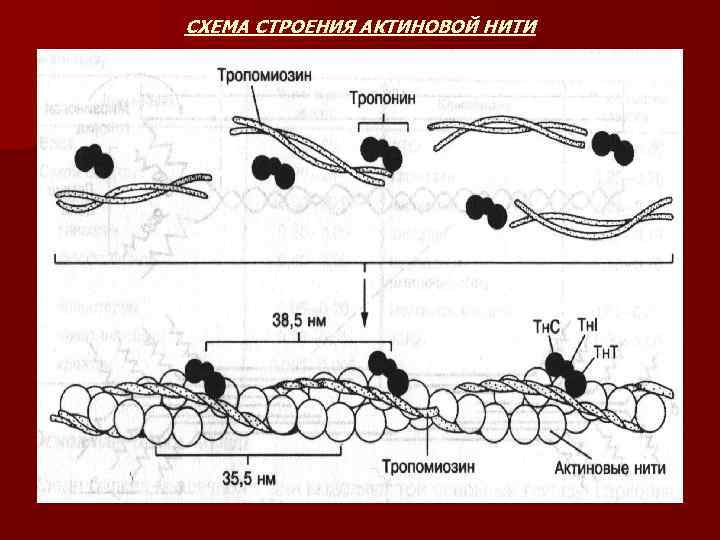
СХЕМА СТРОЕНИЯ АКТИНОВОЙ НИТИ
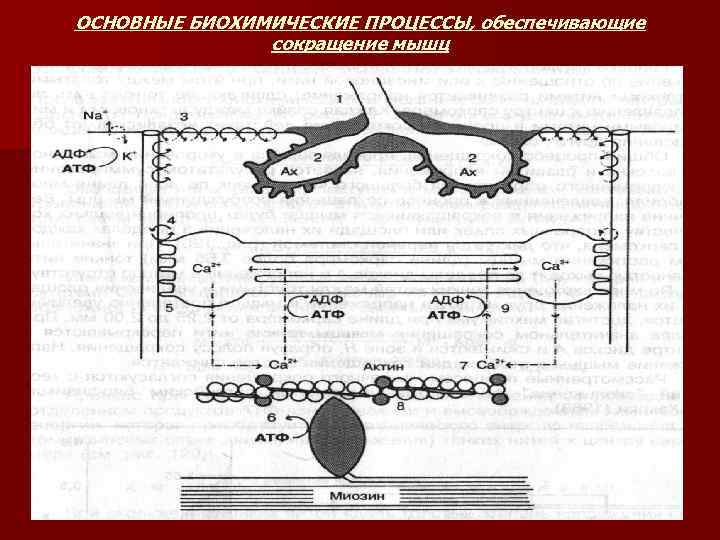
ОСНОВНЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ, обеспечивающие сокращение мышц
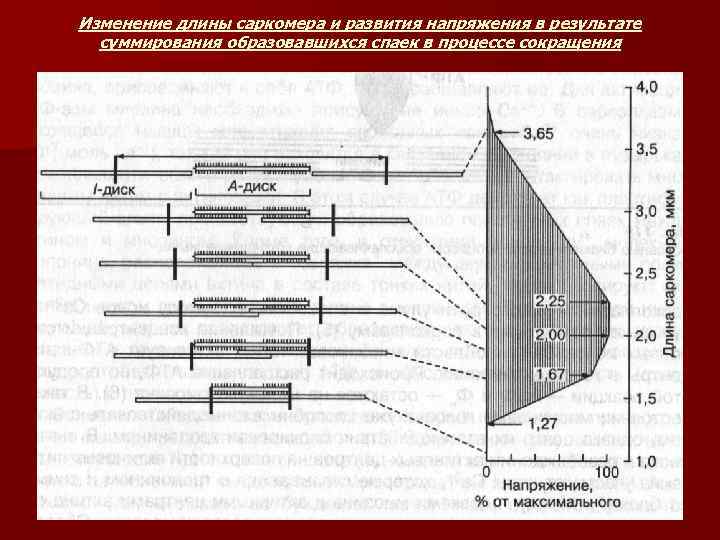
Изменение длины саркомера и развития напряжения в результате суммирования образовавшихся спаек в процессе сокращения

МОЛЕКУЛЯРНЫЙ ХИМИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ
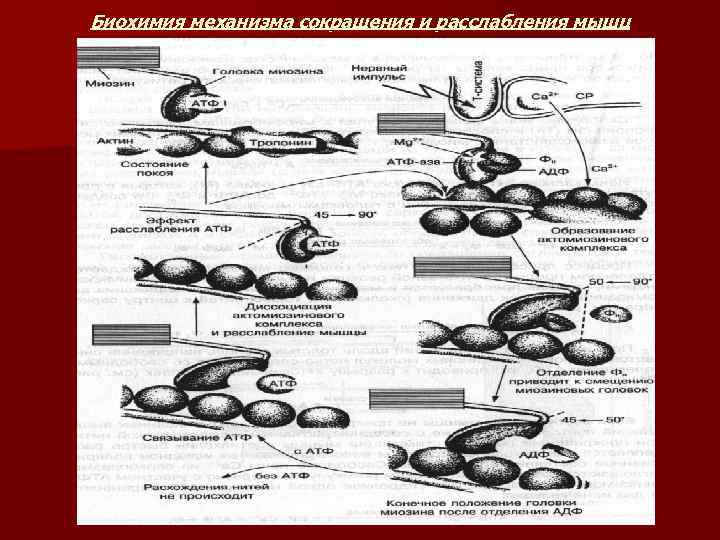
Биохимия механизма сокращения и расслабления мышц

n 1. 2. 3. 4. В процессе сокращения и расслабления мышц АТФ выполняет следующую роль: В покоящейся мышце – препятствует соединению актиновых нитей с миозиновыми. В процессе сокращения мышцы – АТФ поставляет необходимую энергию для движения тонких нитей относительно толстых, что приводит к укорочению мышцы или развития напряжения. В процессе расслабления – обеспечивает энергией активный транспорт Са 2+ в ретикулум. Для поддержания сократительной функции мышцы концентрация АТФ должна быть от 2 до 5 ммоль х кг -1.
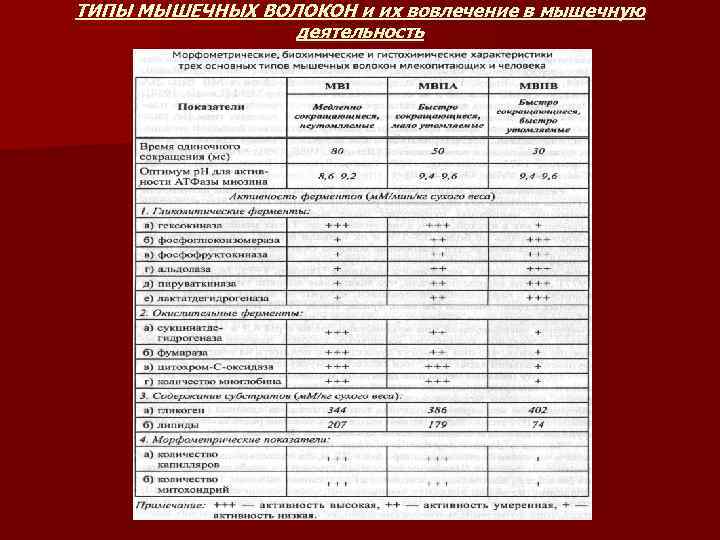
ТИПЫ МЫШЕЧНЫХ ВОЛОКОН и их вовлечение в мышечную деятельность
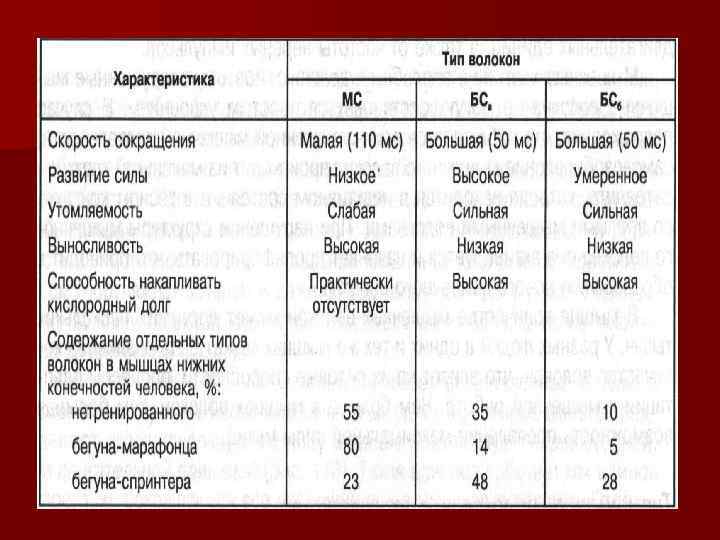



Тип I – аэробные механизмы энергообразования, обеспечивают работу на выносливость n Тип IIA – высокая анаэробная гликолитическая и аэробная способность ресинтеза АТФ Используются при интенсивной работе на выносливость. Например, при беге на 1000 м или плавании на 400 м. n Тип IIB – высокие анаэробные способности ресинтеза АТФ. Кратковременная мышечная деятельность взрывного характера. Например бег на 100 м или плавание на 50 м. n

РЕКРУТИРОВАНИЕ МВ ВРАБОТУ РАЗНОЙ ИНТЕНСИВНОСТИ n n n n При физической работе небольшой интенсивности – около 20 -25% уровня максимальной силы сокращений – в работу вовлекаются в основном МВ I. При более интенсивной работе – 25040% уровня максимальной силы сокращений – включаются МВ IIA. При интенсивности работы выше 40% максимальной мощности включаются МВ IIB. Однако даже при максимальной интенсивности в работу вовлекаются не все МВ: у нетренированных людей – не более 55 -65% имеющихся МВ, у высокотренированных спортсменов силовых видов спорта в работу могут вовлекаться 80 -90% двигательных единиц. Подключение МВ к работе зависит от силы стимуляции мотонейроном. Максимальная величина стимуляции, при которой волокно сокращается максимально – это порог возбуждения. Минимальный порог возбуждения имеют МВI (10 -15 Гц). У быстрых МВ порог возбуждения в 2 раза выше. Все типы МВ вовлекаются в работу при высокой частоте раздражения – 45 -55 Гц. Это важно учитывать при построении методики силовой подготовки спортсменов.
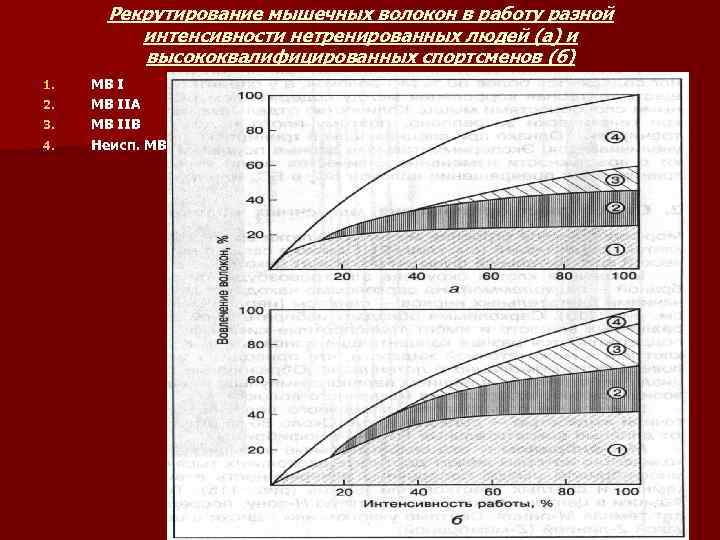
Рекрутирование мышечных волокон в работу разной интенсивности нетренированных людей (а) и высококвалифицированных спортсменов (б) 1. 2. 3. 4. МВ IIA МВ IIB Неисп. МВ

n БЛАГОДАРЮ ЗА ВНИМАНИЕ
БИОХИМИЯ МЫШЦ.ppt