19985.ppt
- Количество слайдов: 30

Биохимия межклеточного матрикса

План лекции: 1. Состав и функции межклеточного матрикса. 2. Коллаген и эластин. 3. Неколлагеновые структурные белки. 4. Углевод-белковые комплексы.
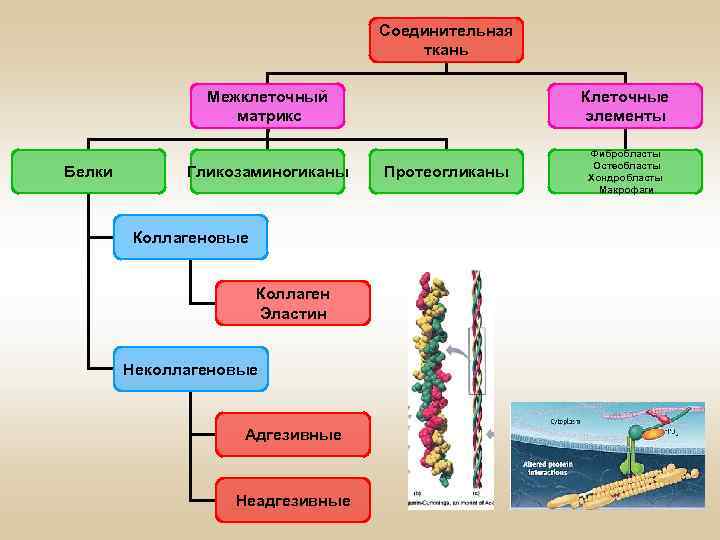
Соединительная ткань Межклеточный матрикс Белки Клеточные элементы Гликозаминогиканы Фибробласты Остеобласты Хондробласты Макрофаги Коллагеновые Коллаген Эластин Неколлагеновые Адгезивные Неадгезивные Протеогликаны

Межклеточный матрикс – это комплекс неорганических и органических компонентов, заполняющих пространство между клетками. Состав межклеточного матрикса: • • структурные белки – коллаген, эластин; протеогликаны и гликозаминогликаны; специализированные белки; неорганические ионы – в минерализованных тканях.

Функции межклеточного матрикса • • Опорная Адгезивная Механическая Защитная функция Участие в регуляции водно-солевого обмена Метаболическая функция Образует высокоспециализированные структуры

Коллаген Основной структурный белок межклеточного матрикса. 25 % общего количества белка в организме. 6% массы тела.

Структурная единица коллагена – тропоколлаген. Аминокислотный состав коллагена: • 1/3 – глицин; • 1/5 – пролин и гидроксипролин; • 1/10 – аланин.
![Типы коллагена Коллаген 1 -го типа [α 1(I)]2 α 2(I) Кость, сухожилия, роговица, плацента, Типы коллагена Коллаген 1 -го типа [α 1(I)]2 α 2(I) Кость, сухожилия, роговица, плацента,](https://present5.com/presentation/26750742_132074873/image-8.jpg)
Типы коллагена Коллаген 1 -го типа [α 1(I)]2 α 2(I) Кость, сухожилия, роговица, плацента, артерии, печень, дентин. Коллаген 2 -го типа [α 1(II)]3 Хрящевая ткань, межпозвоночные диски, стекловидое тело. Коллаген 3 -го типа [α 1(III)]3 Аретрии, матка, кожа плода, строма органов. Коллаген 4 -го типа [α 1(IV)]2α 2(IV) Базальные мембраны.

Синтез коллагена Включает два этапа: • Внутриклеточный – во время этого этапа происходит трансляция и посттрансляционная модификация полипептидных цепей. • Внеклеточный – происходят модификации белка, завершающиеся образованием коллагеновых волокон.
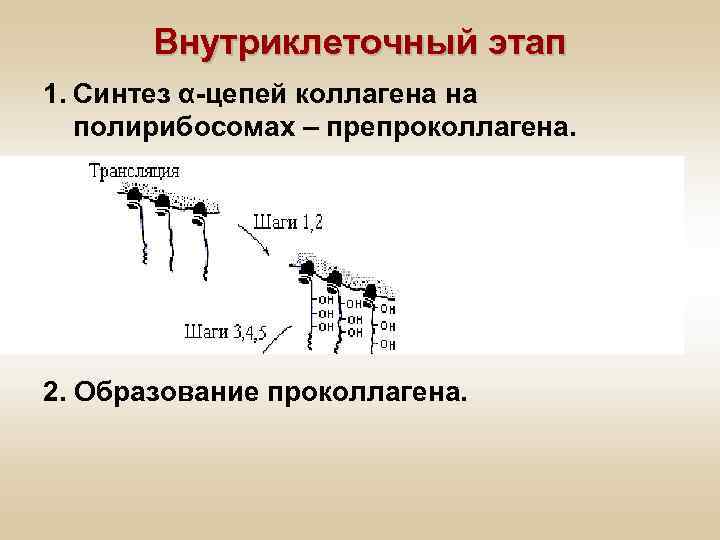
Внутриклеточный этап 1. Синтез α-цепей коллагена на полирибосомах – препроколлагена. 2. Образование проколлагена.
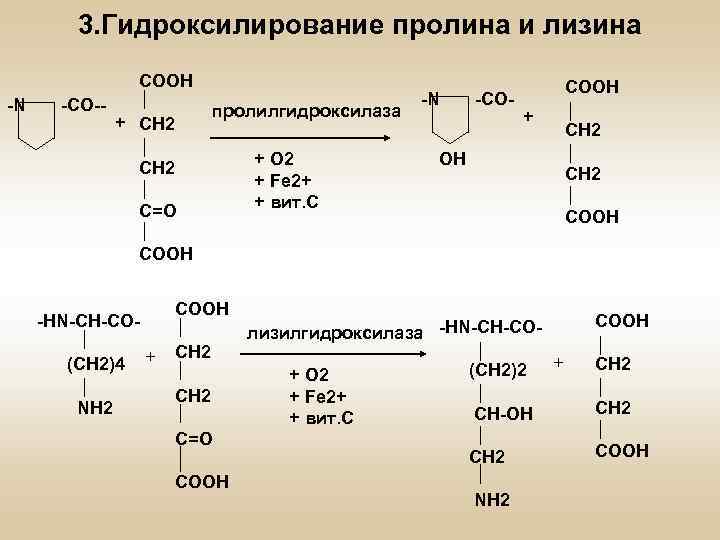
3. Гидроксилирование пролина и лизина COOH -N -CO-- пролилгидроксилаза + CH 2 C=O + О 2 + Fe 2+ + вит. С -N -CO- COOH + CH 2 OH CH 2 COOH -HN-CH-CO(CH 2)4 NH 2 + CH 2 C=O COOH лизилгидроксилаза -HN-CH-CO+ О 2 + Fe 2+ + вит. С (CH 2)2 + CH 2 CH-OH CH 2 СН 2 COOH NH 2
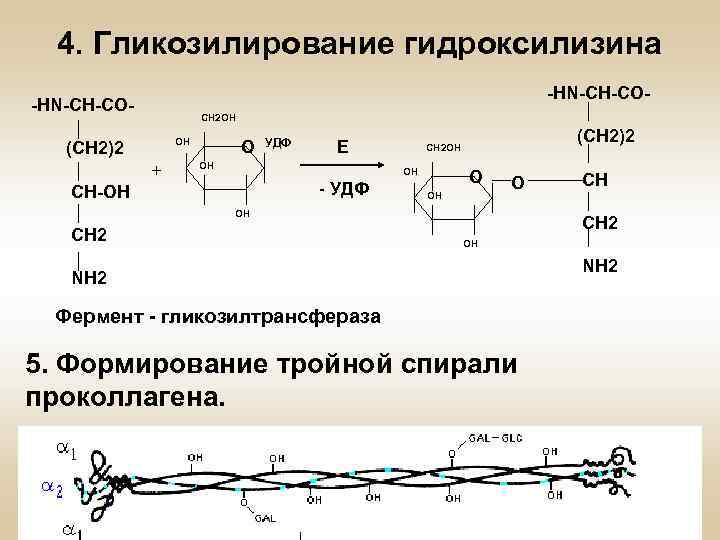
4. Гликозилирование гидроксилизина -HN-CH-CO- CH 2 OH OH (CH 2)2 + O УДФ Е OH OH - УДФ CH-OH (CH 2)2 CH 2 OH O OH О OH CH 2 CH CH 2 OH NH 2 Фермент - гликозилтрансфераза 5. Формирование тройной спирали проколлагена. NH 2
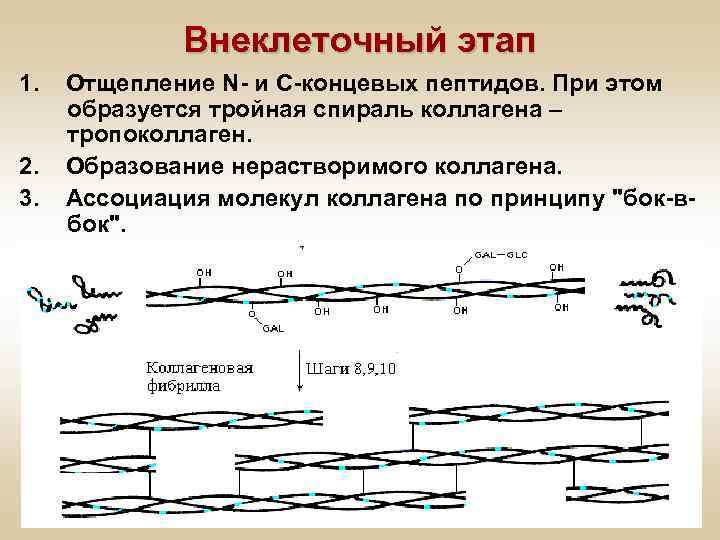
Внеклеточный этап 1. 2. 3. Отщепление N- и С-концевых пептидов. При этом образуется тройная спираль коллагена – тропоколлаген. Образование нерастворимого коллагена. Ассоциация молекул коллагена по принципу "бок-вбок".
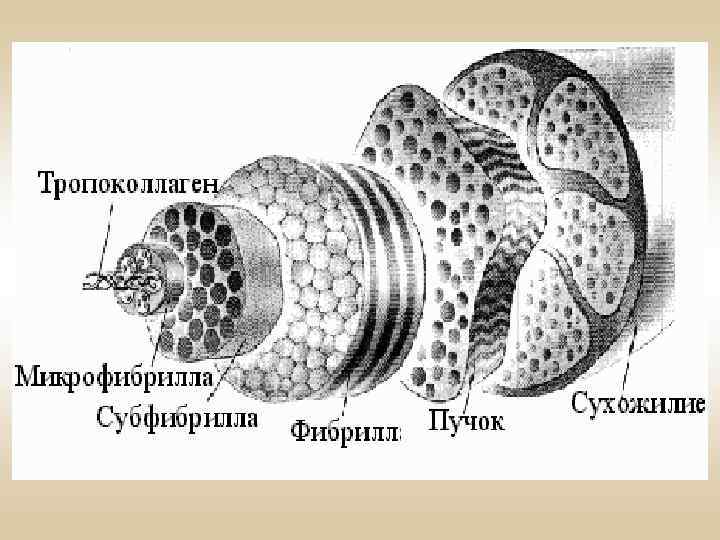

Метаболизм коллагена Коллаген медленно обменивающийся белок. Катаболизм коллагена - коллагеназы (металлопротеиназы - ММР). ТИМП - тканевые ингибиторы матриксных металлопротеиназ (ТИМП-1, -2, -3, -4). Регуляция обмена коллагена: Аскорбиновая кислота. Гормональная регуляция: - глюкокортикоиды; - половые гормоны.
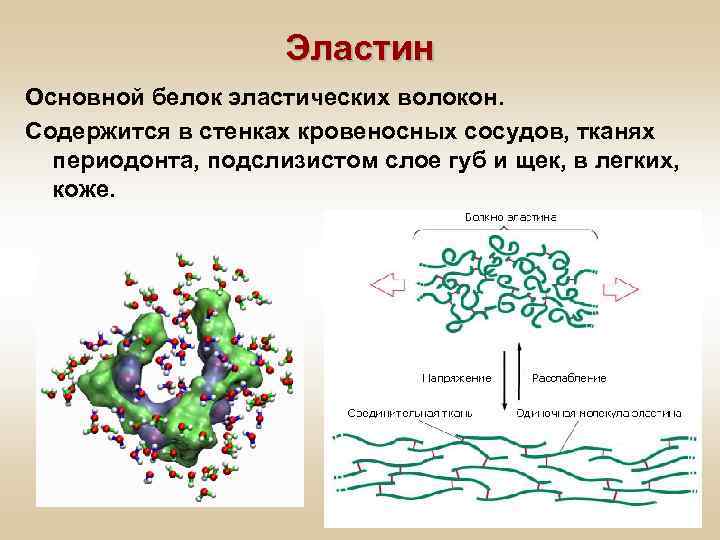
Эластин Основной белок эластических волокон. Содержится в стенках кровеносных сосудов, тканях периодонта, подслизистом слое губ и щек, в легких, коже.
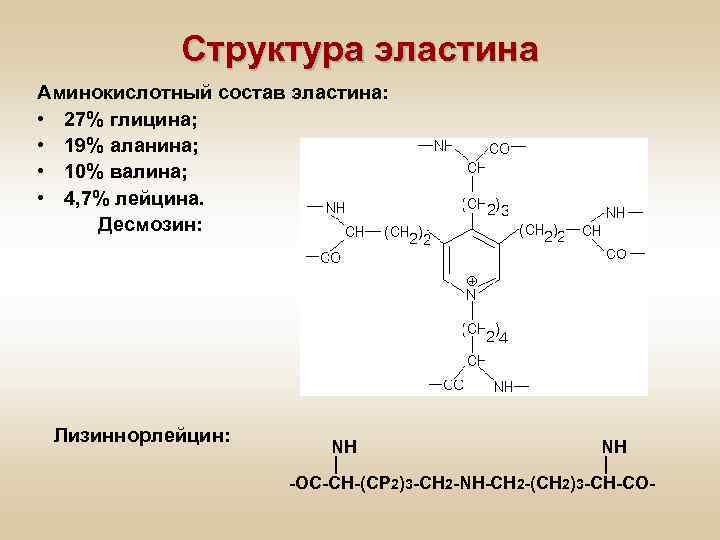
Структура эластина Аминокислотный состав эластина: • 27% глицина; • 19% аланина; • 10% валина; • 4, 7% лейцина. Десмозин: Лизиннорлейцин: NH NH -ОС-СН-(СР 2)3 -СН 2 -NH-CH 2 -(CH 2)3 -CH-CO-

Метаболизм эластина Синтез эластина: 1. Синтез тропоэластина. 2. Образование нерастворимого эластина. Катаболизм эластина: Происходит под действием эластазы нейтрофилов. Ингибитор эластазы – альфа-1 -антитрипсин.
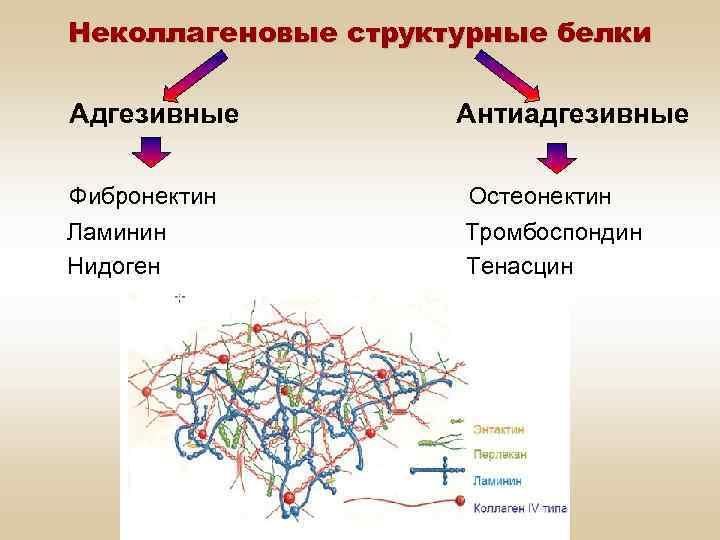
Неколлагеновые структурные белки Адгезивные Фибронектин Ламинин Нидоген Антиадгезивные Остеонектин Тромбоспондин Тенасцин
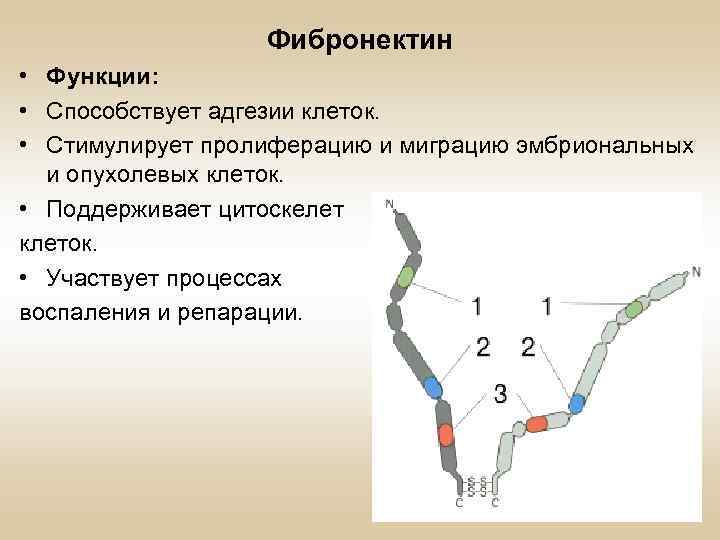
Фибронектин • Функции: • Способствует адгезии клеток. • Стимулирует пролиферацию и миграцию эмбриональных и опухолевых клеток. • Поддерживает цитоскелет клеток. • Участвует процессах воспаления и репарации.

Ламинин связывается со всеми структурными компонентами базальных мембран. Функции: • Адгезия мезенхимальных и эпителиальных клеток. • Влияет на рост, морфологию, дифференцировку и подвижность клеток.

Гликозаминогликаны ГАГ – линейные неразветвленные гетерополисахариды, состоящие из повторяющихся дисахаридных единиц (димеров). Мономерами дисахарида (димера) являются: • гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая), • производное аминосахара (глюкоз- или галактозамин), где NH 2 - группа ацетилирована (+ зараяд исчезает), • сульфатные группы в виде О-эфиров или Nсульфата.
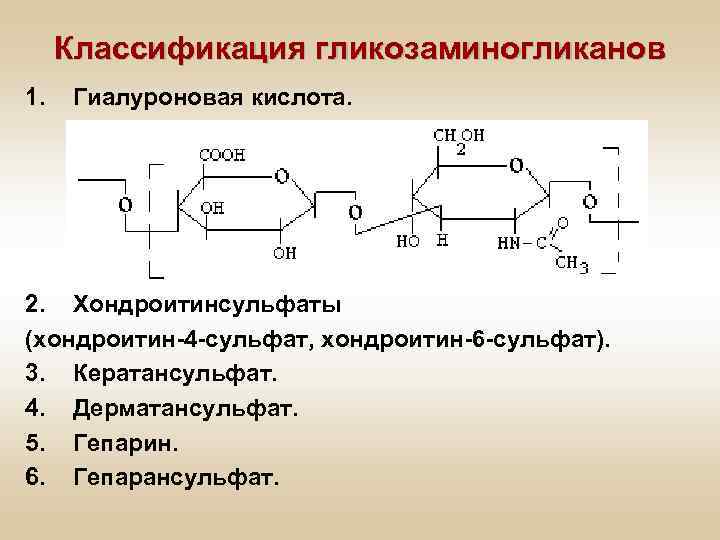
Классификация гликозаминогликанов 1. Гиалуроновая кислота. 2. Хондроитинсульфаты (хондроитин-4 -сульфат, хондроитин-6 -сульфат). 3. Кератансульфат. 4. Дерматансульфат. 5. Гепарин. 6. Гепарансульфат.
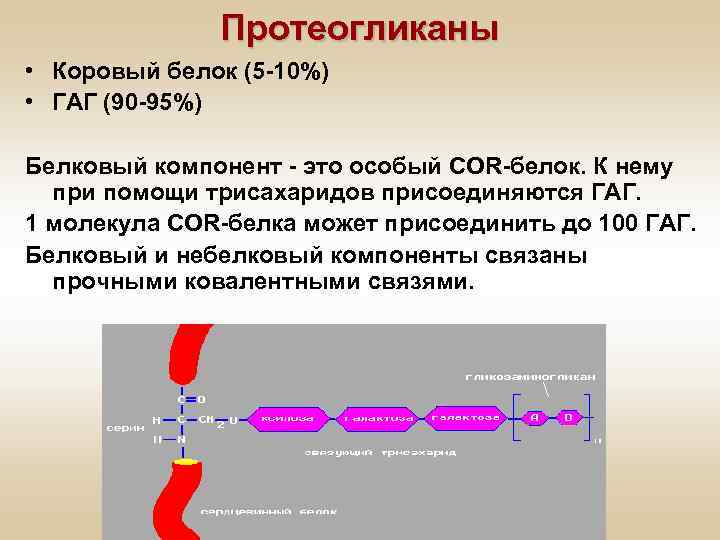
Протеогликаны • Коровый белок (5 -10%) • ГАГ (90 -95%) Белковый компонент - это особый COR-белок. К нему при помощи трисахаридов присоединяются ГАГ. 1 молекула COR-белка может присоединить до 100 ГАГ. Белковый и небелковый компоненты связаны прочными ковалентными связями.
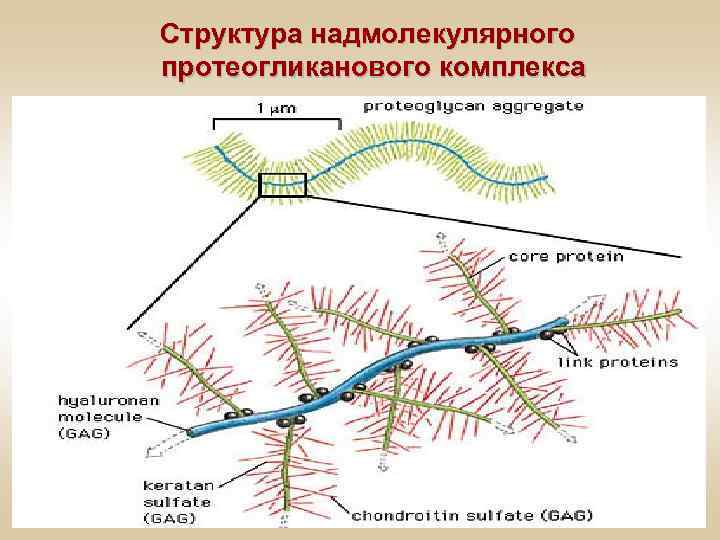
Структура надмолекулярного протеогликанового комплекса
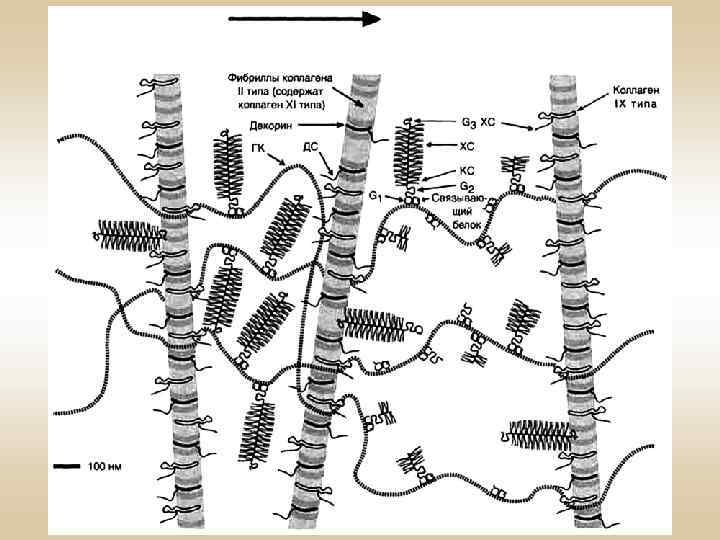

Функции углевод-белковых комплексов • Являются структурными компонентами межклеточного матрикса • Специфически взаимодействуют с белками межклеточного матрикса • Являются полианионами • Препятствуют распространению микроорганизмов • Рессорная функция • Гепарин – антикоагулянт • Гепарансульфаты – компоненты мембран клеток
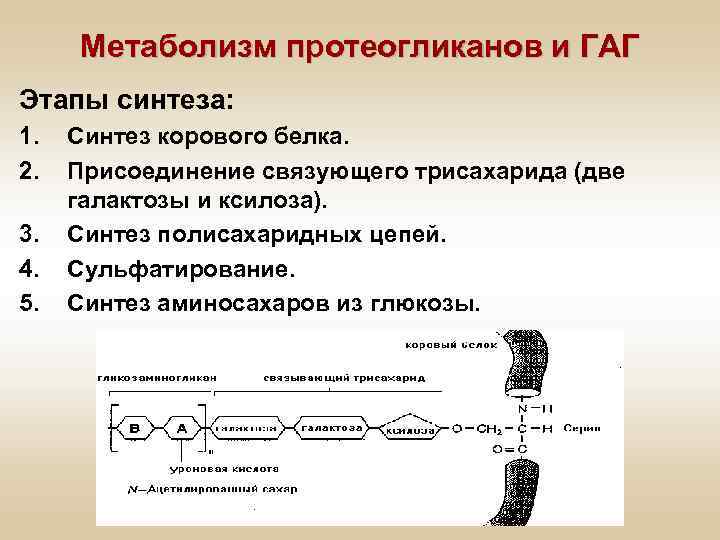
Метаболизм протеогликанов и ГАГ Этапы синтеза: 1. 2. 3. 4. 5. Синтез корового белка. Присоединение связующего трисахарида (две галактозы и ксилоза). Синтез полисахаридных цепей. Сульфатирование. Синтез аминосахаров из глюкозы.

Катаболизм протеогликанов • Распад ПГ связан с обновлением внеклеточных и внутриклеточных структур. • Расщепление корового белка протеиназами. • ГАГ отличаются высокой скоростью обмена: от 3 -10 дней до 3 месяцев. • Разрушение полисахаридных цепей ГАГ осуществляется экзо- и эндогликозидазами. • При этом ГАГ эндоцитозом попадают в клетку, где лизосомальные гидролазы расщепляют их до моносахаров.
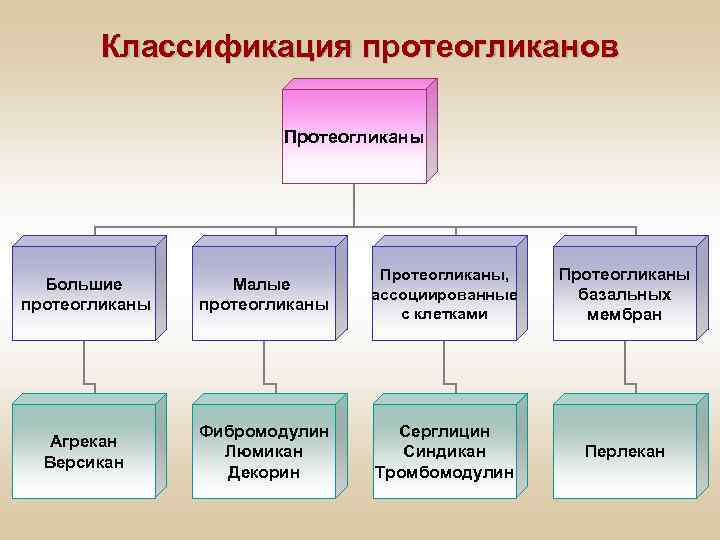
Классификация протеогликанов Протеогликаны Большие протеогликаны Малые протеогликаны Протеогликаны, ассоциированные с клетками Протеогликаны базальных мембран Агрекан Версикан Фибромодулин Люмикан Декорин Серглицин Синдикан Тромбомодулин Перлекан
19985.ppt