Биохимия клетки.ppt
- Количество слайдов: 31

Биохимия клетки Краткий обзор

Углеводы - вещества с общей формулой C x (H 2 O )y Название «углеводы» говорит о том, что водород и кислород в этих соединениях присутствует в том же соотношении что и в молекуле воды. Все углеводы представляют сбой альдегидоспирты или кетоспирты. Химические свойства углеводов определяются именно наличием альдегидной, кетонной групп и гидроксилов.
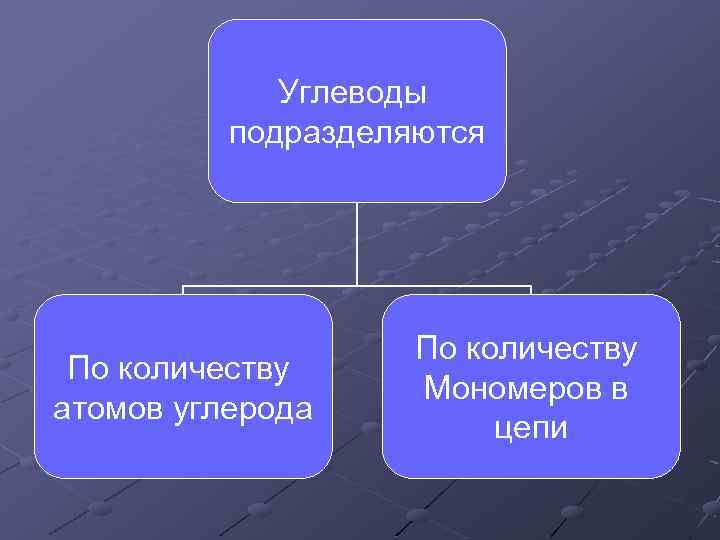
Углеводы подразделяются По количеству атомов углерода По количеству Мономеров в цепи

Классификация по количеству атомов углерода Классификация начинается с трехатомного глицеринового альдегида. Он относится к классу триоз. Следующий класс имеет 4 углеродных атома и называется тетрозами. Тетрозы являются в основном продуктами биохимических реакций бактерий. Пятиуглеродные сахара называются пентозами. Наиболее известными представителями пентоз являются рибоза и дезоксирибоза – компоненты нуклеиновых кислот. Наиболее известны всем шестиуглеродные сахара – гексозы. Примерами гексоз могут служить глюкоза, фруктоза, манноза. Сахара с большим количеством углеродных атомов (гептозы, октозы, нонозы) встречаются реже и в основном как продукты биохимических реакций, или искусственно синтезированные вещества.

Классификация по количеству мономеров в цепочке Классификация начинается с соединений, имеющих один мономер. Это моносахара. Пример моносахаров - глюкоза, ее изомер фруктоза, ксилулоза. Углеводы, имеющие в цепочке два мономера, связанные гликозидной связью, называются дисахарами. К дисахарам относят сахарозу (глюкоха+фруктоза), лактозу – молочный сахар (глюкоза+галактоза), мальтозу – солодовый сахар (глюкоза+глюкоза). По некоторым классификациям сахара имеющие три мономера в цепочке выделяются в отдельную группу - трисахариды. Молекулы, имеющие цепочки длиной от 4 до нескольких десятков мономеров выделяют в группу олигосахаридов. К ним относятся декстрины – продукты расщепления крахмала. Молекулы, имеющие в цепочке более сотни мономеров, относят к классу полисахаридов. Это всем известные крахмал, целлюлоза, чуть менее известные инулин, пектиновые вещества.
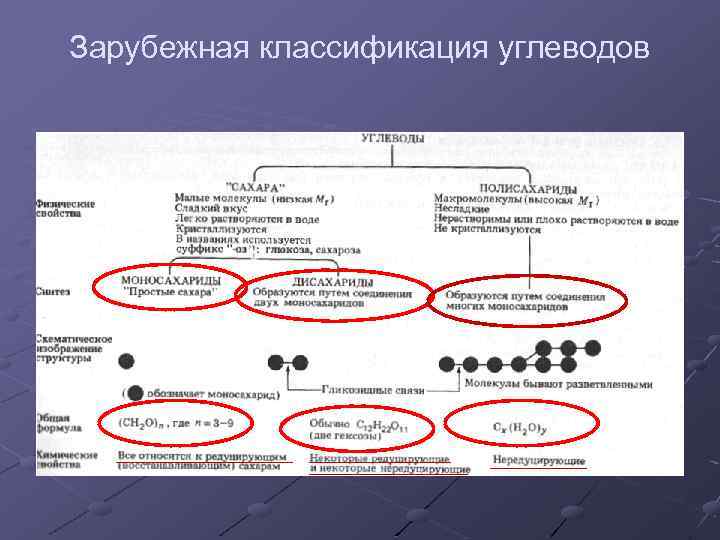
Зарубежная классификация углеводов

Функции углеводов. Монасахариды. Триозы C 3 H 6 O 3 (глицеральдегид, дигидроксиацетон). Играют роль промежуточных продуктов в процессе дыхания, фотосинтезе и других процессах углеводного обмена. Тетрозы C 4 H 8 O 4. Встречаются в природе редко, главным образом у бактерий. Поэтому далее не рассматриваем. Пентозы C 5 H 10 O 5, (рибоза, рибулоза). Участвуют в процессе синтеза нуклеиновых кислот: рибоза в составе РНК, дезоксирибоза в ДНК. Участвуют в синтезе некоторых ферментов (НАД, ФАД, Ко А). Участвуют в синтеза макроэргических соединений (АМФ, АДФ, АТФ). Участвуют в синтезе полисахаров – пентозанов. Гексозы C 6 H 12 O 6, (глюкоза, фруктоза, галактоза, манноза). Служат дыхательным субстратом. Наиболее распространенный из них – глюкоза. Являются мономерами при синтезе полисахаридов (гескозанов). Транспортировка орг. веществ идет в основном в виде производных гексоз (сахароза).

Функции углеводов. Полисахариды Крахмал – Основное запасное вещество растений. Ферментативно расщепляется до глюкозы через ряд промежуточных соединений – декстринов. Целлюлоза – основной структурный компонент клеточных стенок растений. на целлюлозу приходится до 50% всего углерода в растительных организмах. Инулин – представляет собой полимер фруктозы. Является запасным веществом у растений семейства Сложноцветных.

Свойства сахаров. Изомерия – важная особенность углеводов. Одной и той же эмпирической формуле могут соответствовать несколько веществ. Различают структурную и пространственную изомерию. С 6 Н 12 О 6 Структурная изомерия обуславливается различным порядком связей в молекуле. Например, гексозы являются структурными изомерами друга и соответствуют эмпирической формуле C 6 H 12 O 6
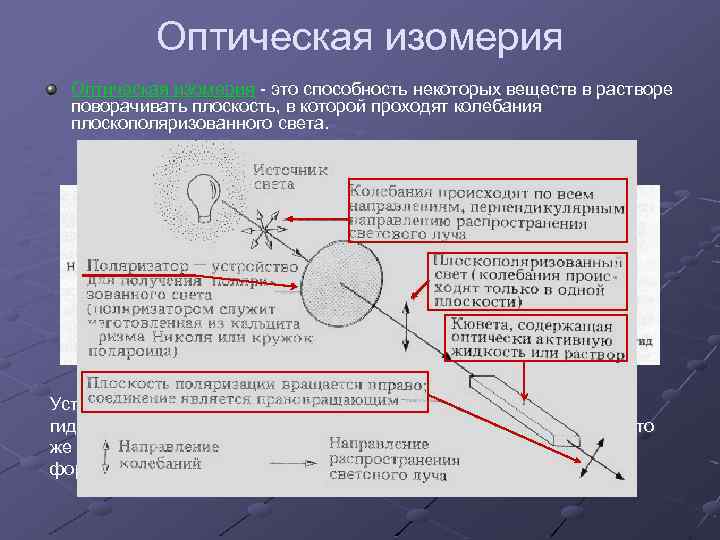
Оптическая изомерия - это способность некоторых веществ в растворе поворачивать плоскость, в которой проходят колебания плоскополяризованного света. Простейшим примером моносахара, имеющего оптическую изомерию, можно назвать глицеральдегид. Установили, что моносахарид обозначают как d изомер если гидроксильная группа у последнего асимметричного атома занимает то же положение что и у d-глицеральдегида. То же самое касается и lформ.

Редуцирующие сахара. Все моносахариды, и некоторые дисахариды как-то мальтоза и лактоза, относятся к числу редуцирующих сахаров. Сахароза – не редуцирующий сахар. Эти сахара имеют восстановительную активность, которая у альдоз зависит от альдегидной группы, а у кетоз как от кетогруппы, так и от гидроксилов Обычная реакция на эти сахара - реакция Фелинга. При этом медь, имеющая в гидроксиде степень окисления +2, восстанавливается до закиси меди (Cu 2 O) в которой имеет степень окисления +1. Cu+2 + e- → Cu+
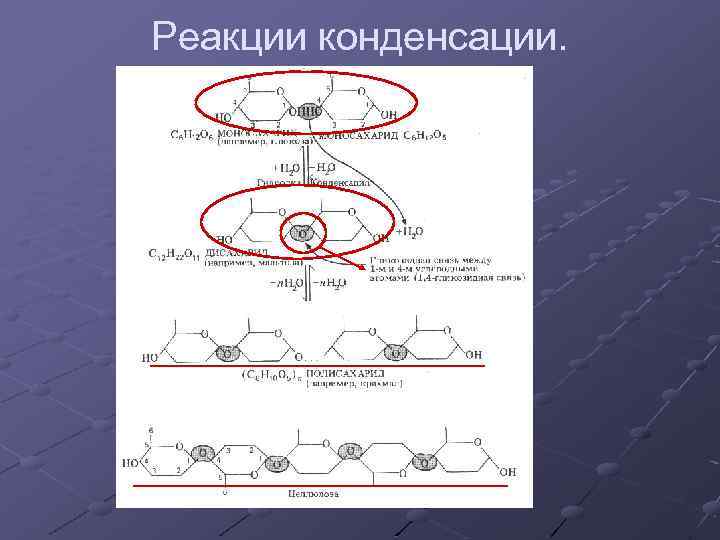
Реакции конденсации.

Аминокислоты Растения синтезируют АМИНОКИСЛОТЫ, органические все аминокислоты, содержащие одну или организмы животные же не могут синтезировать несколько аминогрупп лейцин, изолейцин, треонин, валин, лизин, В клетках встречается свыше 170 метионин, фенилаланин, аминокислот, но только 20 из них триптофан. Эти входят в состав белков. аминокислоты называют незаменимыми Общая формула аминокислоты H 2 N CHR COOH

Свойства аминокислот Аминокислоты бесцветные кристаллические твердые вещества. Хорошо растворимы в воде и нерастворимы в органических растворителях. Из-за наличия аминогруппы и карбоксилов в одной молекуле аминокислоты имеют амфотерные свойства.
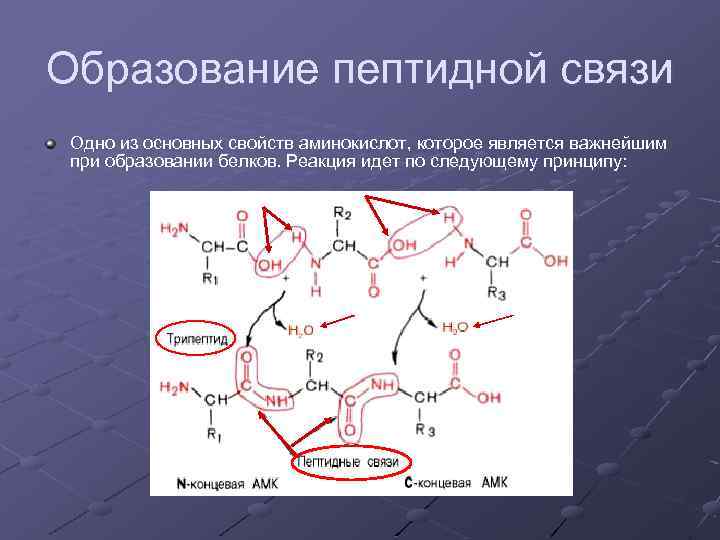
Образование пептидной связи Одно из основных свойств аминокислот, которое является важнейшим при образовании белков. Реакция идет по следующему принципу:

Образование других связей. Образование сульфидных мостов. При соединении двух молекул цистеина, их сульфгидрильные группы (SH), оказавшиеся по соседству, окисляются и образуют дисульфидную связь (S–S). Такие связи могут возникать как между разными полипептидными цепями, так и между участками одной цепи. Образование водородных связей. Электроположительные атомы водорода, соединенные с кислородом или азотом в группах –OH или –NH стремятся обобществить электроны с находящимся рядом атомом кислорода, например группы =CO. Образующаяся в результате водородная связь слаба, но такие связи возникают часто, и тем самым вносят весомый вклад в стабилизацию белковой молекулы

Белки – сложные органические соединения, которые являются основой живых организмов – на долю белка приходится около 50% сухой массы клетки. Состав белков: Углерод: 55 -56% Водород: 6, 5 -7, 5% Кислород: 20 -25% Азот: 15 -18% Сера: 0, 3 -2, 5%

Классификация белков Протеины. Альбумины хорошо растворяются в воде. Глобулины в воде не растворяются, но растворимы в разбавленных растворах солей. Проламины – растворимы в 60 -80% спирте. Встречаются в семенах злаков. Глютелины растворяются только в разбавленных растворах щелочей. Содержатся в семенах растений 13% от состава. Протамины - щелочные белки. Содержат много аргинина (60 -80%). Имеют низкий молекулярный вес. В растениях не обнаружены. Гистоны - щелочные белки с низким молекулярным весом. Содержатся в ядрах клеток. Протеиды построены из протеинов, соединенных с молекулами другого типа (простетическими группами). Фосфопротеиды содержат молекулы фосфорной кислоты, связанные эфирной связью. К ним относится вителлин-белок, содержащийся в яичном желтке, белок молока казеин. Липопротеины - белки связанные с производными лецитина, холестерина, кефалина и других липидов. У растений не выявлены. Гликопротеиды содержат остатки углеводов. Они входят в состав растительных слизей, слюны. Хромопротеиды содержат молекулу окрашенного вещества, обычно типа порфина. Самым важным хромопротеидом является гемоглобин - переносчик кислорода, окрашивающий эритроциты. Металлопротеиды - белки связанные с металлом. Это ферменты: каталаза, пероксидаза, цитохромы и т. д. Нуклеопротеиды - протеины, связанные с нуклеиновыми кислотами. Они представляют собой очень важные с биологической точки зрения белкисоставные части клеточных ядер.

Функции белков Структурная. Примеры: склеротин (наружный скелет насекомых), α-Кератин (кожа, перья, ногти, волосы), фосфолипопротеины (белки мембран). Ферментативная. Примеры: каталаза (нейтрализация перекиси водорода), амилаза (расщепление крахмала до глюкозы). Гормональная. Примеры: инсулин. Транспортная. Примеры: белки-переносчики мембран, гемоглобин. Рецепторная. Пример: белки биомембран. Защитная. Примеры: антитела. Запасающая. Примеры: запасные белки бобовых культур, глиадин пшеницы. Токсины. Примеры: змеиный яд, токсины растений (рицин).
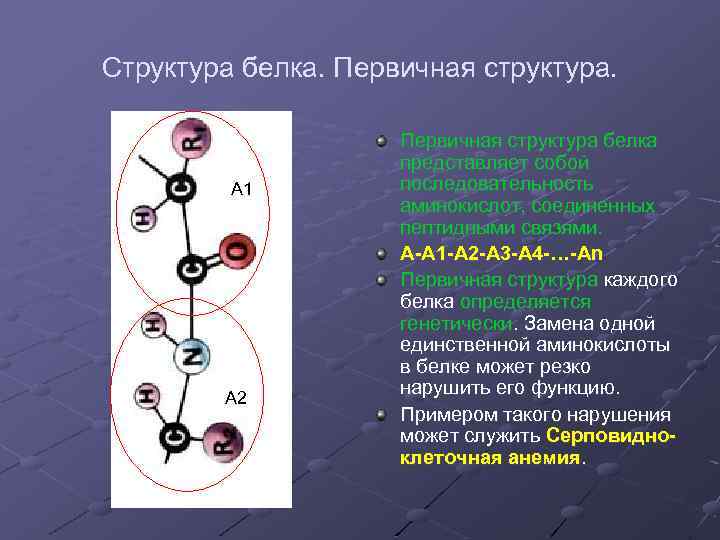
Структура белка. Первичная структура. А 1 А 2 Первичная структура белка представляет собой последовательность аминокислот, соединенных пептидными связями. А А 1 А 2 А 3 А 4 … Аn Первичная структура каждого белка определяется генетически. Замена одной единственной аминокислоты в белке может резко нарушить его функцию. Примером такого нарушения может служить Серповидно клеточная анемия.
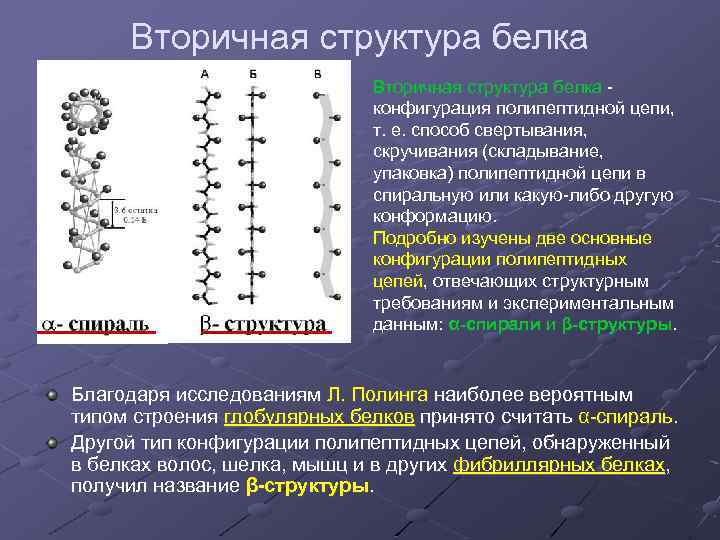
Вторичная структура белка конфигурация полипептидной цепи, т. е. способ свертывания, скручивания (складывание, упаковка) полипептидной цепи в спиральную или какую-либо другую конформацию. Подробно изучены две основные конфигурации полипептидных цепей, отвечающих структурным требованиям и экспериментальным данным: α спирали и β структуры. Благодаря исследованиям Л. Полинга наиболее вероятным типом строения глобулярных белков принято считать α-спираль. Другой тип конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в других фибриллярных белках, получил название β структуры.
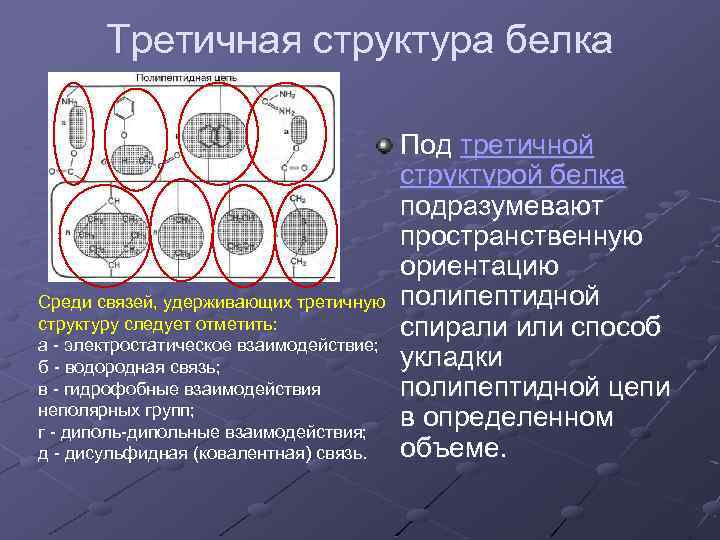
Третичная структура белка Среди связей, удерживающих третичную структуру следует отметить: а - электростатическое взаимодействие; б - водородная связь; в - гидрофобные взаимодействия неполярных групп; г - диполь-дипольные взаимодействия; д - дисульфидная (ковалентная) связь. Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
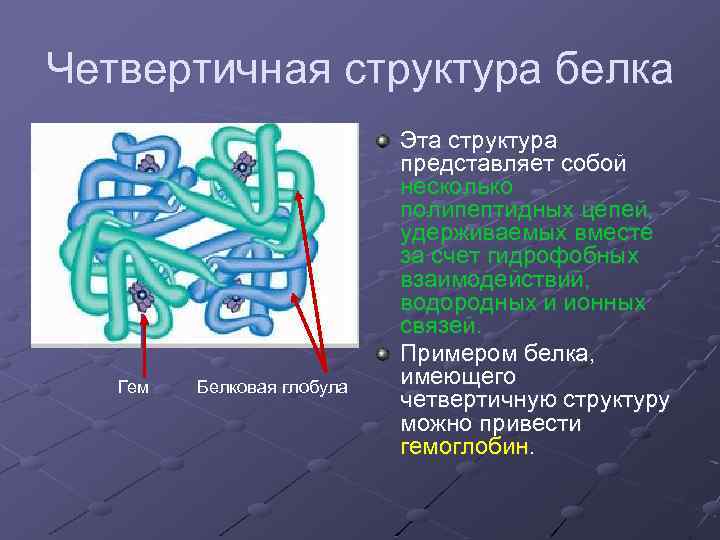
Четвертичная структура белка Гем Белковая глобула Эта структура представляет собой несколько полипептидных цепей, удерживаемых вместе за счет гидрофобных взаимодействий, водородных и ионных связей. Примером белка, имеющего четвертичную структуру можно привести гемоглобин.

Денатурация и ренатурация белка Под денатурацией понимают нарушение трехмерной структуры, присущей данной белковой молекуле. При денатурации молекула белка не способна выполнять свою биологическую функцию. При определенных условиях денатурированный белок спонтанно приобретает исходную структуру. Этот процесс называют ренатурацией. Денатурацию могут вызвать следующие факторы: Нагревание, или воздействие ультрафиолета или рентгеновского излучения. Нарушают водородные и ионные связи. Сильные кислоты и щелочи, концентрированные растворы солей. Нарушают ионные связи. Тяжелые металлы. Вызывают выпадение белка в осадок (высаливание). Органические растворители. Нарушают гидрофобные взаимодействия.
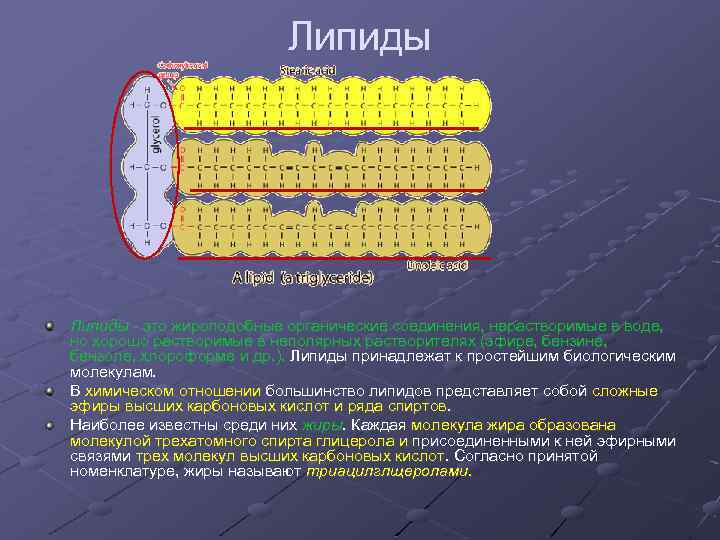
Липиды - это жироподобные органические соединения, нерастворимые в воде, но хорошо растворимые в неполярных растворителях (эфире, бензине, бензоле, хлороформе и др. ). Липиды принадлежат к простейшим биологическим молекулам. В химическом отношении большинство липидов представляет собой сложные эфиры высших карбоновых кислот и ряда спиртов. Наиболее известны среди них жиры. Каждая молекула жира образована молекулой трехатомного спирта глицерола и присоединенными к ней эфирными связями трех молекул высших карбоновых кислот. Согласно принятой номенклатуре, жиры называют триацилглщеролами.

Другие классы липидов. В фосфолипидах одна из крайних цепей высших карбоновых кислот триацилглицерола замещена на группу, содержащую фосфат. Фосфолипиды имеют полярные головки и неполярные хвосты. Группы, образующие полярную головку, гидрофильны, а неполярные хвостовые группы гидрофобны. Двойственная природа этих липидов обусловливает их ключевую роль в организации биологических мембран. Еще одну группу липидов составляют стероиды (стеролы). Эти вещества построены на основе спирта холестерола. Стеролы плохо растворимы в воде и не содержат высших карбоновых кислот. К ним относятся желчные кислоты, холестерол, половые гормоны, витамин D и др. К липидам также относятся терпены (ростовые вещества растений — гиббереллины; каротиноиды — фотосинтетичские пигменты; эфирные масла растений, а также воска).

Функции липидов Структурная. Фосфолипиды вместе с белками образуют биологические мембраны. В состав мембран входят также стеролы. Энергетическая. При окислении жиров высвобождается большое количество энергии, которая идет на образование АТФ. В форме липидов хранится значительная часть энергетических запасов организма. Высокое содержание липидов в семенах растений обеспечивает развитие зародыша и проростка до их перехода к самостоятельному питанию. Семена многих растений (кокосовой пальмы, клещевины, подсолнечника, сои, рапса и др. ) служат сырьем для получения растительного масла промышленным способом. Защитная и изоляционная. Накапливаясь в подкожной клетчатке и вокруг некоторых органов жировой слой защищает организм животных и его отдельные органы от механических повреждений. Благодаря низкой теплопроводности слой подкожного жира помогает сохранить тепло. Воск покрывает кожу, шерсть, перья, делает их более эластичными и предохраняет от влаги. Восковой налет имеют листья и плоды многих растений. Регуляторная (животные). Многие гормоны являются производными холестерола, например половые и кортикостероиды. Производные холестерола, витамин D играют ключевую роль в обмене кальция и фосфора. Желчные кислоты участвуют в процессах пищеварения (эмульгирование жиров) и всасывания высших карбоновых кислот.

Ферменты – биологические катализаторы белковой природы, ускоряющие химические реакции обмена веществ в организме. Общие черты ферментов и неорганических катализаторов: Участвуют в реакции и остаются неизменными после завершения реакции (хотя в последние годы получены данные, что некоторые ферменты после реакции подвергаются модификации и даже распаду); Действуют в малых количествах (например, 1 молекула фермента реннина в желудке теленка створаживает 106 молекул казеина за 10 мин. ); Не сдвигают химическое равновесие реакции и не влияют на величину свободной энергии. Отличие ферментов от неорганических катализаторов Ферменты имеют более высокую каталитическую активность (выше в млн. раз); Каталитическая активность проявляется в очень мягких условиях (умеренные температуры 37 -40ºС, нормальное давление, близкие к нейтральным значения р. Н среды 6, 0÷ 8, 0); Ферменты обладают высокой специфичностью действия, т. е. каждый фермент катализирует в основном только строго определенную химическую реакцию (например, платина катализирует несколько десятков химических реакций); Активность ферментов в клетках строго контролируется и регулируется; Различия связанные с белковой природой ферментов (термолабильность, зависимость от р. Н среды, наличие активаторов и ингибиторов и др. ).
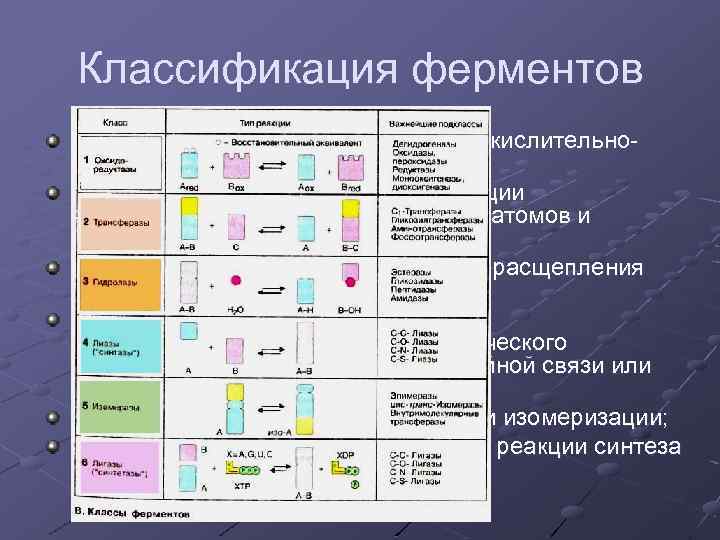
Классификация ферментов Оксидоредуктазы – катализируют окислительновосстановительные реакции; Трансферазы – катализируют реакции межмолекулярного переноса групп атомов и радикалов; Гидролазы– катализируют реакции расщепления при участии воды; Лиазы – катализируют реакции внутримолекулярного негидролитического расщепления, с образованием двойной связи или присоединения по двойной связи; Изомеразы – катализируют реакции изомеризации; Лигазы (синтетазы) – катализируют реакции синтеза с затратой энергии

Специфичность действия ферментов 2 группы: обладающие абсолютной специфич ностью и относительной специфичностью. Относительная (групповая) специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним структуроподобным субстратом. Абсолютная специфичность проявляется тогда, когда фермент действует лишь на одно – единственное вещество и катализирует лишь определенное превращение данного вещества. Например: сахараза катализирует превращение только сахарозы. Стереоспецифичность - фермент катализирует превращение только одного из возможных стереоизомеров субстрата.
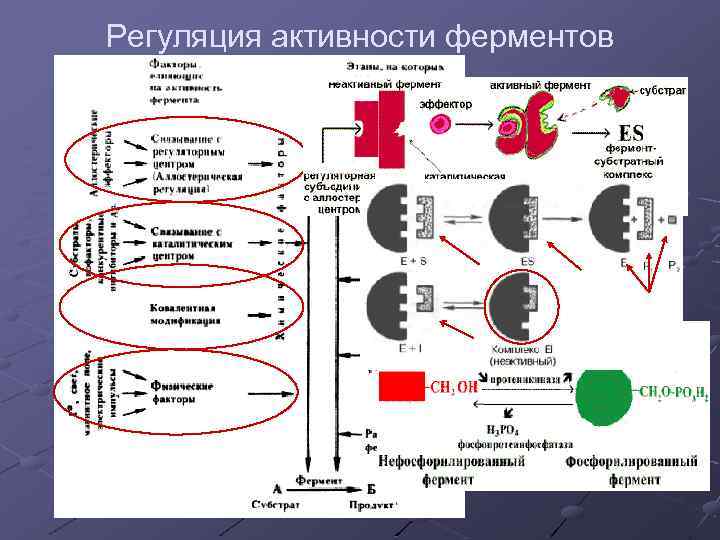
Регуляция активности ферментов
Биохимия клетки.ppt