Биохимия ферментов и кинетика.ppt
- Количество слайдов: 23

Биохимия ферментов
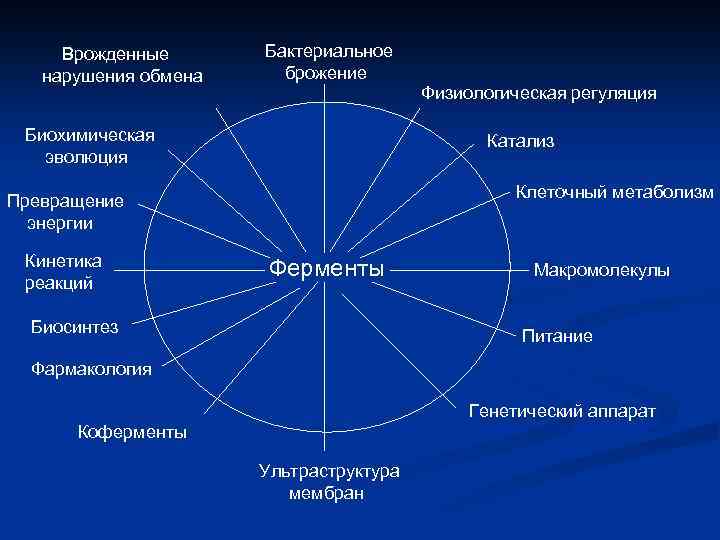
Врожденные нарушения обмена Бактериальное брожение Физиологическая регуляция Биохимическая эволюция Катализ Клеточный метаболизм Превращение энергии Кинетика реакций Ферменты Биосинтез Макромолекулы Питание Фармакология Генетический аппарат Коферменты Ультраструктура мембран

Молекулярная масса ферментов Фермент Молекулярная масса Рибонуклеаза 13 000 Лактатдегидрогеназа 140 000 Цитохром 15 000 Альдолаза 142 000 Трипсин 23 000 Каталаза 248 000 Пепсин 32 1000 Глутаматдегидрогеназа 336 000 Гексокиназа 45 000 Уреаза 480 000 Щелочная фосфатаза 80 000 Пируватдегидрогеназа 4 500 000 с
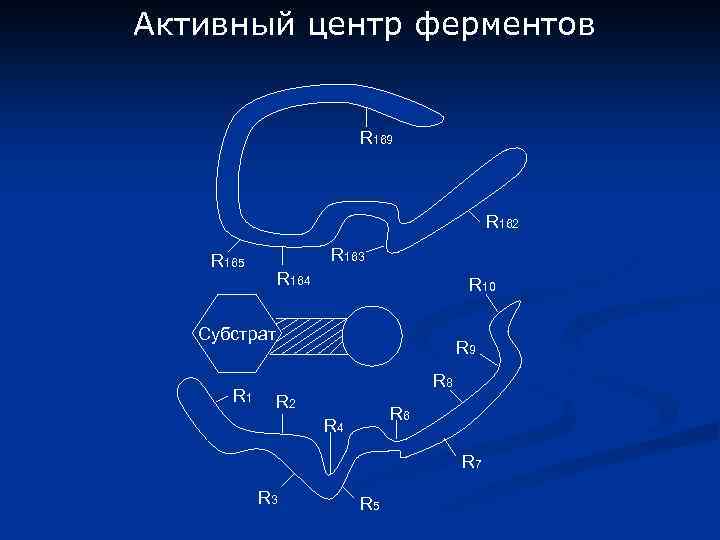
Активный центр ферментов R 169 R 162 R 163 R 165 R 164 R 10 Субстрат R 1 R 9 R 8 R 2 R 6 R 4 R 7 R 3 R 5

Распределение и относительные количества изоферментов ЛДГ + ЛДГ 1 ------ ЛДГ 2 ЛДГ 3 ЛДГ 4 ЛДГ 5 Старт ---Сердце Почки Печень Мышцы -

Механизм действия ферментов Фермент Субстрат Фермент Активный комплекс + Продукты реакции
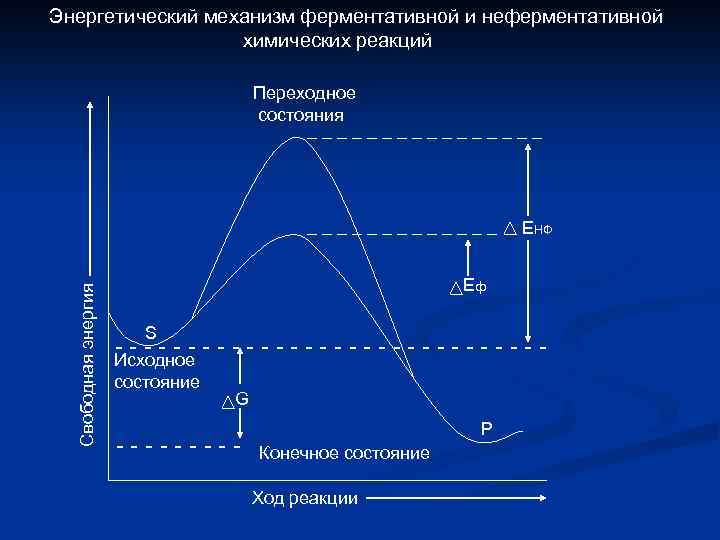
Энергетический механизм ферментативной и неферментативной химических реакций Переходное состояния ________ Свободная энергия _______ ЕНФ Еф S ------Исходное состояние -----------G ----- Р Конечное состояние Ход реакции
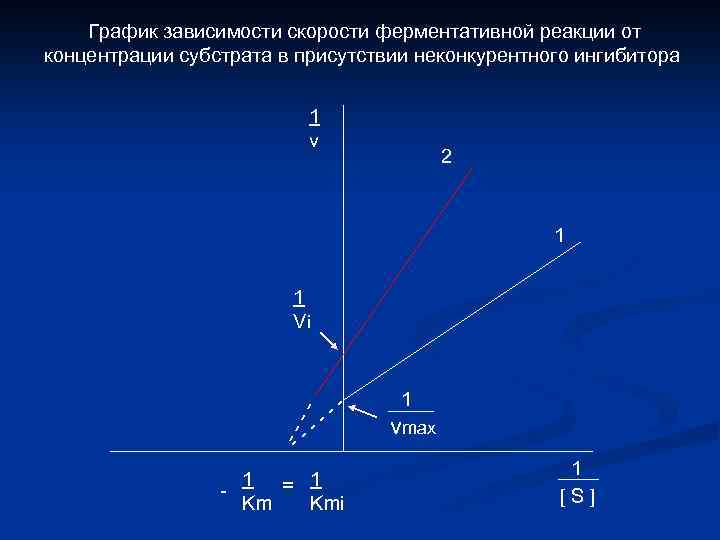
График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора 1 v 2 1 -- 1 Vi -- -- -- 1 = 1 Km Kmi 1 vmax 1 [S]

в 1 V max 2 --------- Скорость реакции V Максимальная скорость V max -------------- Кm б а Концентрация субстрата [ S ]
![Уравнение Михаэлиса - Ментен v= V. . [ s ] Кs + [ s Уравнение Михаэлиса - Ментен v= V. . [ s ] Кs + [ s](https://present5.com/presentation/265324867_442464172/image-10.jpg)
Уравнение Михаэлиса - Ментен v= V. . [ s ] Кs + [ s ] MAX
![v Vmax ---------------1 vmax 2 1 2 --------------------- vmax Km [s] v Vmax ---------------1 vmax 2 1 2 --------------------- vmax Km [s]](https://present5.com/presentation/265324867_442464172/image-11.jpg)
v Vmax ---------------1 vmax 2 1 2 --------------------- vmax Km [s]

Определение численного значения Кm v = ½ vmax Если V max. = 2 1 = 2 s Km + [ s ] V max Кm или Km = [ s ] [s] +[s ] Km + [ s ] = 2 [ s ]
![График Лайнувера – Берка. 1 v Наклон = 1 vmax 1 Km 1 [s] График Лайнувера – Берка. 1 v Наклон = 1 vmax 1 Km 1 [s]](https://present5.com/presentation/265324867_442464172/image-13.jpg)
График Лайнувера – Берка. 1 v Наклон = 1 vmax 1 Km 1 [s] Кm V max

Основные свойства ферментов v б а 0 50 100 c
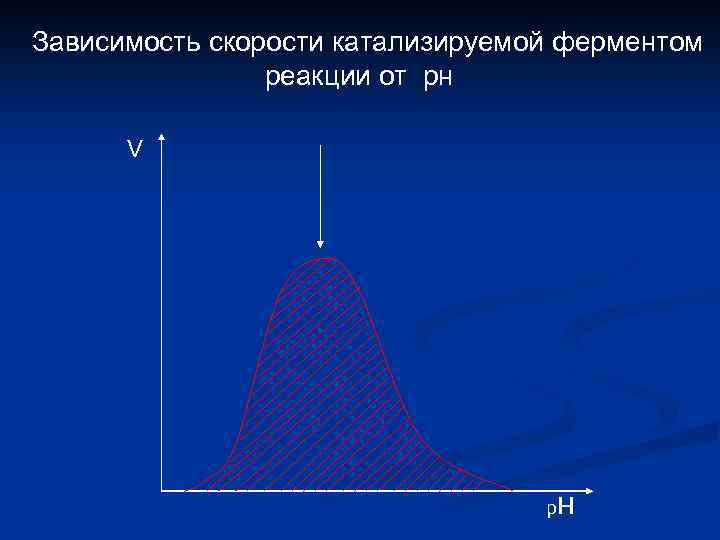
Зависимость скорости катализируемой ферментом реакции от рн V р н
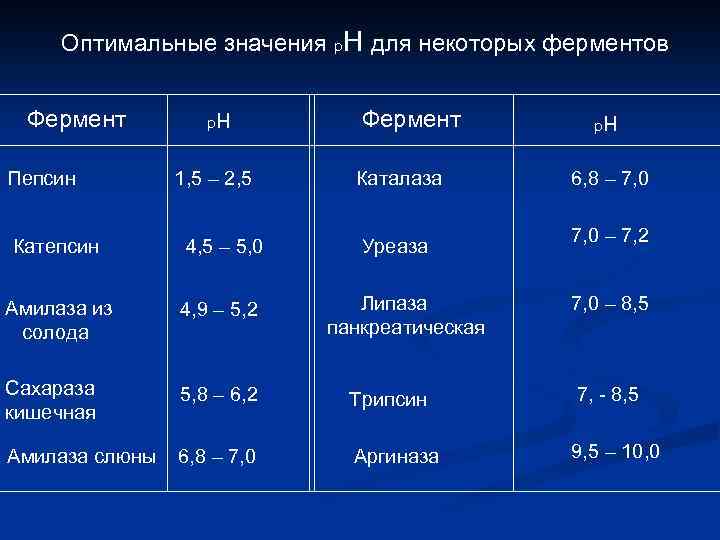
Оптимальные значения р. Н для некоторых ферментов Фермент Пепсин р н 1, 5 – 2, 5 Фермент Каталаза Уреаза р н 6, 8 – 7, 0 – 7, 2 Катепсин 4, 5 – 5, 0 Амилаза из солода 4, 9 – 5, 2 Сахараза кишечная 5, 8 – 6, 2 Трипсин 7, - 8, 5 Амилаза слюны 6, 8 – 7, 0 Аргиназа 9, 5 – 10, 0 Липаза панкреатическая 7, 0 – 8, 5

Торможение активности СДГ малоновой кислотой + Н ООС С С + ООС Сукцинат Н - 2 Н СН Н Н + ООС Блокирование реакции ООС ; СН СН ООС Фумарат + ООС Малонат
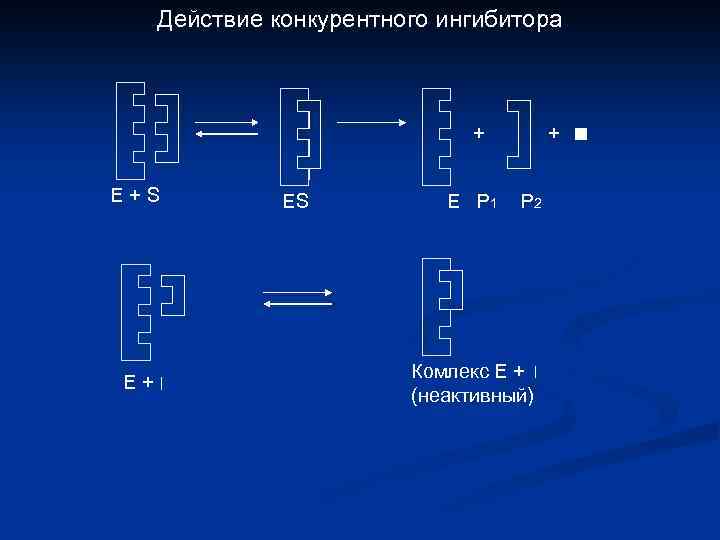
Действие конкурентного ингибитора + Е+S Е+ ES E P 1 + P 2 Комлекс Е + (неактивный)
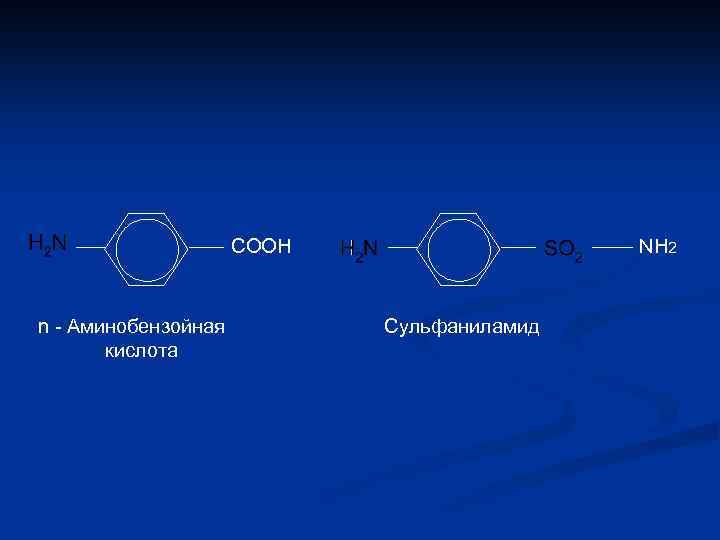
СООН n - Аминобензойная кислота NH 2 Сульфаниламид

График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора v 1 V max = v i 1 V max 2 2 --------------- 0 Km Kmi [S]

График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора. 1 v 2 1 1 vi - - - 1 Km - -- vmax = -- 1 1 Kmi 1 [S]

График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентных ингибиторов v V max 1 Vi ------ 2 ------------------1 Vi 2 0 Km = Kmi 1 2 Vmax [S]

График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора 1 v 2 1 -- 1 Vi -- -- -- 1 = 1 Km Kmi 1 vmax 1 [S]
Биохимия ферментов и кинетика.ppt