биохимия аминокислоты.ppt
- Количество слайдов: 64

БИОХИМИЯ, ч. 1 (32 ч; ) Лектор: доцент каф. БИОХИМИИ к. б. н. Романовская Екатерина Вячеславовна

Предмет биохимии • • • Что изучает биохимия Из истории биохимии Особенности живых организмов Химические компоненты живой материи Иерархия структурно-функциональной организации живых систем

БИОХИМИЯ – наука о химической структуре молекулярных компонентов живых организмов и химических процессах, лежащих в основе биологических функций и процессов жизнедеятельности; наука о молекулярных основах жизни Термин «биохимия» - с 1902 г. (Carl Neuberg) Ergebnisse der Physiologie – в 2 -х частях: Biophysik и Biochimie Journal of Biological Chemistry – с 1905 г.

Из истории биохимии • • • Описание органических соединений, входящих в состав живых организмов (молочной и др. кислот, глицерина, амилового спирта): конец 18 -го – начало 19 -го века; синтез in vitro ряда органических веществ, входящих в состав животных тканей или же являющихся конечными продуктами обмена: 1 -ая половина 19 -го века; открытие гликогена в лаборатории К. Бернара (Франция) в составе ткани печени: 1857; описание белков (Мульдер) и нуклеиновых кислот (Мейцер) – сер. 19 века; активное изучение процесса брожения; Пастер показал возможность анаэробного брожения: 1836 – 1838; Э. Бухнер показал, что бесклеточный экстракт дрожжей способен сбраживать глюкозу в спирт: 1897; Э. Фишер осуществил химический синтез пептидной связи (глицилглицин): 1901; Становление пептидной гипотезы структуры белков (Хофмайстер, Фишер): 1901 - 1906 Ф. Липманн описал роль АТФ в энергетическом обмене: 1914; Дж. Самнер получил уреазу в кристаллическом виде и продемонстрировал ее белковую природу: 1926;

• Открытие Гансом Кребсом цикла лимонной кислоты: 1937; • Биохимически подтверждена генетическая роль ДНК (Эвери, Мак-Леод, Мак-Карти): 1944; • Чаргафф опубликовал работу о количественном содержании нуклеотидов (правила Чаргаффа): 1950; • Л. Полинг и Р. Кори предложили α-спираль и β-слои для описания пространственной структуры белков: 1952; • Дж. Уотсон и Ф. Крик предложили модель двойной спирали ДНК и способ ее репликации: 1953 • Э. Сазерленд изолировал циклическую AMP: 1956; • Ф. Сэнджер определил аминокислотную последовательность пептидного гормона инсулина: 1952 – 1956; • Эксперименты Мезельсона и Сталя по установлению полуконсервативного механизмв репликации ДНК: 1957; • А. Корнберг параллельно с С. Очоа описали ДНКзависимую ДНК-полимеразу: 1959;

Ф. Сэнджер с соавт. установил нуклеотидную последовательность бактериофага φХ 174: 1977

• • • • Кендрю и Пертуц описали первые трехмерные структуры белков миоглобина и гемоглобина: 1960; Дж. Хюриц и С. Вайс открыли РНК-полимеразу: 1960; Модель оперона Жакоба и Моно: 1961; Аллостерическая модель ингибирования ферментов Шанже, Жакоба и Моно: 1963 Очоа и соавт. Расшифровали генетический код: 1965; Трехмерная модель лизоцима по результатам рентгеноструктурного анализа (Филлипс): 1965; Р. Холли установил структуру т. РНК: 1965; Первый синтез фермента – рибонуклеазы: 1969; Г. Темин и Д. Балтимор открыли обратную транскриптазу: 1970; Милштейн открыл способ получения моноклональных антител: 1977; Ф. Шарп и Р. Робертс открыли интроны: 1977; К. Мюллис разработал полимеразную цепную реакцию: 1983; Открытие рибозима (Т. Чех): 1987; Описание прионов (Прузинер): 1990; Э. Файр и К. Мелло получили Нобелевскую премию за открытие интерферирующих РНК: 2006.

Особенности живых организмов – «молекулярная логика живого»

• Химическая сложность и высокая степень организации; каждый компонент живого орагнизма имеет специфическую функцию

• Живые организмы извлекают, трансформируют и используют энергию окружающей их среды (либо в форме орагнических питательных веществ, либо в виде энергии солнечного излучения);

• Живые организмы способны к точному самовоспроизведению и самосборке

Большинство молекулярных компонентов живых систем состоят из атомов углерода, ковалентно связанных с другими атомами углерода, а также водорода, кислорода и азота – это органические соединения.
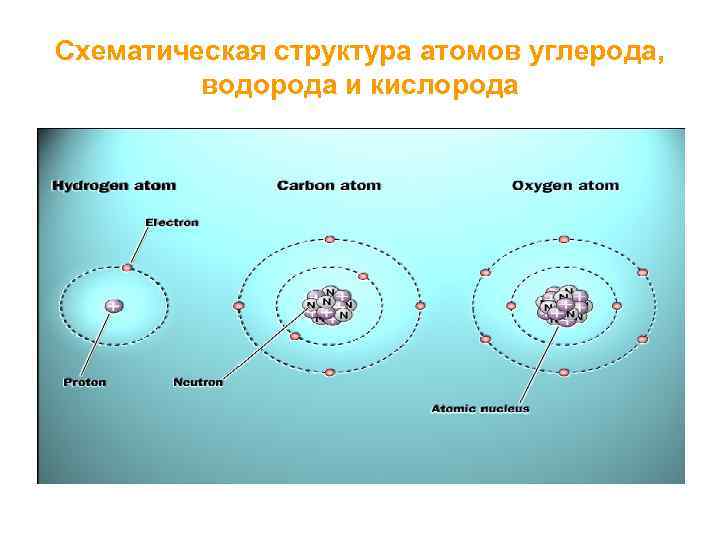
Схематическая структура атомов углерода, водорода и кислорода
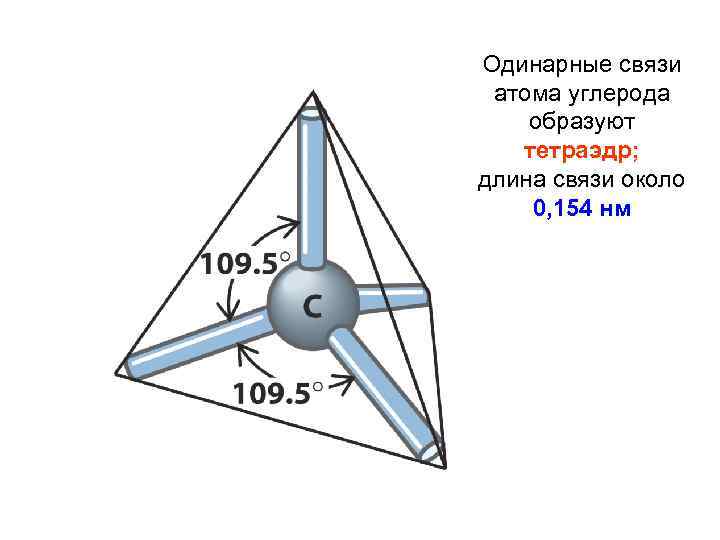
Одинарные связи атома углерода образуют тетраэдр; длина связи около 0, 154 нм
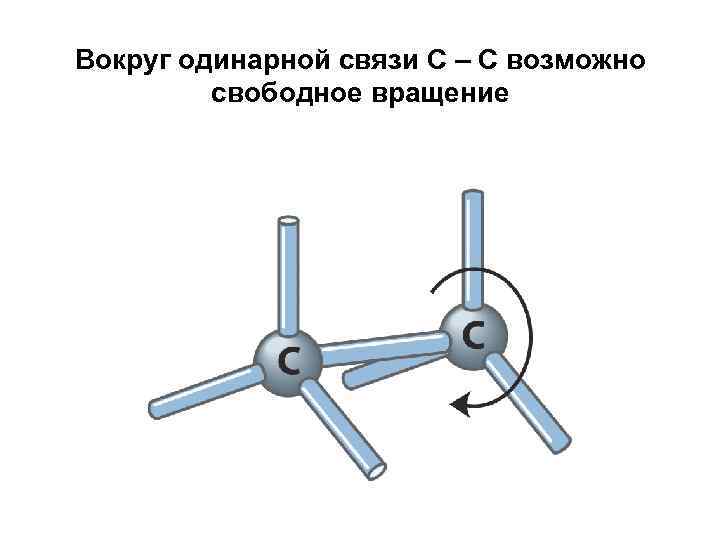
Вокруг одинарной связи С – С возможно свободное вращение
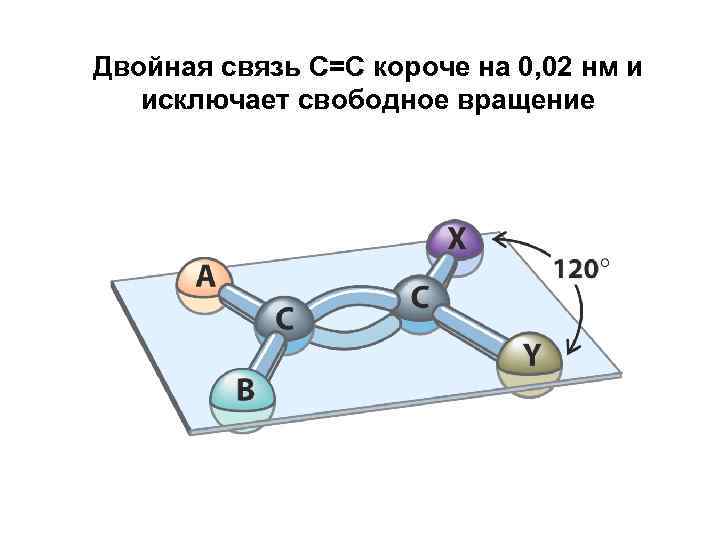
Двойная связь С=С короче на 0, 02 нм и исключает свободное вращение

Ковалентные связи атомов углерода

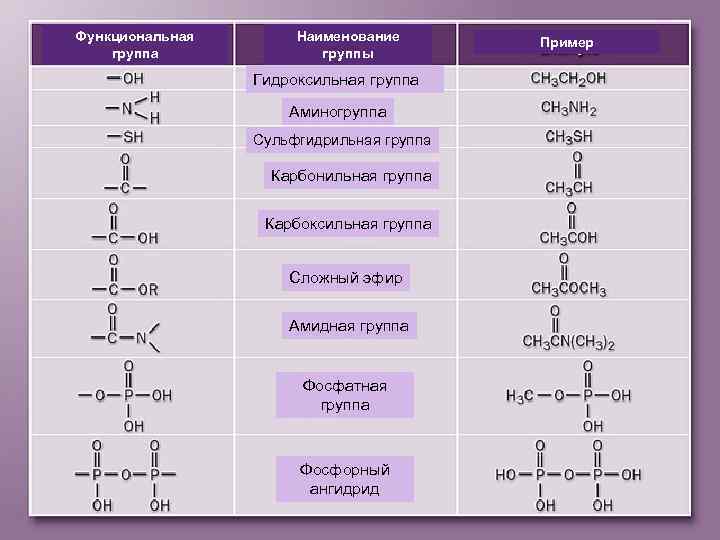
Функциональная группа Наименование группы Гидроксильная группа Аминогруппа Сульфгидрильная группа Карбонильная группа Карбоксильная группа Сложный эфир Амидная группа Фосфатная группа Фосфорный ангидрид Пример

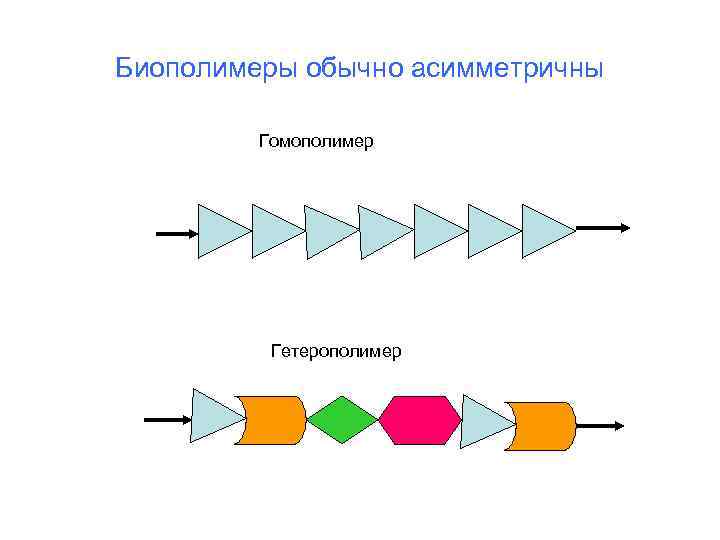
Биополимеры обычно асимметричны Гомополимер Гетерополимер
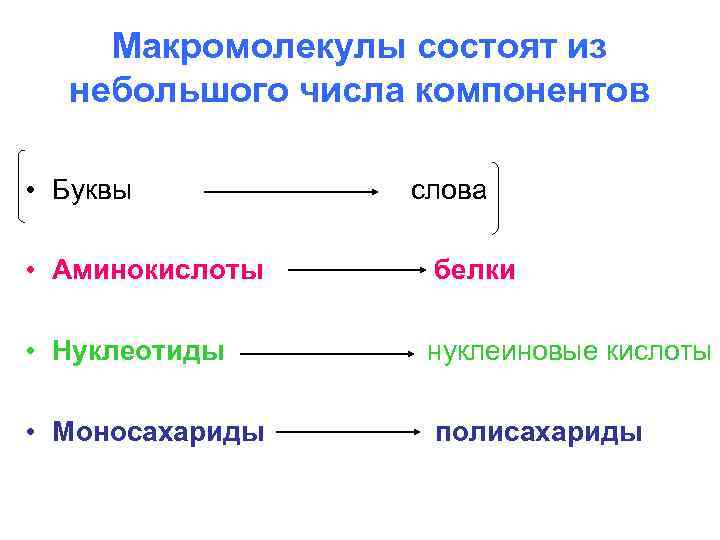
Макромолекулы состоят из небольшого числа компонентов • Буквы слова • Аминокислоты белки • Нуклеотиды нуклеиновые кислоты • Моносахариды полисахариды
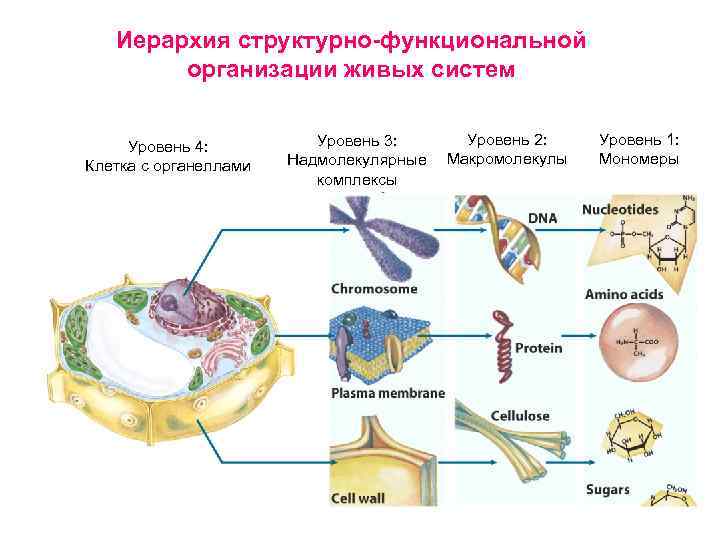
Иерархия структурно-функциональной организации живых систем Уровень 4: Клетка с органеллами Уровень 3: Надмолекулярные комплексы Уровень 2: Макромолекулы Уровень 1: Мономеры
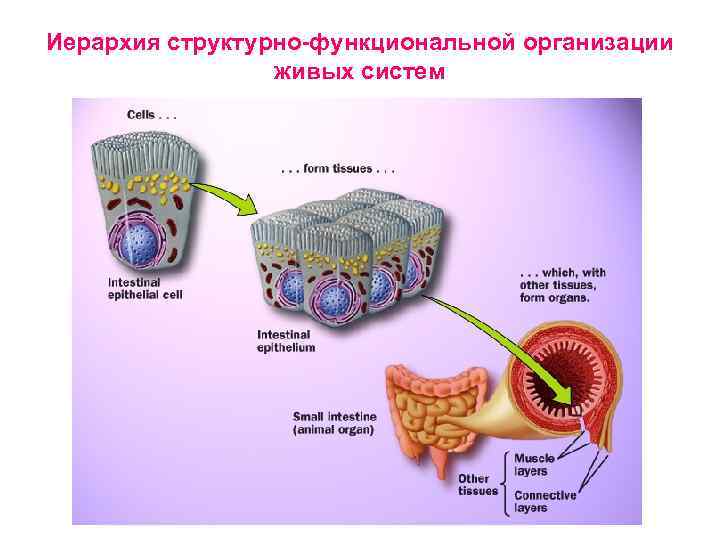
Иерархия структурно-функциональной организации живых систем


ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА v. Основные функции белков; vпринципы структурной организации белков; vструктура аминокислот – мономерных единиц белков; vнекоторые физико-химические свойства аминокислот; vпептидная связь и первичная структура белков.
ОСНОВНЫЕ ФУНКЦИИ БЕЛКОВ • Ферменты – биологические катализаторы • Транспортные белки • Структурные белки • Двигательные белки • Запасные белки • Защитные белки • Регуляторные белки • Специальные функции
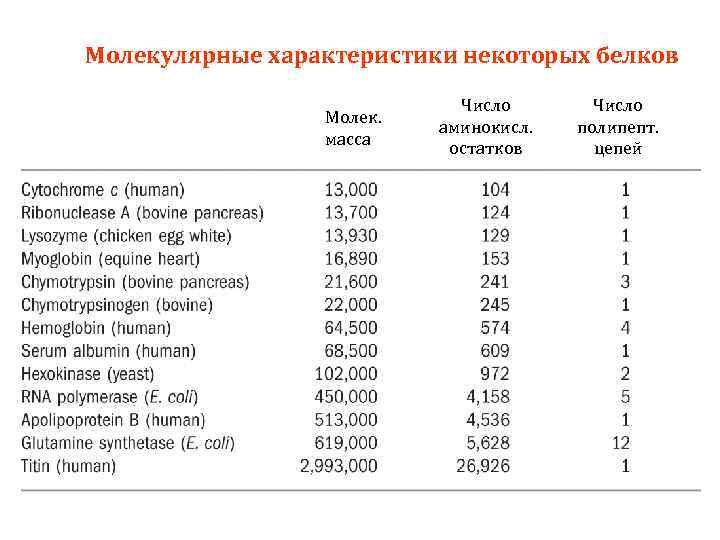
Молекулярные характеристики некоторых белков Молек. масса Число аминокисл. остатков Число полипепт. цепей
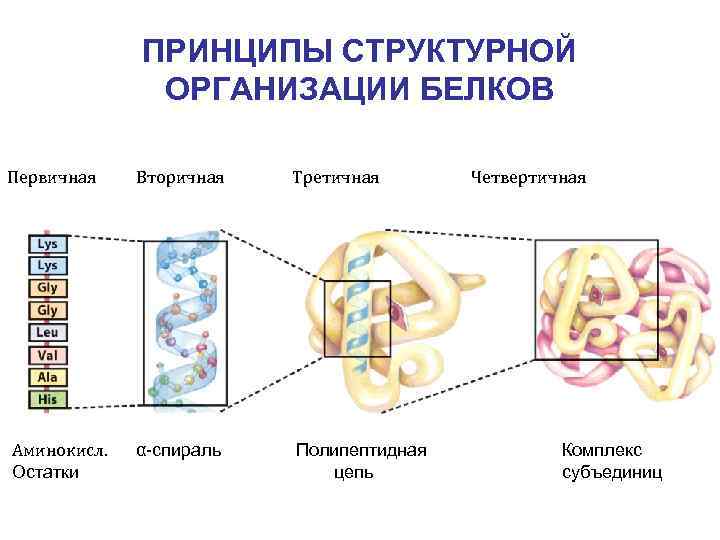
ПРИНЦИПЫ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВ Первичная Вторичная Третичная Аминокисл. Остатки α-спираль Полипептидная цепь Четвертичная Комплекс субъединиц
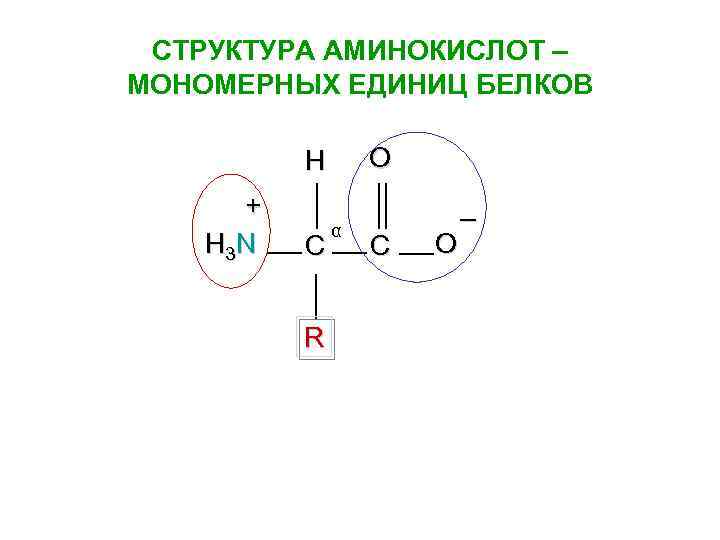
СТРУКТУРА АМИНОКИСЛОТ – МОНОМЕРНЫХ ЕДИНИЦ БЕЛКОВ O H + H 3 N C R α C O –

20 (22) канонических α-аминокислот входит в состав белков Существует более 700 природных аминокислот с различными функциями + – H 3 NCH 2 CO 2 b + – H 3 NCH 2 CH 2 CO 2 g b-аланин – структурный компонент кофермента А g-аминомасляная кислота – медиатор, участвующий в проведении нервного импульса

Классификация аминокислот по полярности бокового радикала Неполярные аминокислоты
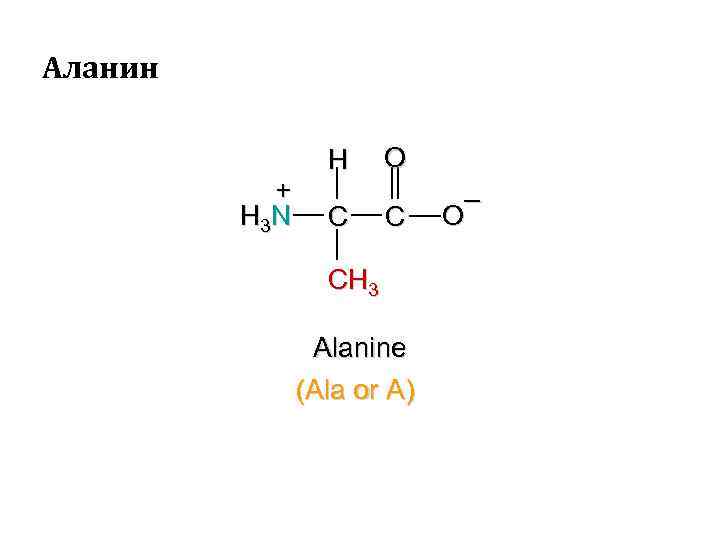
Аланин + H 3 N H C O C CH 3 Alanine (Ala or A) – O
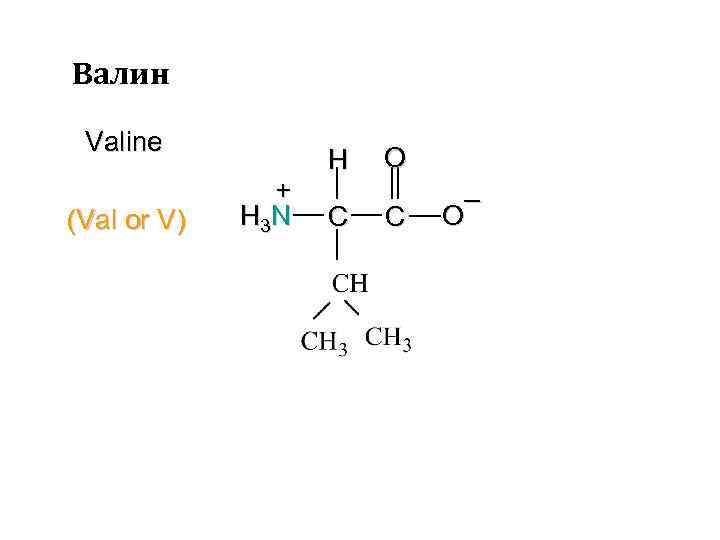
Валин Valine (Val or V) + H 3 N H C O C – O
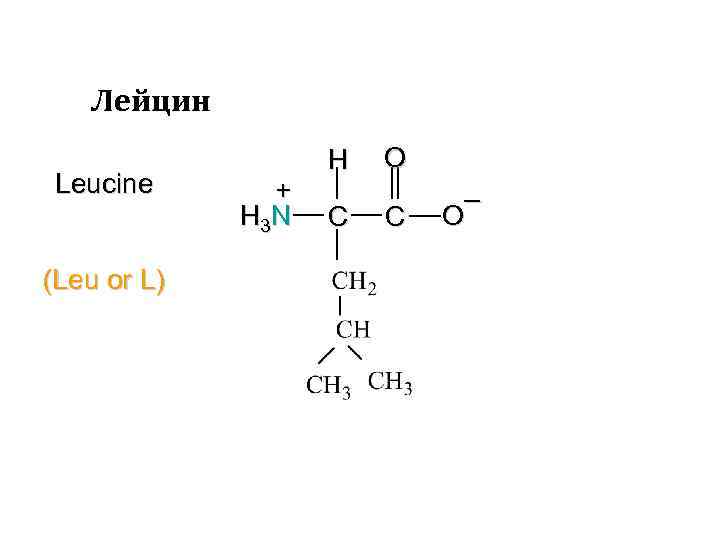
Лейцин Leucine (Leu or L) + H 3 N H C O C – O
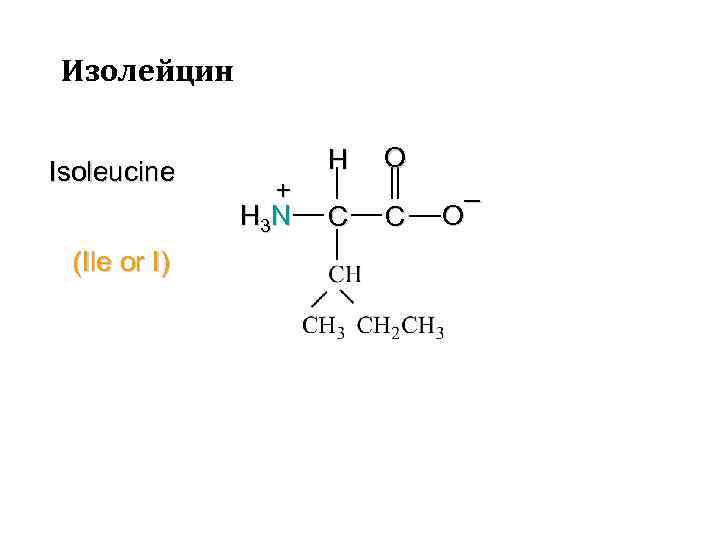
Изолейцин Isoleucine (Ile or I) + H 3 N H C O C – O
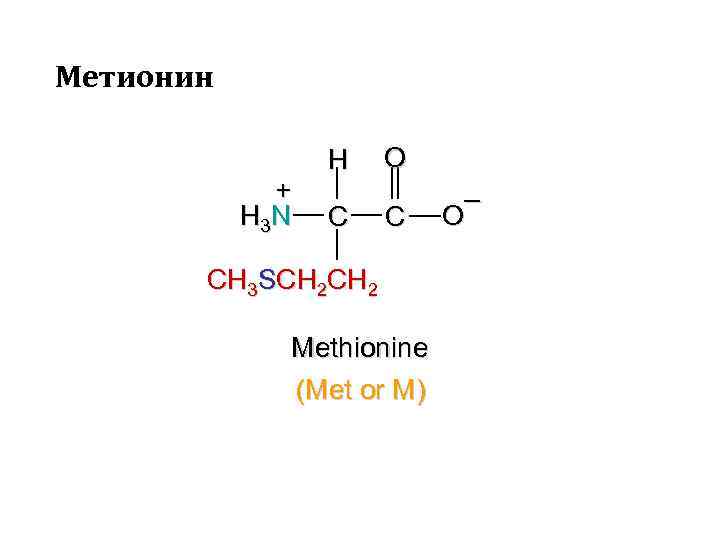
Метионин + H 3 N H C O C CH 3 SCH 2 Methionine (Met or M) – O
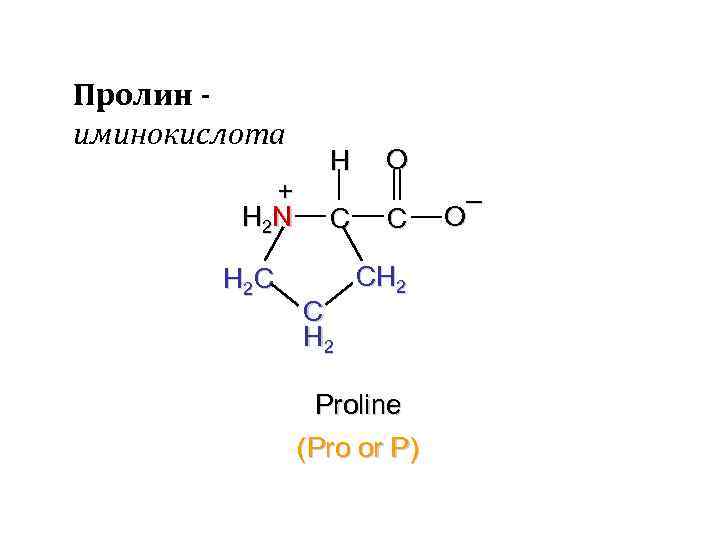
Пролин иминокислота + H 2 N H 2 C H C C H 2 O C CH 2 Proline (Pro or P) – O
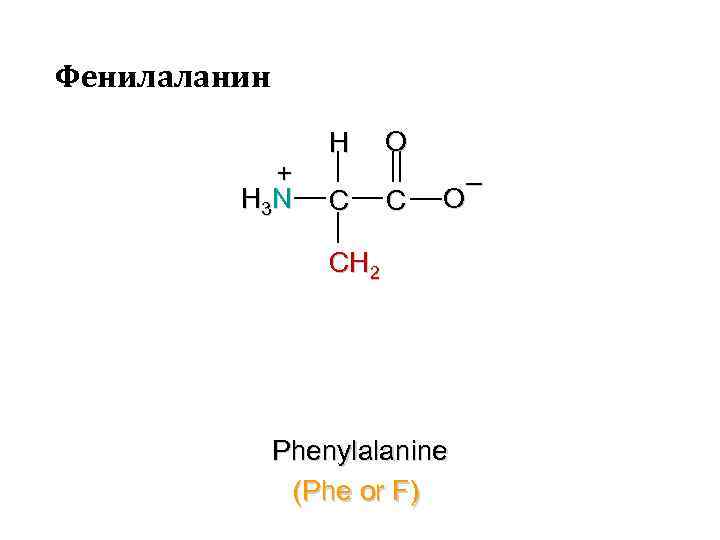
Фенилаланин + H 3 N H C O C – O CH 2 Phenylalanine (Phe or F)
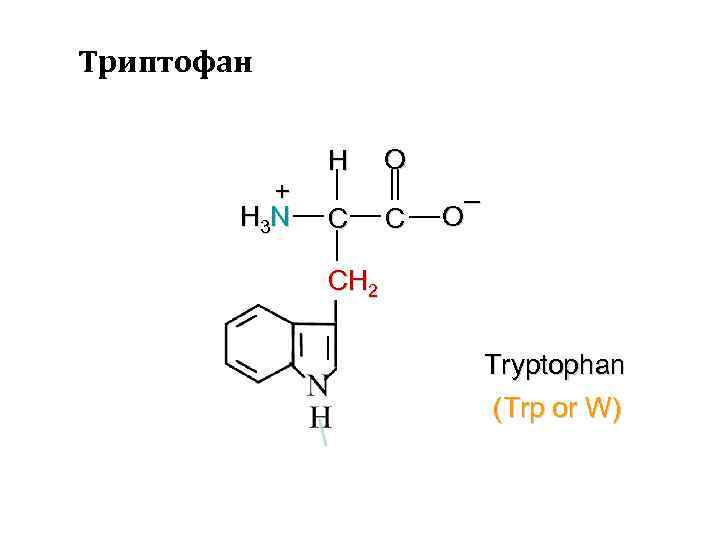
Триптофан + H 3 N H C O C – O CH 2 Tryptophan (Trp or W)

Полярные незаряженные аминокислоты
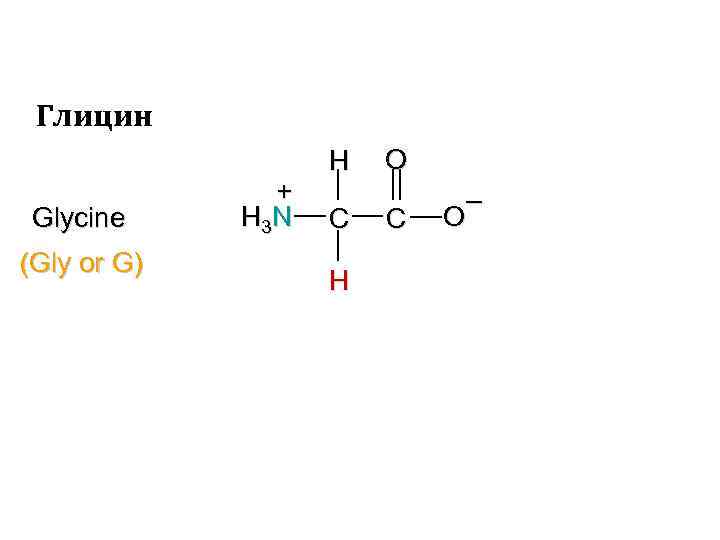
Глицин Glycine (Gly or G) + H 3 N H C H O C – O
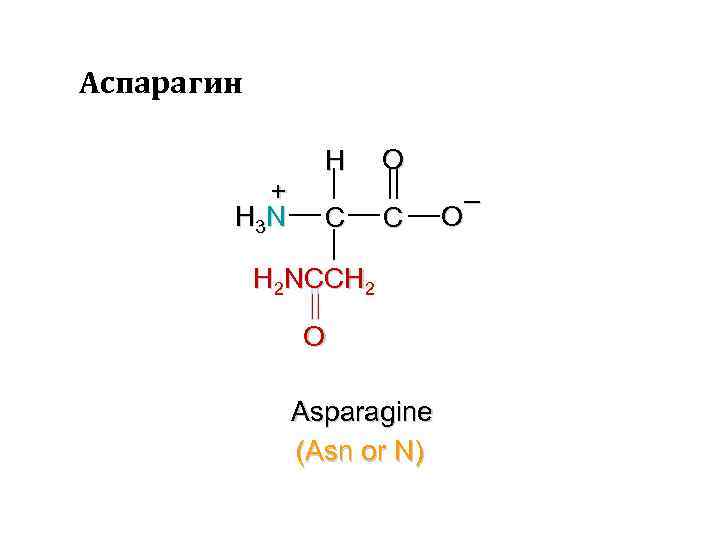
Аспарагин + H 3 N H C O C H 2 NCCH 2 O Asparagine (Asn or N) – O
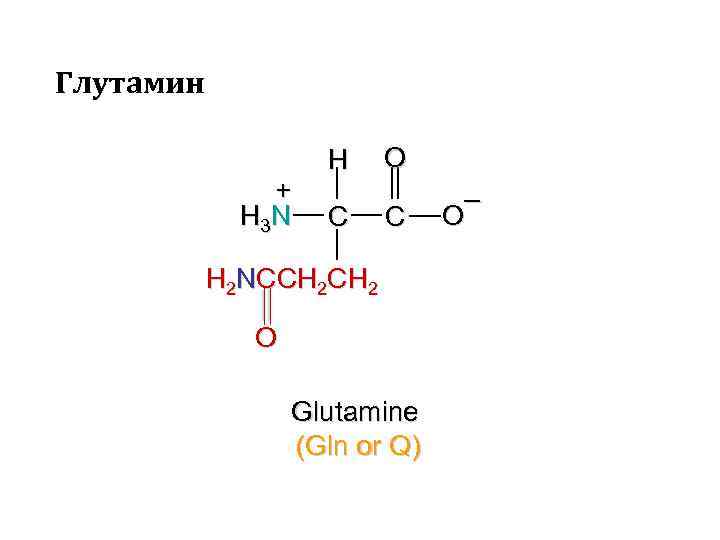
Глутамин + H 3 N H C O C H 2 NCCH 2 O Glutamine (Gln or Q) – O
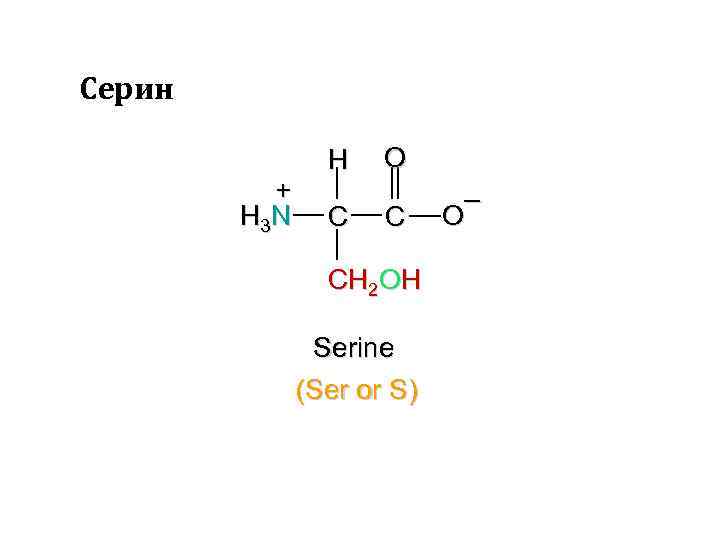
Серин + H 3 N H C O C CH 2 OH Serine (Ser or S) – O
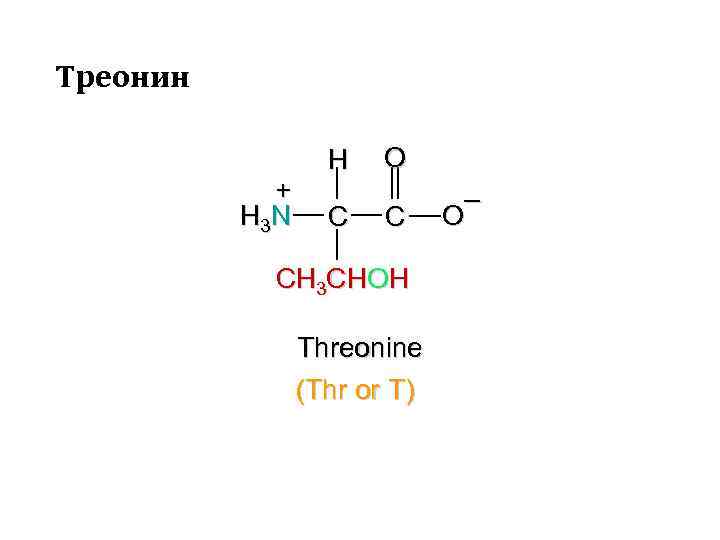
Треонин + H 3 N H C O C CH 3 CHOH Threonine (Thr or T) – O
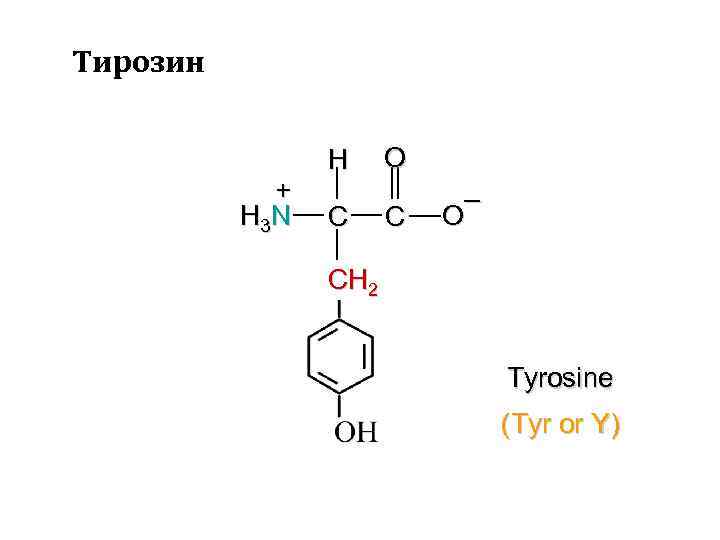
Тирозин + H 3 N H C O C – O CH 2 Tyrosine (Tyr or Y)
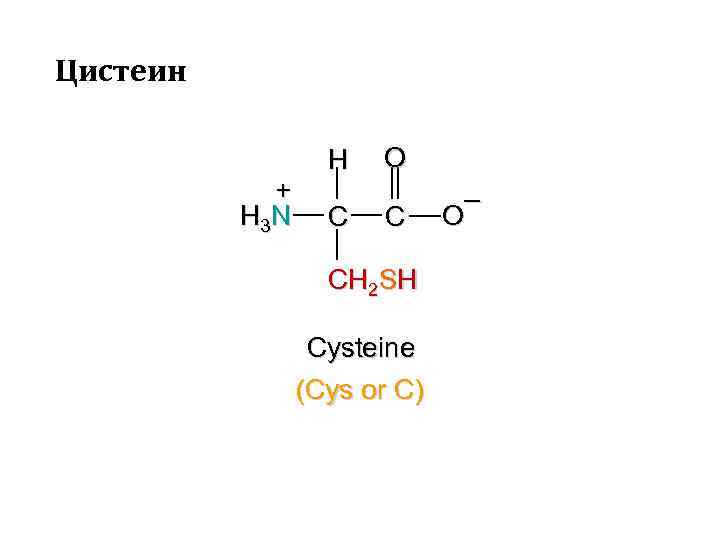
Цистеин + H 3 N H C O C CH 2 SH Cysteine (Cys or C) – O

Полярные отрицательно заряженные аминокислоты
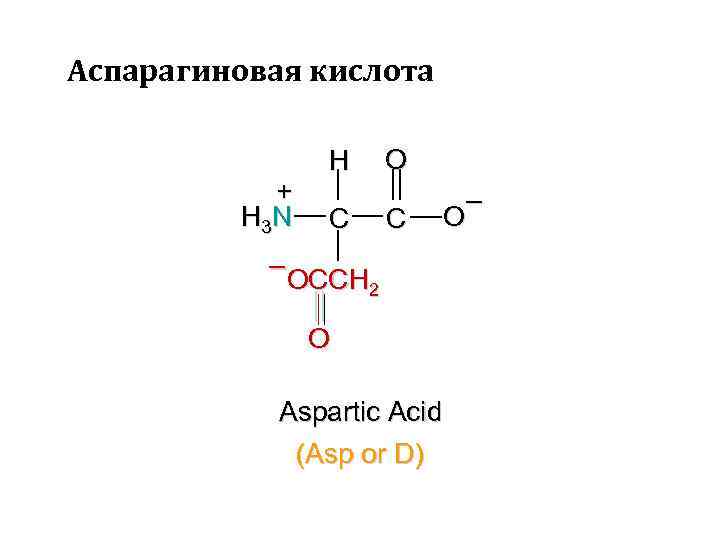
Аспарагиновая кислота + H 3 N H C O C – OCCH 2 O Aspartic Acid (Asp or D)
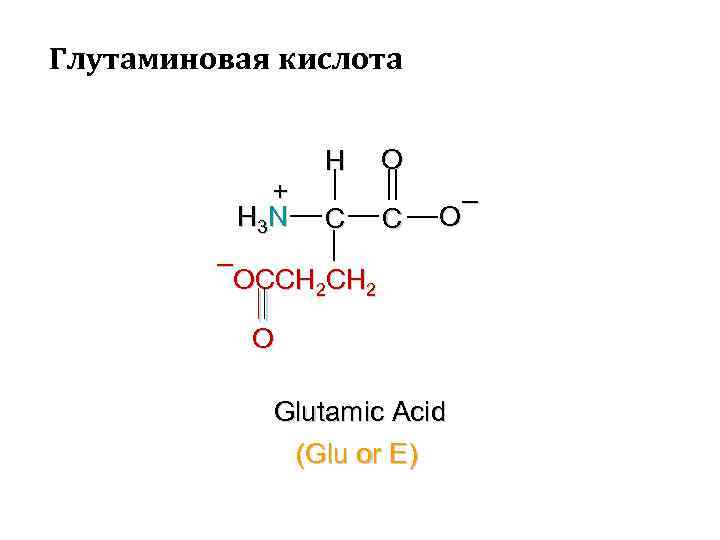
Глутаминовая кислота + H 3 N H C O C – OCCH 2 O Glutamic Acid (Glu or E)

Полярные положительно заряженные аминокислоты
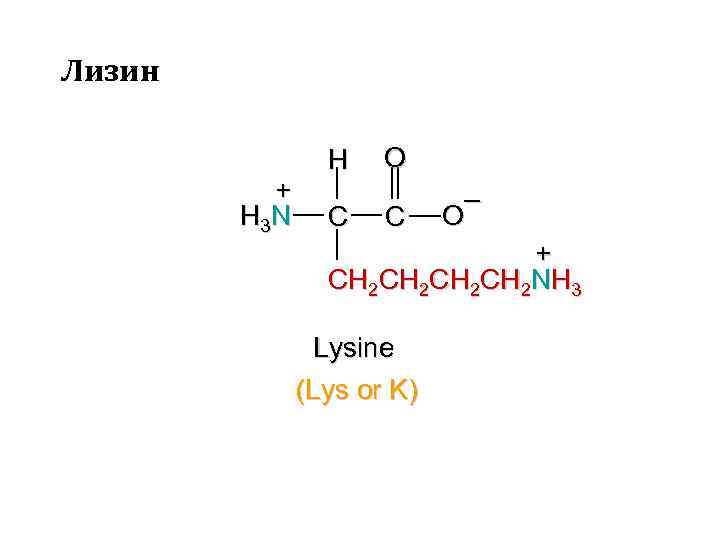
Лизин + H 3 N H C O C – O + CH 2 CH 2 NH 3 Lysine (Lys or K)

Аргинин + H 3 N H C O C – O CH 2 CH 2 NHCNH 2 + NH 2 Arginine (Arg or R)
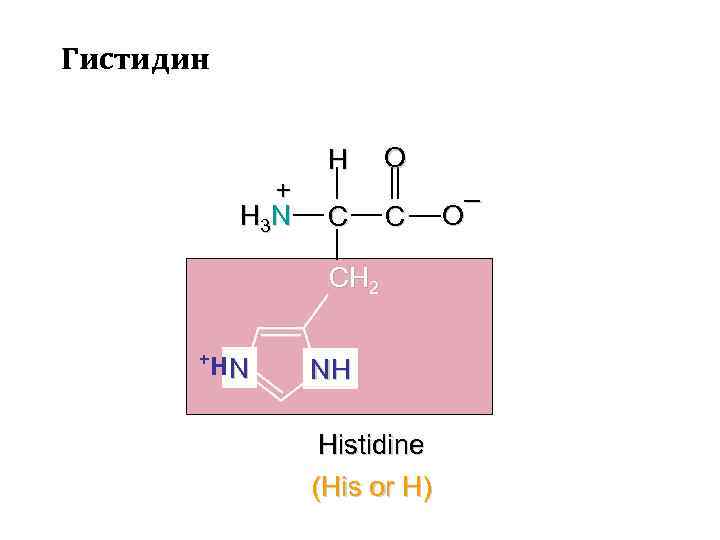
Гистидин + H 3 N H C O C CH 2 +Н N NH Histidine (His or H) – O
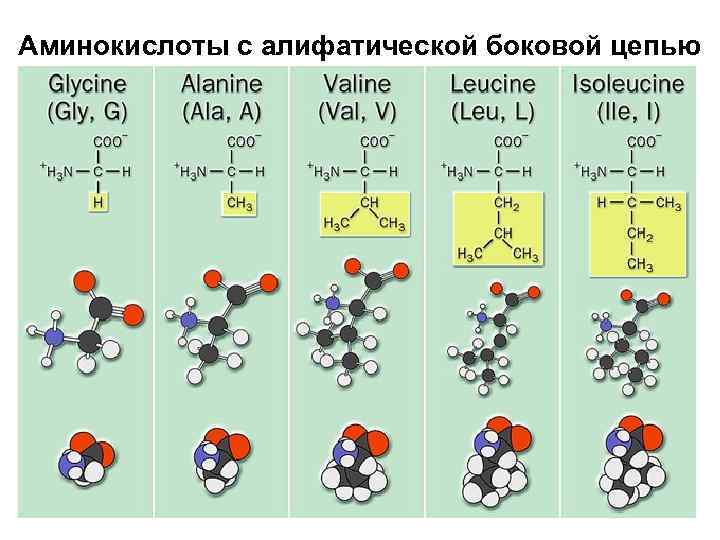
Аминокислоты с алифатической боковой цепью
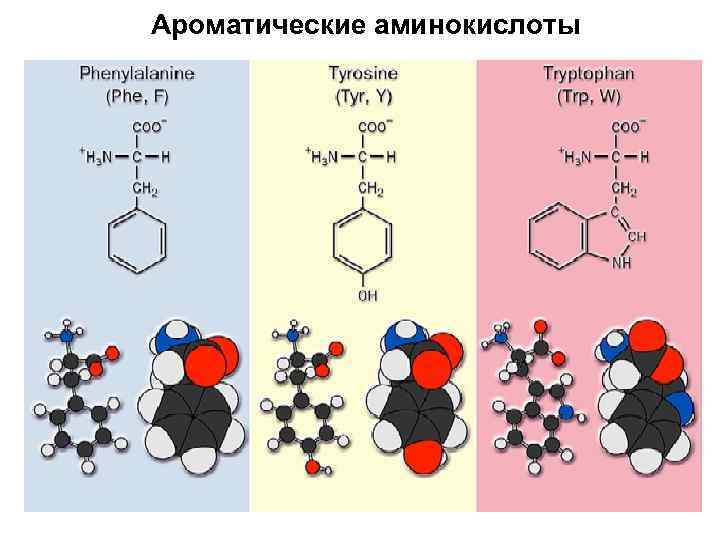
Ароматические аминокислоты
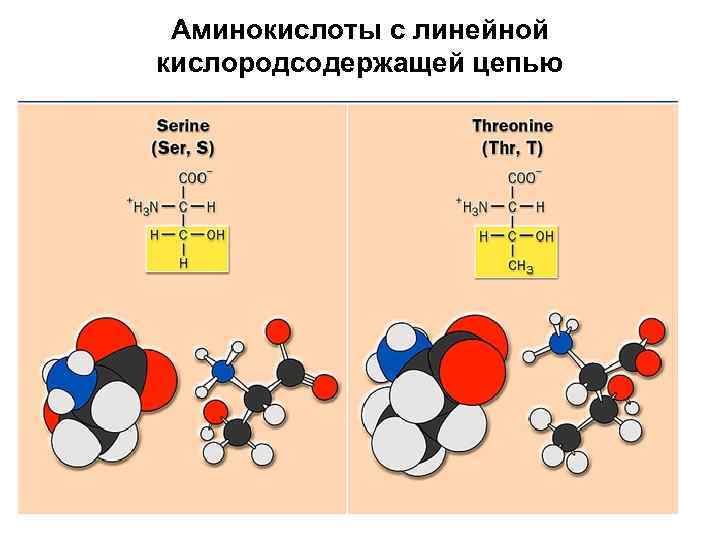
Аминокислоты с линейной кислородсодержащей цепью
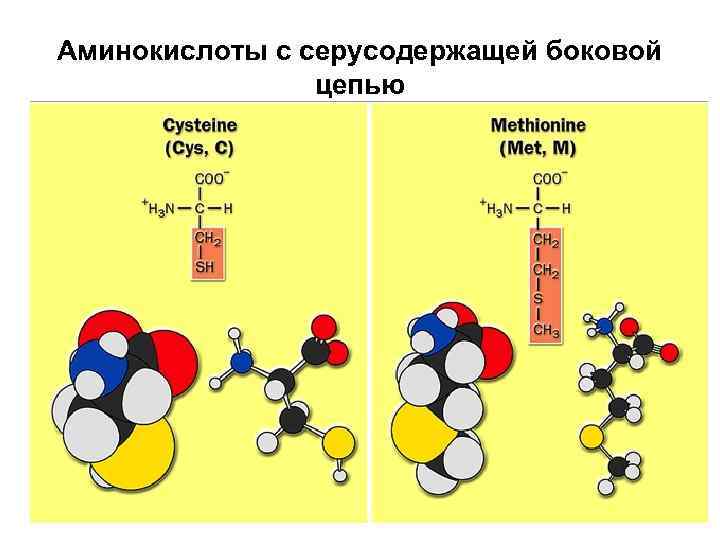
Аминокислоты с серусодержащей боковой цепью
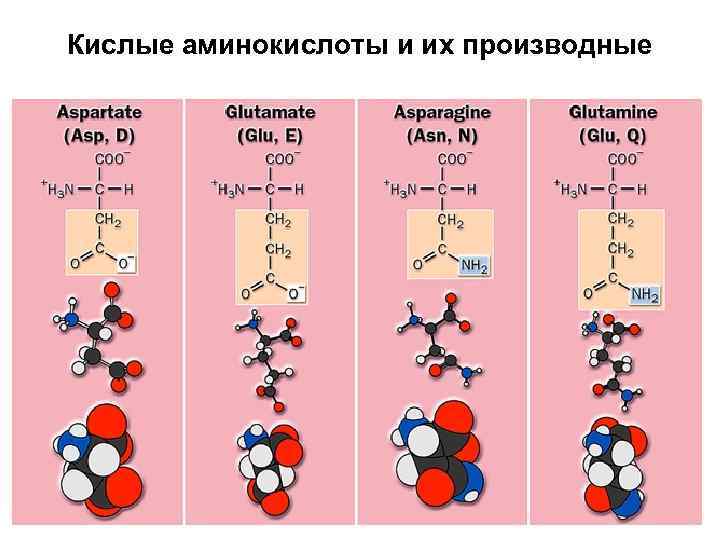
Кислые аминокиcлоты и их производные
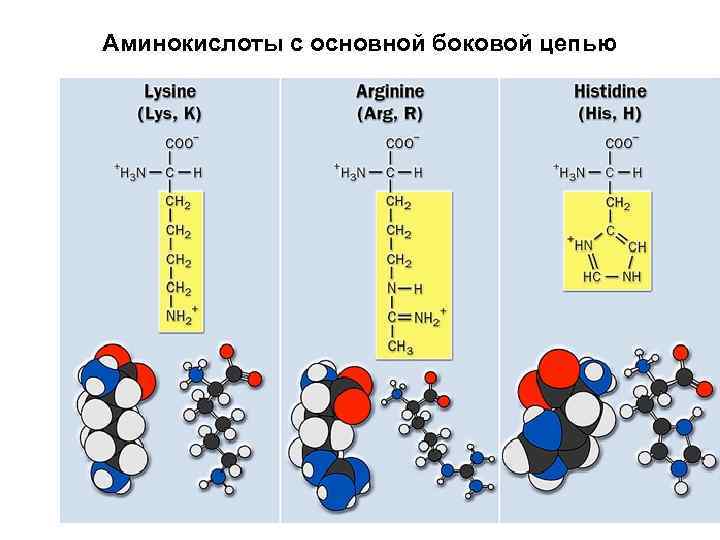
Аминокислоты с основной боковой цепью
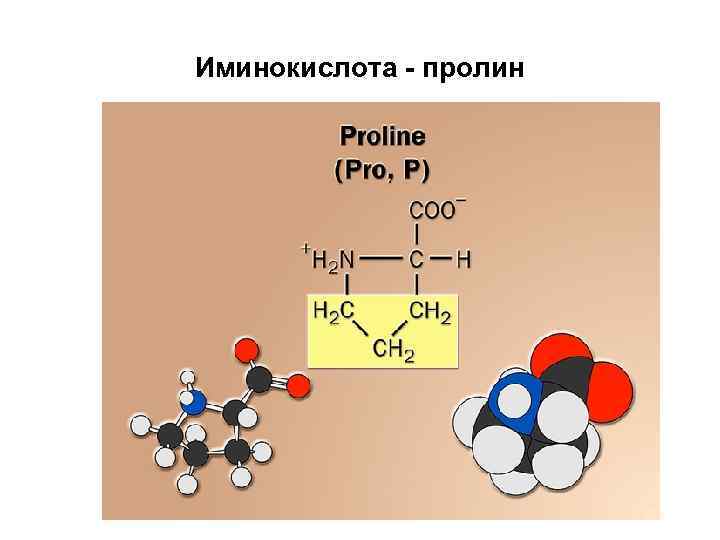
Иминокислота - пролин
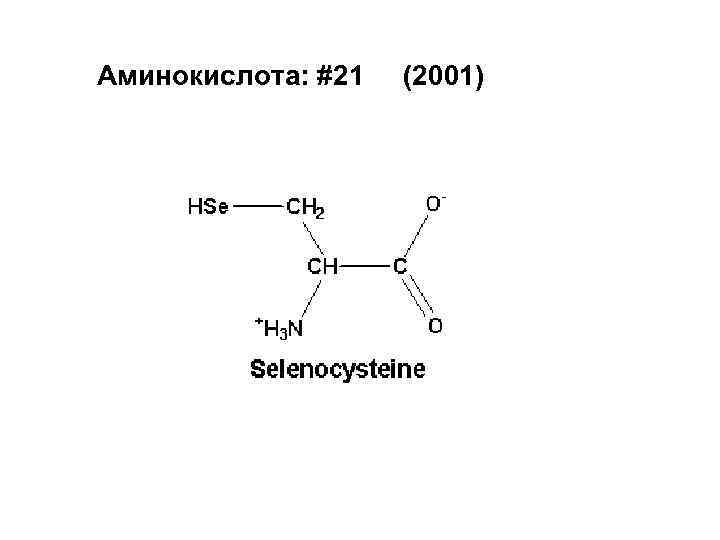
Аминокислота: #21 (2001)
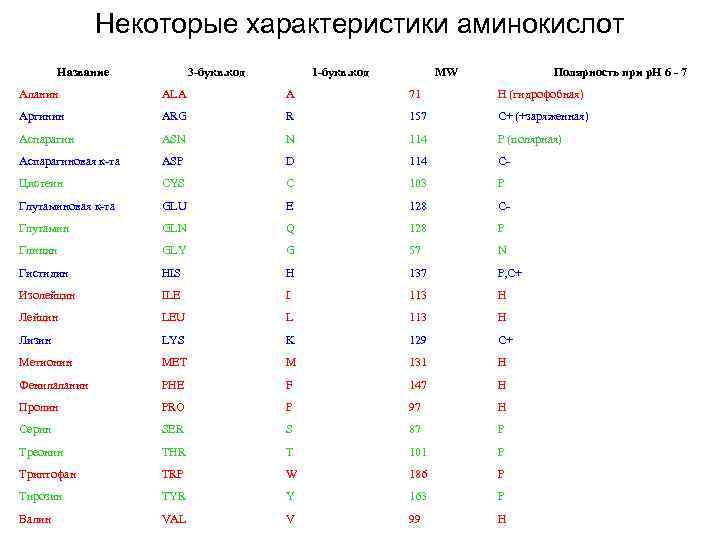
Некоторые характеристики аминокислот Название 3 -букв. код 1 -букв. код MW Полярность при р. Н 6 - 7 Аланин ALA A 71 H (гидрофобная) Аргинин ARG R 157 C+ (+заряженная) Аспарагин ASN N 114 P (полярная) Аспарагиновая к-та ASP D 114 C- Цистеин CYS C 103 P Глутаминовая к-та GLU E 128 C- Глутамин GLN Q 128 P Глицин GLY G 57 N Гистидин HIS H 137 P, C+ Изолейцин ILE I 113 H Лейцин LEU L 113 H Лизин LYS K 129 C+ Метионин MET M 131 H Фенилаланин PHE F 147 H Пролин PRO P 97 H Серин SER S 87 P Треонин THR T 101 P Триптофан TRP W 186 P Тирозин TYR Y 163 P Валин VAL V 99 H
биохимия аминокислоты.ppt