Биохимия - белки.ppt
- Количество слайдов: 15
Биохимия Белки. Структура белковых молекул та денатурация белка. Роль белков в организме. Сущность трансформации белков в ЖКТ. Биосинтез белка.
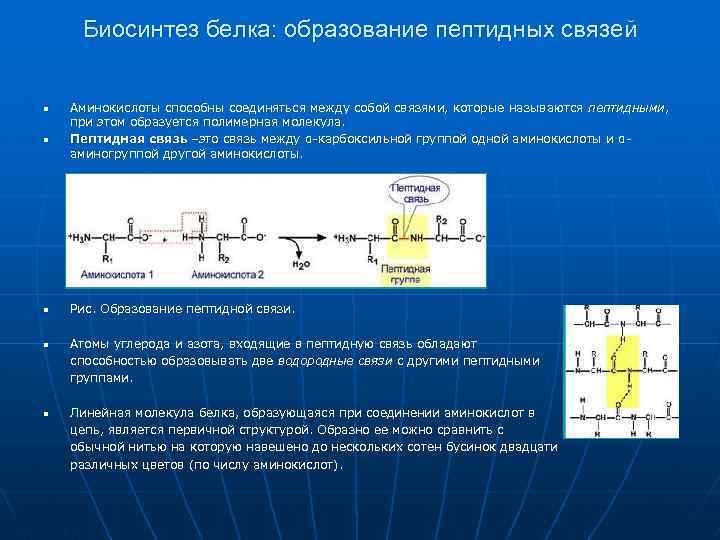
Биосинтез белка: образование пептидных связей n n Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Пептидная связь –это связь между α-карбоксильной группой одной аминокислоты и αаминогруппой другой аминокислоты. n n Рис. Образование пептидной связи. Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами. n Линейная молекула белка, образующаяся при соединении аминокислот в цепь, является первичной структурой. Образно ее можно сравнить с обычной нитью на которую навешено до нескольких сотен бусинок двадцати различных цветов (по числу аминокислот).

Передача наследственной информации n n n Для каждого организма, каждой клетки характерны свои строго специфические белки. Каким образом осуществляется передача генетической информации? Основной фигурой матричных биосинтезов являются нуклеиновые кислоты РНК и ДНК. Они представляют собой полимерные молекулы, в состав которых входят азотистые основания пяти типов, пентозы двух типов и остатки фосфорной кислоты. Азотистые основания в нуклеиновых кислотах могут быть пуриновыми (аденин, гуанин) и пиримидиновыми (цитозин, урацил (только в РНК), тимин (только в ДНК)). В зависимости от строения углевода выделяют рибонуклеиновые кислоты – содержат рибозу (РНК), и дезоксирибонуклеиновые кислоты – содержат дезоксирибозу (ДНК). В подавляющем большинстве случаев передача наследственной информации от материнской клетки к дочерней осуществляется при помощи ДНК (репликация). Для использования генетической информации самой клеткой необходимы РНК, образуемые на матрице ДНК (транскрипция). Далее РНК непосредственно участвуют на всех этапах синтеза белковых молекул (трансляция), обеспечивающих структуру и деятельность клетки. Термин "матричные биосинтезы" подразумевает способность клетки синтезировать полимерные молекулы, такие как нуклеиновые кислоты и белки, на основе шаблона – матрицы. Это обеспечивает точную передачу сложнейшей структуры от уже существующих молекул к новосинтезируемым.
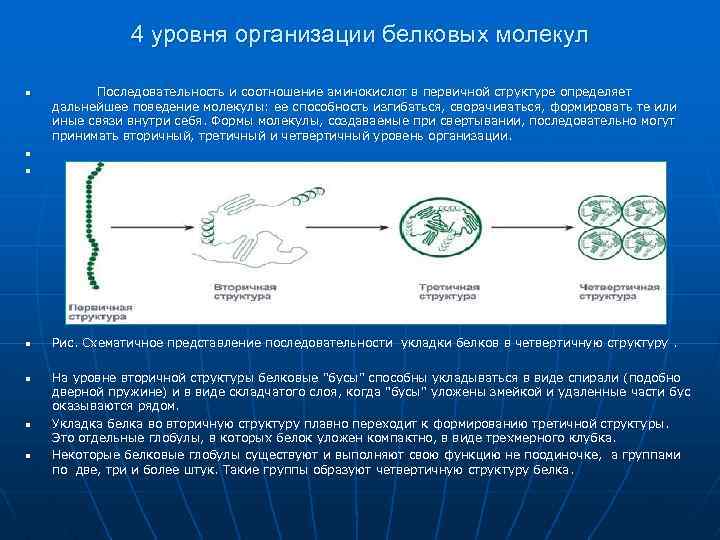
4 уровня организации белковых молекул n Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Формы молекулы, создаваемые при свертывании, последовательно могут принимать вторичный, третичный и четвертичный уровень организации. n Рис. Схематичное представление последовательности укладки белков в четвертичную структуру. n n n На уровне вторичной структуры белковые "бусы" способны укладываться в виде спирали (подобно дверной пружине) и в виде складчатого слоя, когда "бусы" уложены змейкой и удаленные части бус оказываются рядом. Укладка белка во вторичную структуру плавно переходит к формированию третичной структуры. Это отдельные глобулы, в которых белок уложен компактно, в виде трехмерного клубка. Некоторые белковые глобулы существуют и выполняют свою функцию не поодиночке, а группами по две, три и более штук. Такие группы образуют четвертичную структуру белка.
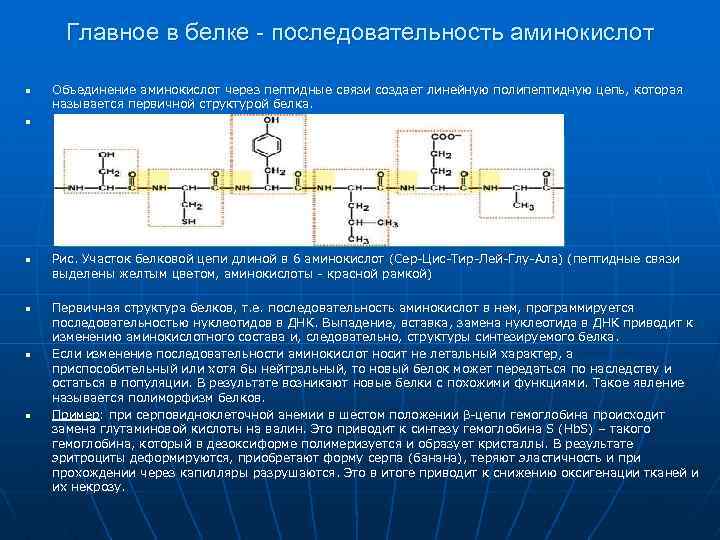
Главное в белке - последовательность аминокислот n n n Объединение аминокислот через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка. Рис. Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала) (пептидные связи выделены желтым цветом, аминокислоты - красной рамкой) Первичная структура белков, т. е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. Такое явление называется полиморфизм белков. Пример: при серповидноклеточной анемии в шестом положении β-цепи гемоглобина происходит замена глутаминовой кислоты на валин. Это приводит к синтезу гемоглобина S (Hb. S) – такого гемоглобина, который в дезоксиформе полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа (банана), теряют эластичность и прохождении через капилляры разрушаются. Это в итоге приводит к снижению оксигенации тканей и их некрозу.

Формирование вторичной структуры белка n n n Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала. Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка. Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и βскладчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – βструктура. Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т. д. Рис. Участие водородных связей в формировании вторичной структуры белка
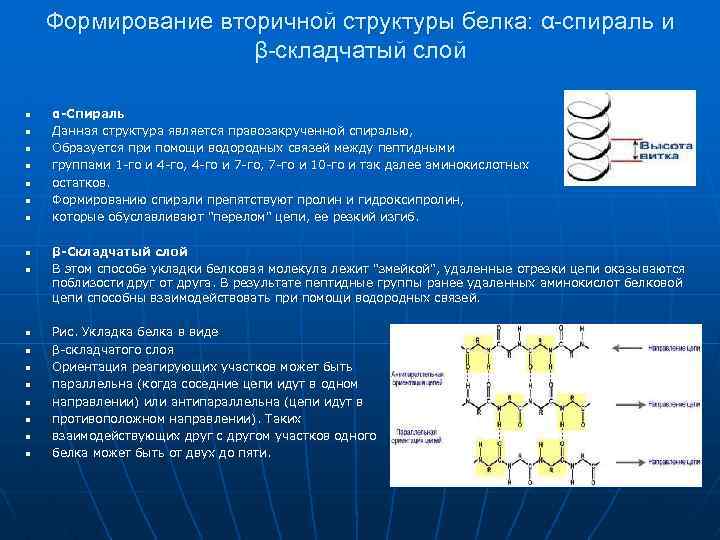
Формирование вторичной структуры белка: α-спираль и β-складчатый слой n n n n n α-Спираль Данная структура является правозакрученной спиралью, Образуется при помощи водородных связей между пептидными группами 1 -го и 4 -го, 4 -го и 7 -го, 7 -го и 10 -го и так далее аминокислотных остатков. Формированию спирали препятствуют пролин и гидроксипролин, которые обуславливают "перелом" цепи, ее резкий изгиб. β-Складчатый слой В этом способе укладки белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей. Рис. Укладка белка в виде β-складчатого слоя Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти.
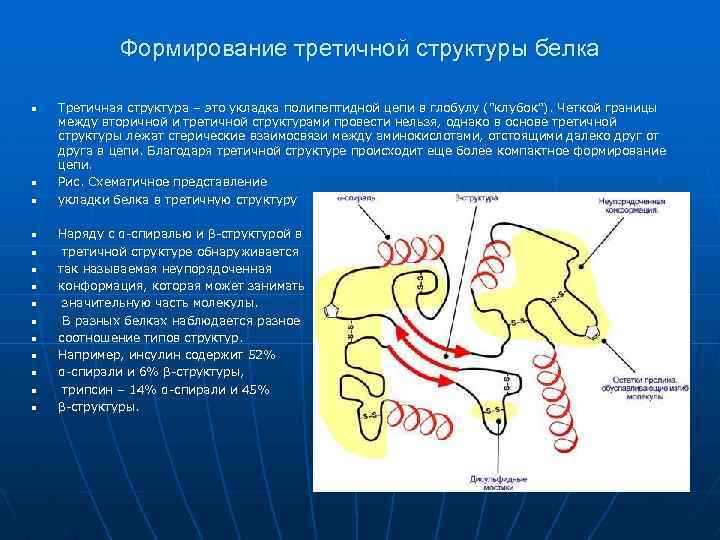
Формирование третичной структуры белка n n n Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи. Рис. Схематичное представление укладки белка в третичную структуру n n n Наряду с α-спиралью и β-структурой в третичной структуре обнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разных белках наблюдается разное соотношение типов структур. Например, инсулин содержит 52% α-спирали и 6% β-структуры, трипсин – 14% α-спирали и 45% β-структуры.

Формирование четвертичной структуры белка. Олигомеры n n Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т. д. Рис. Строение тетрамера гемоглобина взрослых n n n Например, гемоглобин – белок эритроцитов, переносящий кислород, у взрослых состоит из 4 субъединиц – 2 α-субъединицы и 2 β-субъединицы. Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т. е. их поверхность подходит другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей). Любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие.

Свойства белков n n n n К физико-химическим свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства. Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH 3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении р. Н, и отрицательно при его увеличении. Если р. Н раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т. е. способность поддерживать неизменным р. Н крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании. С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины р. Н раствора для осаждения какоголибо известного белка. Растворимость Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется: наличием заряда и взаимоотталкиванием заряженных молекул белка, наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30 -50 г воды.

Свойства белковых растворов n n n n n Растворы белков - коллоидные растворы Свойства белковых растворов определяются большими размерами молекул, т. е. белки являются коллоидными частицами и образуют коллоидные растворы. К свойствам белковых растворов относятся: 1. Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция. Особенно это заметно при прохождении луча света через белковый раствор, когда виден светящийся конус (эффект Тиндаля). 2. Белковые растворы в отличие от истинных обладают малой скоростью диффузии. 3. Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе. Очистка белковых препаратов от посторонних примесей лежит в основе работы "искусственной почки" при лечении острой почечной недостаточности. 4. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки. 5. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней. Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка и потере его функций. Некоторые способы осаждения позволяют впоследствии восстановить нативные свойства и работоспособность белков. Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация). Иногда для ренативации достаточно просто удалить повреждающий агент.

Денатурация белка n n n n Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. 1. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. 2. Химическая денатурация Зависит от природы денатурирующего реагента: кислоты и щелочи образуют водородные связи с пептидными группами, органические растворители образуют водородные связи и вызывают дегидратацию, алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей, тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей. Высаливание – это добавление к раствору белка нейтральных солей (Na 2 SO 4, (NH 4)2 SO 4). Механизм высаливания заключается во взаимодействии анионов (SO 42 -) и катионов (Na+, NH 4+) с зарядами белка (группы NH 4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению. Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены. Осаждение водоотнимающими средствами (ацетон, этанол) - происходит отнятие у белка гидратной оболочки, но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, в этом заключается антисептическое действие этанола. Мягкое изменение р. Н до изоэлектрической точки белка ведет к исчезновению заряда, сопутствующему уменьшению гидратной оболочки и, как следствие, снижению растворимости молекулы.

Классификация белков n n n Классификация по функции В соответствии с биологическими функциями выделяют: структурные белки (коллаген, кератин), ферментативные (пепсин, амилаза), транспортные (трансферрин, альбумин, гемоглобин), пищевые (белки яйца, злаков), сократительные и двигательные (актин, миозин, тубулин), защитные (иммуноглобулины, тромбин, фибриноген), регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин). Классификация по строению В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет <10 и в большинстве случаев не более 3 -4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови. Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген. По количеству белковых цепей в одной молекуле выделяют мономерные белки, которые имеют одну субъединицу (протомер) и полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумин, миоглобин, к полимерным - гемоглобин (4 субъединицы), лактатдегидрогеназа (4 субъединицы), креатинкиназа (2 субъединицы), По химическому составу все белки подразделяют на простые и сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты (нуклеопротеины, фосфопротеины, металлопротеины, липопротеины, хромопротеины, гликопротеины).

Сложные белки n n n У сложных белков, кроме белковой цепи, имеется дополнительная небелковая группа. Она называется лиганд (лат. ligo - связываю), то есть молекула, связанная с белком. В случае если лиганд несет структурную и/или функциональную нагрузку, он называется простетической группой. В роли лиганда могут выступать любые молекулы: молекулы, выполняющие в белке структурную функцию – липиды, углеводы, нуклеиновые кислоты, минеральные элементы, какие-либо другие органические соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК и РНК в нуклеопротеинах, медь в церулоплазмине, переносимые белками молекулы: железо в трансферрине, гемоглобин в гаптоглобине, гем в гемопексине, субстраты для ферментов – любые молекулы и даже другие белки. Узнавание лиганда обеспечивается: комплементарностью структуры центра связывания белка структуре лиганда, иначе говоря, пространственным и химическим соответствием белка и лиганда. Они подходят друг к другу как ключ к замку, например, соответствие фермента и субстрата, иногда узнавание может зависеть от реакционной способности атома, к которому присоединяется лиганд. Например, связывание кислорода железом гемоглобина, или жирной кислоты с альбумином. Функции лиганда в составе сложного белка разнообразны: изменяет свойства белков (заряд, растворимость, термолабильность), например, фосфорная кислота в фосфопротеинах или остатки моносахаридов в гликопротеинах, защищает белок от протеолиза вне и внутри клетки, например углеводная часть в гликопротеинах, в виде лиганда обеспечивается транспорт нерастворимых в воде соединений, например, перенос жиров липопротеинами, придает биологическую активность и определяет функцию белка, например, нуклеиновая кислота в нуклеопротеинах, гем в гемоглобине, углевод в рецепторных белках, влияет на проникновение через мембраны, внутриклеточную миграцию, сортировку и секрецию белков. Это выполняет, как правило, углеводный остаток.

Трансформация белков в ЖКТ n n n Во всех клетках организма постоянно идут процессы анаболизма и катаболизма. Также как и любые другие молекулы, белковые молекулы в организме непрерывно распадаются и синтезируются, т. е. идет процесс самообновления белков. В здоровом организме мужчины массой 70 кг величина скорости распада соответствует скорости синтеза и равна 500 г белка в сутки. ВОЗ рекомендует обязательный прием 42 г белка в сутки для здорового человека для нормального азотистого баланса. Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи. Одним из таких ферментов, действующих в желудке и относящихся к эндопептидазам, является пепсин. Рис. Связи, расщепляемые пепсином. Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи. Сок поджелудочной железы содержит проферменты – трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы, соответственно, способом ограниченного протеолиза. Указанные ферменты осуществляют основную работу по перевариванию белков. В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков. Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы – экзопептидазы.
Биохимия - белки.ppt