Биохимия - Аминокислоты.ppt
- Количество слайдов: 11

Биохимия Аминокислоты

Аминокислоты n n n Аминокислоты по строению являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Аминокислоты - это строительные блоки белковых молекул, но необходимость их изучения кроется не только в данной функции. Несколько из них являются источником для образования нейромедиаторов в ЦНС (гистамин, серотонин, гамма-аминомасляная кислота, дофамин, норадреналин), другие сами являются нейромедиаторами (глицин, глутаминоваякислота). Те или иные группы аминокислот необходимы для синтеза пуриновых и пиримидиновых оснований без которых нет нуклеиновых кислот, используются для синтеза низкомолекулярных биологически важных соединений (креатин, карнитин, карнозин, ансерин и др. ). Аминокислота тирозин целиком входит в состав гормонов щитовидной железы и мозгового вещества надпочечников. С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма (цистиноз, гомоцистеинемия, лейциноз, тирозинемии и др). Самым известным примером является фенилкетонурия.

Применение аминокислот в фармакологии n n n n Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В 12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени. Метионин ("Ациметион") и его активные производные (как вещество "адеметионин" в составе препарата "Гептрал") используют для профилактики и лечения различных заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов. Глутаминовая кислота – является предшественником гамма-аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы. Сам глутамат также является нейромедиатором, стимулирующим передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновых и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот, что активно используется в спортивной медицине. Потребность организма в глутаминовой кислоте намного выше потребности в остальных аминокислотах. Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния. Цистеин участвует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты. Комплексный препарат глутаминовой кислоты, цистеина и глицина "Вицеин" используют в виде глазных капель. Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки. Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т. п. Препараты для парентерального питания: полиамин (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого скота), аминотроф (гидролизат казеина), фибриносол (гидролизат фибрина крови).

Классификация аминокислот n Аминокислоты по строению являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Таким образом, в аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа (NH 2), асимметричный атом углерода и боковая цепь (радикал R). Именно строением боковой цепи аминокислоты и отличаются друг от друга. n n n Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты подразделяются: 1. В зависимости от положения аминогруппы по отношению к С 2 (α-углеродный атом) на αаминокислоты, β-аминокислоты и др. 2. По абсолютной конфигурации молекулы на L- и D-стереоизомеры. 3. По оптической активности в отношении плоскости поляризованного света – на право- и левовращающие. 4. По участию аминокислот в синтезе белков – протеиногенные и непротеиногенные. 5. По строению бокового радикала – ароматические, алифатические, содержащие дополнительные СООН- и NH 2 -группы. n 6. По кислотно-основным свойствам – нейтральные, кислые, основные. n 7. По необходимости для организма – заменимые и незаменимые.

Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3 -х буквенного обозначения. По строению бокового радикала выделяют алифатические (аланин, валин, лейцин, изо- лейцин, пролин, глицин), ароматические (фенилаланин, тирозин, триптофан), серусодержащие (цистеин, метионин), содержащие ОНгруппу (серин, треонин, опять тирозин), содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты) и дополнительную NH 2 -группу (лизин, аргинин, гистидин, также глутамин, аспарагин). По полярности бокового радикала существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные). По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.

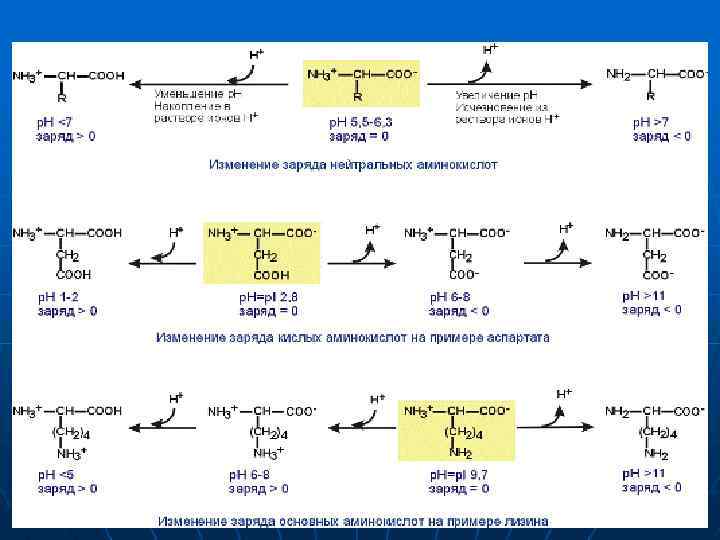
Амфотерность аминокислот n n n Основным физико-химическим свойством аминокислот является амфотерность. Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина р. Н, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, p. I). Значение изоэлектрической точки зависит от строения радикала аминокислоты: ИЭТ большинства аминокислот располагается в диапазоне р. Н от 5, 5 (фенилаланин) до 6, 3 (пролин), ИЭТ кислых аминокислот - для глутамата 3, 2, для аспартата 2, 8, ИЭТ основных аминокислот - для гистидина 7, 6, для аргинина 10, 8, для лизина 9, 7. Заряд аминокислот зависит от величины р. Н среды и от строения их радикала. При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты отрывается положительный заряд и она становится отрицательно заряженной. Когда р. Н снижается (закисление среды), то имеющиеся в растворе ионы Н+ присоединяются к амино- и карбоксигруппам – заряд становится положительным. n Отправным пунктом для понимания причин появления заряда у конкретной аминокислоты является величина изоэлектрической точки. К сказанному абзацем выше необходимо добавить одну очень существенную вещь – изменение р. Н рассматривается относительно изоэлектрической точки. Если р. Н ниже ИЭТ – заряд аминокислоты становится положительным, если р. Н выше – отрицательным.

Соединение аминокислот: пептидная связь n n Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок. Пептидная связь –это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты. Рис. Образование пептидной связи. n При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным. n n Например, аланил-серил-триптофан или γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион). n К свойствам пептидной связи относятся копланарность n Рис. Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
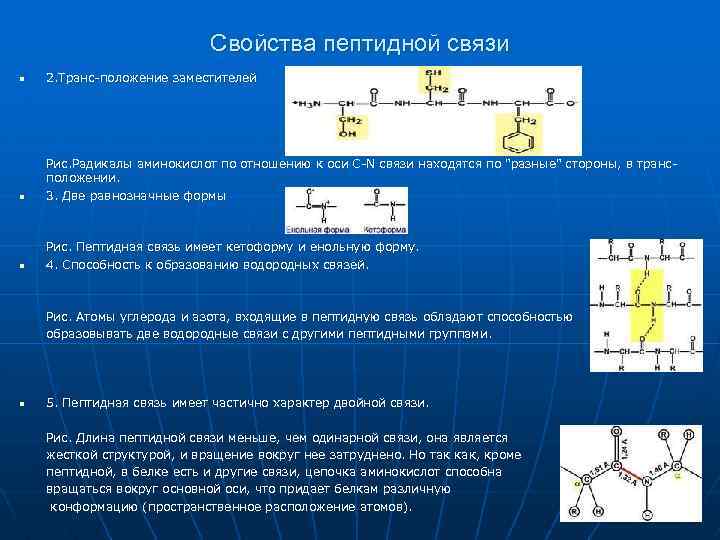
Свойства пептидной связи n 2. Транс-положение заместителей n Рис. Радикалы аминокислот по отношению к оси C-N связи находятся по "разные" стороны, в трансположении. 3. Две равнозначные формы n Рис. Пептидная связь имеет кетоформу и енольную форму. 4. Способность к образованию водородных связей. Рис. Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами. n 5. Пептидная связь имеет частично характер двойной связи. Рис. Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).

Направления метаболизма аминокислот n n Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот. Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк. Рис. Возможные пути превращений аминокислот. Реакции превращения аминокислот в клетке условно разделяют на три части, в зависимости от реагирующей группы: • по боковой цепи (радикалу), • по карбоксильной группе, • с участием аминогруппы. n
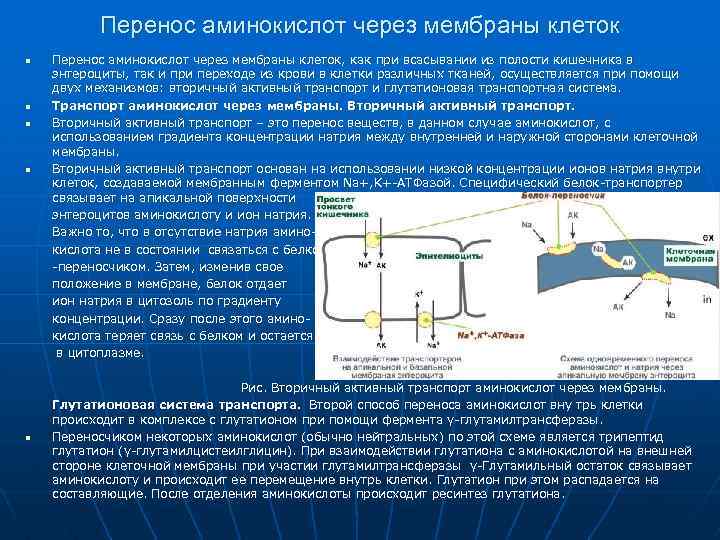
Перенос аминокислот через мембраны клеток n n n Перенос аминокислот через мембраны клеток, как при всасывании из полости кишечника в энтероциты, так и при переходе из крови в клетки различных тканей, осуществляется при помощи двух механизмов: вторичный активный транспорт и глутатионовая транспортная система. Транспорт аминокислот через мембраны. Вторичный активный транспорт – это перенос веществ, в данном случае аминокислот, с использованием градиента концентрации натрия между внутренней и наружной сторонами клеточной мембраны. Вторичный активный транспорт основан на использовании низкой концентрации ионов натрия внутри клеток, создаваемой мембранным ферментом Na+, K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Важно то, что в отсутствие натрия аминокислота не в состоянии связаться с белком -переносчиком. Затем, изменив свое положение в мембране, белок отдает ион натрия в цитозоль по градиенту концентрации. Сразу после этого аминокислота теряет связь с белком и остается в цитоплазме. Рис. Вторичный активный транспорт аминокислот через мембраны. Глутатионовая система транспорта. Второй способ переноса аминокислот вну трь клетки происходит в комплексе с глутатионом при помощи фермента γ-глутамилтрансферазы. Переносчиком некоторых аминокислот (обычно нейтральных) по этой схеме является трипептид глутатион (γ-глутамилцистеилглицин). При взаимодействии глутатиона с аминокислотой на внешней стороне клеточной мембраны при участии глутамилтрансферазы γ-Глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки. Глутатион при этом распадается на составляющие. После отделения аминокислоты происходит ресинтез глутатиона.
Биохимия - Аминокислоты.ppt