Біотехнологія в медицині


Біотехнологія в медицині

План 1. Виробництво антибіотиків. 2. Трансформація стероїдних препаратів. 3. Одержання моноклональних антитіл 4. Одержання ліків з біомаси рослин. 5. Біоcенсори. 6. Застосування імобілізованих ферментів у медицині.

1. Виробництво антибіотиків. Це низькомолекулярні речовини різної хімічної будови. Спільне те, що вони є продуктами життєдіяльності мікроорганізмів, і в той же час в дуже малих концентраціях специфічно порушують їх ріст, метаболічні процеси. Відомо близько 5000 – 6000 антибіотиків продуцентами яких є : 1. шість родів нитчатих грибів (Cephalosporium, Penicillinum); 2. три роди актиноміцетів (виробляють близько 4000 антибіотиків, в основному це рід Streptomices, що дає 70 % загальної їх кількості); 3. два роди бактерій (виробляють близько 500 антибіотиків).
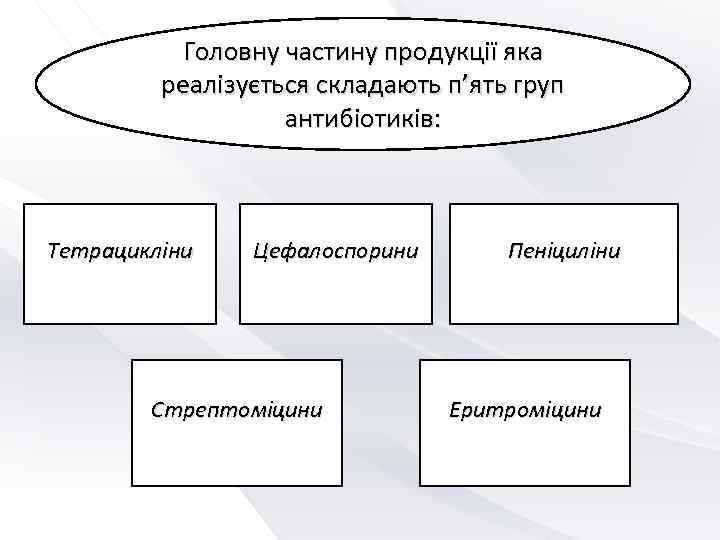
Головну частину продукції яка реалізується складають п’ять груп антибіотиків: Тетрацикліни Цефалоспорини Пеніциліни Стрептоміцини Еритроміцини

Пеніцилін та його похідні. Природний пеніцилін, який виробляється деякими видами зеленої плісняви (Penicillіum), являє собою суміш речовин загальною формулою: 6 – амінопеніциланова кислота ( 6 – АПК) Основним продуцентом пеніциліну є Penicillin chrizogenum. Виявилось, що при введенні в середовище карбонових кислот, або їх похідних переважно утворюється той пеніцилін, який містить боковий ланцюг введеної кислоти. Одержані таким чином пеніциліни називають біосинтетичними. Так у присутності фенілоцтової кислоти (R=С 6 Н 5 СН 2), утворюється пеніцилін G, параоксифенілоцтової кислоти (R=НОС 6 Н 4 СН 2) – оксибензилпеніцилін, феноксиоцтової кислоти (R=С 6 Н 5 ОСН 2) – феноксиметилпеніцилін.

Для виробництва найбільш розповсюдженого антибіотика - пеніциліну (G), використовують високопродуктивні промислові штами Penicillium chrizogenum, який вирощують в 100 000 літрових ферментерах в присутності фенілоцтової кислоти на багатому поживному середовищі. Для забезпечення безперервного виходу 14 -15 ферментерів працюють в змінному режимі (їх загружають почергово), так як мікробіологічна стадія виробництва пеніциліну триває протягом 200 годин, а видалення продукту з ферментера - 15 годин. Після закінчення ферментації мікроорганізми і культуральну рідину розділяють фільтруванням, а клітини плісняви промивають. З фільтрату і промивної рідини в кристалізаторах, з допомогою бутанолу та йонів калію (К+) одержують кристалічну калієву сіль пеніциліну (99, 5%). Цей антибіотик є вихідною речовиною для одержання подальших хімічних модифікацій.

Виробництво антибіотиків – сама більша галузь фармацевтики. Але їх застосування можливе не лише для терапевтичних цілей. Фітобактеріоміцин, трихотецин, використовуються для біологічного захисту рослин, від хвороб. Препарати тетрацикліну, бацитрацину, гризину, гігроміцину використовують в тваринництві для лікування і профілактики. Нізин і тетрациклін – добавки для концервацій. Монензин – стимулятор росту сільськогосподарських тварин. Фармакологічна дія заключається у пригніченні утворення метану в рубці жуйних метаногенними бактеріями. При цьому збільшується кількість летких кислот, особливо пропіонової, які засвоюються тваринами.

2. Трансформація стероїдних препаратів. В останні 30 років субстратна та стереоспецифічність ферментів як каталізаторів, знайшла широке використання у виробництві стероїдів, при здійсненні різноманітних реакцій (гідроксилювання, дегідратації, епоксидування, окиснення, відновлення, гідрогенізації, етерифікації, гідролізу ефірів, ізомеризації та ін. ). Специфічність таких реакцій визначається або вибором певного виду мікрооганізмів, або хімічною модифікацією субстрату, що виключає інші реакції. Використання біотрансформації поряд з традиційними хімічними перетвореннями, дозволило одержувати більш простими і дешевими способами багато стероїдів, на основі стеролвмісної рослинної сировини. Саме завдяки цьому такі стероїди як преднізолон, декаметазон, тестостерон, естрадіол, сьогодні широко застосовуються в медицині.
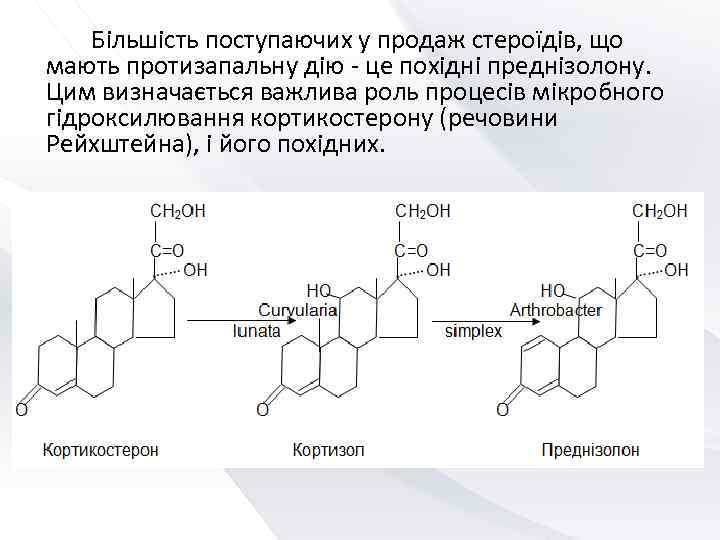
Більшість поступаючих у продаж стероїдів, що мають протизапальну дію - це похідні преднізолону. Цим визначається важлива роль процесів мікробного гідроксилювання кортикостерону (речовини Рейхштейна), і його похідних.

Приклади застосування в клініці стероїдних препаратів

3. Одержання моноклональних антитіл Уже в 60 -ті роки ХХ ст. розроблено методи злиття соматичних клітин тварин і людини. У процесі використовували вірус Сендай і ПЕГ, які збільшують вірогідність утворення гібриду. Один з результатів методу злиття клітин ссавців швидко знайшов застосування в БТ. Це лінії клітин, що одержуються при гібридизації за участю клітин мієломи та лімфоцитів, за допомогою яких можуть виробляти моноклональні антитіла, тобто антитіла здатні реагувати лише з одним антигеном. Мієломи – злоякісні утворення імунної системи, які мають здатність до необмеженого росту і продукують (синтезують) один тип білків – антитіл. Тобто це природний продуцент моноклональних антитіл.

Одержання гібридом на основі мієломних клітин та імунізованих лімфоцитів складається із наступних етапів: 1. Одержання мієломних клітин і підготовка їх до гібридизації. 2. Одержання лімфоцитів – продуцентів антитіл до заданих антигенів. 3. Злиття мієломних клітин з лімфоцитами (використовують ПЕГ, вірус Сендай і лізолецитин, а також електричний імпульс). 4. Скрінінг гібридомних клітин. 5. Перевірка здатності продукувати задані моноклональні антитіла. 6. Клонування гібридомних клітин з контролем на стабільність імунних властивостей. 7. Одержання масових культур гібридомних клітин.

Моноклональні антитіла використовують в діагностиці, наприклад: ► при визначенні групи крові; ► при пересадці органів і тканин; ► для вивчення функціонування (мічених) нейронів, клітинних мембран та ін. ; ► при очищенні білка та інших сполук (імуноадсорбція); ► пасивна імунізація (не вдалося ще одержати стабільні клони на основі клітин людини); ► при встановленні алергену.

4. Одержання ліків з біомаси рослин. Вперше вдалося ввести в культури клітини тварин на початку ХХ століття. Перші успіхи по культивуванню рослинних клітин відносять до 30 -х років, але розвиток цього напрямку відносять до 60 - 70 -х років ХХ ст. У 70 -ті роки розроблено спосіб одержання протопластів рослин, а також відкриття гібридизації соматичних клітин. Культивують рослинні клітини у вигляді: ► каллюсної тканини; ► суспензійних культур; ► поодиноких клітин.

Каллюсна тканина (ранева) у природі характерна для травмованих рослин. Для її одержання шматочок тканини (клітину) поміщують на штучне напіврідке поживне середовище у пробірки, колби, чашки Петрі. Калюсну тканину використовують для одержання з неї рослин (соматичних гібридів, безвірусних рослин та ін. ), а також для збереження в стані росту колекцій різних штамів, ліній, мутантів, з неї одержують, також, суспензії клітин, які культивують на рідкому поживному середовищі. Суспензійні культури – це суміш поодиноких, 3 -5 і навіть >50 з’єднаних клітин, які вирощують у завислому стані. Їх одержують перемішуючи в колбах на качалалках калюсну рихлу тканину. Можна отримати суспензію і з фрагмента рослини, але це більш трудоємкий процес. Джерело окремих клітин – ізольовані протопласти або суспензійні культури.

5. Біоcенсори. Створення біосенсорів базується на досягненнях у біології, хімії, фізиці, мікроелектроніці. Біосенсор – аналітичний пристрій який селективно реагує на концентрацію хімічних сполук у біологічних зразках. Біосенесор – аналітичний прилад, що містить іммобілізований біологічний матеріал, та за допомогою відповідного перетворювача перетворює інформацію про властивості досліджуваної системи в кількісний сигнал. Перша важлива частина будь-якого біосенсора – біологічно чутливий елемент. Друга важлива частина біосенсора – перетворювач “первинного” сигналу і система відображення результатів.
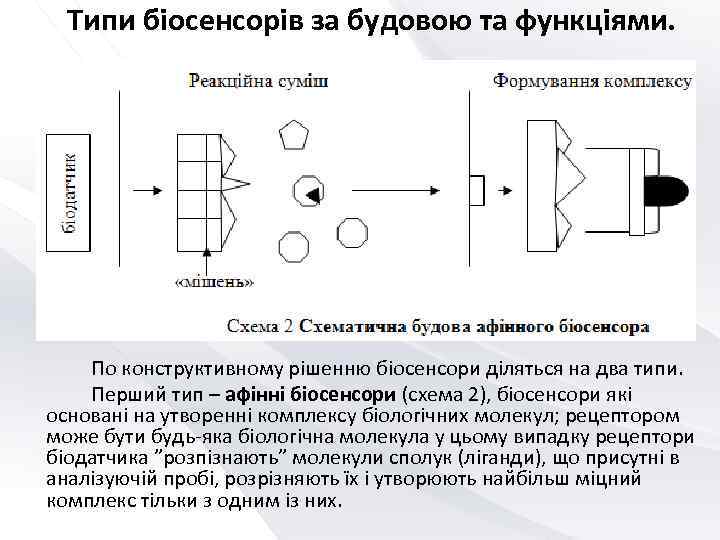
Типи біосенсорів за будовою та функціями. По конструктивному рішенню біосенсори діляться на два типи. Перший тип – афінні біосенсори (схема 2), біосенсори які основані на утворенні комплексу біологічних молекул; рецептором може бути будь-яка біологічна молекула у цьому випадку рецептори біодатчика ”розпізнають” молекули сполук (ліганди), що присутні в аналізуючій пробі, розрізняють їх і утворюють найбільш міцний комплекс тільки з одним із них.
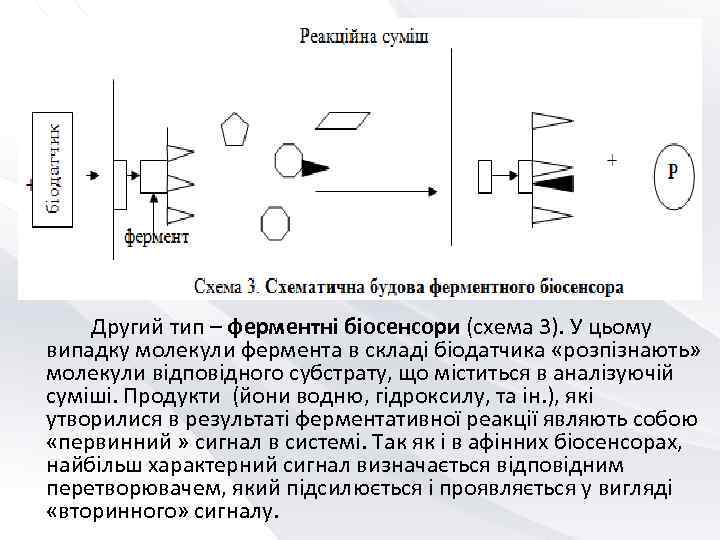
Другий тип – ферментні біосенсори (схема 3). У цьому випадку молекули фермента в складі біодатчика «розпізнають» молекули відповідного субстрату, що міститься в аналізуючій суміші. Продукти (йони водню, гідроксилу, та ін. ), які утворилися в результаті ферментативної реакції являють собою «первинний » сигнал в системі. Так як і в афінних біосенсорах, найбільш характерний сигнал визначається відповідним перетворювачем, який підсилюється і проявляється у вигляді «вторинного» сигналу.

Біосенсори - не тільки ідеальні прилади для проведення моніторингу навколишнього середовища, визначення хімічних речовин, отрут. Доцільно сказати, що в галузі створення біосенсорів для домашнього застосування (включаючи біосенсорні туалети), тримає першість Японія, вчені європейських країн – у розробці фундаментальних основ нових конструкцій біосенсорів. В Україні біосенсори створюються як в лабораторіях інститутів Академії наук, так і в приватних лабораторіях. Вони застосовуються для покращення здоров’я людини і тварин, при моніторинзі навколишнього середовища.

Біосенсорні технології не тільки дозволяють створити просте у використанні устаткування, але й відкривають можливості для проведення різних біохімічних аналізів різного роду, навіть в домашніх умовах. Здатність біомолекул до селективного “молекулярного розпізнавання” у співвідношенні з розвитком новітніх технологій, волокняної оптики та комп’ютерних систем, призвели до прориву в області біосенсорних технологій. Відповідно деяким оцінкам, методи діагностики та моніторингу за станом здоров’я людей і тварин, станом навколишнього середовища на основі розвитку біосенсорних технологій будуть найбільш перспективні.

Дякую за увагу

