Биотехнология-7.ppt
- Количество слайдов: 87

Биотехнология растений

Лекция 6: Трансгенные растения-4 1. Получение инсерционных мутантов растений на основе агробактериальной трансформации a) Клонирование генов b) Изучение с помощью трансгенных растений экспрессии генов и структуры растительных промоторов c) Получение растений со сверхэкспрессией гена с целью изучения функции гена d) Использование методов «генетической хирургии» для изучения взаимодействия клеток и тканей в процессах развития e) Использование трансформации для изучения роли гормонов в развитиии растений.
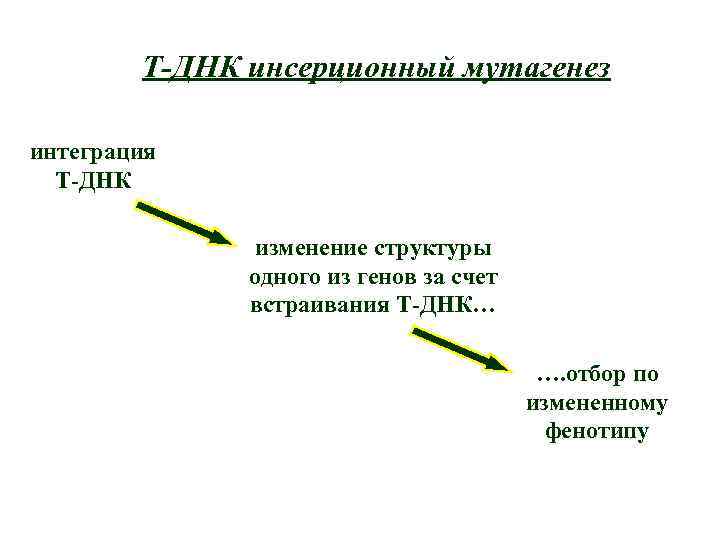
Т-ДНК инсерционный мутагенез интеграция Т-ДНК изменение структуры одного из генов за счет встраивания Т-ДНК… …. отбор по измененному фенотипу
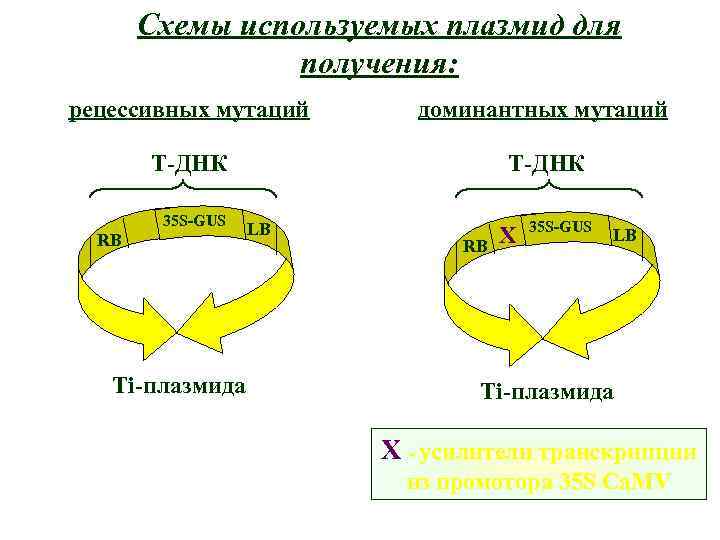
Схемы используемых плазмид для получения: рецессивных мутаций доминантных мутаций T-ДНК 35 S-GUS RB Ti-плазмида LB RB X 35 S-GUS LB Ti-плазмида X - усилители транскрипции из промотора 35 S Ca. MV

Клонирование генов
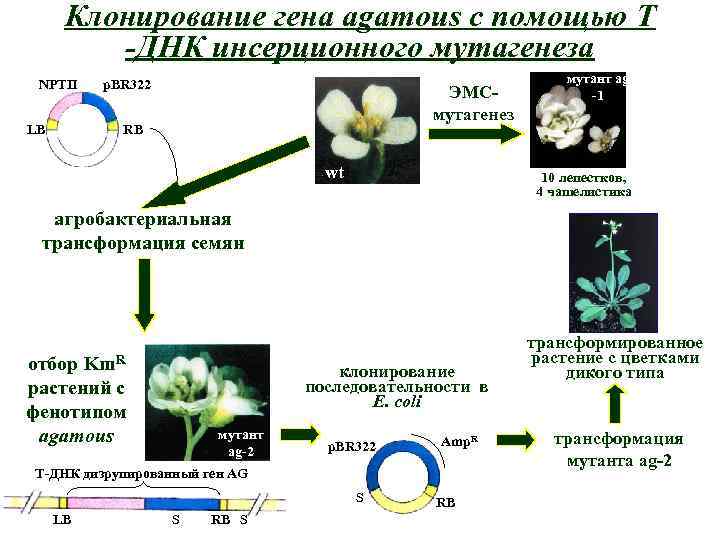
Клонирование гена agamous с помощью Т -ДНК инсерционного мутагенеза NPTII p. BR 322 ЭМСмутагенез RB LB wt мутант ag -1 10 лепестков, 4 чашелистика агробактериальная трансформация семян Km. R отбор растений с фенотипом agamous клонирование последовательности в E. coli мутант ag-2 p. BR 322 Amp. R T-ДНК дизрупированный ген AG S LB S RB трансформированное растение с цветками дикого типа трансформация мутанта ag-2
Ген, маркированный транспозоном (tagged gene), можно клонировать с помощью «вытягивания за транспозон»
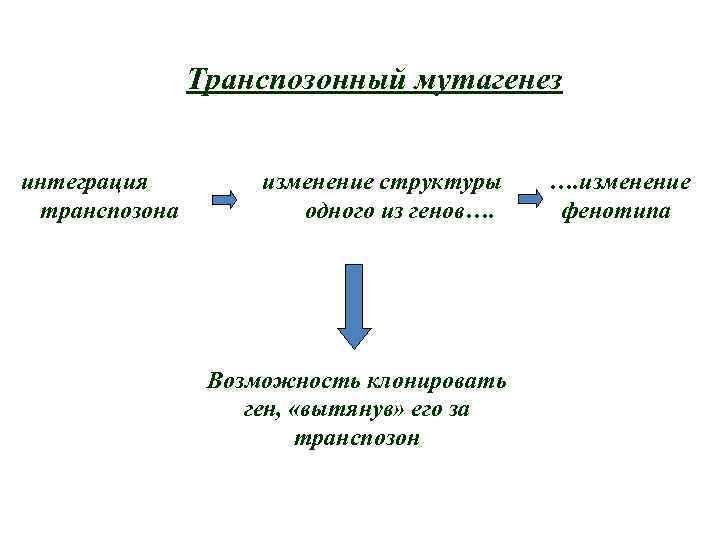
Транспозонный мутагенез интеграция транспозона изменение структуры одного из генов…. Возможность клонировать ген, «вытянув» его за транспозон …. изменение фенотипа

При встраивании транспозона в кодирующую последовательность гена, наблюдается мутантный фенотип. При вырезании фенотип восстанавливается
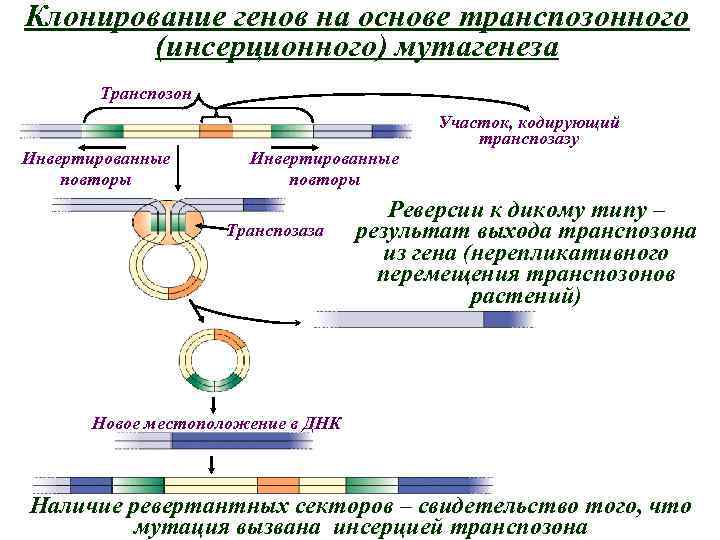
Клонирование генов на основе транспозонного (инсерционного) мутагенеза Транспозон Участок, кодирующий транспозазу Инвертированные повторы Транспозаза Реверсии к дикому типу – результат выхода транспозона из гена (нерепликативного перемещения транспозонов растений) Новое местоположение в ДНК Наличие ревертантных секторов – свидетельство того, что мутация вызвана инсерцией транспозона

Клонирование генов на основе транспозонного (инсерционного) мутагенеза Antirrhinum majus (L. ) wild type floricaula у мутанта floricaula (flo) вместо цветков развиваются побеги

Получение мутации flo 613 и клонирование гена FLORICAULA львиного зева (Coen et al. , 1990) 1. Выращивание 26 000 растений львиного зева с активным мобильным элементом Tam 3 (Transposone of Antirrhinum majus) при tº=15ºC, вызывающей наибольшую частоту транспозиций (растения М 1). 2. Самоопыление растений М 1 с целью выявления рецессивных мутаций, возникших в М 1 в результате перемещения Tam 3. 3. Выявление 15 разных гомеозисных мутаций среди 80 000 растений М 2, в том числе и flo 613. 4. Укоренение и вегетативное размножение веточек мутанта flo 613 при tº=15ºC, для выявления реверсий. Генетический анализ.

• Рестрикционный анализ ДНК из выделенных клонов, необходимый для выявления участков растительной ДНК, фланкирующих транспозон • Субклонирование растительной ДНК с целью дальнейшего использования в качестве пробы • Создание геномной библиотеки из растений дикого типа • Скрининг библиотеки с меченой пробой растительной ДНК, фланкирующей транспозон, для выявления клона, содержащего ген FLO • Доказательство того, что выявленные клоны содержат ген FLO
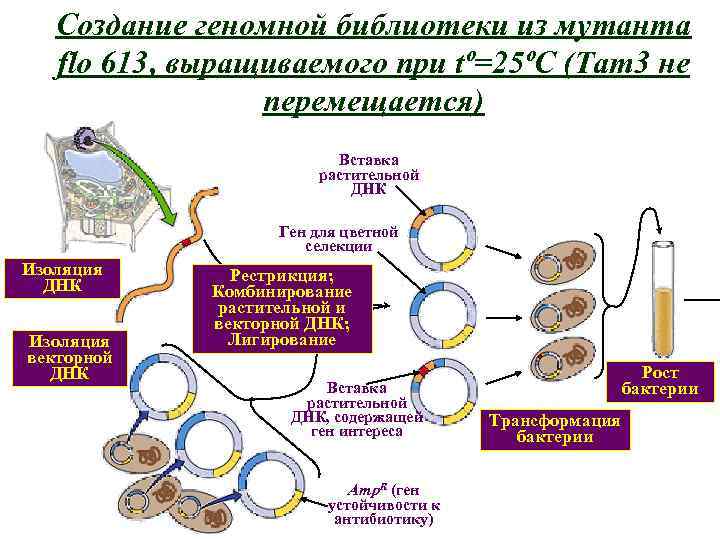
Создание геномной библиотеки из мутанта flo 613, выращиваемого при tº=25ºC (Тam 3 не перемещается) Вставка растительной ДНК Ген для цветной селекции Изоляция ДНК Изоляция векторной ДНК Рестрикция; Комбинирование растительной и векторной ДНК; Лигирование Вставка растительной ДНК, содержащей ген интереса Amp. R (ген устойчивости к антибиотику) Рост бактерии Трансформация бактерии
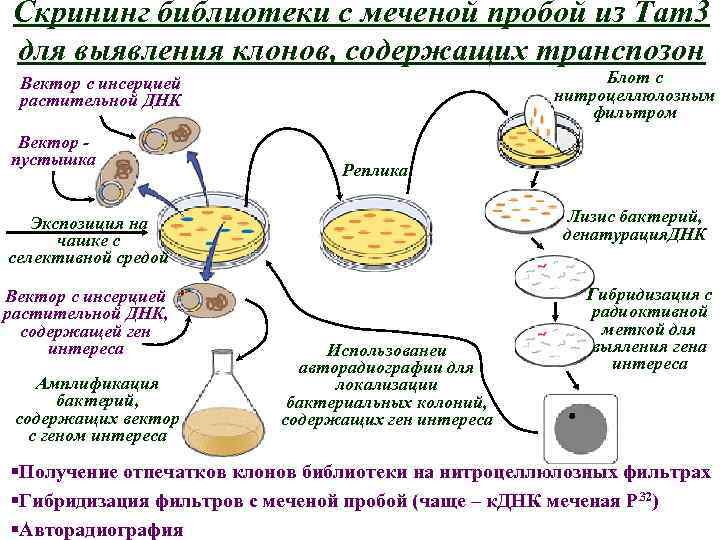
Скрининг библиотеки с меченой пробой из Tam 3 для выявления клонов, содержащих транспозон Блот с нитроцеллюлозным фильтром Вектор с инсерцией растительной ДНК Вектор пустышка Реплика Лизис бактерий, денатурация. ДНК Экспозиция на чашке с селективной средой Вектор с инсерцией растительной ДНК, содержащей ген интереса Амплификация бактерий, содержащих вектор с геном интереса Использованеи авторадиографии для локализации бактериальных колоний, содержащих ген интереса Гибридизация с радиоктивной меткой для выяления гена интереса §Получение отпечатков клонов библиотеки на нитроцеллюлозных фильтрах §Гибридизация фильтров с меченой пробой (чаще – к. ДНК меченая Р 32) §Авторадиография
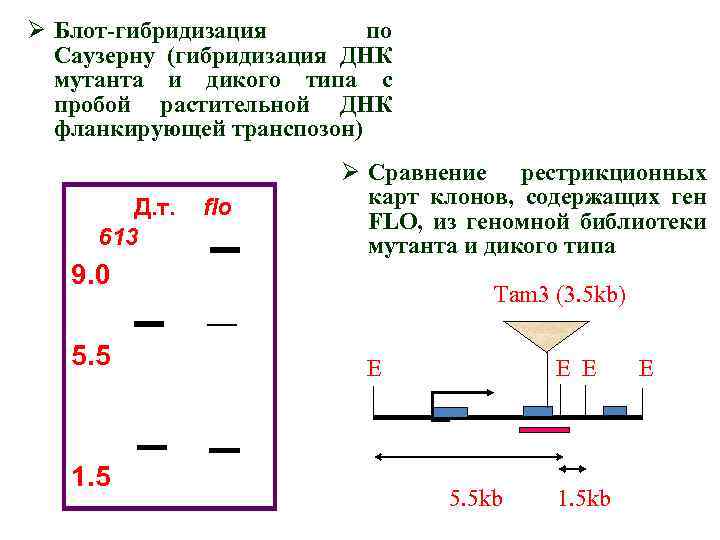
Ø Блот-гибридизация по Саузерну (гибридизация ДНК мутанта и дикого типа с пробой растительной ДНК фланкирующей транспозон) Д. т. 613 flo Ø Сравнение рестрикционных карт клонов, содержащих ген FLO, из геномной библиотеки мутанта и дикого типа 9. 0 5. 5 1. 5 Tam 3 (3. 5 kb) Е Е Е 5. 5 kb 1. 5 kb Е

Ген FLORICAULA – уникальный ген, присутствующий в геноме покрытосеменных в 1 копии. Он кодирует белок, содержащий домены, характерные для белков – активаторов транскрипции (транскрипционных факторов): богатый пролином домен на N-конце и кислую область в середине белка. Наиболее активная экспрессия гена FLORICAULA наблюдается в закладывающихся примордиях цветка. Клонирование гена открывает возможность для изучения роли кодируемого им белка и м. РНК во взаимодействии клеток

Изучение механизмов регуляции экспрессии генов растений с использованием репортерных (индикаторных) генов Возможности метода: 1) Выявление факторов (внешних и внутренних), определяющих особенности экспрессии исследуемого гена 2) Выявление цис-регуляторных элементов гена, отвечающих на действие внешних и внутренних факторов

К промотору исследуемого гена присоединяют репортерный ген ATG ТАТА интрон ATG Растительный ген Бактериальный ген-репортер Слитые гены-репортеры ATG-растения ТАТА Химерный белок

Promoter-reporter fusion: Использование гибридных конструкций, содержащих репортерный ген, «слитый» с промотором изучаемого гена Green fluorescent protein (GFP) - флуоресцентный белок - стабильный, - позволяет определить локализацию продукта на клеточном, тканевом уровне - не дает точной количественной оценки экспрессии (полуколичественный метод) p. SCR: : GFP ß-glucuronidase (GUS) - широко используется для изучения активности генов, т. к. позволяет выявить слабый уровень экспрессии -позволяет определить локализацию продукта на клеточном, тканевом уровне, белок стабильный, накапливается в тканях - не дает точной количественной оценки экспрессии (полуколичественный метод) Luciferase (LUC) -позволяет определить локализацию продукта на тканевом уровне, - дает наиболее точную количественную оценку - может использоваться для изучения динамических процессов (белок короткоживущий) p. CO: : GUS
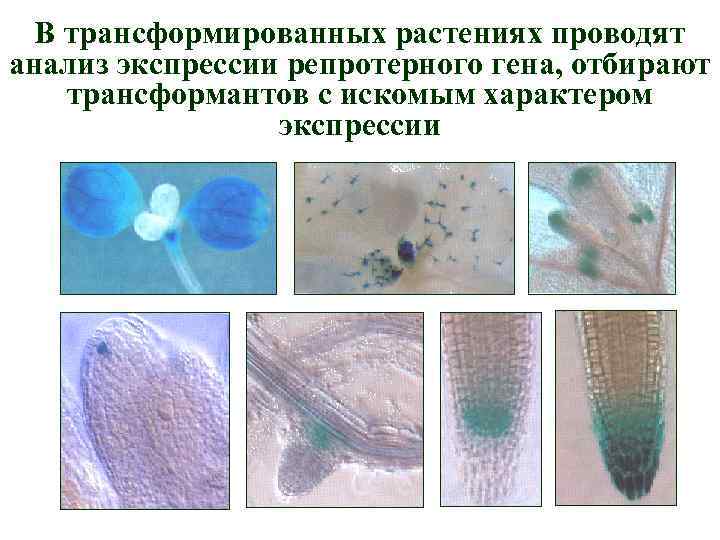
В трансформированных растениях проводят анализ экспрессии репротерного гена, отбирают трансформантов с искомым характером экспрессии
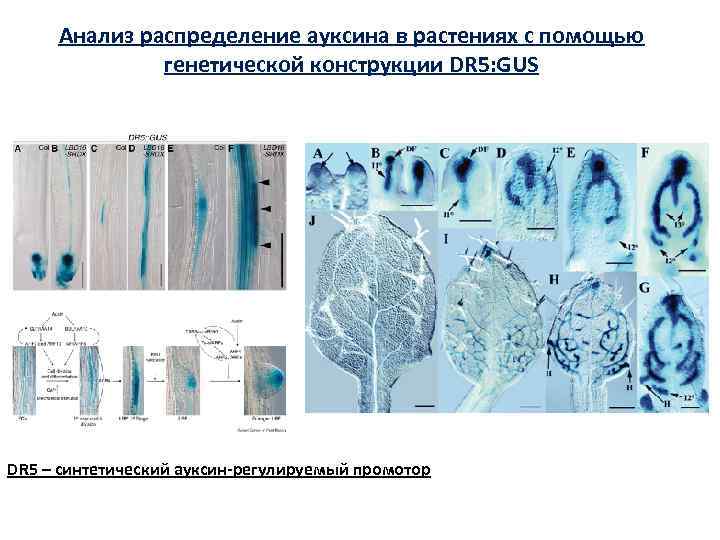
Анализ распределение ауксина в растениях с помощью генетической конструкции DR 5: GUS DR 5 – синтетический ауксин-регулируемый промотор
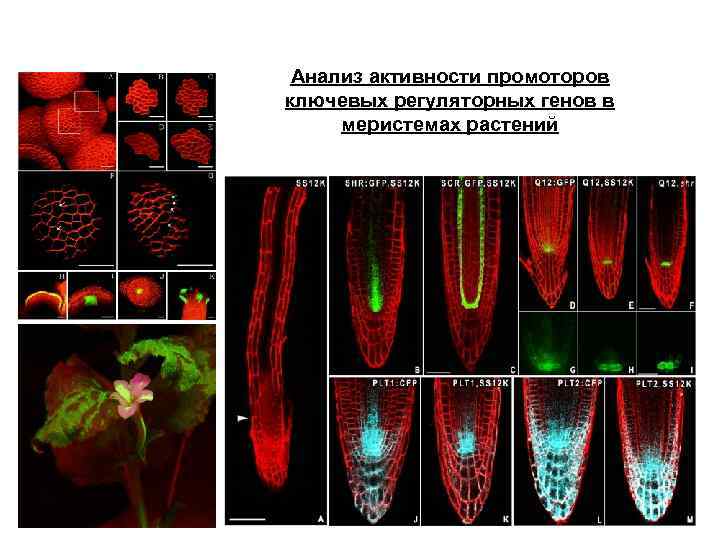
Анализ активности промоторов ключевых регуляторных генов в меристемах растений

Получение растений со сверхэкспрессией гена с целью изучения функции гена
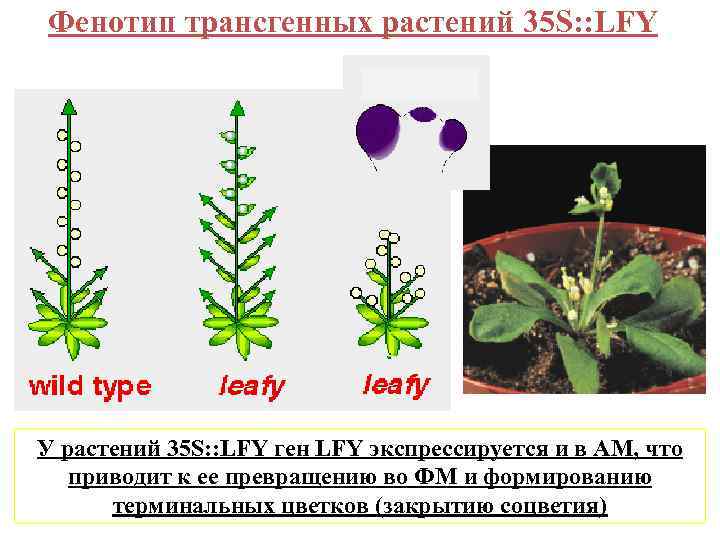
Фенотип трансгенных растений 35 S: : LFY У растений 35 S: : LFY ген LFY экспрессируется и в АМ, что приводит к ее превращению во ФМ и формированию терминальных цветков (закрытию соцветия)
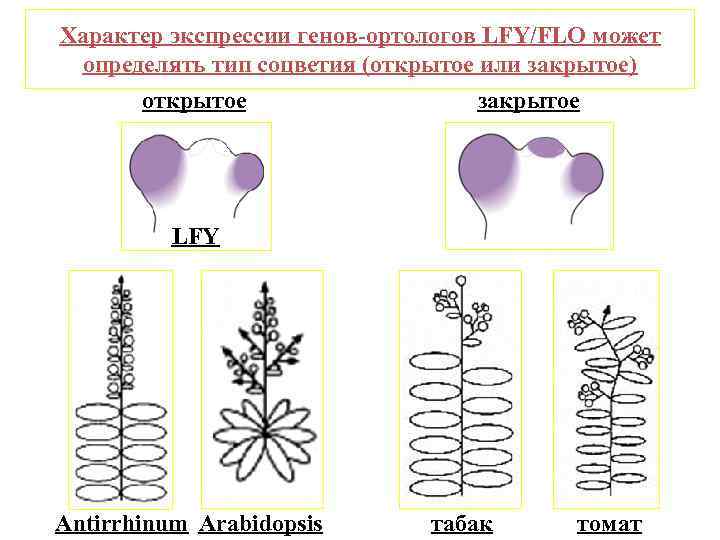
Характер экспрессии генов-ортологов LFY/FLO может определять тип соцветия (открытое или закрытое) открытое закрытое LFY Antirrhinum Arabidopsis табак томат
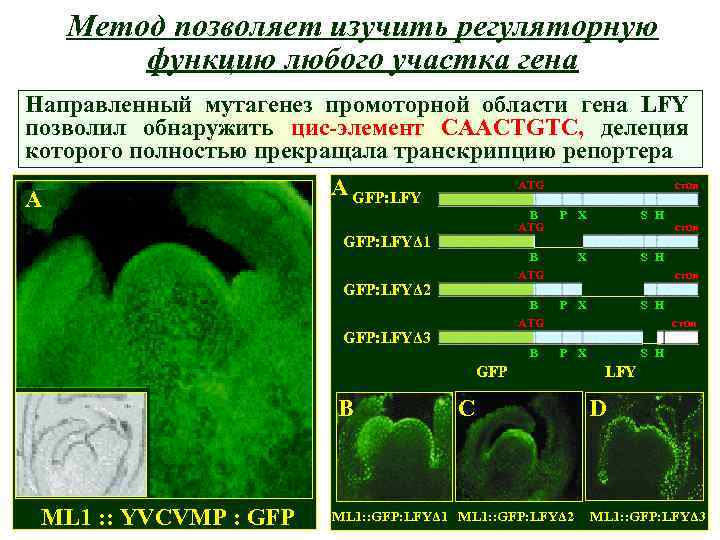
Метод позволяет изучить регуляторную функцию любого участка гена Направленный мутагенез промоторной области гена LFY позволил обнаружить цис-элемент CAACTGTC, делеция которого полностью прекращала транскрипцию репортера A A GFP: LFY ATG B ATG GFP: LFYΔ 1 стоп P X S H B ATG GFP: LFYΔ 2 стоп B ATG P X B GFP: LFYΔ 3 ML 1 : : YVCVMP : GFP S H P X стоп GFP B стоп C ML 1: : GFP: LFYΔ 1 ML 1: : GFP: LFYΔ 2 S H LFY D ML 1: : GFP: LFYΔ 3

Мутант арабидопсиса по гену LFY lfy-26

Основные семейства транскрипционных факторов растений Консервативные для эукариот: Уникальные для растений: ТФ с MADS-доменом ТФ GRAS ТФ с гомеодоменом ТФ AP 2 -like ТФ MYB ТФ с В 3 -доменом ТФ b. ZIP ТФ с GARP/ARRM-доменом etc. MYB 29
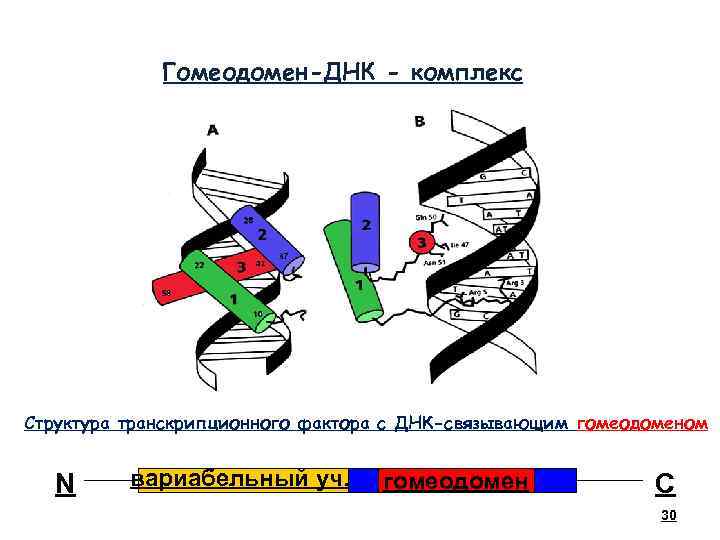
30 Гомеодомен-ДНК - комплекс Структура транскрипционного фактора с ДНК-связывающим гомеодоменом N вариабельный уч. гомеодомен С 30
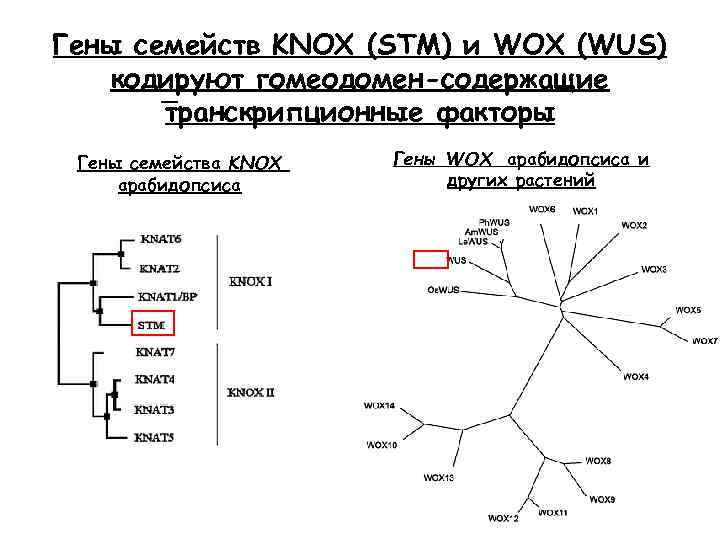
Гены семейств KNOX (STM) и WOX (WUS) кодируют гомеодомен-содержащие транскрипционные факторы Гены семейства KNOX арабидопсиса Гены WOX арабидопсиса и других растений 31 31
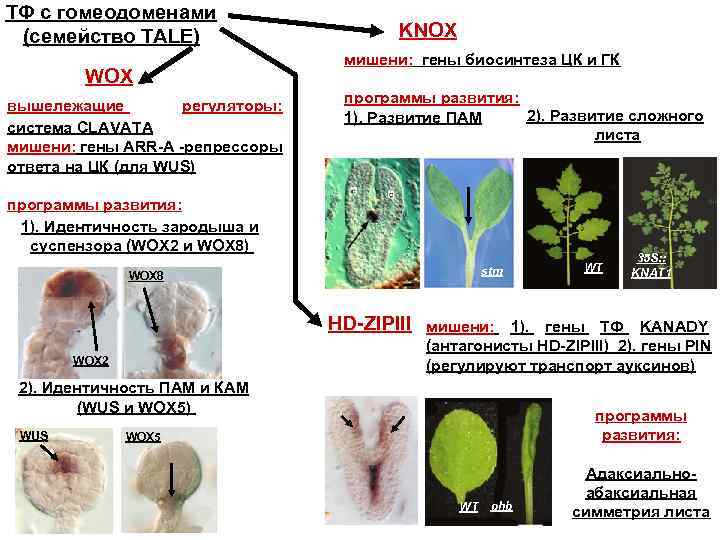
ТФ с гомеодоменами (семейство TALE) WOX вышележащие регуляторы: система CLAVATA мишени: гены ARR-A -репрессоры ответа на ЦК (для WUS) KNOX мишени: гены биосинтеза ЦК и ГК программы развития: 2). Развитие сложного 1). Развитие ПАМ листа программы развития: 1). Идентичность зародыша и суспензора (WOX 2 и WOX 8) stm WOX 8 HD-ZIPIII WOX 2 35 S: : KNAT 1 мишени: 1). гены ТФ KANADY (антагонисты HD-ZIPIII) 2). гены PIN (регулируют транспорт ауксинов) 2). Идентичность ПАМ и КАМ (WUS и WOX 5) WUS WT программы развития: WOX 5 WT phb Адаксиальноабаксиальная симметрия листа

Ген KNOTTED 1 был идентифи-цирован на основе доминантных мутаций kn 1, вызывающих отсутствие лигулы и появление узелков (knots) на листьях, особенно вокруг жилок. В связи с доминантностью мутаций судить о функции гена сложно

Зная о важной роли гомеобоксных генов в развитии животных, приступили к клонированию и изучению KNOTTED 1 -подобных генов (KNOX-гены knotted 1 -like homeobox-containing) в растениях По гомологии с KN 1 клонированы другие гомеобоксные гены кукурузы (более 13), A. thaliana (7), табака, томатов, сои, риса, ячменя и др. Класс II Кукуруза KNOX 1 Кукуруза KNOX 2 KNOX 6 Кукуруза KNOX 7 B. napus BNHD 1 Другие Резушка ATH 1 Человек PNX-1 Helix II turn Helix III Экспрессируются только в АМ побега Класс I Кукуруза KN 1 Рис OSH 1 Кукуруза RS 1 Кукуруза KNOX 4 Резушка KNAT 1 Кукуруза KNOX 8 Кукуруза KNOX 3 Соя SBH 1 Резушка KNAT 2 Кукуруза KNOX 10 Кукуруза LG 3 Кукуруза KNOX 5 Кукуруза KNOX 11

Сверхэкспрессия гена KNAT 1 у арабидопсиса На листьях возникали дополнительные меристематические очаги, из которых могли возникать почки и побеги Листья A. thaliana 35 S: : KNAT 1 превращаются из простых в пальчаторассеченные, хотя фенотип сильно варьировал (Chuck, Linkoln, Hake, 1996)

Сверхэкспрессия гена KNAT в листьях томатов дикий тип 35 S: : KNAT

KNOTTED-подобные гены – возможные участники морфологической эволюции растений

Обнаружение связи между уровнем экспрессии KNOX-генов и усложнением структуры листа позволило предположить, что эти гены могли участвовать в формировании разных типов листа Ø у видов с простым листом (арабидопсис, табак, кукуруза, рис) KNOX-гены экспрессируются только в АМ, но не в примордиях листьев; Ø у томата, имеющего сложный лист, эти гены экспрессируются и в примордиях листьев
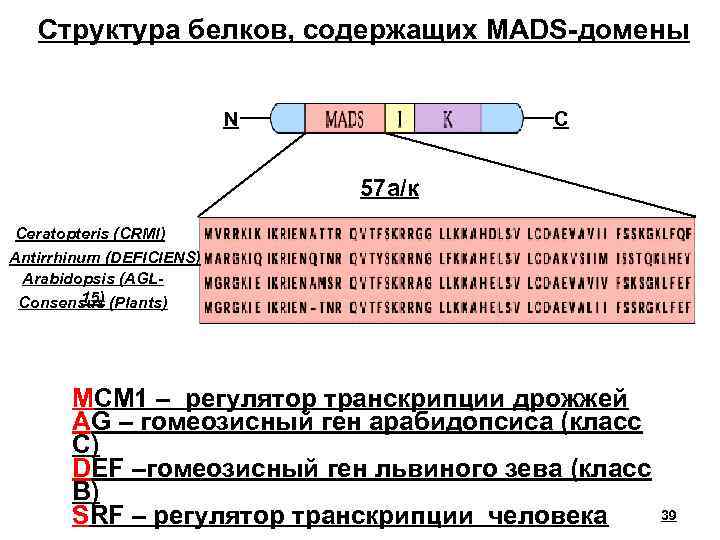
Структура белков, содержащих MADS-домены N C 57 а/к Ceratopteris (CRMl) Antirrhinum (DEFICIENS) Arabidopsis (AGL 15) Consensus (Plants) MCM 1 – регулятор транскрипции дрожжей AG – гомеозисный ген арабидопсиса (класс С) DEF –гомеозисный ген львиного зева (класс В) SRF – регулятор транскрипции человека 39
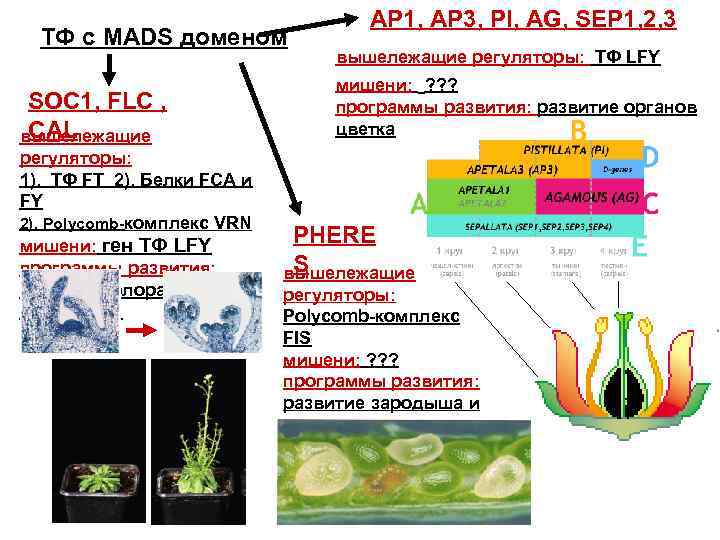
ТФ с MADS доменом SOC 1, FLC , CAL вышележащие регуляторы: 1). ТФ FT 2). Белки FCA и FY 2). Polycomb-комплекс VRN мишени: ген ТФ LFY программы развития: развитие флоральной меристемы AP 1, AP 3, PI, AG, SEP 1, 2, 3 вышележащие регуляторы: ТФ LFY мишени: ? ? ? программы развития: развитие органов цветка PHERE S вышележащие регуляторы: Polycomb-комплекс FIS мишени: ? ? ? программы развития: развитие зародыша и эндосперма
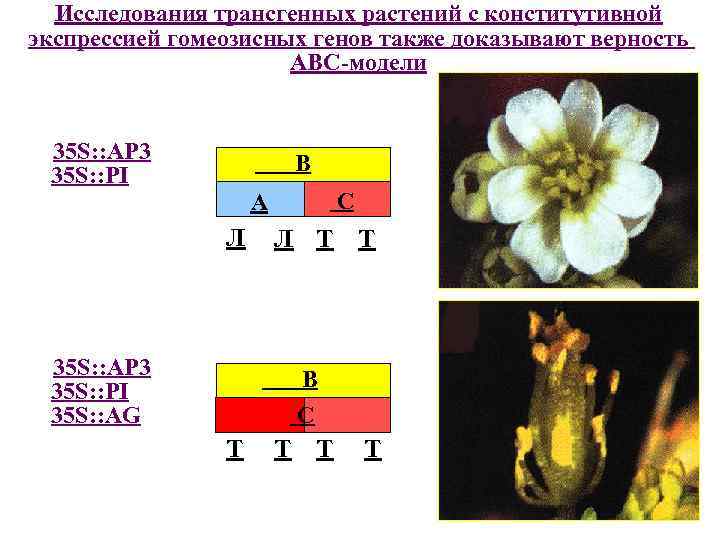
Исследования трансгенных растений с конститутивной экспрессией гомеозисных генов также доказывают верность АВС-модели 35 S: : AP 3 35 S: : PI В С A Л 35 S: : AP 3 35 S: : PI 35 S: : AG Л Т Т В С Т Т
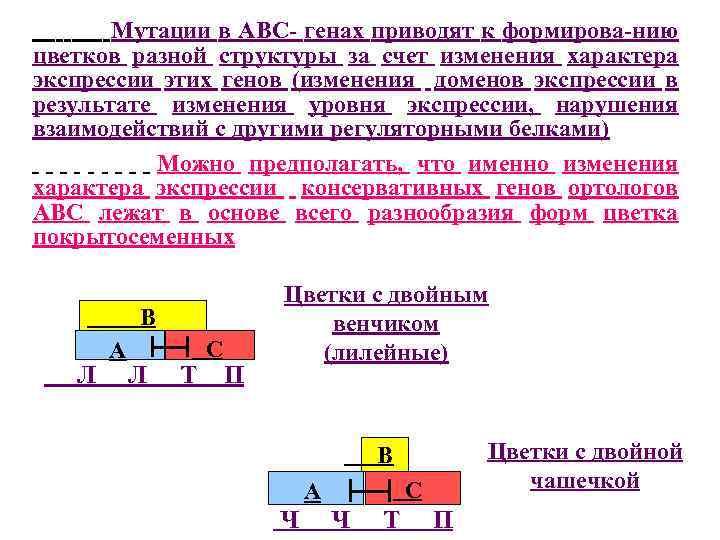
Мутации в АВС- генах приводят к формирова-нию цветков разной структуры за счет изменения характера экспрессии этих генов (изменения доменов экспрессии в результате изменения уровня экспрессии, нарушения взаимодействий с другими регуляторными белками) Можно предполагать, что именно изменения характера экспрессии консервативных генов ортологов АВС лежат в основе всего разнообразия форм цветка покрытосеменных В Л A Л Т С П Цветки с двойным венчиком (лилейные) Цветки с двойной чашечкой В Ч A С Ч Т П
Использование методов «генетической хирургии» для изучения взаимодействия клеток и тканей в процессах развития

Day, Galgoci, Irish, 1995. Генетическое удаление лепестков и тычинок для выяснения роли клеточных взаимодействий в развитии цветка Модели, описывающие процесс возникновения органов цветка: «Последовательная» модель Wardlow, 1957. Порядок возникновения органов цветка отражает последовательность индуктивных сигналов (развитие органов каждого последующего круга зависит от сигналов, поступающих из предыдущих кругов
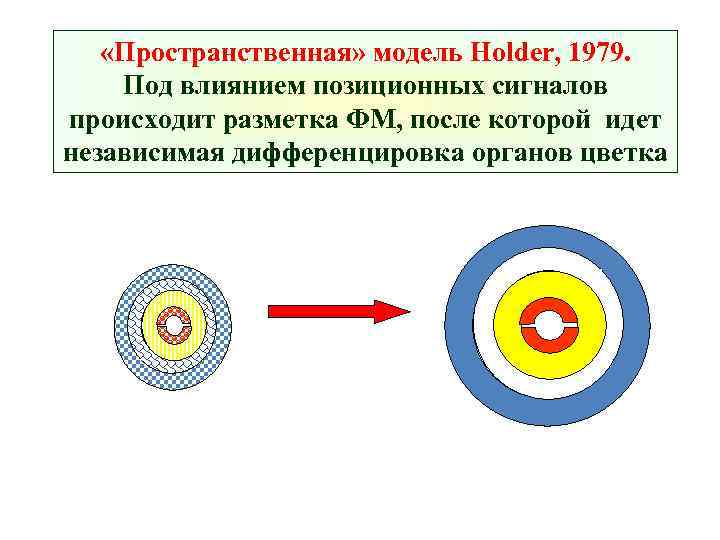
«Пространственная» модель Holder, 1979. Под влиянием позиционных сигналов происходит разметка ФМ, после которой идет независимая дифференцировка органов цветка

В основе «генетической хирургии» лежит метод трансформации растений химерными генами следующей конструкции: 1. Кодирующая часть гена – последовательность, кодирующая продукт, вызывающий гибель растительных клеток и не способный перемещаться в другие клетки: а) ген Corynebacterium diphtheriae, кодирующий дифтерийный токсин DT-A-белок, который катализирует АДФ-рибозилирование фактора элонгации. Это ведет к ингибированию белкового синтеза и гибели клеток. В состав DT-A-белка не входит сигнальный пептид, белок не является секреторным, поэтому вызывает гибель только тех клеток, где ген экспрессируется;
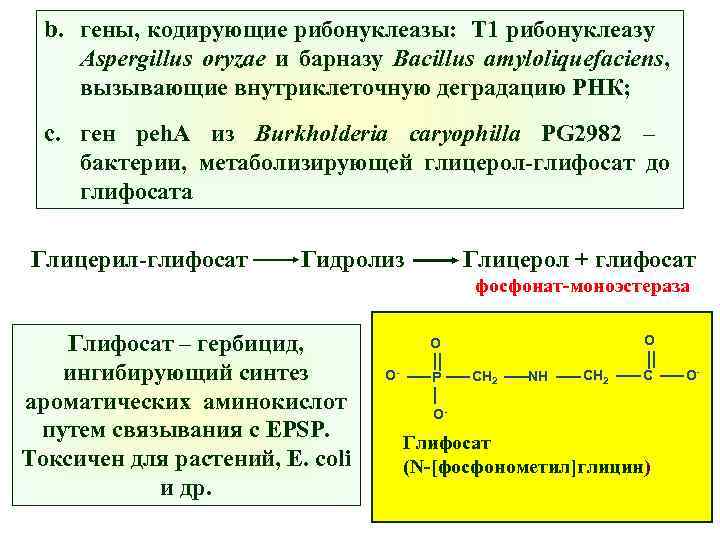
b. гены, кодирующие рибонуклеазы: Т 1 рибонуклеазу Aspergillus oryzae и барназу Bacillus amyloliquefaciens, вызывающие внутриклеточную деградацию РНК; c. ген peh. A из Burkholderia caryophilla PG 2982 – бактерии, метаболизирующей глицерол-глифосат до глифосата Глицерил-глифосат Гидролиз Глицерол + глифосат фосфонат-моноэстераза Глифосат – гербицид, ингибирующий синтез ароматических аминокислот путем связывания с EPSP. Токсичен для растений, E. сoli и др. O O O- P CH 2 NH CH 2 C O- Глифосат (N-[фосфонометил]глицин) O-

Целью работы Day, Galgoci, Irish (1995) была проверка существующих моделей с использованием метода генетической хирургии Объекты: Arabidopsis thaliana и Nicotiana tabacum 1. 7 т. п. н. 5’ 3’ AP 3 DT-A NOS 1. 7 т. п. н. 5’ 3’ AP 3 uid. A NOS
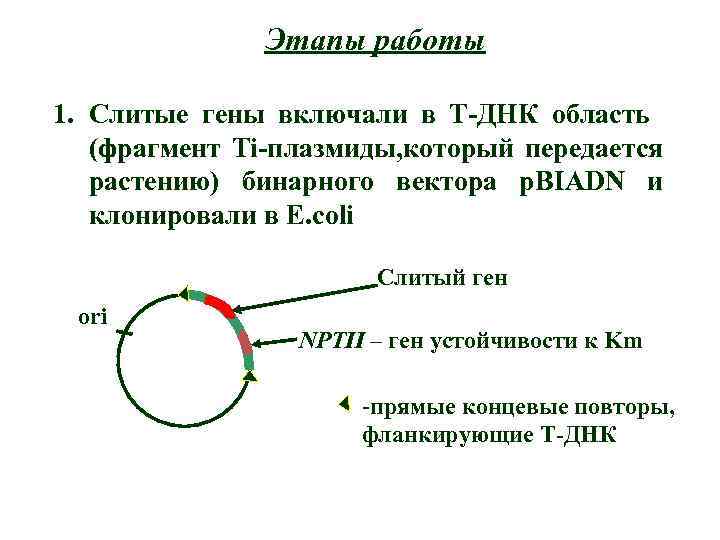
Этапы работы 1. Слитые гены включали в Т-ДНК область (фрагмент Ti-плазмиды, который передается растению) бинарного вектора p. BIADN и клонировали в E. coli Слитый ген ori NPTII – ген устойчивости к Km -прямые концевые повторы, фланкирующие Т-ДНК

РЕЗУЛЬТАТЫ: 1. У резушки получено 5 трансгенных растений, в геноме которых присутствовали от 1 до 5 копий трансгенов (Саузерн-блоттинг) 2. Все трансгенные растения имели одинаковый фенотип: органы 2 и 3 кругов (лепестки и тычинки) отсутствовали, а чашелистики и пестики имели нормальную морфологию. Следовательно, разметка кругов начинается на ранних стадиях до экспрессии трансгена во ФМ, т. е. верна пространственная модель
Использование трансформации для изучения роли гормонов в развитиии растений
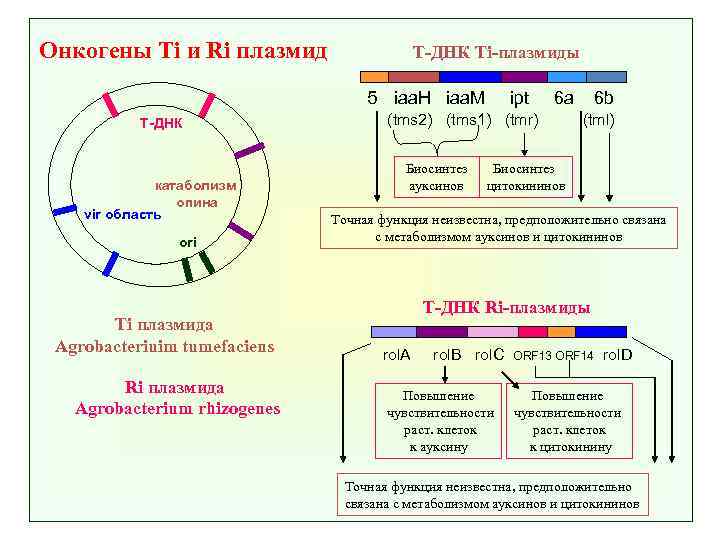
Онкогены Ti и Ri плазмид Т-ДНК Ti-плазмиды 5 iaa. H iaa. M Т-ДНК катаболизм опина vir область ori Ti плазмида Agrobacteriuim tumefaciens Ri плазмида Agrobacterium rhizogenes ipt 6 a (tms 2) (tms 1) (tmr) Биосинтез ауксинов 6 b (tml) Биосинтез цитокининов Точная функция неизвестна, предположительно связана с метаболизмом ауксинов и цитокининов Т-ДНК Ri-плазмиды rol. A rol. B rol. C Повышение чувствительности раст. клеток к ауксину ORF 13 ORF 14 rol. D Повышение чувствительности раст. клеток к цитокинину Точная функция неизвестна, предположительно связана с метаболизмом ауксинов и цитокининов
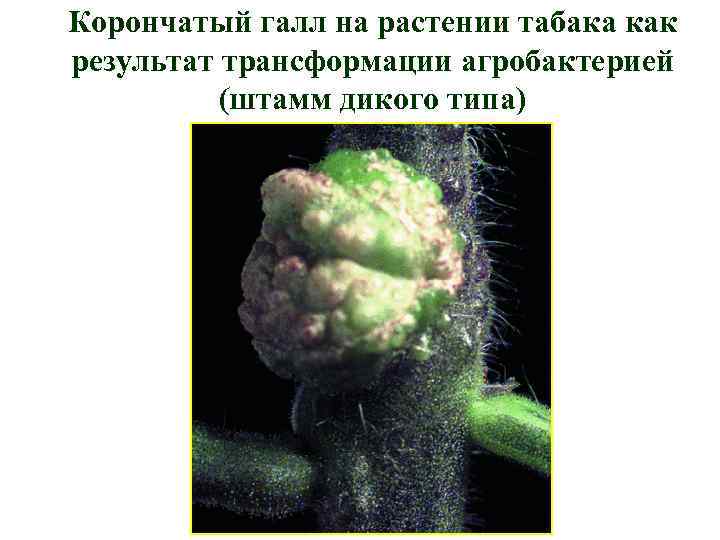
Корончатый галл на растении табака как результат трансформации агробактерией (штамм дикого типа)

Трансгенные рстения с геном tmr

Ген tmr в трансгенных растениях, экспрессирующийся в плодах (промотор 2 А 11)

Опухолеобразование у редиса – генетический признак Гибрид Опухоль + Опухоль - 2 (1: 3) 18 х10* 9 15 2, 00 18 х16* 6 19 0, 01 18 х19* 67 171 1, 26 18 х21* 11 50 1, 41 6 х10* 14 46 0, 09 8 х16* 12 24 1, 33

Фенокопии опухолеобразования у трансгенных растений с геном ipt на корнеплоде интактных растений ipt npt. II у растений in vitro на среде с БАП

Прямая и обратная генетика в изучении функции гена Прямая генетика: фенотип ген Обратная генетика: ген фенотип

Подходы, используемые обратной генетикой: - гомологичная рекомбинация/замещение гена -замещение гена: альтернативные подходы (Zn-fingers nucleases, TALEN) - РНК-интерференция/ генный сайленсинг - T-ДНК-инсерционный мутагенез/T-DNA tagging - TILLING (Target Induced Local Leisons IN Genomes)
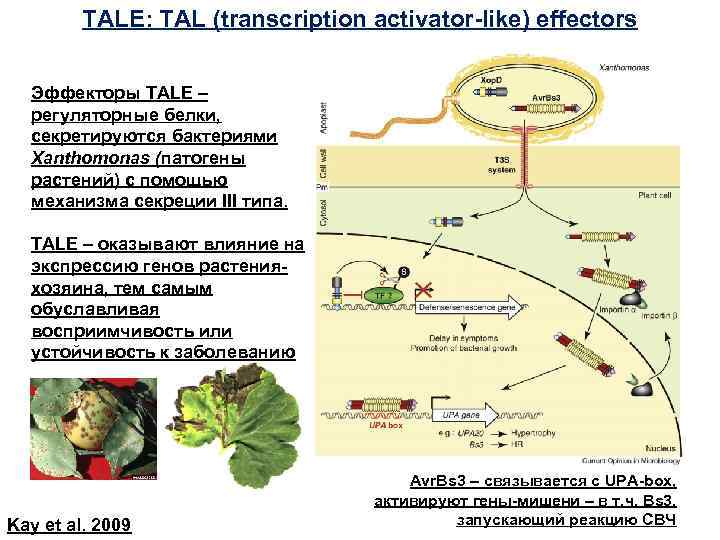
TALE: TAL (transcription activator-like) effectors Эффекторы TALE – регуляторные белки, секретируются бактериями Xanthomonas (патогены растений) с помощью механизма секреции III типа. TALE – оказывают влияние на экспрессию генов растенияхозяина, тем самым обуславливая восприимчивость или устойчивость к заболеванию Kay et al. 2009 Avr. Bs 3 – связывается с UPA-box, активируют гены-мишени – в т. ч. Bs 3, запускающий реакцию СВЧ
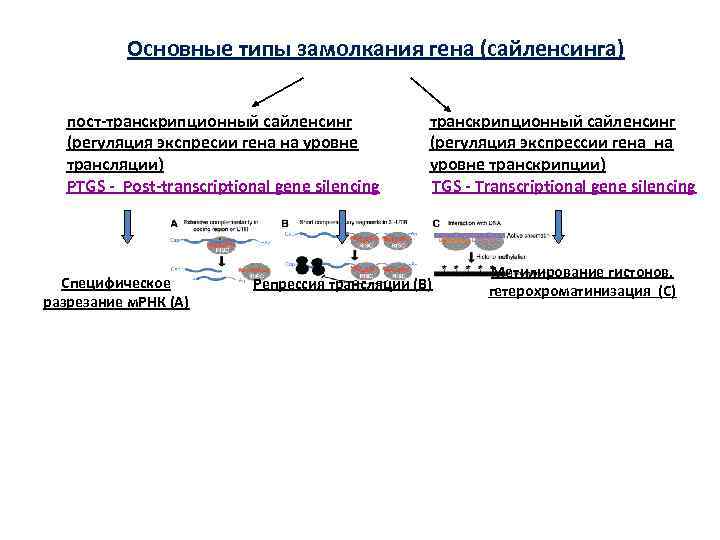
Основные типы замолкания гена (сайленсинга) пост-транскрипционный сайленсинг (регуляция экспресии гена на уровне трансляции) PTGS - Post-transcriptional gene silencing Специфическое разрезание м. РНК (А) транскрипционный сайленсинг (регуляция экспрессии гена на уровне транскрипции) TGS - Transcriptional gene silencing Репрессия трансляции (В) Метилирование гистонов, гетерохроматинизация (С)
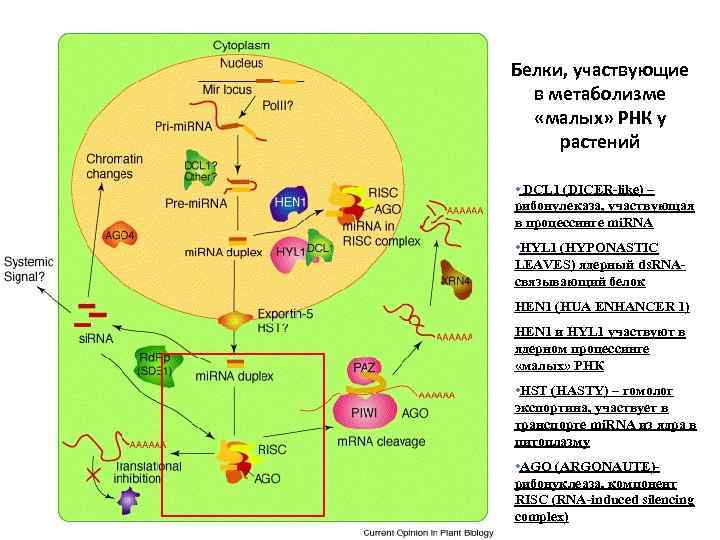
Белки, участвующие в метаболизме «малых» РНК у растений • DCL 1 (DICER-like) – рибонулеказа, участвующая в процессинге mi. RNA • HYL 1 (HYPONASTIC LEAVES) ядерный ds. RNAсвязывающий белок HEN 1 (HUA ENHANCER 1) HEN 1 и HYL 1 участвуют в ядерном процессинге «малых» РНК • HST (HASTY) – гомолог экспортина, участвует в транспорте mi. RNA из ядра в цитоплазму • AGO (ARGONAUTE)рибонуклеаза, компонент RISC (RNA-induced silencing complex)
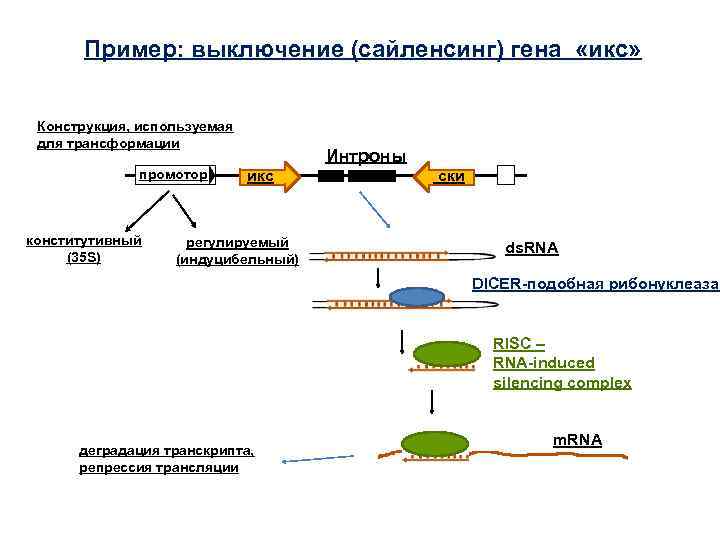
Пример: выключение (сайленсинг) гена «икс» Конструкция, используемая для трансформации промотор конститутивный (35 S) Интроны икс регулируемый (индуцибельный) ски ds. RNA DICER-подобная рибонуклеаза RISC – RNA-induced silencing complex деградация транскрипта, репрессия трансляции m. RNA
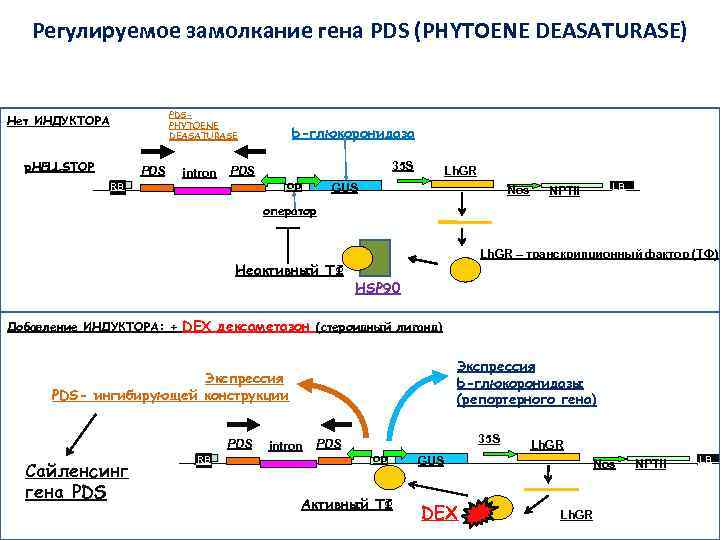
Регулируемое замолкание гена PDS (PHYTOENE DEASATURASE) PDSPHYTOENE DEASATURASE Нет ИНДУКТОРА p. HELLSTOP PDS intron b-глюкоронидаза 35 S PDS op RB RB Lh. GR GUS Nos LB LB NPTII оператор Неактивный ТФ Lh. GR – транскрипционный фактор (ТФ) HSP 90 Добавление ИНДУКТОРА: + DEX дексаметазон (стероидный лиганд) Экспрессия b-глюкоронидазы (репортерного гена) Экспрессия PDS- ингибирующей конструкции PDS Сайленсинг гена PDS RB RB intron 35 S PDS op Активный ТФ Lh. GR GUS DEX Nos Lh. GR NPTII LB LB

Регулируемое замолкание (индуцибельный сайленсинг) гена PDS (PHYTOENE DEASATURASE) No Dex
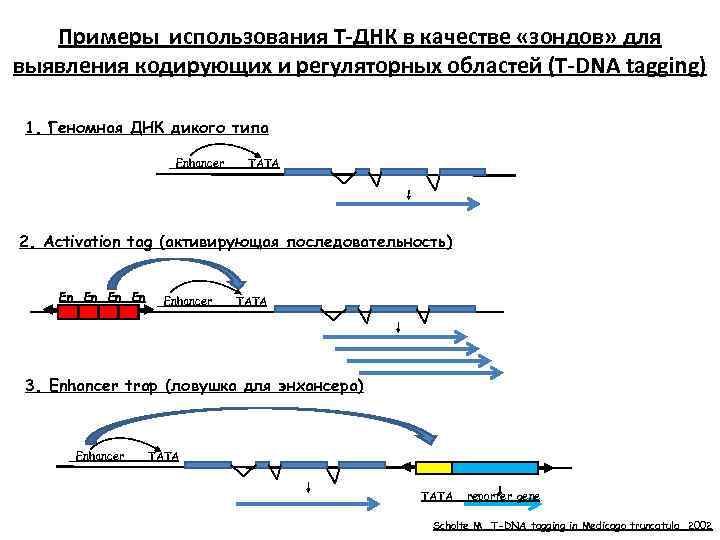
Примеры использования Т-ДНК в качестве «зондов» для выявления кодирующих и регуляторных областей (Т-DNA tagging) 1. Геномная ДНК дикого типа Enhancer TATA 2. Activation tag (активирующая последовательность) En En Enhancer TATA 3. Enhancer trap (ловушка для энхансера) Enhancer TATA reporter gene Scholte M. T-DNA tagging in Medicago truncatula. 2002
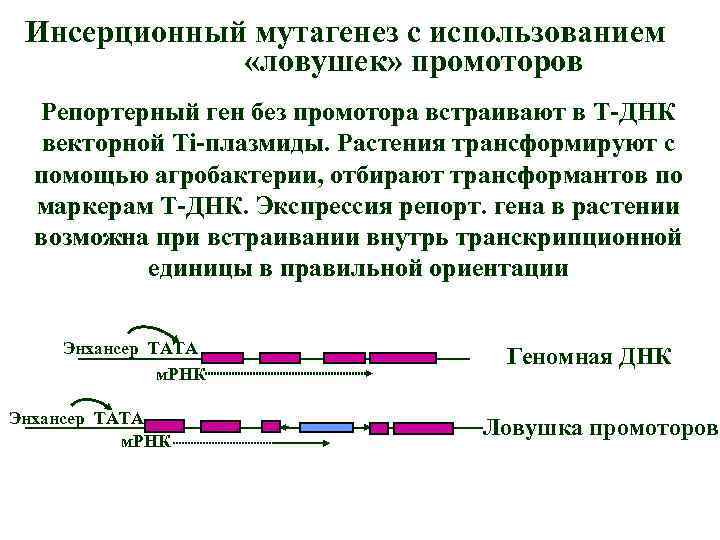
Инсерционный мутагенез с использованием «ловушек» промоторов Репортерный ген без промотора встраивают в Т-ДНК векторной Ti-плазмиды. Растения трансформируют с помощью агробактерии, отбирают трансформантов по маркерам Т-ДНК. Экспрессия репорт. гена в растении возможна при встраивании внутрь транскрипционной единицы в правильной ориентации Энхансер ТАТА м. РНК Геномная ДНК Ловушка промоторов
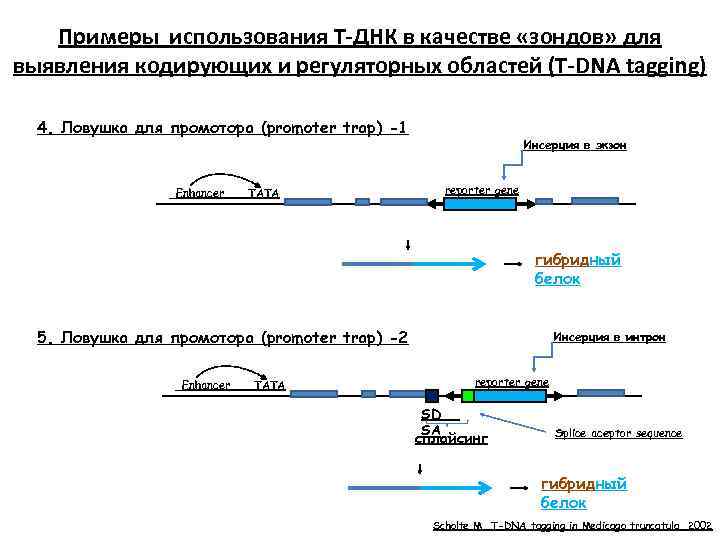
Примеры использования Т-ДНК в качестве «зондов» для выявления кодирующих и регуляторных областей (Т-DNA tagging) 4. Ловушка для промотора (promoter trap) -1 Enhancer TATA Инсерция в экзон reporter gene гибридный белок 5. Ловушка для промотора (promoter trap) -2 Enhancer TATA Инсерция в интрон reporter gene SD SA сплайсинг Splice aceptor sequence гибридный белок Scholte M. T-DNA tagging in Medicago truncatula. 2002
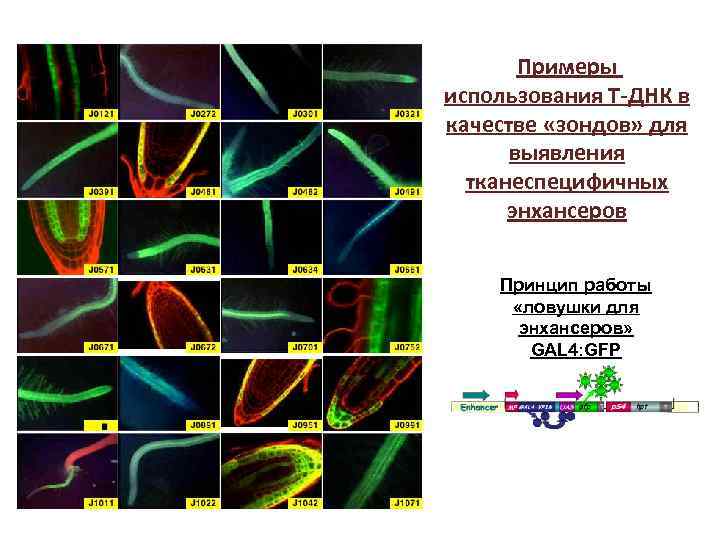
Примеры использования Т-ДНК в качестве «зондов» для выявления тканеспецифичных энхансеров Принцип работы «ловушки для энхансеров» GAL 4: GFP
Методы редактирования генома растений

Модификации генома: разновидности Изменение случайного места в геноме Редактирование генома

Редактирование генома Инактивация конкретного локуса Замена одного локуса на другой с помощью гомологичной рекомбинации (HR) Этот путь затруднён у Чтобы инактивировать растений. конкретный локус, надо Введение DSB также осуществить в нём разрыв существенно увеличивает двунитевой ДНК (DSB) вероятность гомологичной рекомбинации

Программируемые нуклеазы • ZFN (Zink-Finger Nucleases) • TALENs (Transcription Activator-Like Effector Nucleases) • CRISPR-Cas система (Clustered regularly Interspaced Palindromic Repeats- CRISPR associated protein)

Нуклеазы с цинковыми пальцами В качестве ДНКсвязывающего домена используется универсальный домен типа «Цинковые пальцы»
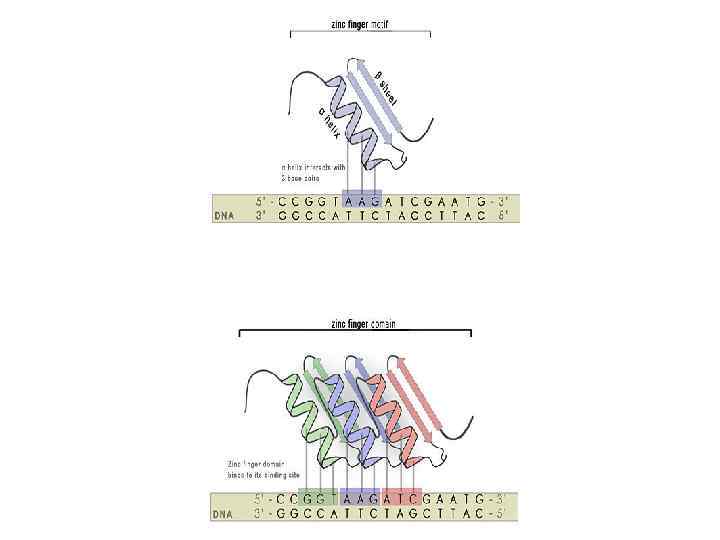
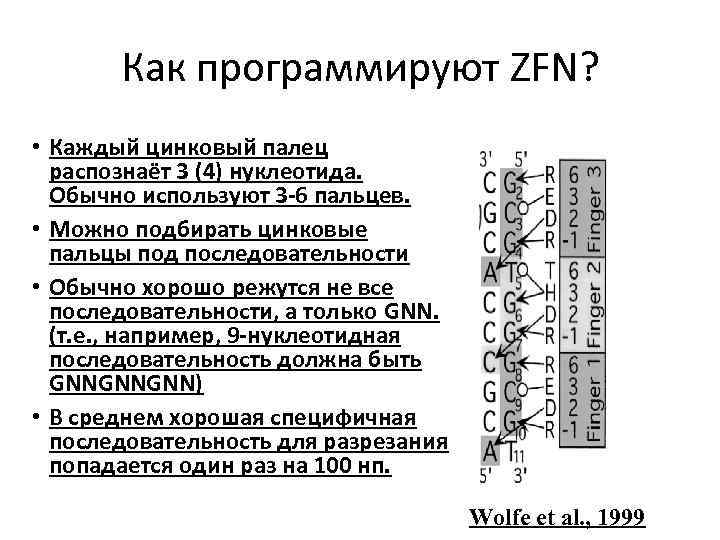
Как программируют ZFN? • Каждый цинковый палец распознаёт 3 (4) нуклеотида. Обычно используют 3 -6 пальцев. • Можно подбирать цинковые пальцы под последовательности • Обычно хорошо режутся не все последовательности, а только GNN. (т. е. , например, 9 -нуклеотидная последовательность должна быть GNNGNNGNN) • В среднем хорошая специфичная последовательность для разрезания попадается один раз на 100 нп. Wolfe et al. , 1999

TALEN (Transcription Activator-Like Effectors Nucleases)
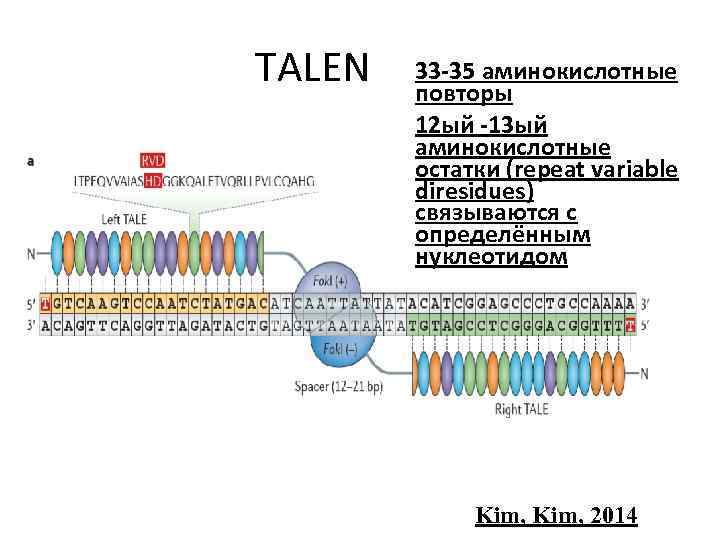
TALEN 33 -35 аминокислотные повторы 12 ый -13 ый аминокислотные остатки (repeat variable diresidues) связываются с определённым нуклеотидом Kim, 2014

Применение TALEN Потеря функции гена LOX 3 (кодирует липоксигеназу, создающую перекись водорода) увеличивает сроки хранения семян Этот ген инактивировали с помощью TALEN Рис дикого типа Рис lox 3 После обработки для ускоренного старения Ma et al. , 2015

Система CRISPR/Cas 9 (Clustered regularly Interspaced Palindromic Repeats- CRISPR associated protein)
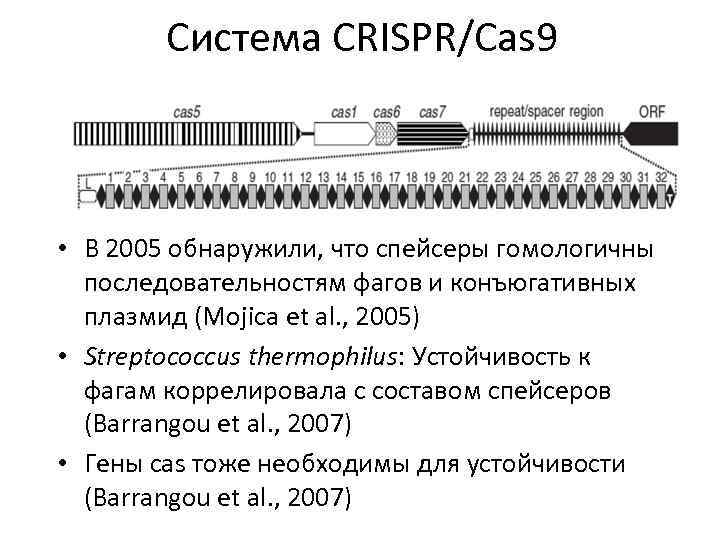
Система CRISPR/Cas 9 • В 2005 обнаружили, что спейсеры гомологичны последовательностям фагов и конъюгативных плазмид (Mojica et al. , 2005) • Streptococcus thermophilus: Устойчивость к фагам коррелировала с составом спейсеров (Barrangou et al. , 2007) • Гены cas тоже необходимы для устойчивости (Barrangou et al. , 2007)
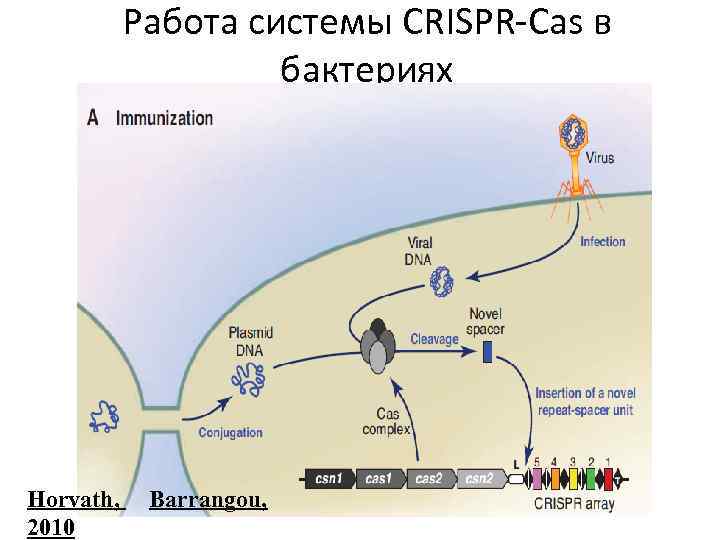
Работа системы CRISPR-Cas в бактериях Horvath, 2010 Barrangou,

Čermák al. , 2015 et
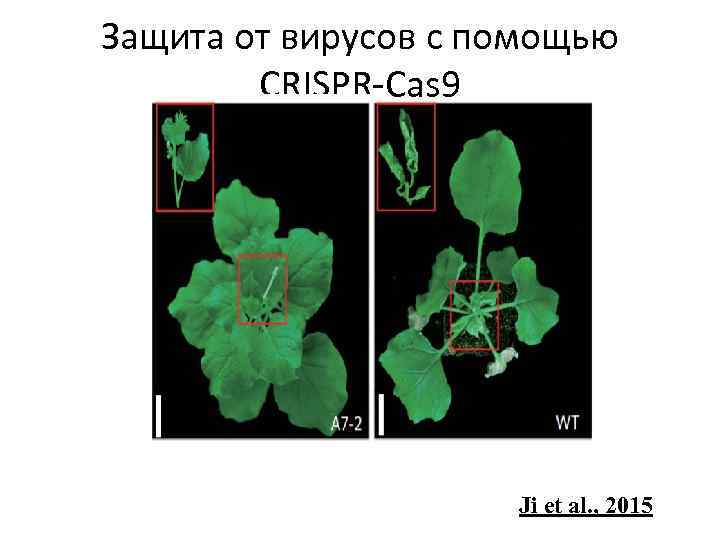
Защита от вирусов с помощью CRISPR-Cas 9 Ji et al. , 2015
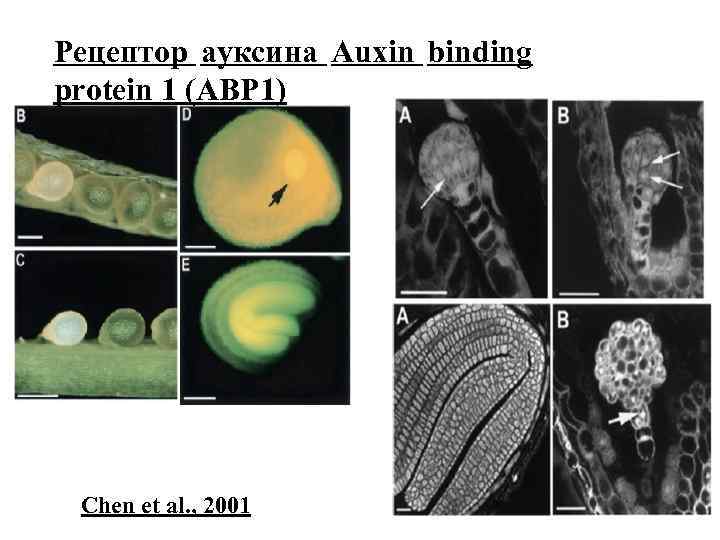
Рецептор ауксина Auxin binding protein 1 (ABP 1) Chen et al. , 2001
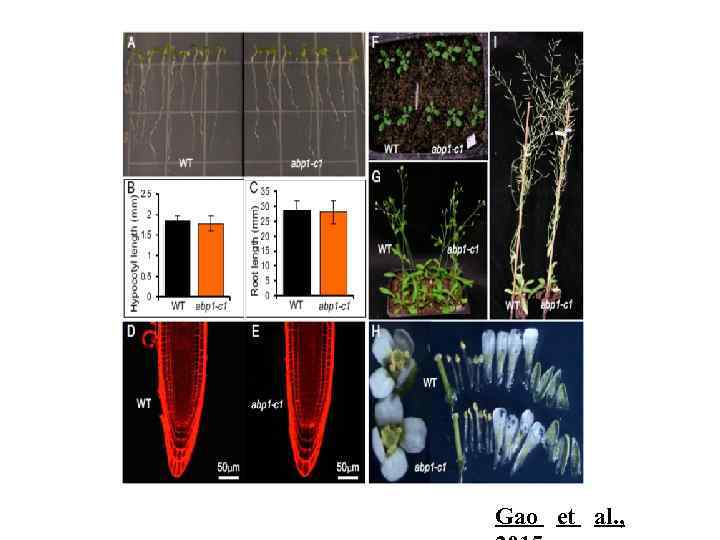
Gao et al. ,
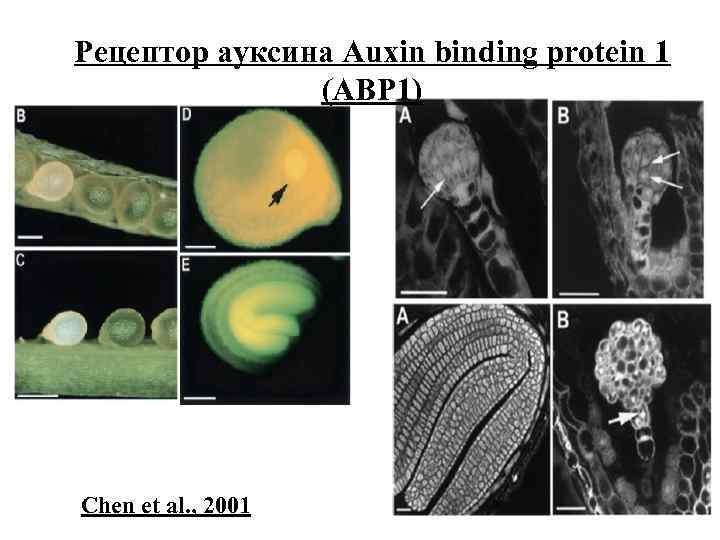
Рецептор ауксина Auxin binding protein 1 (ABP 1) Chen et al. , 2001
Биотехнология-7.ppt