БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ (1).ppt
- Количество слайдов: 46

БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ

В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Гли, Про Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат.
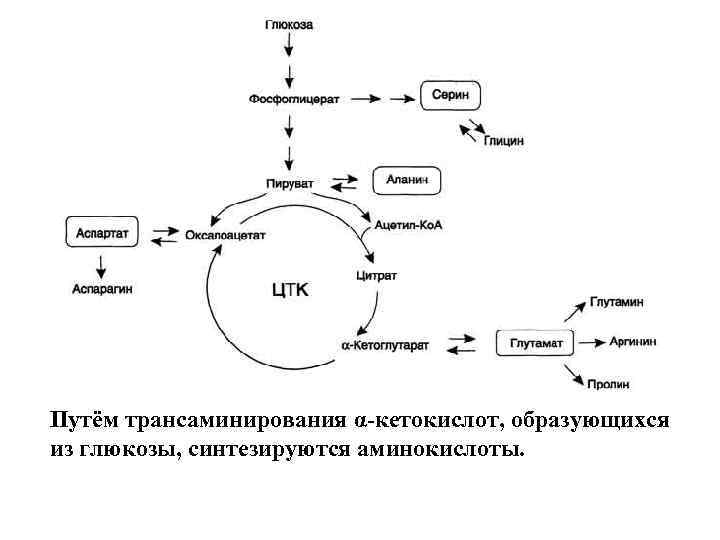
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты.

Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой. Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме.

Амиды глутамин и аспарагин синтезируются из соответствующих дикарбоновых аминокислот Глу и Асп

Серин образуется из 3 -фосфоглицерата промежуточного продукта гликолиза, который окисляется до 3 -фосфопирувата и затем трансаминируется с образованием серина.

Существует 2 пути синтеза глицина: 1) из серина с участием производного фолиевой кислоты в результате действия сериноксиметилтрансферазы: 2) в результате действия фермента глицинсинтазы в реакции:
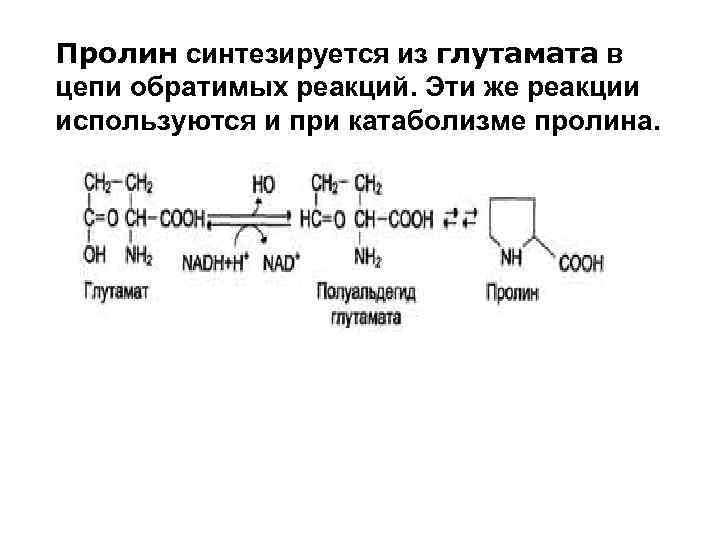
Пролин синтезируется из глутамата в цепи обратимых реакций. Эти же реакции используются и при катаболизме пролина.

Частично заменимые аминокислоты Apr и Гис синтезируются в небольших количествах, которые не отвечают потребностям организма. • Синтез аргинина происходит в реакциях орнитинового цикла; Гистидин синтезируется из АТФ и рибозы. Часть имидазольного цикла гистидина - N=CH-NHобразуется из пуринового ядра аденина, источником которого служит АТФ, остальная часть молекулы - из атомов рибозы.

Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно. Образование других аминокислот также возможно при наличии соответствующих α-кетокислот, которые могут трансаминироваться с глутаматом.

ОБМЕН ОТДЕЛЬНЫХ АМИНОКИСЛОТ

Обмен серина и глицина Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза 3 фосфоглицерата, а аминогруппу получает от глутаминовой кислоты. Глицин - также заменимая аминокислота, основным источником которой служит серин. Реакцию синтеза глицина из серина катализирует фермент сериноксиметилтрансфераза.

Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н 4 -фолата. Эта реакция обратима и катализируется глицинсинтазой ферментным комплексом, локализованным в митохондриях клеток печени.

Пути метаболизма серина и глицина Аминокислоты серии и глицин выполняют в организме человека разнообразные и очень важные функции.

Биологическая роль серина и глицина Серин принимает участие в синтезе нейромедиатора ацетилхолина, фосфолипидов, аминокислот (глицин, цистеин). Глицин является нейромедиатором, а также предшественником гема, пуриновых оснований, глутатиона.

Роль фолиевой аминокислоты в обмене В превращениях серина и глицина используются коферменты - производные фолиевой кислоты. Фолиевая кислота является незаменимым пищевым веществом для человека и большинства млекопитающих. Фолиевая кислота в печени превращается в Н 4 фолат в две стадии с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH.
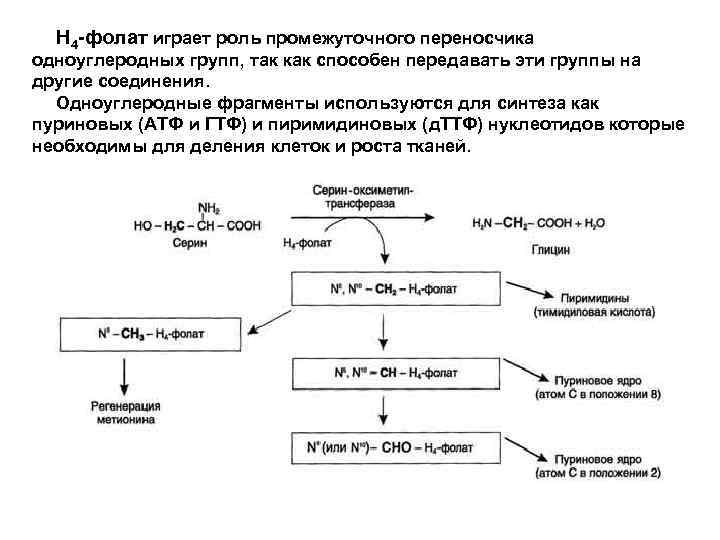
Н 4 -фолат играет роль промежуточного переносчика одноуглеродных групп, так как способен передавать эти группы на другие соединения. Одноуглеродные фрагменты используются для синтеза как пуриновых (АТФ и ГТФ) и пиримидиновых (д. ТТФ) нуклеотидов которые необходимы для деления клеток и роста тканей.

Недостаточность фолиевой кислоты Гиповитаминоз фолиевой кислоты возникает довольно редко, причинами его могут быть: • Нарушение всасывания фолиевой кислоты в кишечнике при хронических энтеритах и энтероколитах • Снижение активности ферментов, участвующих в синтезе кофермента Н 4 -фолата при гепатите, циррозе печени • Недостаточное потребление овощей, фруктов и мясных продуктов • Дисбактериоз

Дефицит фолиевой кислоты приводит к нарушению обмена одноуглеродных фрагментов и развитию мегалобластной (макроцитарная) анемии. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина и увеличением размера эритроцитов. Эти симптомы появляются вследствие нарушения синтеза ДНК и РНК из-за недостатка их предшественников - тимидиловой кислоты и пуриновых нуклеотидов, для синтеза которых необходимы производные Н 4 фолата. Клетки кроветворной ткани быстро делятся, поэтому они в первую очередь реагируют на нарушение синтеза нуклеиновых кислот снижением скорости эритропоэза.
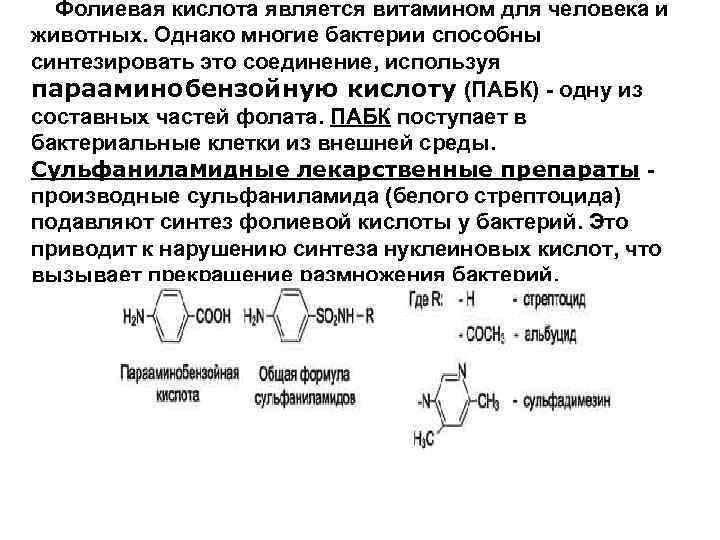
Фолиевая кислота является витамином для человека и животных. Однако многие бактерии способны синтезировать это соединение, используя парааминобензойную кислоту (ПАБК) - одну из составных частей фолата. ПАБК поступает в бактериальные клетки из внешней среды. Сульфаниламидные лекарственные препараты производные сульфаниламида (белого стрептоцида) подавляют синтез фолиевой кислоты у бактерий. Это приводит к нарушению синтеза нуклеиновых кислот, что вызывает прекращение размножения бактерий.

Обмен метионина

Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-т. РНК участвует в инициации процесса трансляции. Метильная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метильная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноуглеродного фрагмента служит активная форма метионина(SAM)- Sаденозилметионин.

Реакция активации происходит путем присоединения метионина к молекуле аденозина, донором которой является АТФ. Структура (-S+-CH 3) в SAM активируется под действием положительного заряда атома серы и легко отщепляется, переходя на молекулу акцептора в реакциях трансметилирования. Отщепление метильной группы от SAM и перенос ее на соединение акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в Sаденозилгомоцистеин (SAГ).

Синтез фосфатидилхолина из фосфатидилэтиноламина активно происходит в печени, кишечнике и других тканях. Фосфатидилхолины - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов.

Синтез карнитина Карнитин - переносчик жирных кислот через мембрану митохондрий, где протекает β-окисление жирных кислот, которое является важным источником энергии для скелетных мышц и миокарда. Синтез карнитина из лизина происходит с участием 3 молекул SAM, необходимого для формирования триметиламиногруппы.

Синтез креатина Креатин необходим для образования в мышцах и головном мозге высокоэнергетического соединения - креатинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы.

Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования. Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение креатинфосфат.

Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток. В норме активность его в крови очень мала. Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период.
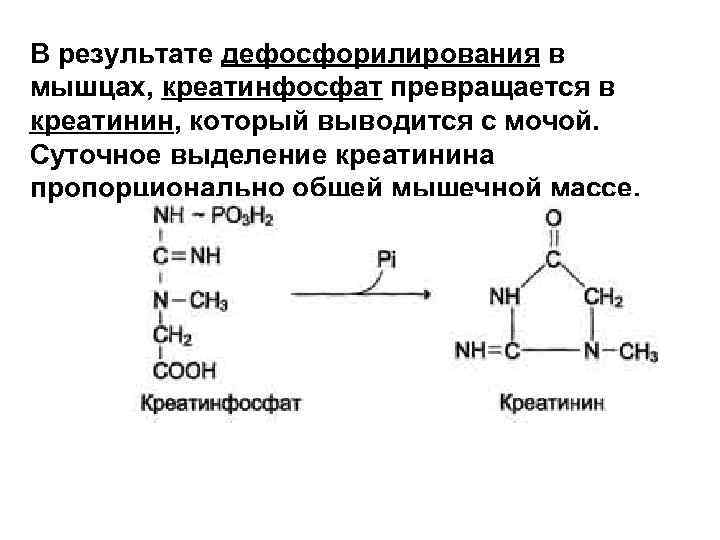
В результате дефосфорилирования в мышцах, креатинфосфат превращается в креатинин, который выводится с мочой. Суточное выделение креатинина пропорционально общей мышечной массе.

Определение содержания креатина и креатинина в крови и моче используется для характеристики интенсивности работы мышц в медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии.

Обмен цистеина
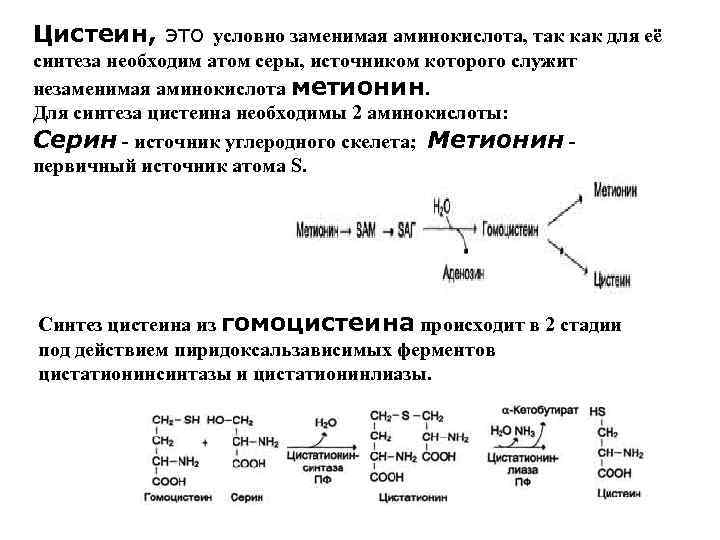
Цистеин, это условно заменимая аминокислота, так как для её синтеза необходим атом серы, источником которого служит незаменимая аминокислота метионин. Для синтеза цистеина необходимы 2 аминокислоты: Серин - источник углеродного скелета; Метионин первичный источник атома S. Синтез цистеина из гомоцистеина происходит в 2 стадии под действием пиридоксальзависимых ферментов цистатионинсинтазы и цистатионинлиазы.
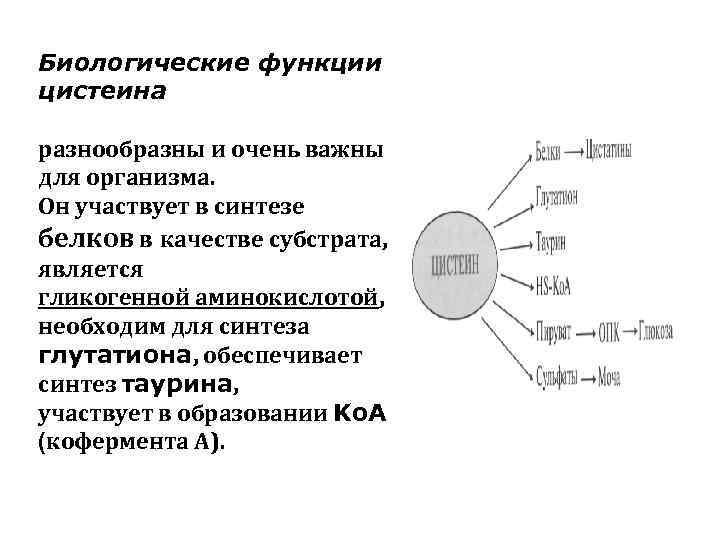
Биологические функции цистеина разнообразны и очень важны для организма. Он участвует в синтезе белков в качестве субстрата, является гликогенной аминокислотой, необходим для синтеза глутатиона, обеспечивает синтез таурина, участвует в образовании Ko. A (кофермента А).

Обмен фенилаланина и тирозина

Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически активных соединений. Фенилаланин используется в организме только в 2 процессах: включается в белки и превращается в тирозин. Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток.
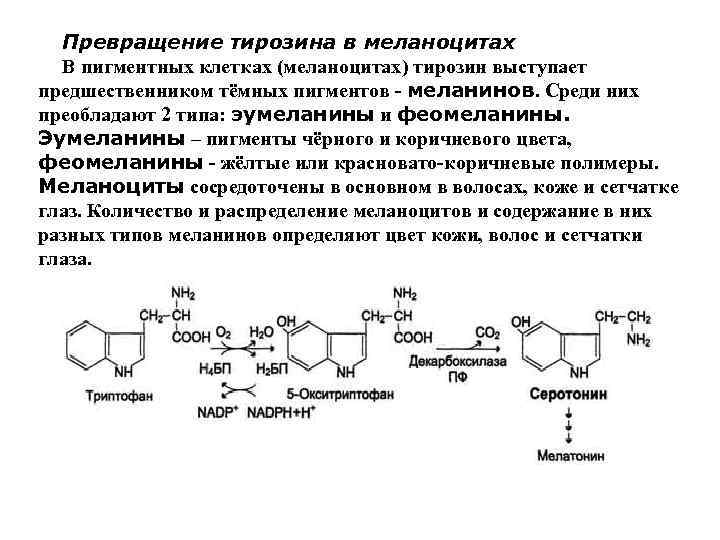
Превращение тирозина в меланоцитах В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов. Среди них преобладают 2 типа: эумеланины и феомеланины. Эумеланины – пигменты чёрного и коричневого цвета, феомеланины - жёлтые или красновато-коричневые полимеры. Меланоциты сосредоточены в основном в волосах, коже и сетчатке глаз. Количество и распределение меланоцитов и содержание в них разных типов меланинов определяют цвет кожи, волос и сетчатки глаза.
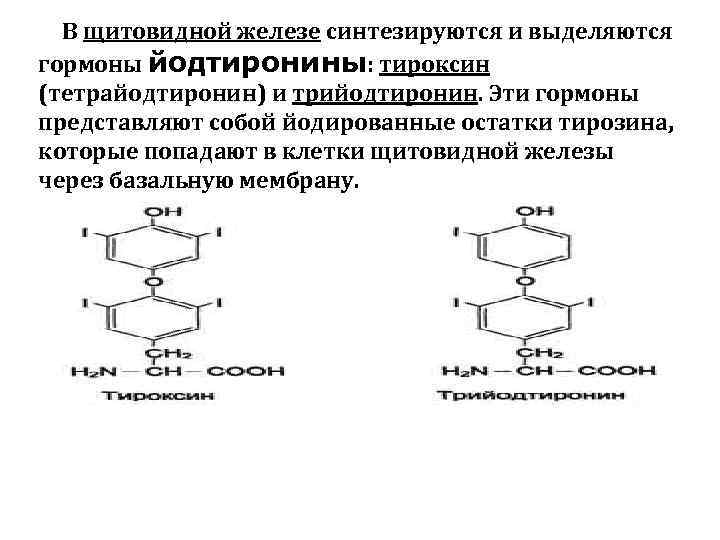
В щитовидной железе синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайодтиронин) и трийодтиронин. Эти гормоны представляют собой йодированные остатки тирозина, которые попадают в клетки щитовидной железы через базальную мембрану.

Превращения тирозина в надпочечниках и нервной ткани (синтез катехоламинов) При образовании катехоламинов, которое происходит в нервной ткани и надпочечниках, и меланина в меланоцитах промежуточным продуктом служит диоксифенилаланин (ДОФА). Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами: Тирозиназа в меланоцитах является Сu+-зависимым ферментом. Тирозингидроксилаза в надпочечниках и катехоламинергических нейронах не нуждается в ионах меди. Это – Fе 2+-зависимый фермент.

Физиологическая роль тирозингидроксилазы чрезвычайно велика, так как этот фермент является регуляторным и определяет скорость синтеза катехоламинов. Активность тирозингидроксилазы значительно изменяется в результате: • Аллостерической регуляции (ингибитор норадреналин); • Фосфорилирования/дефосфорилирования: в результате фосфорилирования с участием протеинкиназы А снижается сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы.

Классическая фенилкетонурия (ФКУ) - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы, которые приводят к снижению активности фермента или полной его инактивации. При этом концентрация фенилаланина повышается в крови в 20 -30 раз (в норме - 1, 0 -2, 0 мг/дл), в моче - в 100 -300 раз по сравнению с нормой (30 мг/дл). Концентрация фенилпирувата и фениллактата в моче достигает 300 -600 мг/дл при полном отсутствии в норме.

Наиболее тяжёлые проявления ФКУ - нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. При отсутствии лечения больные не доживают до 30 лет. Частота заболевания - 1: 10 000 новорождённых. Заболевание наследуется по аутосомнорецессивному типу. Тяжёлые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефаличеекий барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотанина).

Тирозинемии Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирозинурии. Различают 3 типа тирозинемии. Тирозинемия типа 1 (тирозиноз). Причиной заболевания является дефект фермента фумарилацетоацетатгидролазы, катализирующего расщепление фумарилацетоацетата на фумарат и ацетоацетат. Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот.

Патофизиология этого нарушения. Острая форма тирозиноза характерна для новорождённых. Клинические проявления - диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6 -8 мес из-за развивающейся недостаточности печени. Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина.

Тирозинемия типа II (синдром Рихнера-Ханхорта). Причина - дефект фермента тирозинаминотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений. Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента гидроксифенилпируватдиоксигеназы, превращающего гидроксифенилпируват в гомогентизиновую кислоту. В результате в крови больных повышается концентрация гидроксифенилацетата, тирозина и фенилаланина. При лечении назначают бедную белком диету и витамин С.

Альбинизм Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов. Клиническое проявление альбинизма (от лат. albus белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1: 20 000.

Болезнь Паркинсона Заболевание развивается при недостаточности дофамина. Это одно из самых распространённых неврологических заболеваний (частота 1: 200 среди людей старше 60 лет). При этой патологии снижена активность тирозингидроксилазы, ДОФАдекарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется.
БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ (1).ppt