Индивидуальные пути обмена аминокислот 1.ppt
- Количество слайдов: 38
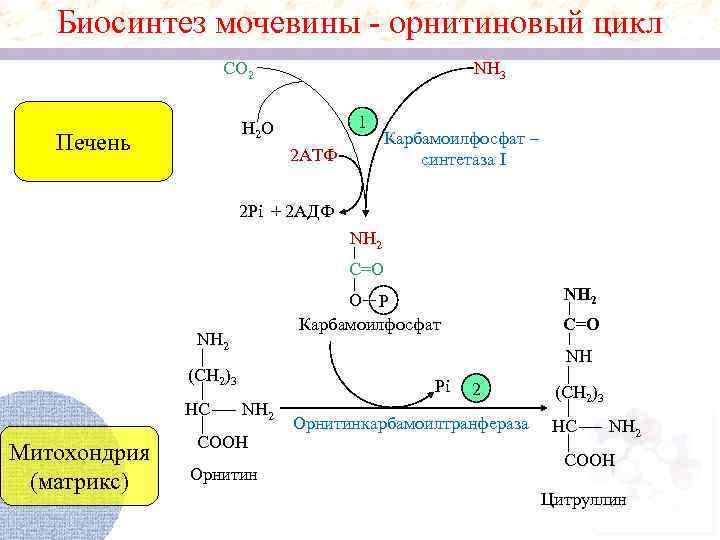
Биосинтез мочевины - орнитиновый цикл CO 2 NH 3 1 H 2 O Печень 2 АТФ Карбамоилфоcфат – синтетаза I 2 Pi + 2 АДФ NH 2 C=O NH 2 Митохондрия (матрикс) C=O NH (СН 2)3 НС NH 2 O P Карбамоилфоcфат Pi NH 2 СООН Орнитин 2 Орнитинкарбамоилтранфераза (СН 2)3 НС NH 2 СООН Цитруллин
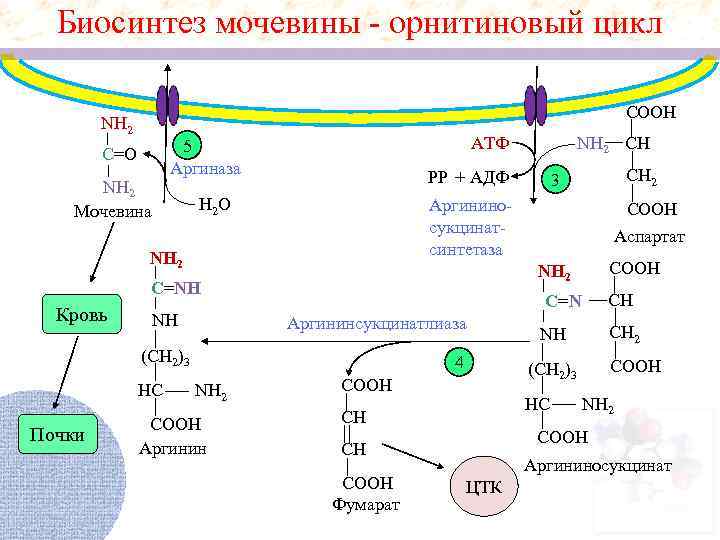
Биосинтез мочевины - орнитиновый цикл СООН NH 2 Мочевина РP + АДФ H 2 O Аргининсукцинатлиаза Почки 4 NH 2 СООН Аргинин Аспартат СООН CН C=N (СН 2)3 НС СООН NH 2 C=NH NH CН 2 3 Аргининосукцинатсинтетаза NH 2 Кровь NH 2 CН АТФ 5 Аргиназа C=O СООН (СН 2)3 СООН НС CН NH 2 СООН CН СООН Фумарат CН 2 NH Аргининосукцинат ЦТК

Гипераммониемия К развитию гипераммониемии (повышение содержания аммиака в крови) приводят генетические дефекты ферментов орнитинового цикла и заболевания печени (гепатит, цирроз). Известны наследственные заболевания, обусловленные дефектом одного из 5 ферментов орнитинового цикла: • Гипераммониемия I и II типа (карбамоилфоcфат– синтетаза (1), орнитинкарбамоилтранфераза (2)) • Цитруллинемия (аргинино-сукцинатсинтетаза (3)) Ø Аргиносукцинатурия (аргининсукцинатлиаза (4)) Ø Гипераргининемия (аргиназа (5))

Токсичность аммиака При увеличении концентрации аммиака в 8 – 10 раз (до 0, 6 ммоль/л) проявляется его токсическое действие. Ø Ø Наблюдаются: Головокружение; Тошнота; Рвота; Судорожные припадки с потерей сознания. Наследственные формы гипераммониемии приводят к отставанию в умственном развитии детей

Токсичность аммиака v Снижение обезвреживания NH 4+ приводит к сдвигу р. Н крови в щелочную сторону (алкалозу), который отрицательно сказывается на транспорте О 2 в ткани гемоглобином, в результате чего возникают гипоксия, приводящая к гипоэнергетическому состоянию тканей, прежде всего головного мозга. v Накопление аммиака в тканях снижает количество α-кетоглутарата, связывающего избыток путем превращения в глутамат, что угнетает трансаминирование и ЦТК (усиление гипоэнергетического состояния тканей)

Токсичность аммиака v Накопление NH 4+ в нервной ткани усиливает синтез глутамина из глутамата, что приводит к снижению содержания последнего, а это подавляет синтез основного тормозного медиатора γаминомасляной кислоты (ГАМК). Глутамат ГАМК + СО 2 В результате происходит повышение нервномышечной возбудимости и возникают судороги.

Токсичность аммиака v Судорожные припадки могут быть также следствием подавления работы Na+, K+-АТФаз, нарушения трансмембранного переноса ионов Na+ и K+ и проведения нервных импульсов. Для снижения концентрации аммиака в крови и облегчения состояния больных рекомендуется малобелковая диета и введение метаболитов орнитинового цикла (аргинин, цитруллин, глутамат).

Кафедра биологической химии ПУТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ

Гликогенные аминокислоты образуют промежуточные продукты ОПК (пируват, αкетоглутарат, сукцинил-Ко. А, фумарат, оксалоацетат), идущие процессе глюконеогенеза на синтез глюкозы Кетогенные аминокислоты (Лиз, Лей) превращаются в ацетил-Ко. А из которого могут синтезироваться кетоновые тела Гликокетогенные аминокислоты распадаются на два продукта – метаболит ОПК и ацетил-Ко. А (Иле) или ацетоацетат (Три, Фен, Тир), которые могут использоваться для синтеза как глюкозы, так и кетоновых тел
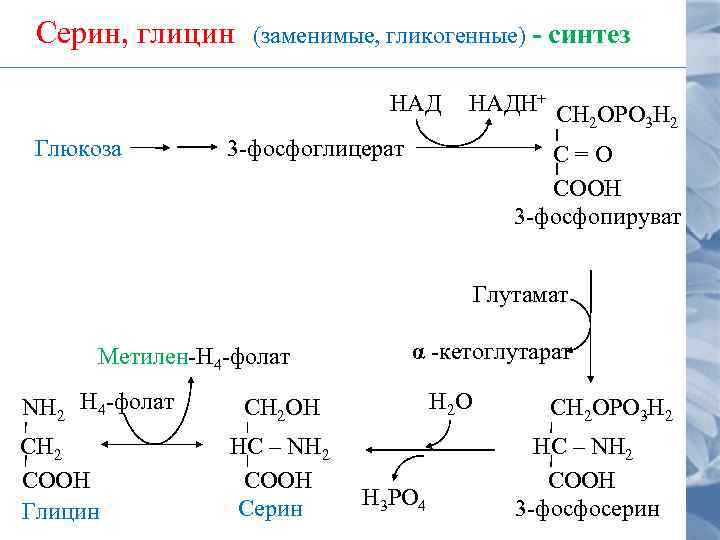
Серин, глицин (заменимые, гликогенные) - синтез НАД Глюкоза НАДН+ СН ОРО Н 2 3 -фосфоглицерат С=О СООН 3 -фосфопируват Глутамат Метилен-Н 4 -фолат NН 2 Н 4 -фолат СH 2 СООН Глицин α -кетоглутарат H 2 О СН 2 ОН НС – NH 2 СООН Серин Н 3 РО 4 СН 2 ОРО 3 Н 2 НС – NH 2 СООН 3 -фосфосерин
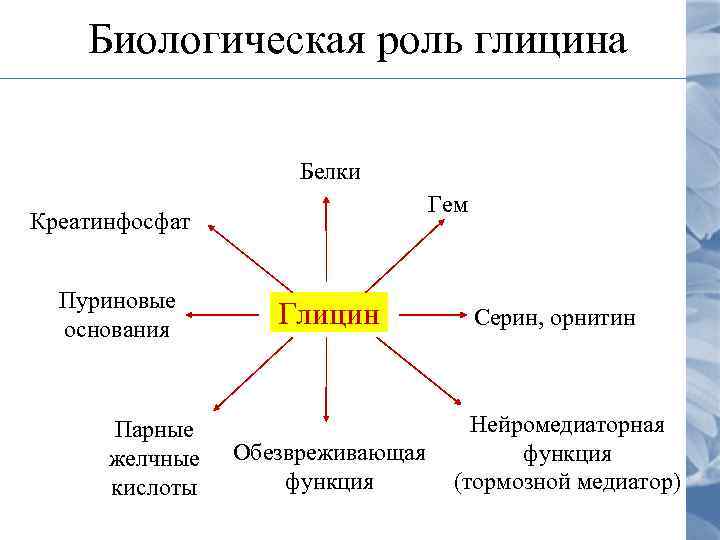
Биологическая роль глицина Белки Гем Креатинфосфат Пуриновые основания Парные желчные кислоты Глицин Обезвреживающая функция Серин, орнитин Нейромедиаторная функция (тормозной медиатор)
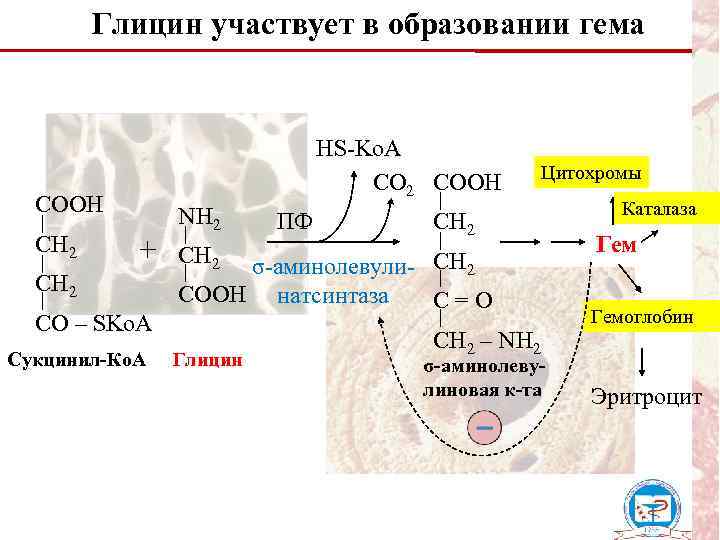
Глицин участвует в образовании гема HS-Ko. A CO 2 СOOH CH 2 + CH 2 CO – SKo. A Сукцинил-Ко. А NH 2 ПФ Цитохромы CH 2 σ-аминолевули- CH 2 COOH натсинтаза C=O Глицин CH 2 – NH 2 σ-аминолевулиновая к-та Каталаза Гемоглобин Эритроцит
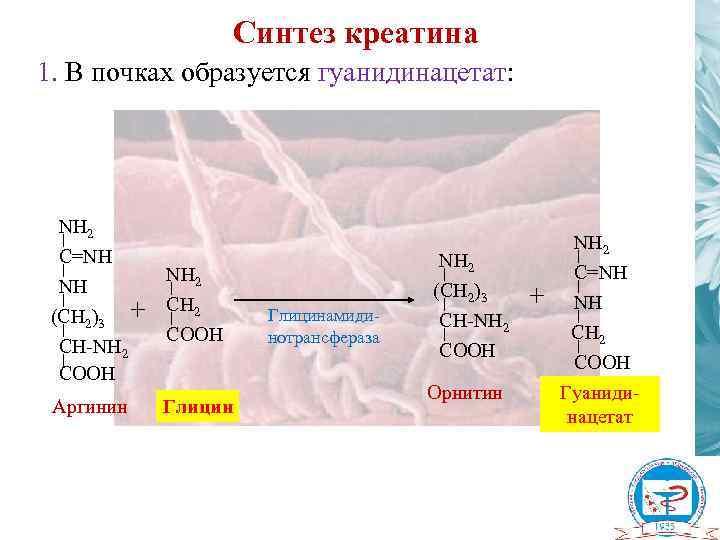
Синтез креатина 1. В почках образуется гуанидинацетат: NH 2 C=NH NH (CH 2)3 CH-NH 2 COOH Аргинин + NH 2 COOH Глицинамидинотрансфераза NH 2 (CH 2)3 CH-NH 2 COOH Орнитин + NH 2 C=NH NH CH 2 COOH Гуанидинацетат
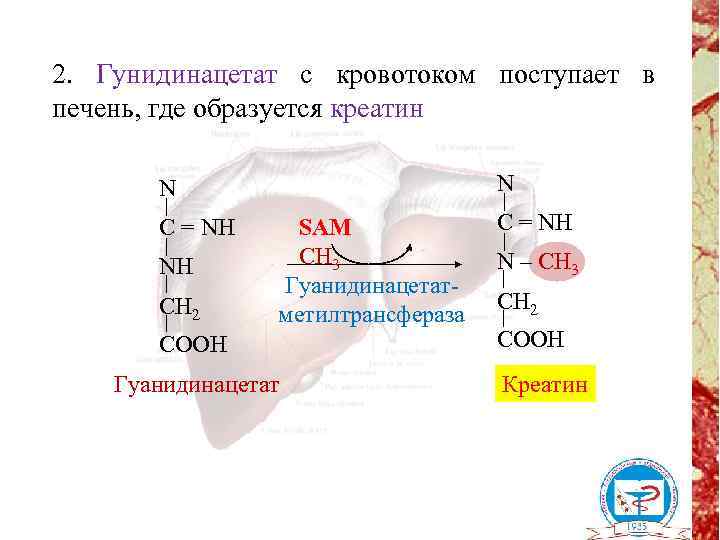
2. Гунидинацетат с кровотоком поступает в печень, где образуется креатин N N C = NH NH CH 2 SAM CH 3 Гуанидинацетатметилтрансфераза COOH Гуанидинацетат C = NH N – CH 3 CH 2 COOH Креатин
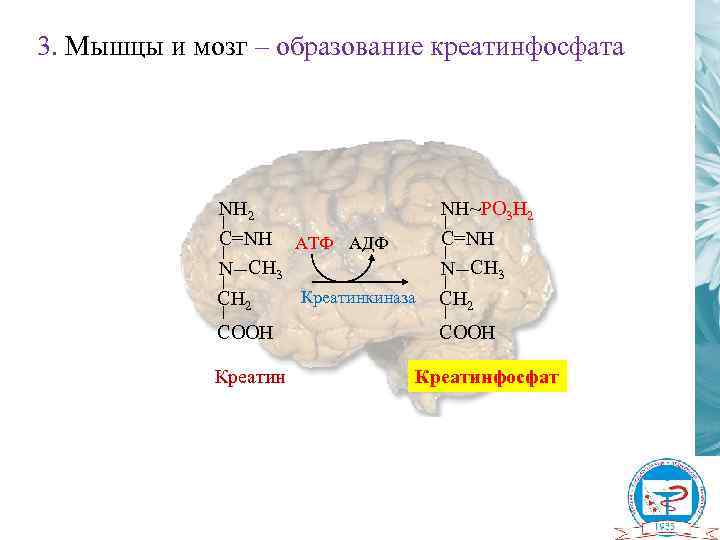
3. Мышцы и мозг – образование креатинфосфата NH 2 C=NH АТФ АДФ N CH 3 NH~PO 3 H 2 C=NH N CH 3 CH 2 COOH Креатинкиназа COOH Креатинфосфат
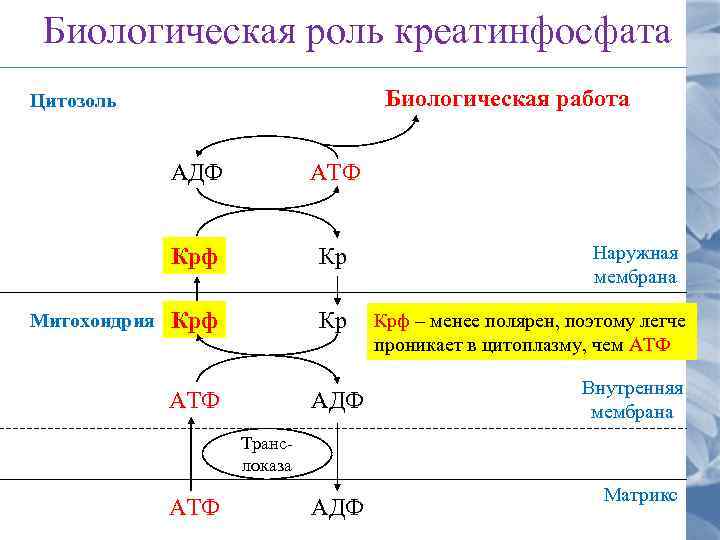
Биологическая роль креатинфосфата Биологическая работа Цитозоль АДФ Крф Митохондрия АТФ Кр Крф Кр АТФ АДФ Наружная мембрана Крф – менее полярен, поэтому легче проникает в цитоплазму, чем АТФ Внутренняя мембрана Транслоказа АТФ АДФ Матрикс
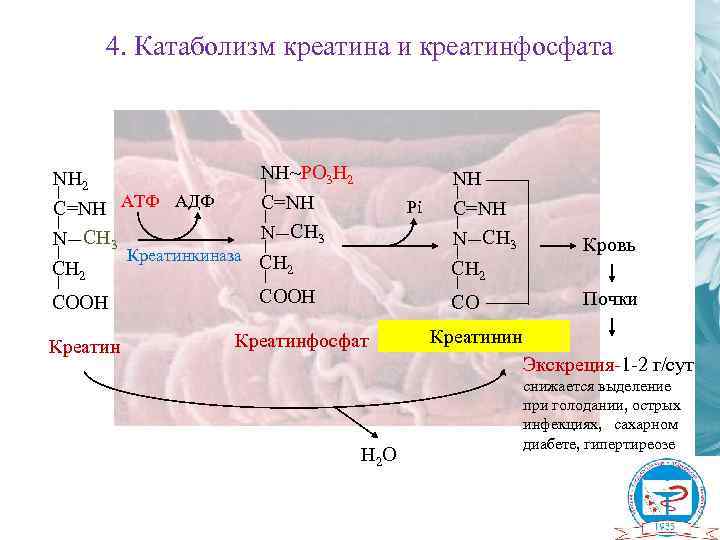
4. Катаболизм креатина и креатинфосфата NH 2 C=NH АТФ АДФ N CH 3 CH 2 COOH Креатин NH~PO 3 H 2 C=NH N CH 3 Pi Креатинкиназа CH 2 NH C=NH N CH 3 Кровь CH 2 COOH CO Креатинфосфат Почки Креатинин Экскреция-1 -2 г/сут H 2 О снижается выделение при голодании, острых инфекциях, сахарном диабете, гипертиреозе
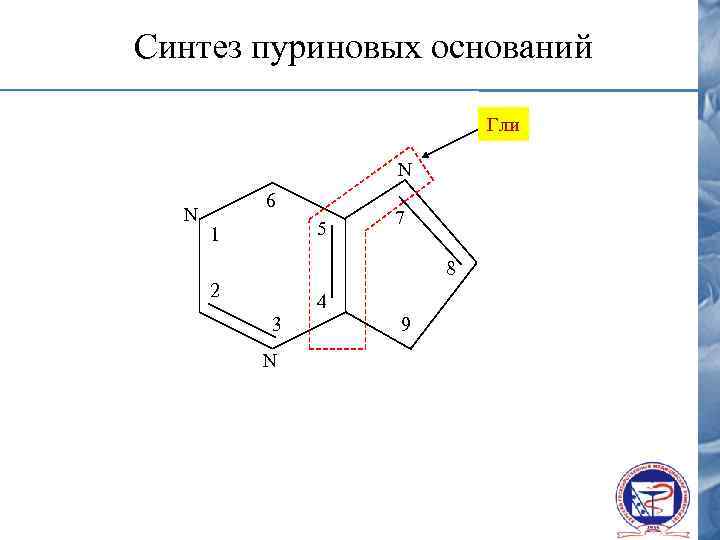
Синтез пуриновых оснований Гли N N 6 5 1 7 8 2 4 3 N 9
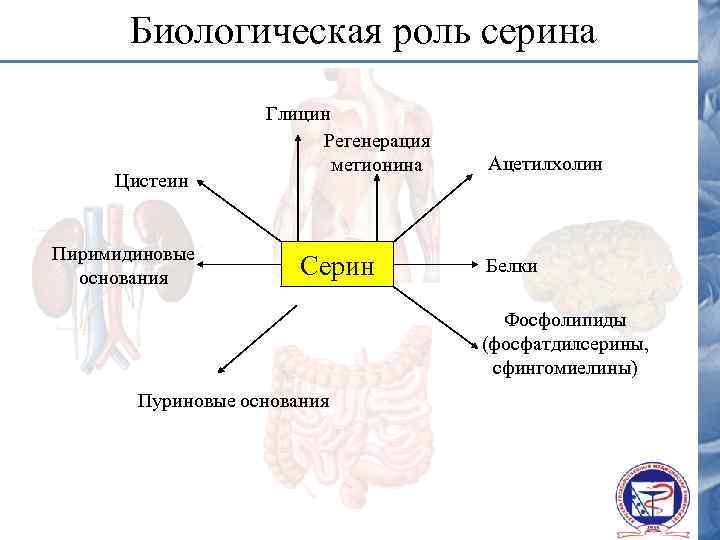
Биологическая роль серина Цистеин Пиримидиновые основания Глицин Регенерация метионина Серин Ацетилхолин Белки Фосфолипиды (фосфатдилсерины, сфингомиелины) Пуриновые основания
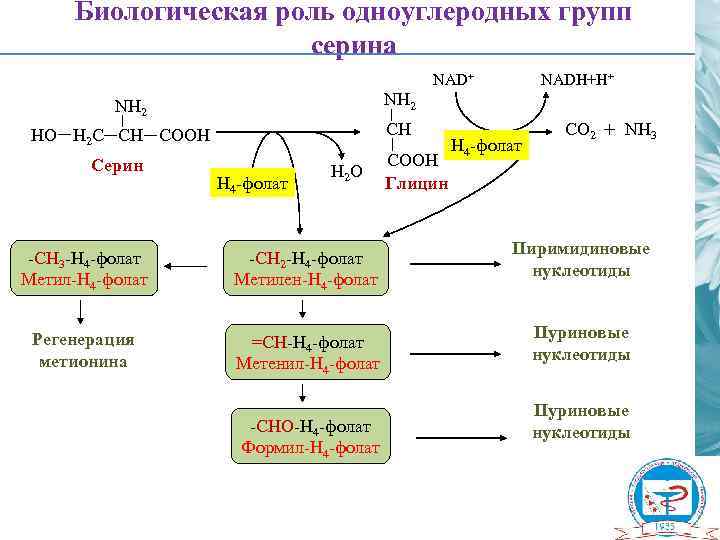
Биологическая роль одноуглеродных групп серина NAD+ NH 2 CH HО H 2 C CH COOH Серин NADH+H+ H 4 -фолат H 2 О -CH 3 -H 4 -фолат Метил-Н 4 -фолат -CH 2 -H 4 -фолат Метилен-Н 4 -фолат Регенерация метионина =CH-H 4 -фолат Метенил-Н 4 -фолат -CHО-H 4 -фолат Формил-Н 4 -фолат COOH Глицин H 4 -фолат СО 2 + NH 3 Пиримидиновые нуклеотиды Пуриновые нуклеотиды
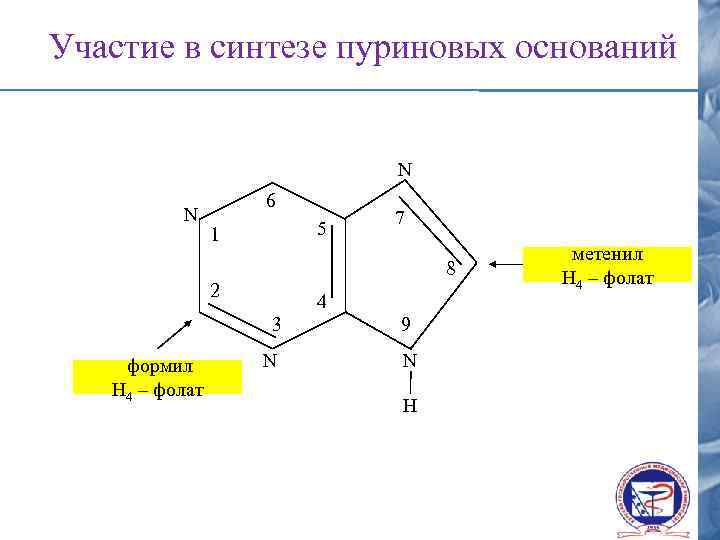
Участие в синтезе пуриновых оснований N N 6 5 1 7 8 2 4 3 формил Н 4 – фолат N 9 N H метенил Н 4 – фолат
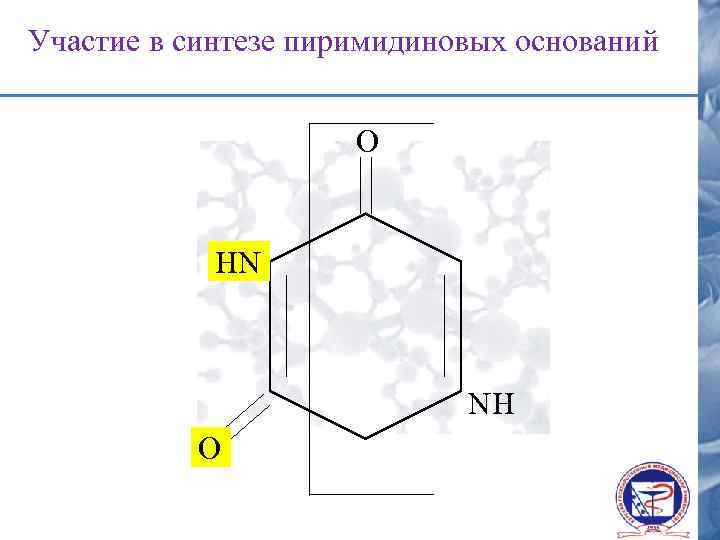
Участие в синтезе пиримидиновых оснований О HN NH О
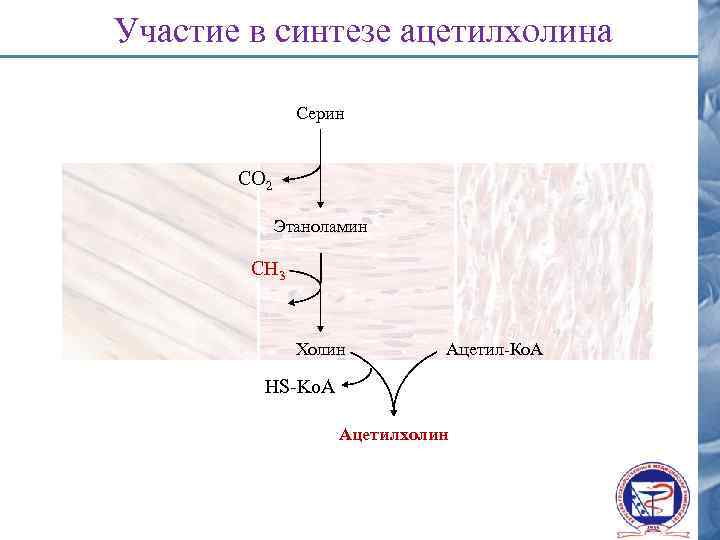
Участие в синтезе ацетилхолина Серин СО 2 Этаноламин CH 3 Холин Ацетил-Ко. А HS-Ko. A Ацетилхолин
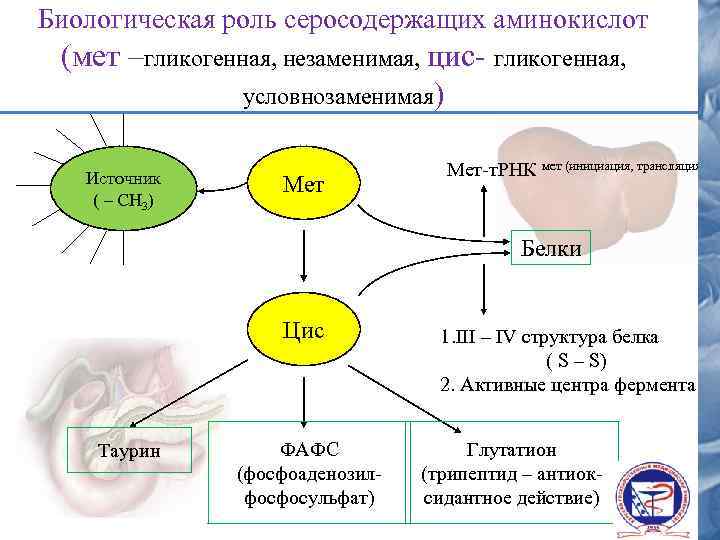
Биологическая роль серосодержащих аминокислот (мет –гликогенная, незаменимая, цис- гликогенная, условнозаменимая) Источник ( – СН 3) Мет-т. РНК мет (инициация, трансляция) Белки Цис Таурин ФАФС (фосфоаденозилфосфосульфат) 1. III – IV структура белка ( S – S) 2. Активные центра фермента Глутатион (трипептид – антиоксидантное действие)
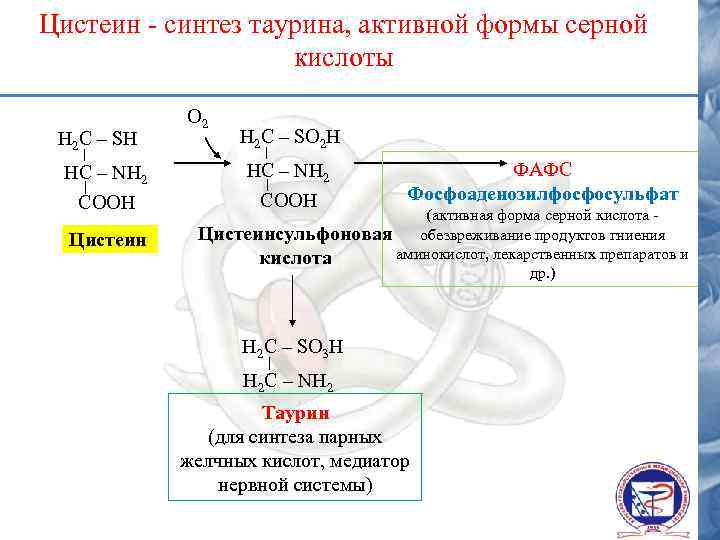
Цистеин - синтез таурина, активной формы серной кислоты Н 2 С – SH О 2 Н 2 С – SО 2 H НС – NH 2 СООН Цистеин ФАФС Фосфоаденозилфосфосульфат (активная форма серной кислота Цистеинсульфоновая обезвреживание продуктов гниения аминокислот, лекарственных препаратов и кислота др. ) Н 2 С – SО 3 H Н 2 С – NH 2 Таурин (для синтеза парных желчных кислот, медиатор нервной системы)
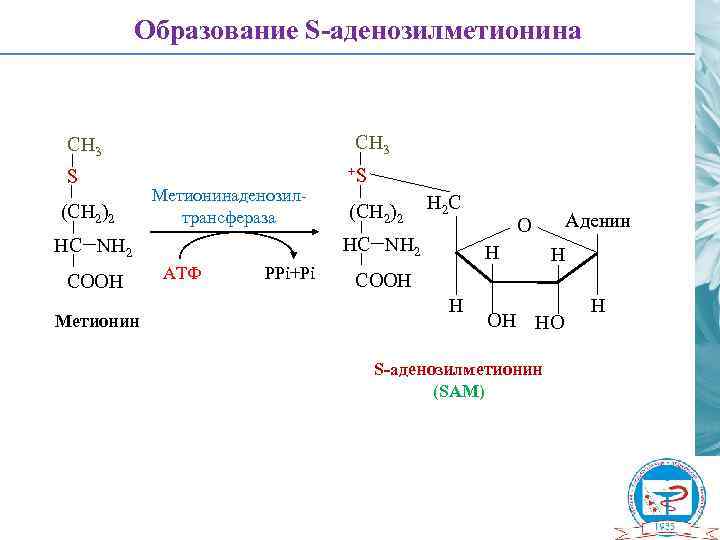
Образование S-аденозилметионина СH 3 S (CH 2)2 Метионинаденозилтрансфераза Метионин (CH 2)2 H 2 C НC NH 2 COOH +S АТФ PPi+Pi Аденин O H H COOH HO S-аденозилметионин (SAM) H
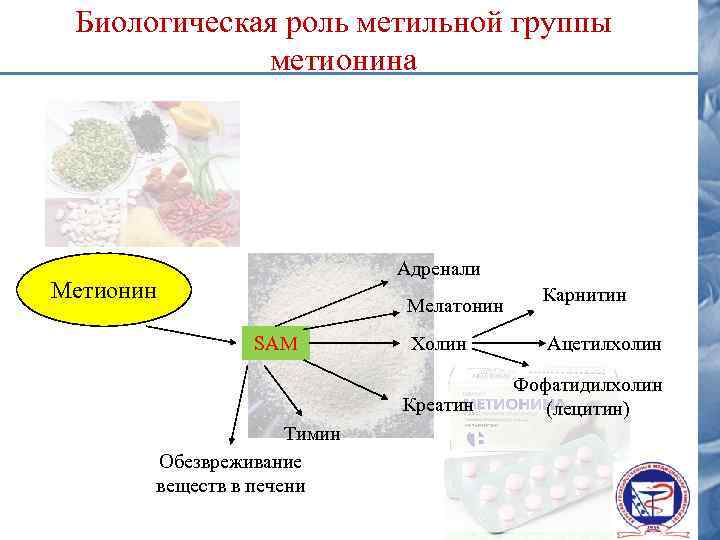
Биологическая роль метильной группы метионина Адренали Метионин Мелатонин SAM Холин Креатин Тимин Обезвреживание веществ в печени Карнитин Ацетилхолин Фофатидилхолин (лецитин)
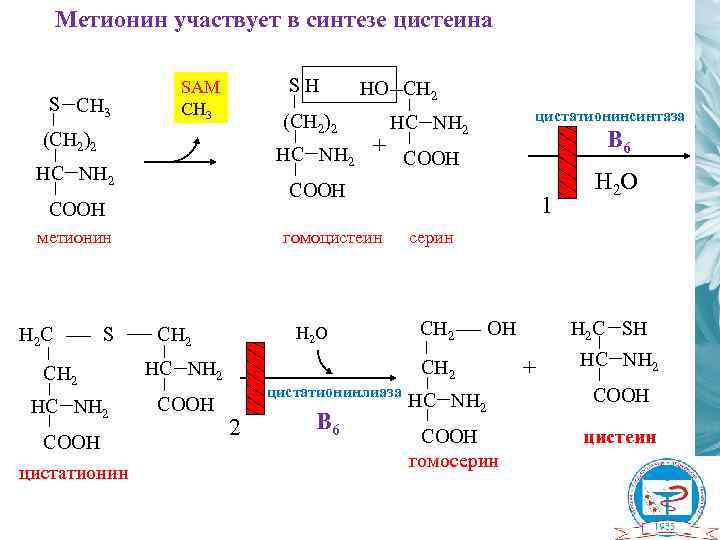
Метионин участвует в синтезе цистеина S СH 3 SН SAM CH 3 (CH 2)2 НC NH 2 метионин S CH 2 НC NH 2 COOH цистатионин + цистатионинсинтаза НC NH 2 B 6 COOH H 2 C НО CH 2 гомоцистеин H 2 O CH 2 серин CH 2 ОН CH 2 НC NH 2 COOH 1 цистатионинлиаза 2 B 6 H 2 O НC NH 2 COOH гомосерин H 2 С SH + НC NH 2 COOH цистеин
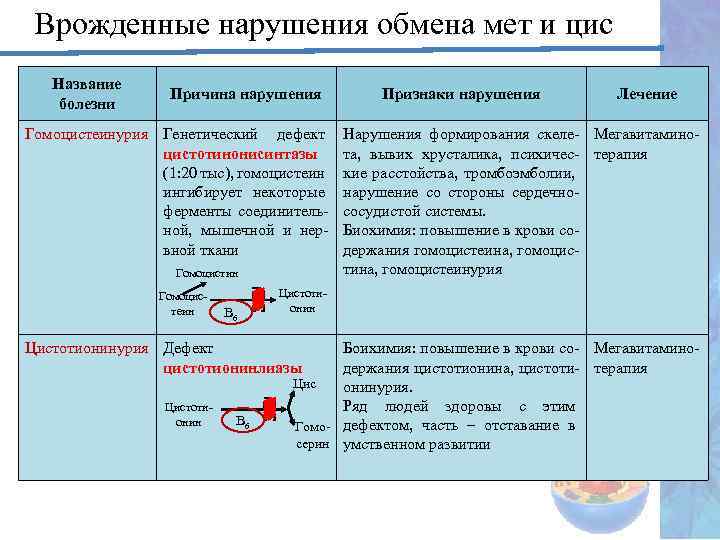
Врожденные нарушения обмена мет и цис Название болезни Причина нарушения Гомоцистеинурия Генетический дефект цистотинонисинтазы (1: 20 тыс), гомоцистеин ингибирует некоторые ферменты соединительной, мышечной и нервной ткани Гомоцистин Гомоцистеин В 6 Лечение Нарушения формирования скеле- Мегавитаминота, вывих хрусталика, психичес- терапия кие расстойства, тромбоэмболии, нарушение со стороны сердечнососудистой системы. Биохимия: повышение в крови содержания гомоцистеина, гомоцистеинурия Цистотионинурия Дефект цистотионинлиазы Цистотионин Признаки нарушения Боихимия: повышение в крови со- Мегавитаминодержания цистотионина, цистоти- терапия Цис онинурия. Ряд людей здоровы с этим Гомо- дефектом, часть – отставание в серин умственном развитии
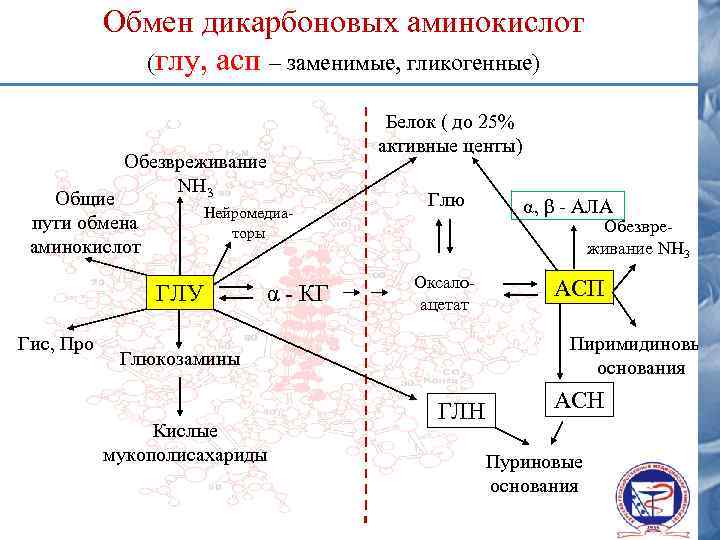
Обмен дикарбоновых аминокислот (глу, асп – заменимые, гликогенные) Белок ( до 25% активные центы) Обезвреживание NH 3 Общие пути обмена аминокислот Нейромедиаторы ГЛУ Гис, Про α - КГ Глю Обезвреживание NH 3 Оксалоацетат АСП Пиримидиновые основания Глюкозамины Кислые мукополисахариды α, β - АЛА ГЛН АСН Пуриновые основания
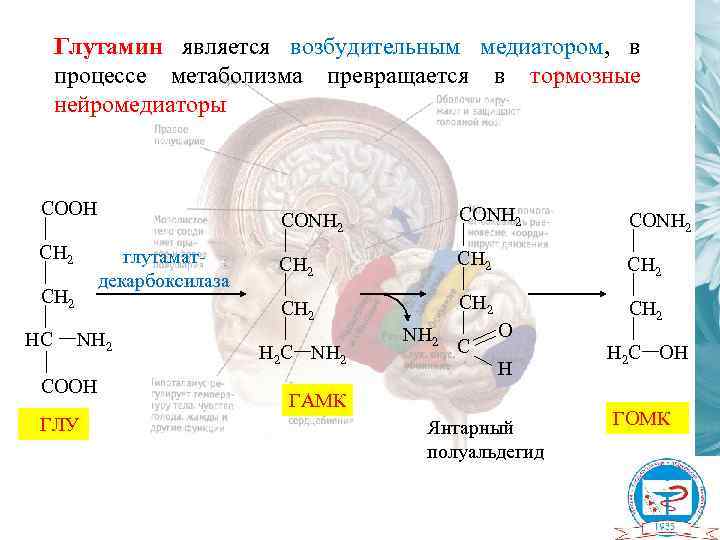
Глутамин является возбудительным медиатором, в процессе метаболизма превращается в тормозные нейромедиаторы CОOH глутаматдекарбоксилаза CH 2 HC NH 2 COOH ГЛУ CОNH 2 CH 2 CH 2 CОNH 2 CH 2 H 2 C NH 2 C O H ГАМК Янтарный полуальдегид H 2 C OH ГОМК

Биологическая роль γ-аминомасляной кислоты (ГАМК) 1. ГАМК – увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного испульса; 2. Повышает дыхательную активность нервной ткани; 3. Улучшает кровоснабжение головного мозга.
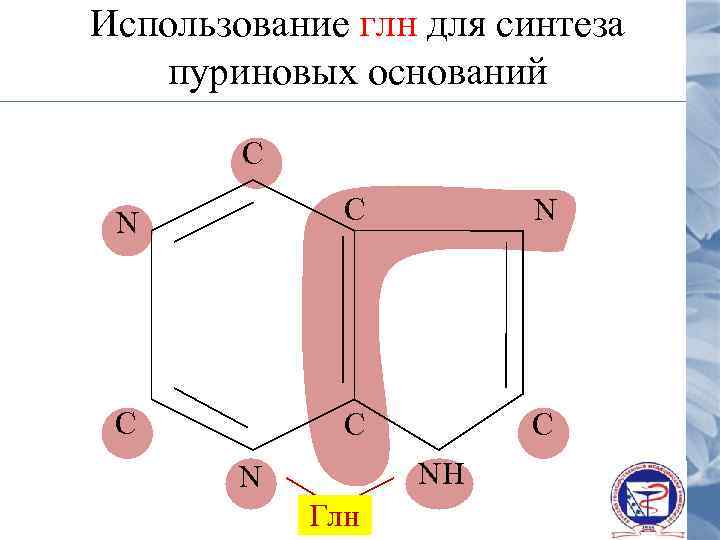
Использование глн для синтеза пуриновых оснований С N С С С NH N Глн
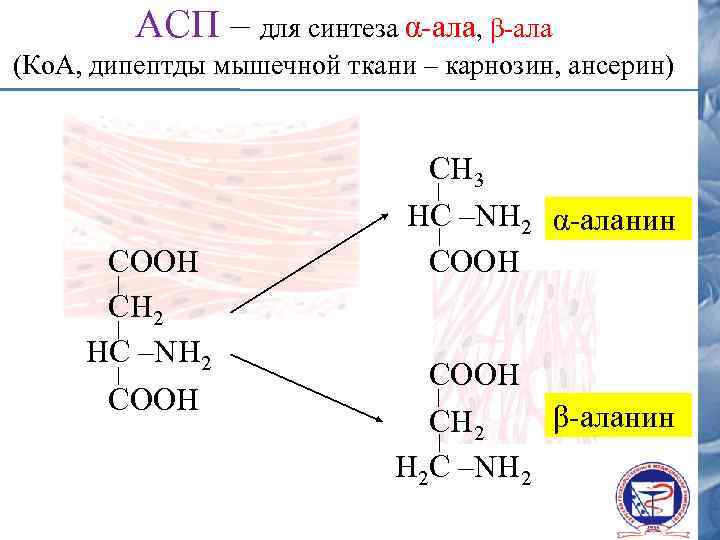
АСП – для синтеза α-ала, β-ала (Ко. А, дипептды мышечной ткани – карнозин, ансерин) СООН СН 2 НС –NH 2 СООН СН 3 НС –NH 2 α-аланин СООН СOOН β-аланин СH 2 Н 2 С –NH 2
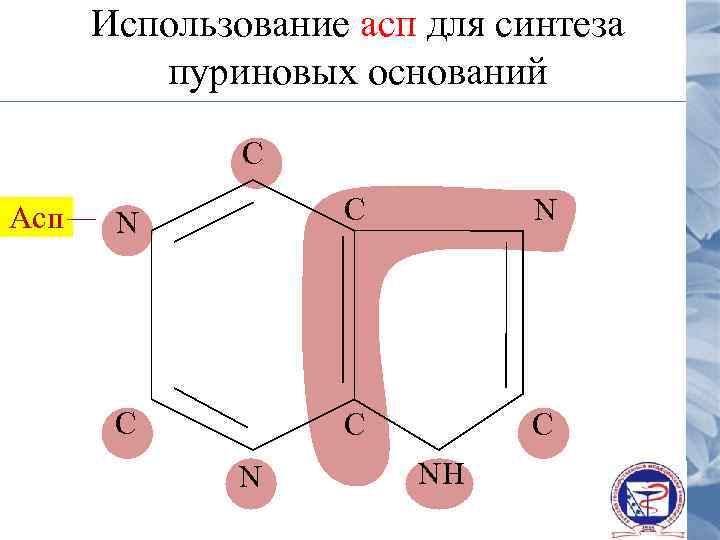
Использование асп для синтеза пуриновых оснований С Асп N С С С N NH
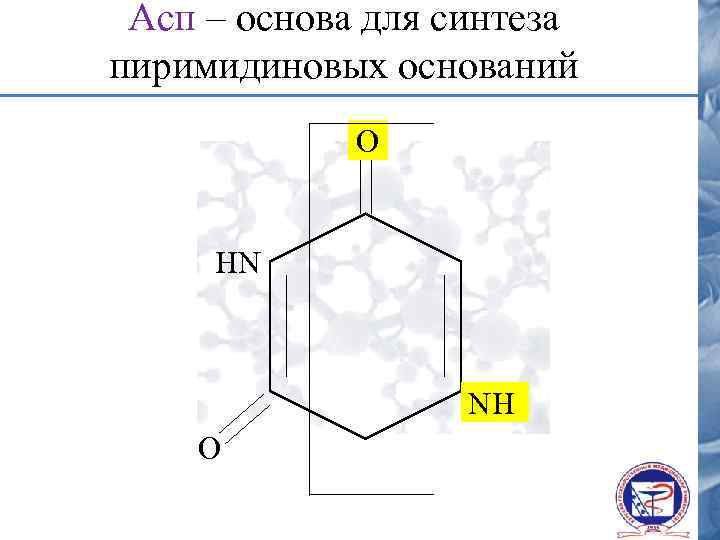
Асп – основа для синтеза пиримидиновых оснований О HN NH О

Биологическая роль аргинина (гликогенная, частично заменимая) 1. Используется в синтезе креатина, который в виде креатинфосфата способен служить источником энергии для работы мышц человека и млекопитающих. 2. В мышцах беспозвоночных аргининосукцинат выполняет энергетическую функцию. 3. Служит предшественником орнитина. 4. Является источником NO в организме.
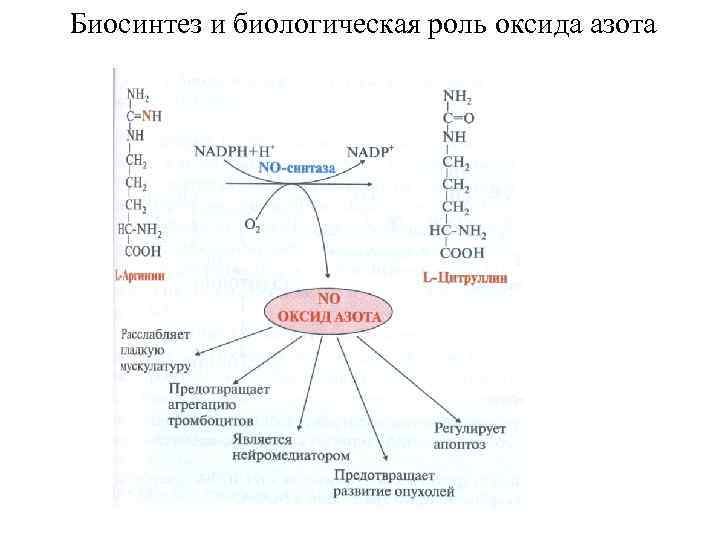
Биосинтез и биологическая роль оксида азота
Индивидуальные пути обмена аминокислот 1.ppt