Трансляция.pptx
- Количество слайдов: 56

Биосинтез белка (трансляция)

Трансляция – общие сведения В процессе трансляции информация, закодированная в первичной структуре нуклеиновых кислот, переводится в аминокислотную последовательность синтезируемых белков. Перевод осуществляется в соответствии с правилами генетического кода. Трансляция происходит с участием рибосом, м. РНК, т. РНК, белковых факторов трансляции.

Структура т. РНК – короткие молекулы (70 -90 нукл. ), содержащие уникальный тринуклеотид, который определяет, какую аминокислоту эта т. РНК присоединяет и с каким кодоном она может спариваться. Имеют вторичную и третичную структуру. Вторичная структура – «клеверный лист» из-за наличия трех петель. 1) ТΨС-петля, содержит тимидин (Т) и псевдоуридин (Ψ); 2) антикодоновая петля, содержит антикодон; 3) DU-петля, содержит дигидроурацил (DU).
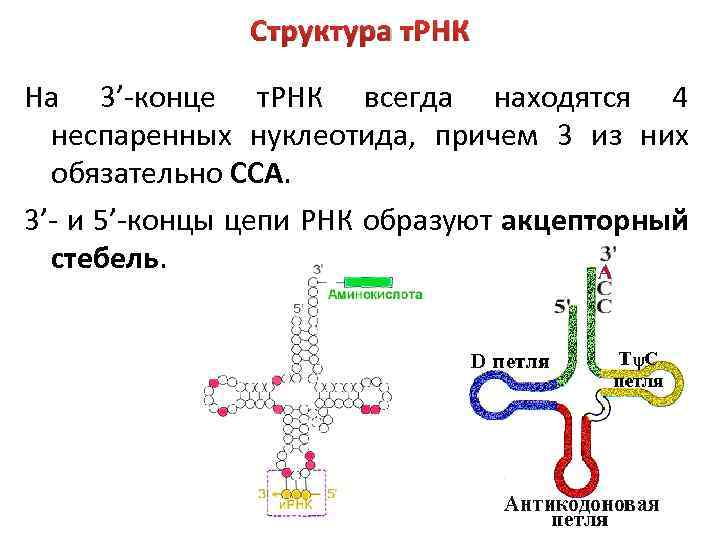
Структура т. РНК На 3’-конце т. РНК всегда находятся 4 неспаренных нуклеотида, причем 3 из них обязательно ССА. 3’- и 5’-концы цепи РНК образуют акцепторный стебель.
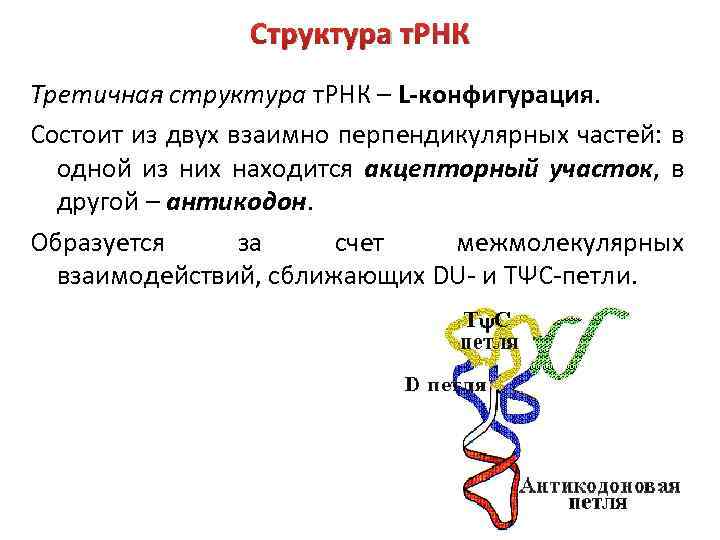
Структура т. РНК Третичная структура т. РНК – L-конфигурация. Состоит из двух взаимно перпендикулярных частей: в одной из них находится акцепторный участок, в другой – антикодон. Образуется за счет межмолекулярных взаимодействий, сближающих DU- и ТΨС-петли.

Рекогниция Синтез белка в клетке состоит из двух этапов: 1) рекогниция; 2) собственно синтез полипептида на рибосоме. Рекогниция – образование ковалентной связи между т. РНК и соответствующей аминокислотой.

Рекогниция 1955 г. – Ф. Крик предложил «адапторную гипотезу» , в которой постулировал существование специальных малых адапторных РНК и специальных ферментов, ковалентно присоединяющих аминокислотные остатки к этим РНК. Каждой аминокислоте соответствует свой вид адапторной РНК и свой фермент. С другой стороны, адапторная РНК имеет нуклеотидный триплет, комплементарный соответствующему кодону м. РНК. Т. о. , узнавание кодона м. РНК аминокислотой осуществляется через систему адапторная РНКфермент.

Рекогниция 1957 г. – М. Хогланд, П. Замечник, М. Стефенсон (США), а также К. Огата и Х. Нохара (Япония) сообщили об открытии низкомолекулярной РНК и специальной ферментной фракции. Показали, что образующийся комплекс аминоацил-т. РНК является промежуточным соединением в переносе аминокислоты в полипептидную цепь. Адапторные РНК были названы трансферными (транспортными), а ферменты – аминоацилт. РНК-синтетазами.
Аминоацил-т. РНК-синтетазы (АРСазы)
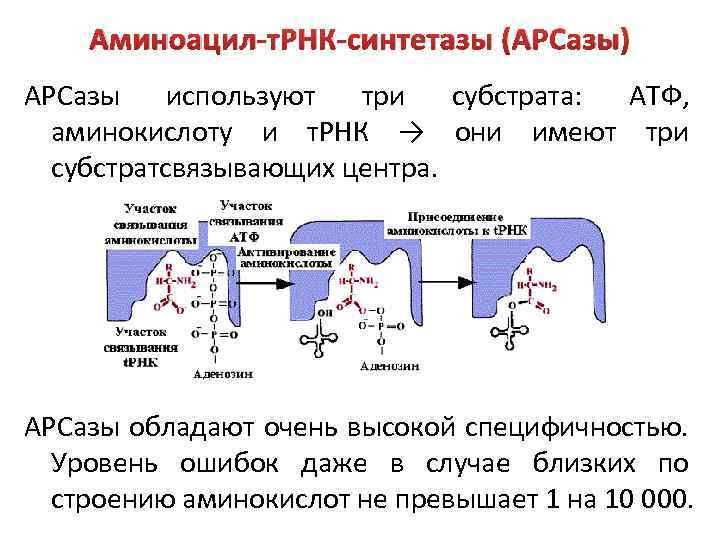
Аминоацил-т. РНК-синтетазы (АРСазы) АРСазы используют три субстрата: АТФ, аминокислоту и т. РНК → они имеют три субстратсвязывающих центра. АРСазы обладают очень высокой специфичностью. Уровень ошибок даже в случае близких по строению аминокислот не превышает 1 на 10 000.

Рекогниция В клетке для каждой из 20 белковых аминокислот существует своя аминоацил-т. РНК -синтетаза. Число различных т. РНК всегда больше, чем аминокислот и ферментов. Изоакцепторные т. РНК – т. РНК, которые способны связываться с одной и той же аминокислотой. Изоакцепторные т. РНК могут узнавать разные кодоны для данной аминокислоты.
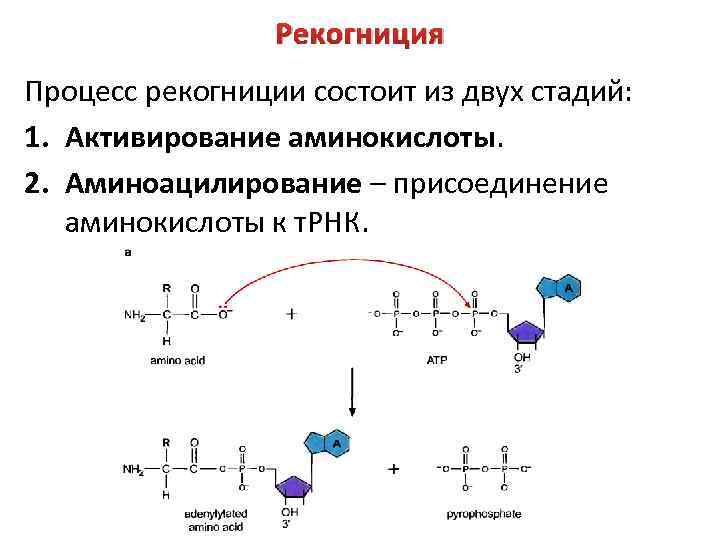
Рекогниция Процесс рекогниции состоит из двух стадий: 1. Активирование аминокислоты. 2. Аминоацилирование – присоединение аминокислоты к т. РНК.
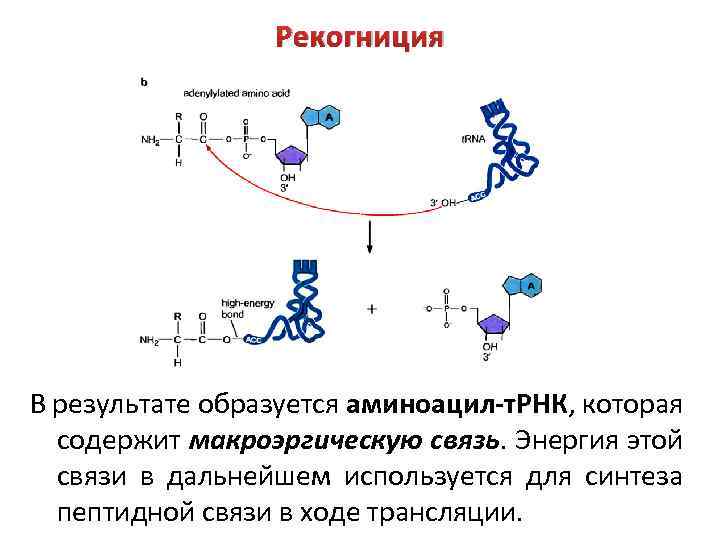
Рекогниция В результате образуется аминоацил-т. РНК, которая содержит макроэргическую связь. Энергия этой связи в дальнейшем используется для синтеза пептидной связи в ходе трансляции.

Рибосомы
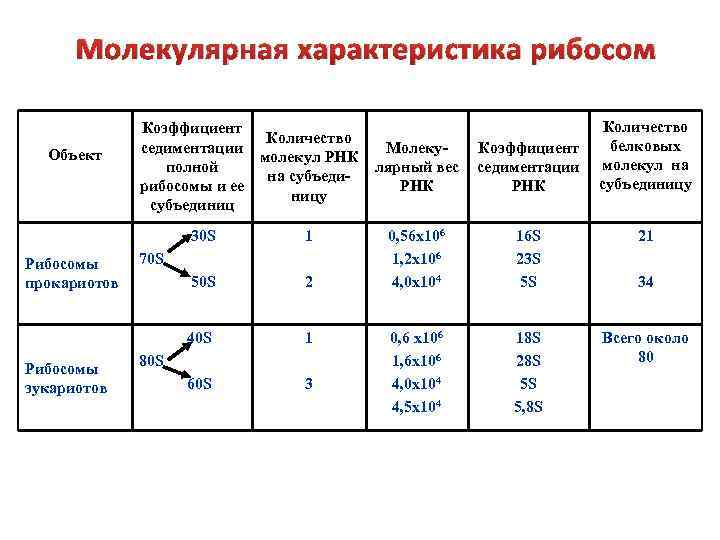
Молекулярная характеристика рибосом Объект Коэффициент Количество седиментации молекул РНК полной на субъедирибосомы и ее ницу субъединиц 30 S Рибосомы эукариотов 50 S 2 40 S Рибосомы прокариотов 1 1 60 S 3 70 S 80 S Количество белковых молекул на субъединицу Молекулярный вес РНК Коэффициент седиментации РНК 0, 56 х106 1, 2 х106 4, 0 х104 16 S 23 S 5 S 21 0, 6 х106 1, 6 х106 4, 0 х104 4, 5 х104 18 S 28 S 5 S 5, 8 S Всего около 80 34
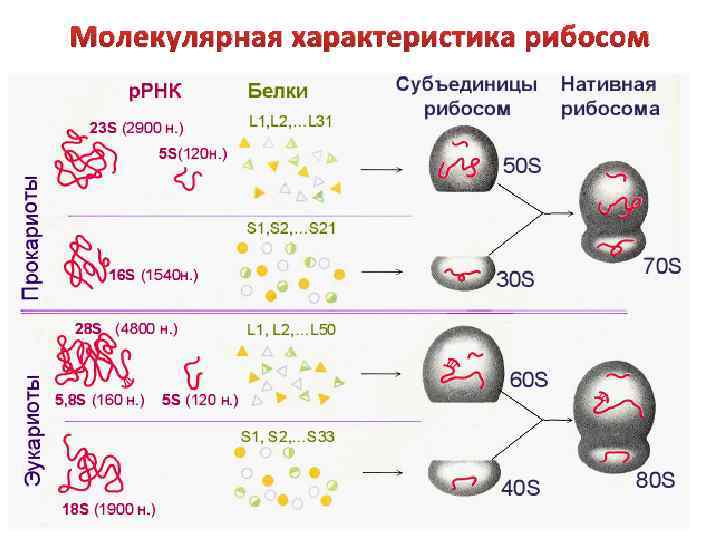
Молекулярная характеристика рибосом
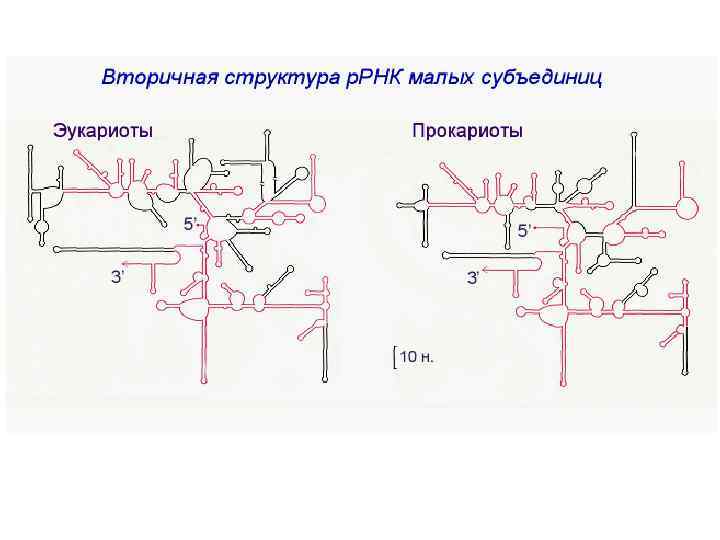
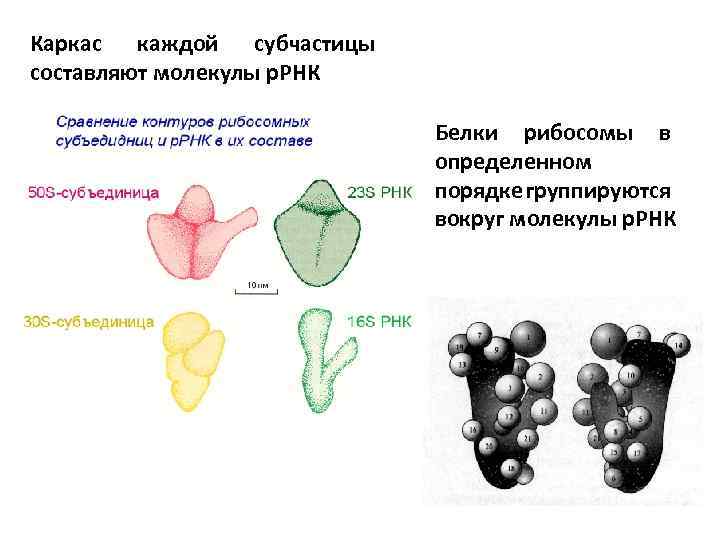
Каркас каждой субчастицы составляют молекулы р. РНК Белки рибосомы в определенном порядке группируются вокруг молекулы р. РНК
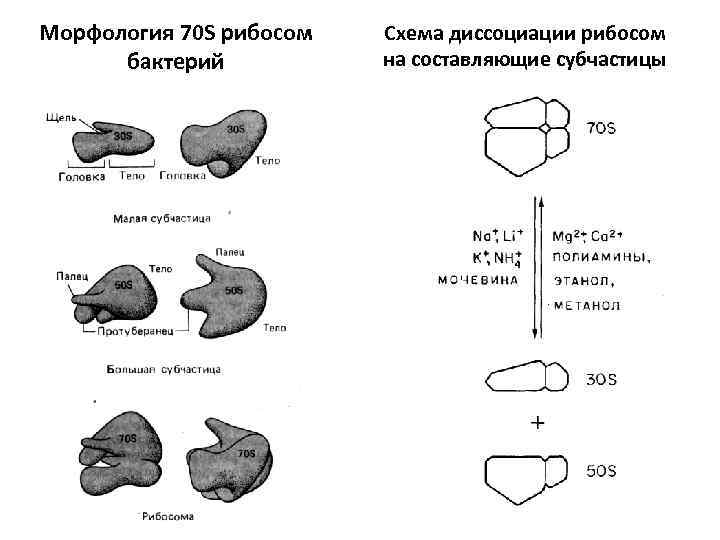
Морфология 70 S рибосом бактерий Схема диссоциации рибосом на составляющие субчастицы
Малая субъединица Большая субъединица Рибосома

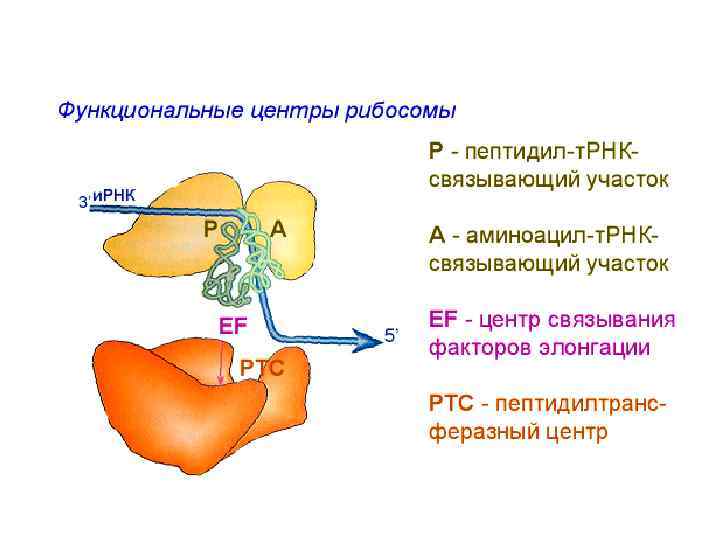
Функциональные центры рибосомы Р-центр - пептидильный, донорный. Он является донором формилметионина при инициации, или пептидила при элонгации трансляции. А-центр аминоацильный, акцепторный. Акцептирует формилметионин в самом начале или пептидил при элонгации трансляции. Центр связывания факторов элонгации К-центр каталитический (пептидилтрансферазный). В К-центре задействована 23 S р. РНК и несколько белков большой субъединицы.

Синтез полипептидов на рибосоме 3 этапа: 1) Инициация 2) Элонгация 3) Терминация
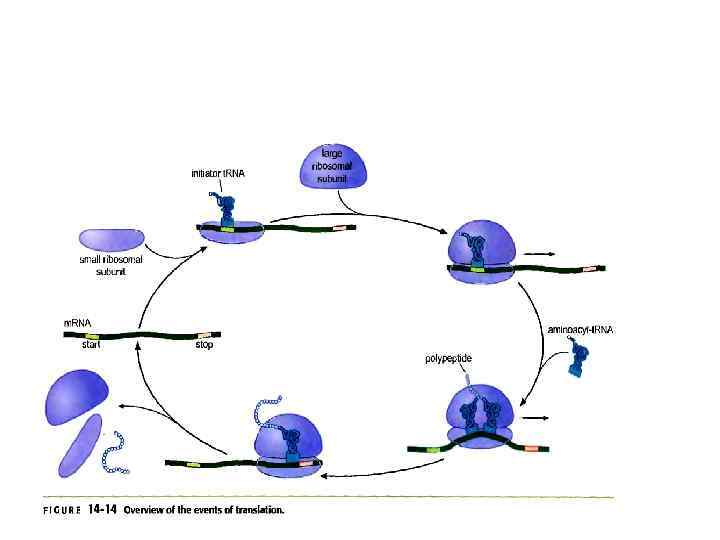

Трансляция у прокариот

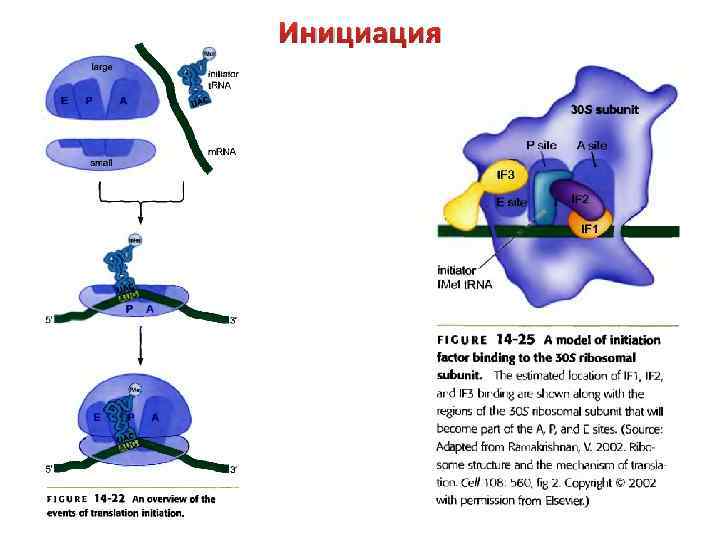
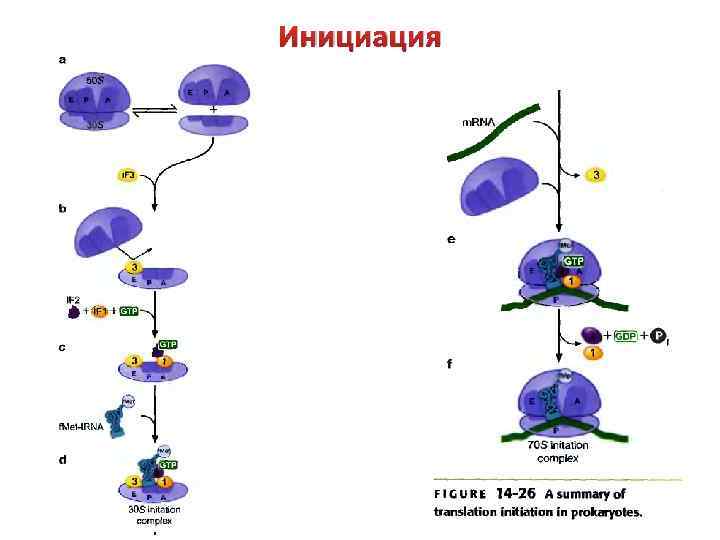
Инициация Происходит формирование инициационного комплекса, который включает участок м. РНК с сайтом связывания рибосом, малую субчастицу рибосомы, инициаторную т. РНК, три белковых фактора инициации (IF 1, IF 2, IF 3). В ходе этого процесса расходуется одна молекула GTP, которая взаимодействует с IF 2 и изменяет его конформацию. Стадии: 1) Свободная 30 S субчастица рибосомы объединяется с факторами инициации и GTP;
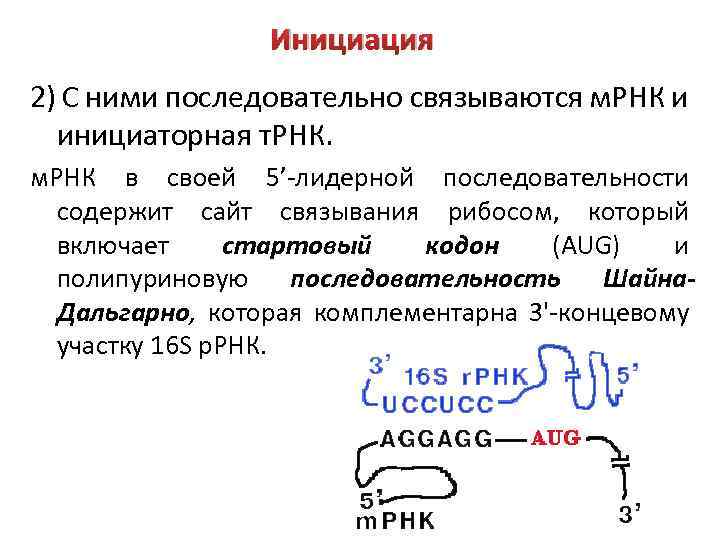
Инициация 2) С ними последовательно связываются м. РНК и инициаторная т. РНК. м. РНК в своей 5’-лидерной последовательности содержит сайт связывания рибосом, который включает стартовый кодон (AUG) и полипуриновую последовательность Шайна. Дальгарно, которая комплементарна 3'-концевому участку 16 S р. РНК.

Инициация Назначение комплементарного взаимодействия 3'концевого участка 16 S р. РНК и последовательности Шайна-Дальгарно - правильная установка инициирующего кодона AUG на малой субъединице рибосомы. 3) Инициаторная т. РНК взаимодействует со стартовым кодоном (AUG). У E. coli инициаторная т. РНК – это формилметионин-т. РНК. Спаривание инициаторной т. РНК и стартового кодона определяет рамку считывания трансляции. В результате формируется тройной стабильный инициационный комплекс.
Инициация

Инициация 4) Факторы инициации IF 1 и IF 3 покидают тройной комплекс, уступая место 50 S субчастице рибосомы. В результате малая и большая субчастицы рибосомы объединяются, это приводит к формированию двух центров связывания т. РНК: Рцентра и А-центра. Формилметионин-т. РНК вместе со стартовым кодоном размещается в Р-центре. А -центр свободен для присоединения следующей аминоацил-т. РНК. 5) Молекула GTP расщепляется до GDP и ортофосфата, фактор инициации IF 2 освобождается из комплекса. Инициационный комплекс готов для вступления в стадию элонгации.
Инициация
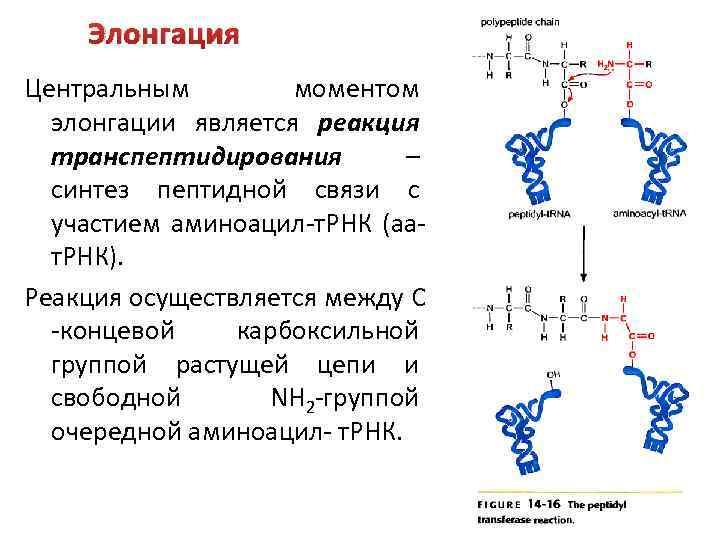
Элонгация Центральным моментом элонгации является реакция транспептидирования – синтез пептидной связи с участием аминоацил-т. РНК (аат. РНК). Реакция осуществляется между С -концевой карбоксильной группой растущей цепи и свободной NH 2 -группой очередной аминоацил- т. РНК.

Элонгация В элонгации принимают участие три белковых фактора: EF-Tu, EF-Ts и EF-G. Подразделяется на три стадии: 1) Фактор элонгации EF-Tu, молекула GTP и очередная аа-т. РНК взаимодействуют с Ацентром рибосомы. Вхождение аа-т. РНК в А-центр происходит в соответствии с установленным в ней кодоном м. РНК.
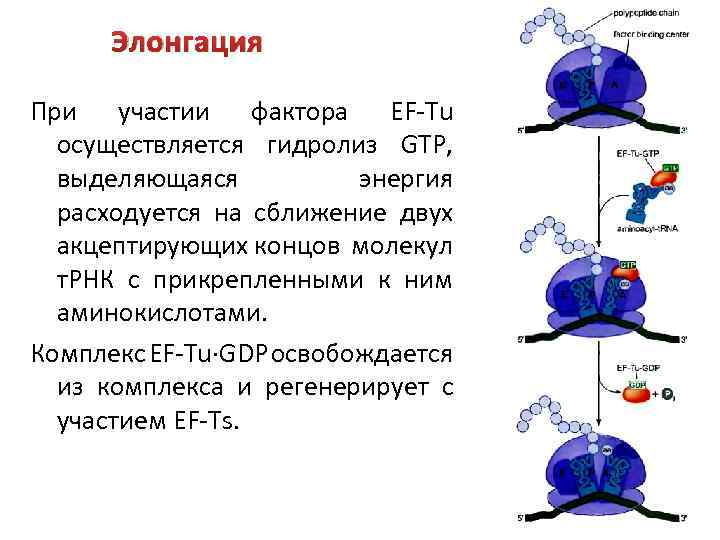
Элонгация При участии фактора EF-Tu осуществляется гидролиз GTP, выделяющаяся энергия расходуется на сближение двух акцептирующих концов молекул т. РНК с прикрепленными к ним аминокислотами. Комплекс EF-Tu·GDP освобождается из комплекса и регенерирует с участием EF-Ts.

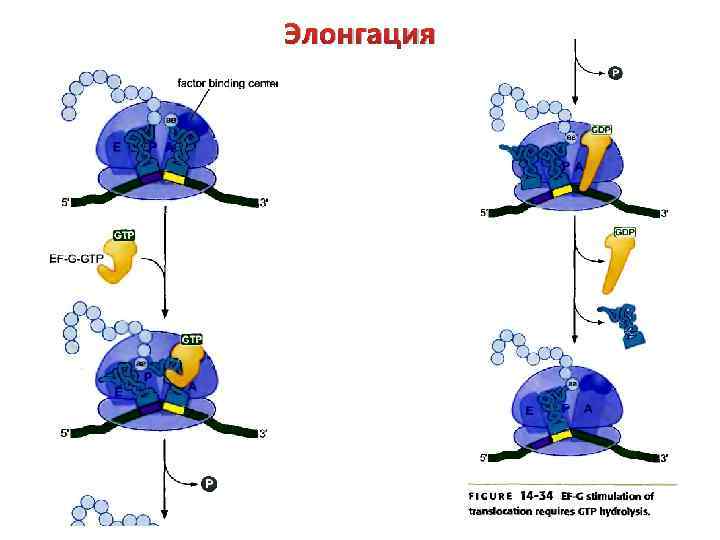
Элонгация 2) Стадия транспептидации. Первый аминокислотный остаток (формилметионин) переносится на свободную NH 2 -группу аа-т. РНК, расположенной в А-центре рибосомы. В результате этой реакции образуется первая пептидная связь и возникает пептидил-т. РНК. Она располагается в А-центре, а освободившаяся т. РНК временно сохраняется в Р-центре.

Элонгация 3) Стадия транслокации. Образовавшаяся пептидил-т. РНК перемещается из Ацентра в Р-центр (вместе с м. РНК). При этом освободившаяся формилметионин-т. РНК перемещается из Р-центра в Е-центр (exit). Одновременно с этим А-участок освобождается для связывания с очередной аа-т. РНК. Транслокацию можно рассматривать как «шаг» рибосомы по м. РНК в направлении 5’ → 3’. «Шаг» происходит строго на расстояние одного триплета. В результате напротив освободившегося А-центра располагается очередной кодон м. РНК.

Элонгация Транслокация индуцируется фактором EF-G, который освобождается из элонгирующего комплекса после гидролиза GTP. После этого все стадии элонгации повторяются. Таким образом, на любой стадии элонгации с рибосомой взаимодействуют две молекулы т. РНК: до транслокации т. РНК занимают А- и Рцентры, после транслокации – Р- и Е-центры. Между А- и Е-центрами существует аллостерическое взаимодействие.
Элонгация

Терминация Процесс трансляции вступает в завершающую фазу после того, как в А-центр рибосомы попадает терминирующий кодон м. РНК (нонсенс-кодоны). В распознавании этих кодонов принимают участие белковые факторы RF-1 и RF-2. RF-1 распознает кодоны UAG и UAA, RF-2 распознает кодоны UAA и UGA. Фактор RF-3 взаимодействует с А-центром рибосомы. После формирования такого комплекса происходит расщепление сложноэфирной связи между полипептидом и т. РНК, а также освобождение синтезированного полипептида.

Терминация Одновременно с освобождением полипептида от комплекса отделяется т. РНК и м. РНК, а сама рибосома диссоциирует на 30 S и 50 S субчастицы (под действием фактора IF-3). Диссоциацию комплекса обеспечивают все три RF совместно с фактором EF-G при участии молекулы GTP. Освободившиеся компоненты затем вступают в новый раунд белкового синтеза.
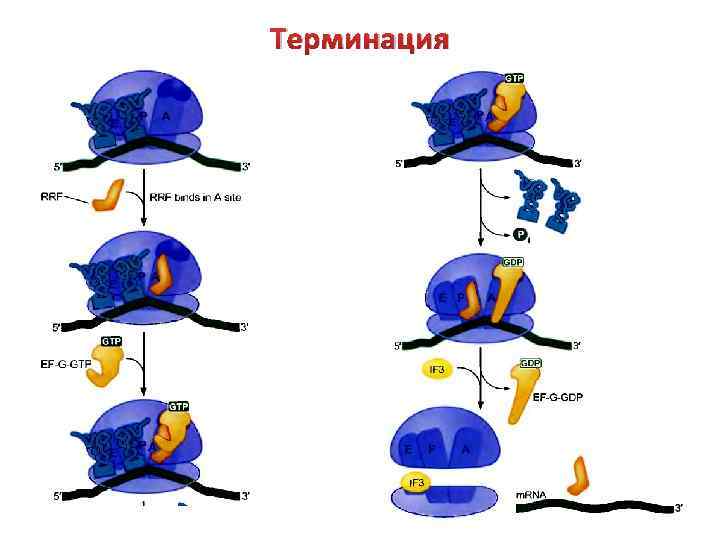
Терминация
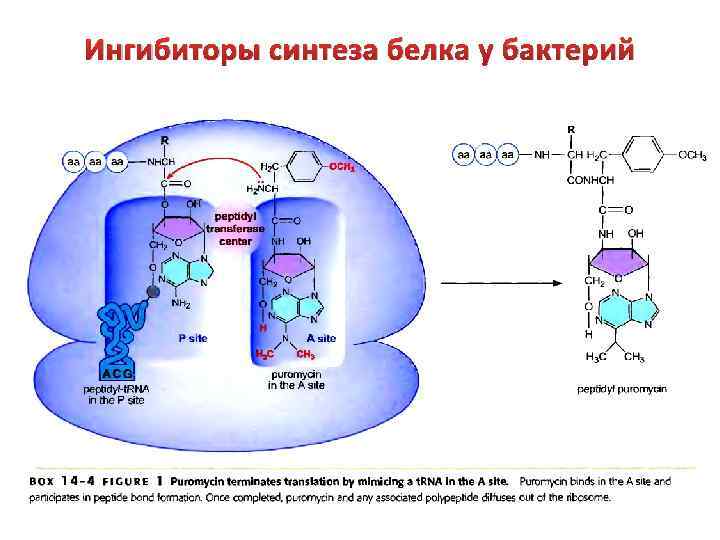
Ингибиторы синтеза белка у бактерий

Трансляция у эукариот

Инициация Зрелые м. РНК эукариот содержат «кэп» на 5’конце. Он необходим для связывания м. РНК с 40 S субчастицей рибосомы. У большинства м. РНК стартовым является кодон AUG, ближайший к 5’-концу. При этом за два нуклеотида до него должен располагаться пуриновый нуклеотид (А или G), а сразу после него – G: … NNN A(G) NN AUG G NNN… где N – пиримидиновый нуклеотид.

Инициация трансляции у эукариот связана с функционирование большого числа белковых факторов инициации (e. IF-факторы). 1) Собственно факторы инициации (e. IF 1 – e. IF 5) 2) Дополнительные факторы (e. IF-2 В, e. IF-S) Что делают? Факторы группы e. IF-4 (e. IF-4 А, e. IF-4 В, e. IF-4 Е, e. IF-4 F) участвуют в подготовке 5’-концевой области м. РНК к инициации трансляции (связываются с кэпом м. РНК, расплетают м. РНК) Факторы e. IF-1, e. IF-2, e. IF-3, e. IF-2 В, e. IF-S взаимодействуют с субчастицами рибосомы и облегчают присоединение инициаторной аат. РНК (метионин-т. РНК) и м. РНК.
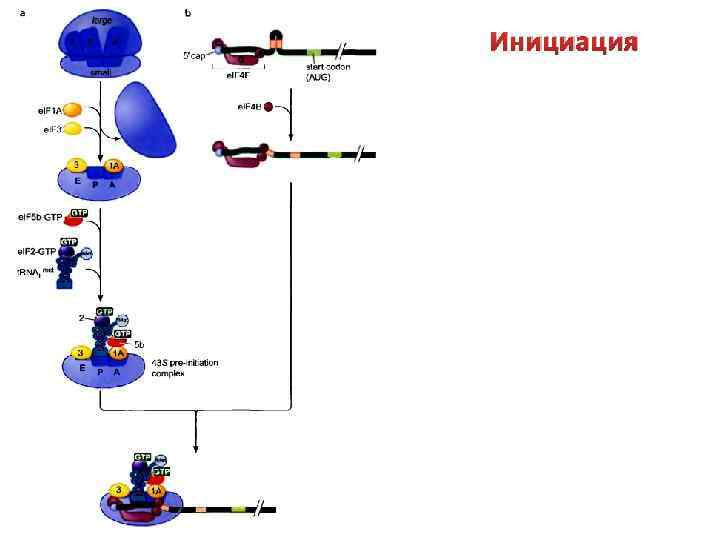
Инициация
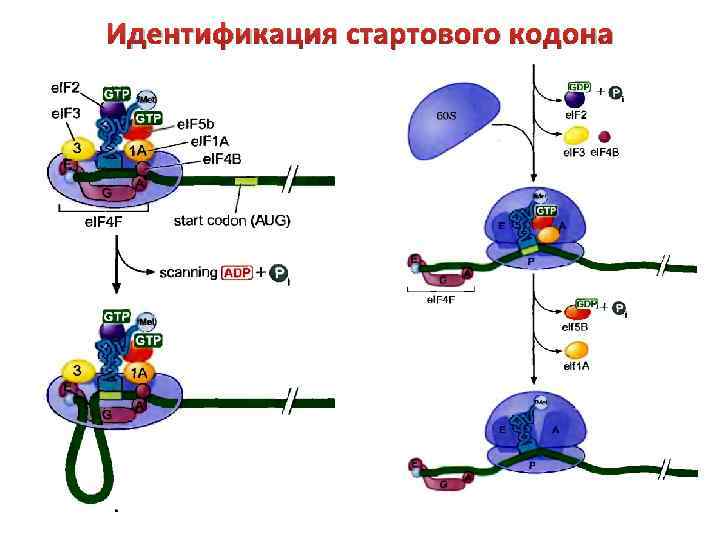
Идентификация стартового кодона

Элонгация В элонгации участвуют факторы элонгации e. IF-1 и e. IF-2 (аналоги e. IF-Tu и e. IF-G). Фактор e. IF-1 взаимодействует с аа-т. РНК и GTP; этот комплекс затем присоединяется к А-центру рибосомы. Факторы элонгации эукариот, в отличие от прокариотных, обладают выраженной РНКсвязывающей способностью.

Элонгация В терминации трансляции участвует один белковый фактор – R.
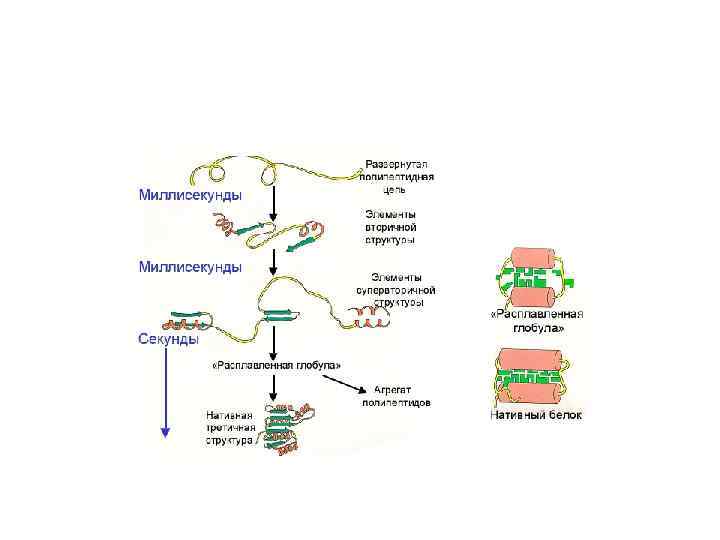
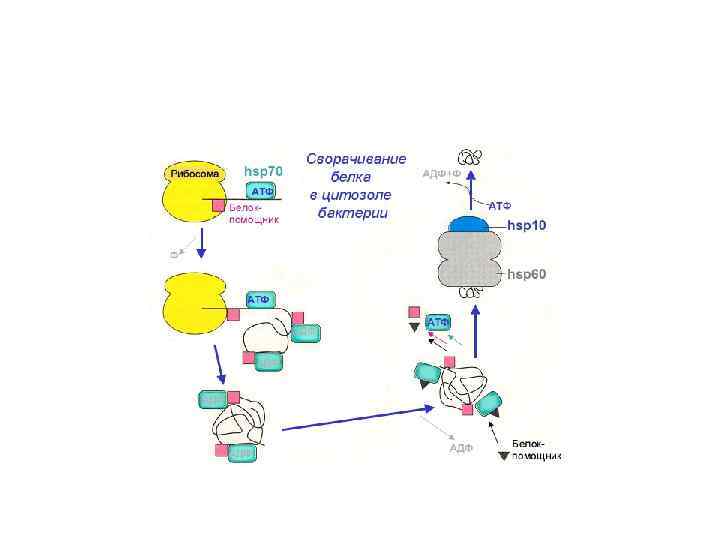
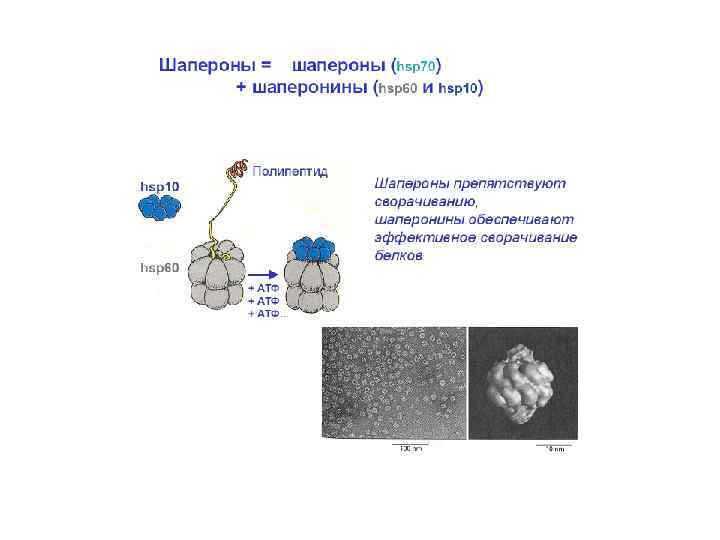

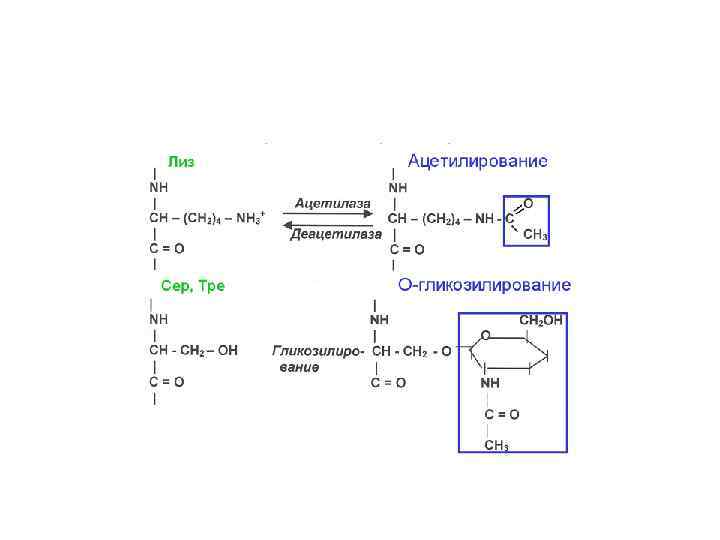

Трансляция.pptx