Биосинтез белка.ppt
- Количество слайдов: 36

БИОСИНТЕЗ БЕЛКА

Биосинтез белка (трансляция) – это процесс, в ходе которого информация о структуре белка, записанная в виде линейной последовательности нуклеотидов в молекуле зрелой м. РНК, «переводится на язык аминокислот» при участии т. РНК и рибосом. В результате образуется молекула белка со строго определенной первичной структурой.

В состав м. РНК входят 4 нуклеотида, а в состав белков – 20 аминокислот. Из этого следует, что должен существовать способ кодирования аминокислот последовательностью нескольких нуклеотидов. Способ кодирования, согласно которому в м. РНК зашифрована последовательность аминокислот в белке, получил название генетического (биологического или аминокислотного) кода.

СВОЙСТВА ГЕНЕТИЧЕСКОГО КОДА • триплетен: каждая аминокислота кодируется в молекуле ДНК или м. РНК тремя нуклеотидами – кодоном. Из 4 нуклеотидов, входящих в состав м. РНК, можно составить 64 триплета (43=64). Из них имеют смысл, т. е. шифруют включение в белок определенной аминокислоты, 61 триплет. Три остальных триплета – UAA, UAG, UGA – сигнализируют о завершении аминокислотной последовательности белка и выполняют функцию точки в записи информации. Их называют стоп-кодонами.
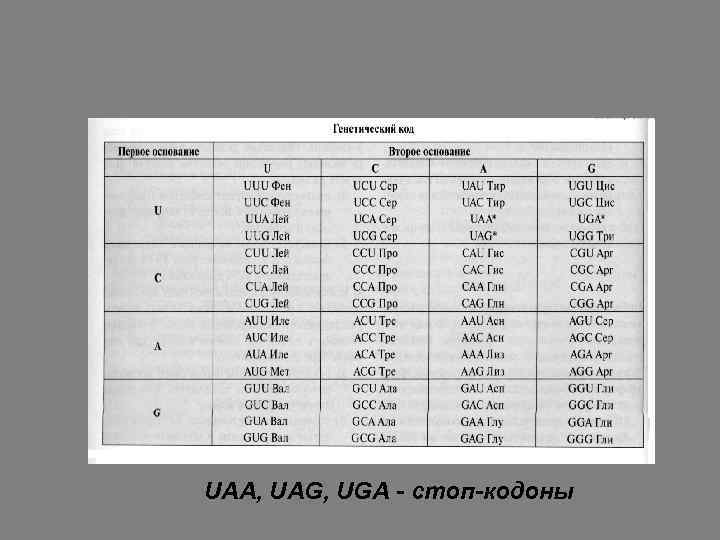
UAA, UAG, UGA - стоп-кодоны

СВОЙСТВА ГЕНЕТИЧЕСКОГО КОДА • однонаправлен: кодоны расположены линейно, не перекрываются и читаются в направлении от 5’ к 3’ концу. • специфичен: каждый кодон шифрует только одну определенную аминокислоту. • вырожден: большинство аминокислот закодировано в молекулах ДНК и м. РНК более чем одним кодоном. Исключение составляют 2 аминокислоты – метионин и триптофан, каждая из которых зашифрована только одним кодоном, а всем остальным аминокислотам соответствует 2 -6 кодонов.

СВОЙСТВА ГЕНЕТИЧЕСКОГО КОДА • универсален: смысл кодонов един почти для всех организмов на Земле. Исключением является м. РНК митохондрий, у которой 4 кодона имеют другой смысл. • комплементарен: последовательность кодонов в зрелой м. РНК соответствует последовательности аминокислот в белке, который синтезируется на этой матрице.

Декодирование информации о структуре белка, записанной в виде последовательности кодонов м. РНК, возможно благодаря т. РНК, выполняющим функции адапторов ( «приспособителей» аминокислот к кодонам м. РНК). В центре полинуклеотидной цепи этих молекул имеется антикодоновая петля, в которой находится триплет нуклеотидов – антикодон, способный связываться с кодоном м. РНК по принципу комплементарности и антипараллельности. На 3’конце молекулы все т. РНК имеют акцепторный триплет – ССА, к которому аминокислоты присоединяются α-карбоксильной группой.

Каждой аминокислоте соответствует своя т. РНК. В цитозоле связывание аминокислот с т. РНК катализируют ферменты аминоацил-т. РНКсинтетазы (аа-т. РНК-синтетазы), которые образуют сложноэфирную связь между αкарбоксильной группой аминокислоты и 3’гидроксильной – группой рибозы акцепторного триплета – ССА. В ходе реакции АТФ расщепляется на АМФ и пирофосфат, давая энергию на образование макроэргической связи между аминокислотой и т. РНК, поэтому образование аа-т. РНК можно рассматривать как реакцию активации аминокислот.

Аспарагил-т. РНК-синтетаза катализирует активацию аспартата

Образование полипептидных цепей белка требует участия большого числа компонентов, основными из которых являются: • аминокислоты – субстраты синтеза белка. • м. РНК – матрица, содержащая информацию о первичной структуре белка в виде линейной последовательности кодонов. • т. РНК – адапторы аминокислот к кодонам м. РНК. • аа-т. РНК-синтетазы, катализирующие связывание аминокислот с соответствующими т. РНК.

• рибосомы – субклеточные структуры, на которых происходит сборка аминокислот в полипептидные цепи. • АТФ и ГТФ – источники энергии. • Mg 2+ - кофактор, стабилизирующий структуру рибосом. • факторы инициации, элонгации, терминации – внерибосомные белки, облегчающие и ускоряющие процесс трансляции.

После образования аа-т. РНК дальнейшие события по сборке аминокислот в полипептидные цепи белка происходят на рибосомах и включают инициацию, элонгацию и терминацию. Инициация начинается с присоединения к зрелой м. РНК малой субъединицы рибосомы 40 S, инициирующей аа-т. РНК (у эукариотов это всегда Мет-т. РНКмет), факторов инициации и молекулы ГТФ. При связывании антикодона Мет-т. РНКмет с кодоном AUG к образовавшемуся комплексу с затратой энергии ГТФ присоединяется субъединица 60 S рибосомы, а факторы инициации удаляются.

Формируется полная 80 S рибосома с двумя активными центрами: Р-центром (пептидильным), с которым оказывается связанной Мет-т. РНКмет, и А-центром (аминоацильным), в область которого попадает первый смысловой кодон м. РНК.
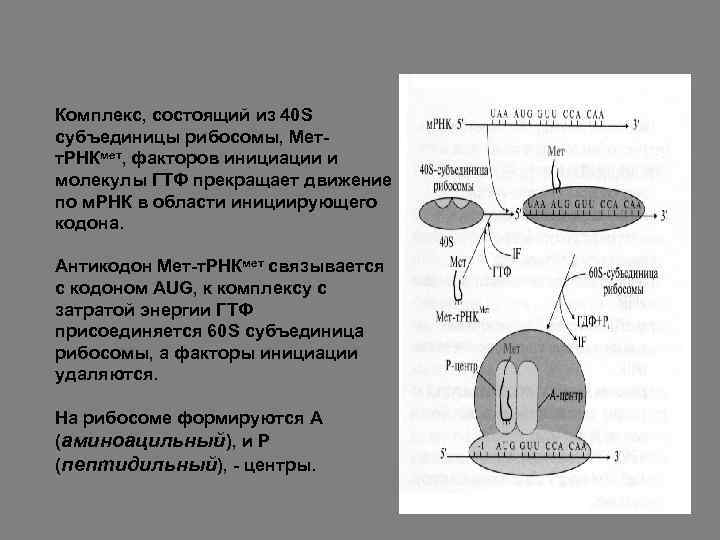
Комплекс, состоящий из 40 S субъединицы рибосомы, Метт. РНКмет, факторов инициации и молекулы ГТФ прекращает движение по м. РНК в области инициирующего кодона. Антикодон Мет-т. РНКмет связывается с кодоном AUG, к комплексу с затратой энергии ГТФ присоединяется 60 S субъединица рибосомы, а факторы инициации удаляются. На рибосоме формируются А (аминоацильный), и Р (пептидильный), - центры.

Элонгация включает 3 последовательные стадии • связывание аа-т. РНК в А-центре. В свободный А-центр присоединяется аа-т. РНК, у которой антикодон комплементарен кодону м. РНК, находящемуся в области этого центра. Для того чтобы это событие стало возможным, требуются затрата энергии ГТФ и участие фактора элонгации EF 1.

• образование пептидной связи. Между α-NH 2 -группой аминокислоты, находящейся в Ацентре в составе аа-т. РНК, и карбоксильной группой метионина или другой аминокислоты, входящей в растущую полипептидную цепь и присоединенной к т. РНК Р-центра, возникает пептидная связь. Катализирует эту реакцию пептидилтрансфераза. Продуктом реакции становится удлиненная на одну аминокислоту пептидил-т. РНК в А-центре рибосомы.

• перемещение рибосомы по м. РНК (транслокация). Рибосома перемещается по м. РНК на один кодон в направлении от 5’-и 3’концу с использованием энергии ГТФ и при участии фактора элонгации EF 2. В результате передвижения рибосомы пептидилт. РНК (Мет-т. РНКмет) из А-центра попадает в Р-центр, а в А-центре оказывается следующий кодон м. РНК. т. РНК, которая передала Мет (или растущий пептид) на аминокислоту аа-т. РНК (Вал-т. РНКвал) на этом этапе теряет связь с Р-центром и уходит в цитозоль клетки.

1. связывание аа-т. РНК (аа-т. РНК Вал-т. РНКвал) в А-центре требует затраты энергии ГТФ и участия фактора элонгации EF 1 2. образование пептидной связи катализирует пептидилтрансфераза, Активный центр которой формируется р. РНК, входящей в состав большой субъединицы рибосомы 3. перемещение рибосомы по м. РНК на один кодон в направлении от 5’-и 3’концу идет с использованием энергии ГТФ (транслокация)

связывание аа-т. РНК (Вал-т. РНКвал ) в А-центре образование пептидной связи перемещение рибосомы по м. РНК

Терминация наступает, когда в А-центр рибосомы попадает один из стоп-кодонов м. РНК - UAA, UAG, UGA. В нем участвуют белковые факторы терминации RF 1, RF 3, которые узнают эти кодоны и высвобождают вновь синтезированный пептид из связи с т. РНК, субъединицами рибосомы и м. РНК. Этот этап энергозависим и сопровождается гидролизом ГТФ. По мере продвижения рибосомы по м. РНК к 3’ концу молекулы 5’ конец высвобождается и к нему могут присоединяться новые рибосомы. Как правило, одновременно несколько рибосом могут синтезировать полипептидные цепи на одной и той же м. РНК.

Комплекс м. РНК с несколькими работающими рибосомами образует полирибосому. В виде частиц, плавающих в цитоплазме клеток. Такие свободные полирибосомные образования ответственны за синтез внутриклеточных белков В форме, связанной с ЭПР и обеспечивающей синтез белков на экспорт. При попадании в А-центр стоп-кодона вновь синтезированный пептид высвобождается из связи с т. РНК и рибосомой с участием факторов терминации и энергии ГТФ.

Посттрансляционные модификации белков Полипептиды, являющиеся продуктом трансляции, не всегда функционально активны и требуют дополнительных посттрансляционных преобразований. • Фолдинг молекул. Так, еще в процессе синтеза полипептидных цепей на рибосоме при участии шаперонов происходит образование вторичной, третичной структуры белков и формирование более выгодной пространственной конформации.
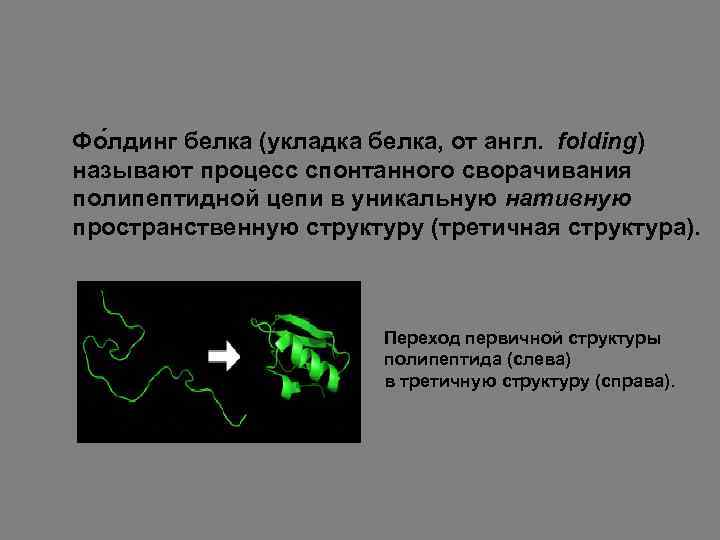
Фо лдинг белка (укладка белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (третичная структура). Переход первичной структуры полипептида (слева) в третичную структуру (справа).

Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности м. РНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры. Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность, гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается определённая трёхмерная структура. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.

• Образование дисульфидных связей – между остатками цистепина имеет важное значение для формирования нативной структуры белков (инсулина, иммуноглобулинов и рибонуклеазы). • Частичный протеолиз сопровождает синтез всех белков на экспорт, равно как и некоторых внутриклеточных белков, в результате молекулы укорачиваются и меняют конформацию. • Присоединение простетической группы происходит при образовании сложных белков. • Сборка протомеров в олигомерные белки обеспечивает формирование четвертичной структуры.

Модификация аминокислотных остатков свойственна многим белкам. • Фосфорилирование гидроксильных групп в остатках серина, треонина и тирозина изменяет функциональную активность многих регуляторных белков. • Гидроксилирование остатков пролина и лизина в молекуле коллагена необходимо для формирования фибрилл. • Карбоксилирование глутамина в факторах свертывания крови и белках костной ткани. • Метилирование аргигина и лизина в молекулах гистонов. • Йодирование тирозина в белке щитовидной железы.

Остановка любого из матричных синтезов опасна для клеток и может вызвать их гибель. В настоящее время описана довольно большая группа разных по структуре соединений, которые являются ингибиторами этих процессов. Наиболее широко используются антибиотики, образующиеся в процессе жизнедеятельности микроорганизмов и способные оказывать избирательное токсическое действие на синтез ДНК, РНК и белка.


РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКОВ У ЭУКАРИОТ В организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям, хотя количество и структура ДНК в них практически одинаковы. Разный набор и количество белков в дифференцированных клетках разных типов возникает благодаря существованию: 1. механизмов, которые сохраняют стабильную репрессию транскрипции одних генов и чтение (экспрессию) других на протяжении всей жизни клетки и даже многих ее регенераций, причем в разных тканях стабильной репрессии подвергаются разные гены. 2. адаптивной регуляции, обеспечивающей приспособление организма к меняющимся условиям внутренней и внешней среды.

На определенных стадиях дифференцировки от гамет до взрослого состояния все гены молекулы ДНК в разные периоды времени и в определенной последовательности экспрессируются. Однако в ядрах дифференцированных клеток хроматин приобретает такую укладку, что остается небольшое число генов способных транскрибироваться. Различают гетерохроматин, в котором ДНК не доступна для транскрипции и эухроматин, имеющий более рыхлую укладку и способный связывать РНКполимеразу. В области эухроматина на ДНК расположены транскрибируемые гены.
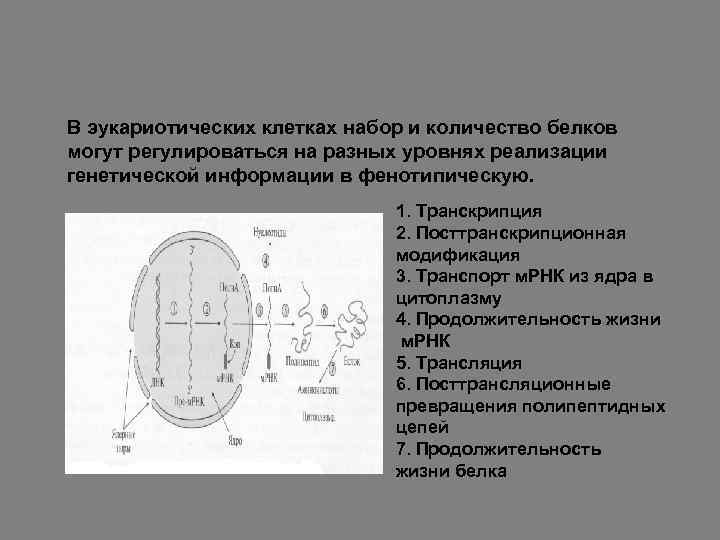
В эукариотических клетках набор и количество белков могут регулироваться на разных уровнях реализации генетической информации в фенотипическую. 1. Транскрипция 2. Посттранскрипционная модификация 3. Транспорт м. РНК из ядра в цитоплазму 4. Продолжительность жизни м. РНК 5. Трансляция 6. Посттрансляционные превращения полипептидных цепей 7. Продолжительность жизни белка

Важнейшим этапом, определяющим набор и количество белков в клетке, является транскрипция. У эукариот большинство транскрибируемых генов кодируют белки, которые обеспечивают жизнеспособность клеток. Такие гены участвуют в биологическом окислении, синтезе АТФ, построении мембран и нуклеиновых кислот. На ДНК имеются короткие специфические последовательности, которые обеспечивают регуляцию экспрессии генов, именно к ним и присоединяются регуляторные белки.
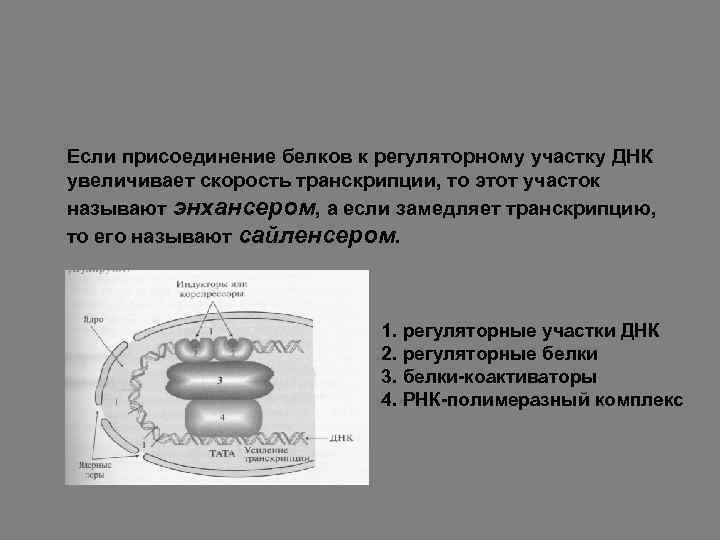
Если присоединение белков к регуляторному участку ДНК увеличивает скорость транскрипции, то этот участок называют энхансером, а если замедляет транскрипцию, то его называют сайленсером. 1. регуляторные участки ДНК 2. регуляторные белки 3. белки-коактиваторы 4. РНК-полимеразный комплекс

Индукторами или корепрессорами, стимулирующими присоединение регуляторных белков к ДНК, могут быть гормоны, ионы металлов, субстраты или продукты метаболических путей. У белков-регуляторов имеется 3 важнейших участка: • Участок, по которому белки взаимодействуют с энхансерами или сайленсерами • Участок, к которому присоединяются индукторы или корепрессоры • Участок, взаимодействующий с белкамипосредниками или транскрипционными факторами и изменяющий сродство промотора к РНК-полимеразе

Пример: стероидные гормоны кортизол, альдостерон легко проходят плазматическую мембрану и в цитозоле клеток-мишеней присоединяются к белку-рецептору. Образуется комплекс, который проходит ядерную мембрану и связывается с регуляторным участком определенного гена. При присоединении к энхансеру, изменение конформаци ДНК вызывает индукцию транскрипции.
Биосинтез белка.ppt