Биополимеры.ppt
- Количество слайдов: 48
Биополимеры 1

Основу жизни составляют биополимеры • длинные цепи, состоящие из структурных звеньев • чрезвычайно большое многообразие структур: 20 видов аминокислот могут образовать 1012 молекул белков, 5 видов нуклеотидов – до 1010 разновидностей нуклеиновых кислот • обеспечивают проявление важнейших функций живого • обеспечивают многообразие жизни 2
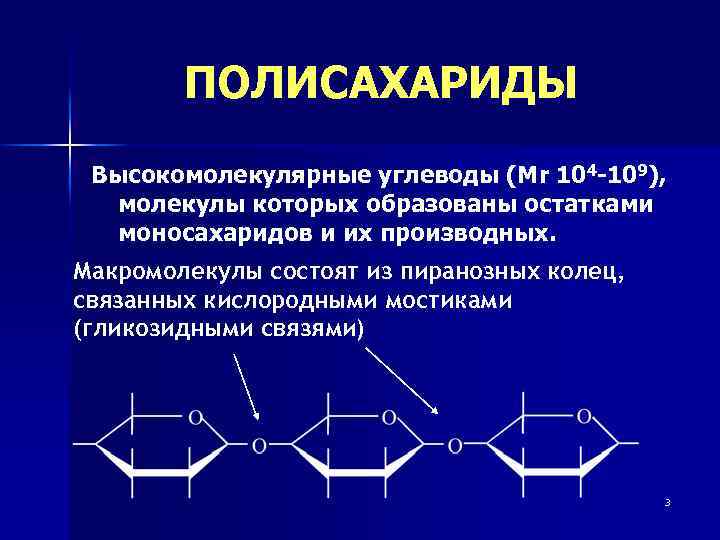
ПОЛИСАХАРИДЫ Высокомолекулярные углеводы (Мr 104 -109), молекулы которых образованы остатками моносахаридов и их производных. Макромолекулы состоят из пиранозных колец, связанных кислородными мостиками (гликозидными связями) 3
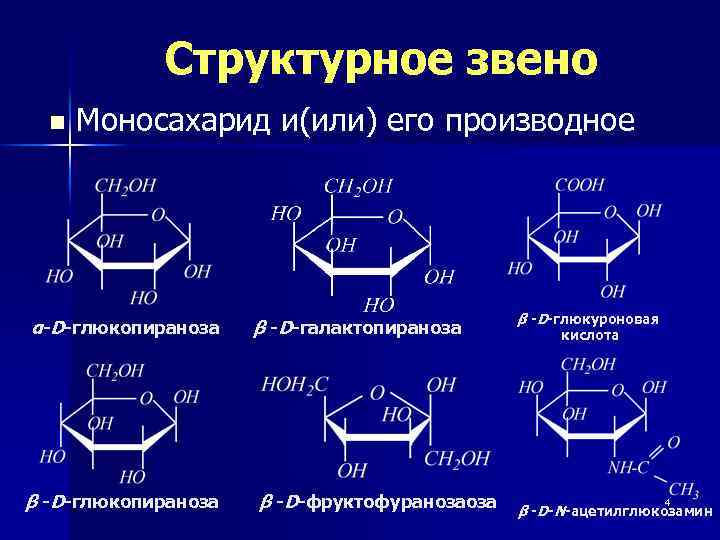
Структурное звено n Моносахарид и(или) его производное α-D-глюкопираноза β -D-галактопираноза β -D-фруктофуранозаоза β -D-глюкуроновая кислота 4 β -D-N-ацетилглюкозамин

Связи в цепи n Гликозидные связи (кислородные мостики, образованные ОН-группами моносахаридов) …-ОН + НО-…. Виды гликозидных связей: А) в цепи - Н 2 О α(1→ 4) Б) в местах ответвлений …-О-… β(1→ 4) β(1→ 3) β(2→ 1) α(1→ 6) 5

Классификация полисахаридов Растительные полисахариды (крахмал, целлюлоза, инулин, пектины, гемицеллюлозы и др. ) n Животные полисахариды (гликоген, хитин, гиалуроновая кислота, гепарин и др. ) n Микробные полисахариды (муреин, декстраны и др. ) n 6

Классификация полисахаридов Гомополисахариды (крахмал, гликоген, целлюлоза, хитин, инулин и др. ) n Гетерополисахариды (пектины, гиалуроновая кислота, хондроитин, гепарин, муреин и др. ) n 7

Классификация полисахаридов Линейные полисахариды (амилоза, целлюлоза, хитин, гиалуроновая кислота и др. ) n Разветвлённые полисахариды (амилопектин, гликоген, декстраны и др. ) n 8
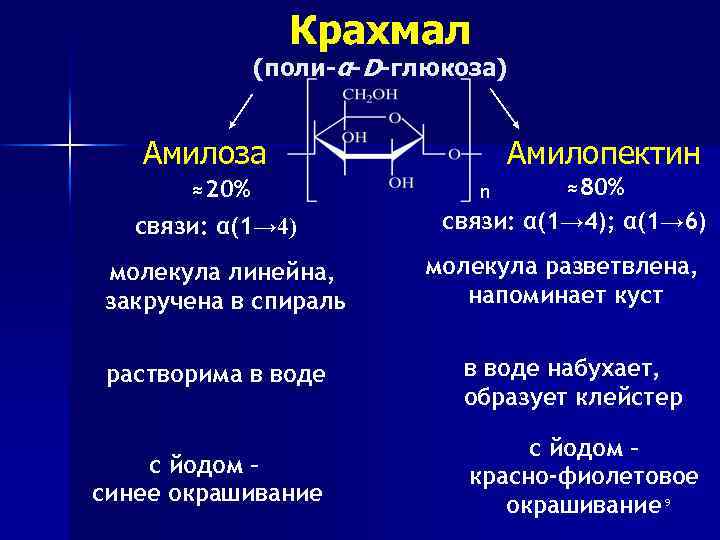
Крахмал (поли-α-D-глюкоза) Амилоза ≈20% связи: α(1→ 4) молекула линейна, закручена в спираль растворима в воде с йодом – синее окрашивание Амилопектин ≈80% связи: α(1→ 4); α(1→ 6) n молекула разветвлена, напоминает куст в воде набухает, образует клейстер с йодом – красно-фиолетовое окрашивание 9

Целлюлоза (поли-β-D-глюкоза) связи: β(1→ 4) n молекула линейна, не спирализована молекулы связаны друг с другом в мицеллы, фибриллы, волокна в воде не растворяется 10
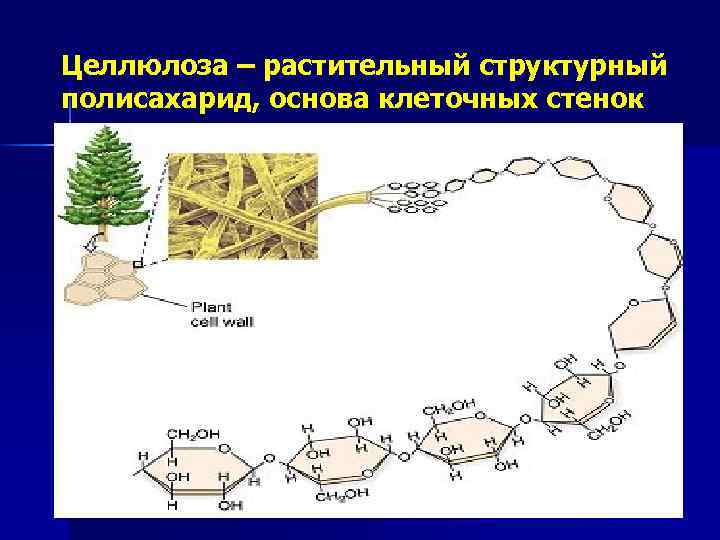
Целлюлоза – растительный структурный полисахарид, основа клеточных стенок 11

Производные целлюлозы: Нитроцеллюлоза (взрывчатое вещество) n Ацетат целлюлозы (ацетатный шёлк) n Вискоза n 12
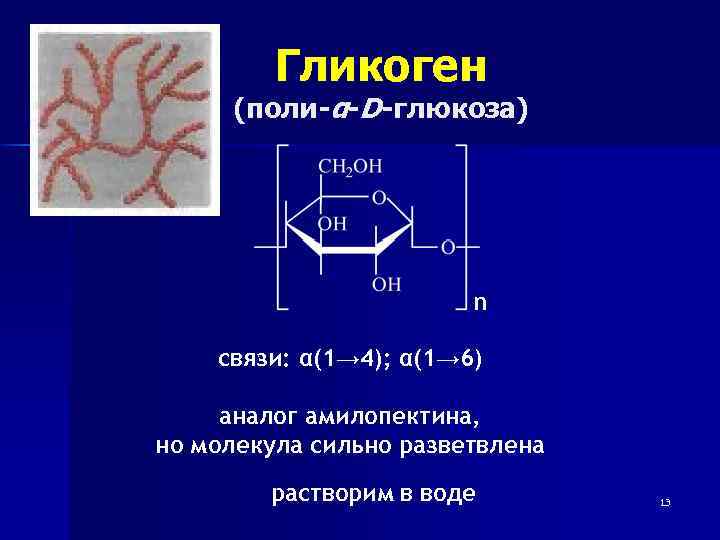
Гликоген (поли-α-D-глюкоза) n связи: α(1→ 4); α(1→ 6) аналог амилопектина, но молекула сильно разветвлена растворим в воде 13
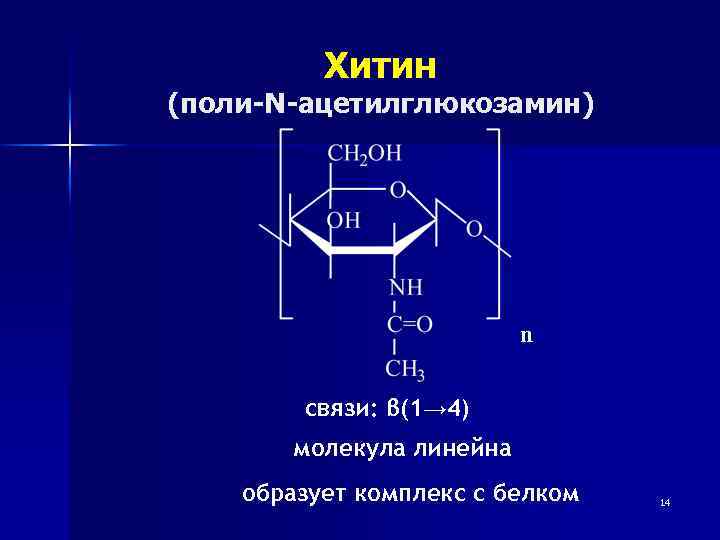
Хитин (поли-N-ацетилглюкозамин) n связи: β(1→ 4) молекула линейна образует комплекс с белком 14
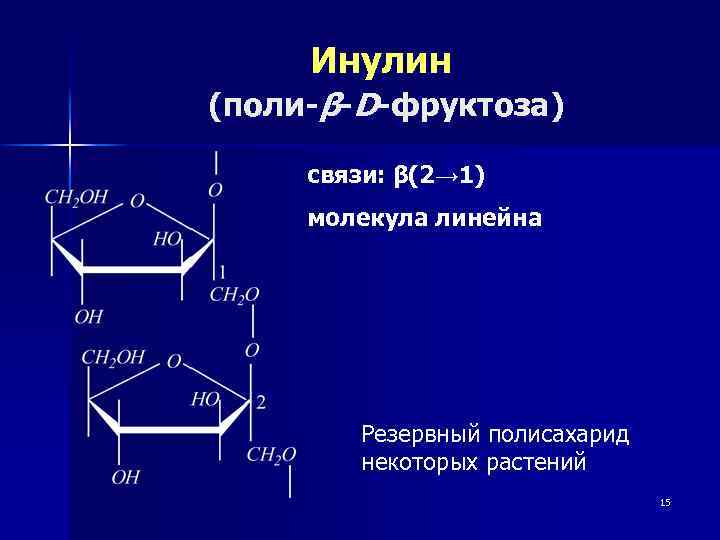
Инулин (поли-β-D-фруктоза) связи: β(2→ 1) молекула линейна Резервный полисахарид некоторых растений 15
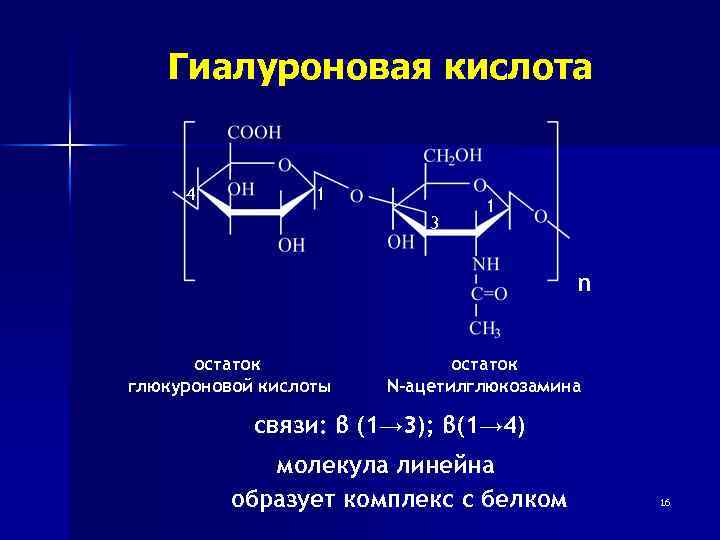
Гиалуроновая кислота 4 1 3 1 n остаток глюкуроновой кислоты остаток N-ацетилглюкозамина связи: β (1→ 3); β(1→ 4) молекула линейна образует комплекс с белком 16

БЕЛКИ Белки – русский аналог слова Альбумин (Albus белый). Протеин (prwtoς - первый) – синоним слова белок. Означает также простой белок в отличие от протеида – белка содержащего небелковую часть (гемоглобин). Полипептиды – биополимеры, молекулы которых построены из остатков аминокислот, связанных пептидными связями 17

Белки – один из основных классов биологических макромолекул, при гидролизе разлагающихся на аминокислоты. n Белки – это полипептиды, способные самопроизвольно формировать и удерживать определённую пространственную структуру. Пространственная структура белка – это основа его функциональности. n 18
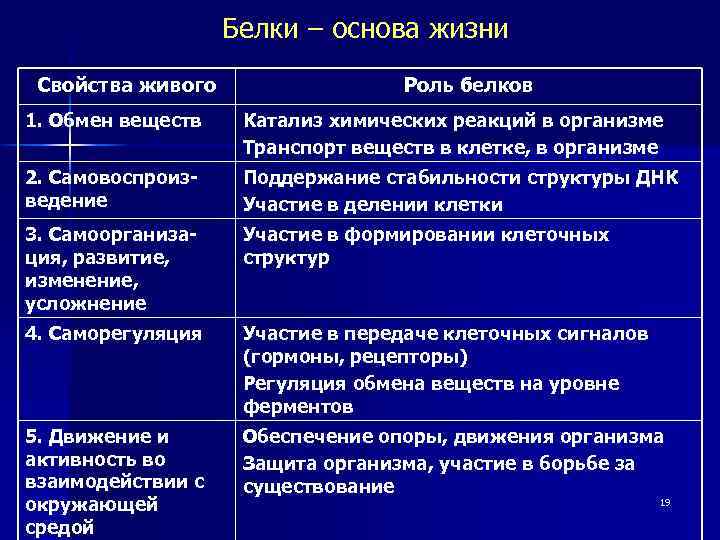
Белки – основа жизни Свойства живого Роль белков 1. Обмен веществ Катализ химических реакций в организме Транспорт веществ в клетке, в организме 2. Самовоспроизведение Поддержание стабильности структуры ДНК Участие в делении клетки 3. Самоорганизация, развитие, изменение, усложнение Участие в формировании клеточных структур 4. Саморегуляция Участие в передаче клеточных сигналов (гормоны, рецепторы) Регуляция обмена веществ на уровне ферментов 5. Движение и активность во взаимодействии с окружающей средой Обеспечение опоры, движения организма Защита организма, участие в борьбе за существование 19

Структурное звено na -аминокислоты в L-форме (20 видов). Молекулы протеиногенных аминокислот имеют единый план строения: у одного и того же атома углерода (a – углеродного атома) находится карбоксильная (кислотная функциональная группа), и аминогруппа (основная функциональная группа) 20

Классификация протеиногенных аминокислот (по природе радикала) n n Глицин (гли) не входит ни в одну из групп – нейтральная аминокислота. Неполярные аминокислоты: – – n Алифатические (ала, вал, лей, иле, про) Ароматические (фен, тир, трп) Полярные аминокислоты: – – – Ионогенные положительно-заряженные (арг, лиз, гис) Ионогенные отрицательно-заряженные (асп, глу) Амиды (асн, глн) Содержащие ОН-группу (сер, тре) S-содержащие аминокислоты (цис, мет) 21
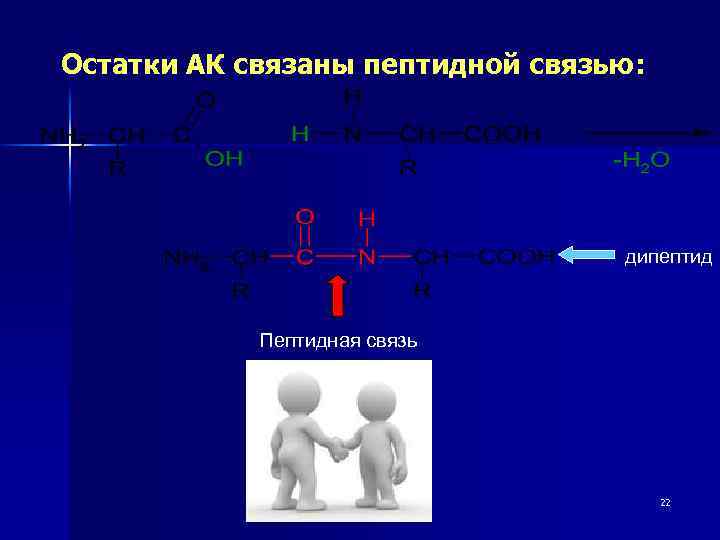
Остатки АК связаны пептидной связью: дипептид Пептидная связь 22
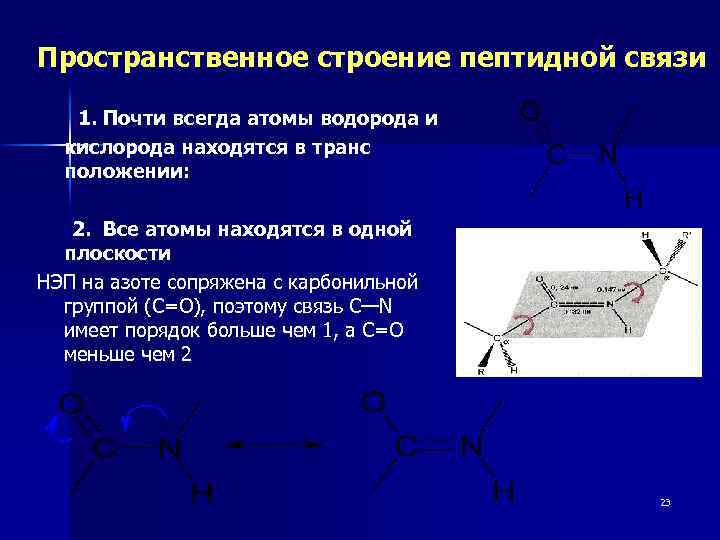
Пространственное строение пептидной связи 1. Почти всегда атомы водорода и кислорода находятся в транс положении: 2. Все атомы находятся в одной плоскости НЭП на азоте сопряжена с карбонильной группой (С=О), поэтому связь C—N имеет порядок больше чем 1, а С=О меньше чем 2 23

Полипептидные цепи Аминокислоты связываются в цепочки за счёт a – амино- и a –карбоксильных групп. В результате цепи имеют единый план строения: пептидные связи (-СО-NH-) перемежаются с aуглеродными атомами, с которыми связаны аминокислотные радикалы. На одном конце цепи остаётся свободная a –аминогруппа (начало цепи), на другом конце - свободная a – карбоксильная группа (окончание цепи). 24
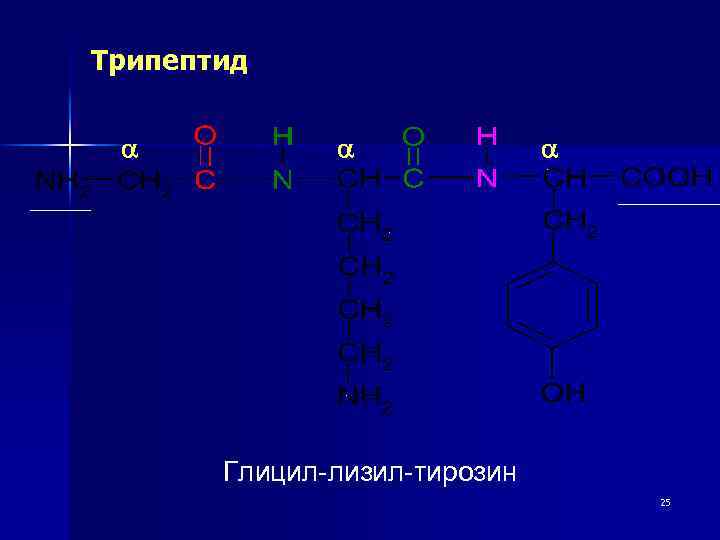
Трипептид a a a Глицил-лизил-тирозин 25

n Полипептидная цепь (первичная структура белков) – это последовательность аминокислотных остатков в молекуле белка или пептида. NH 2 -Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH Первичная структура определяет все остальные уровни структурной организации белка. Это самая прочная из структур, поддерживается ковалентными связями – пептидными (амидными). Её можно разрушить только химическим способом – гидролизом. 26

Первичная структура белка инсулина Две цепи: 20 АК + 31 АК, связанные 2 -мя дисульфидными мостиками 27
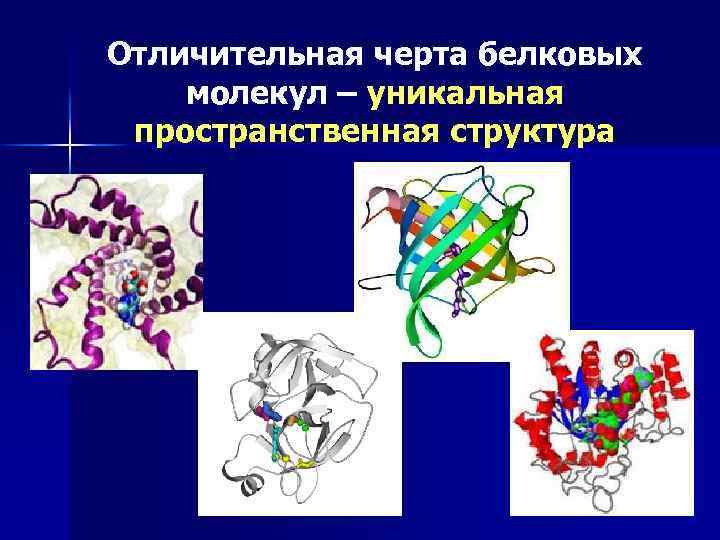
Отличительная черта белковых молекул – уникальная пространственная структура 28

Благодаря пространственной структуре макромолекулы компактно уложены инсулин гемоглобин гормон роста 29

Сложные белки Холопротеин n n n Апопротеин + Простетическая группа Хромопротеины (гемоглобин, миоглобин, цитохромы, родопсин, каталаза и др. ) Гликопротеины Липопротеины Фосфопротеины (казеин молока, овальбумин куриного яйца) Металлопротеины (ферритин) Нуклеопротеины (вирус табачной мозаики) 30

Нуклеиновые кислоты – молекулярная основа хранения и передачи наследственной информации Нуклеиновые кислоты – полимеры, молекулы которых состоят из мономеров – нуклеотидов, связанных фосфодиэфирными связями 31

Структурное звено – Нуклеотид, образованный моносахаридом, азотистым основанием и остатком фосфорной кислоты Нуклеиновые кислоты ДНК Аденин, гуанин, цитозин, тимин дезоксирибоза Фосфат РНК Аденин, гуанин, цитозин, урацил рибоза фосфат 32
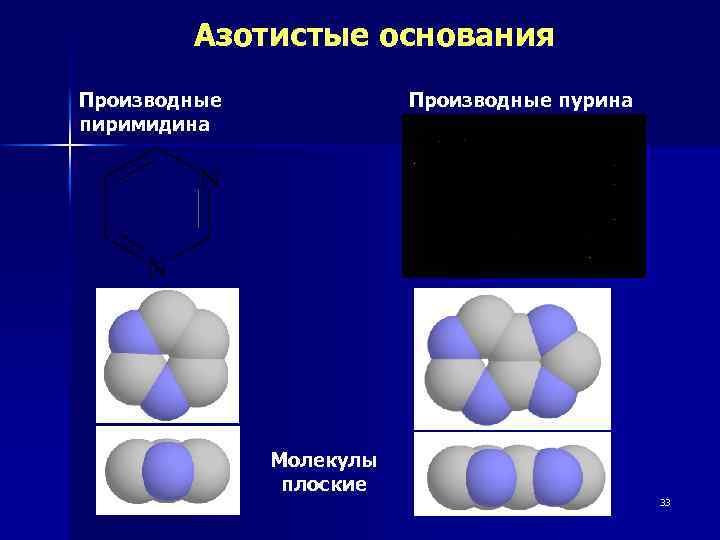
Азотистые основания Производные пиримидина Производные пурина Молекулы плоские 33

Пиримидиновые основания Цитозин Cyt (4 -амино-2 оксопиримидин) Урацил Ura (2, 4 -диоксопиримидин) Тимин Thy (5 -метил-2, 4 диоксопиримидин, 34 5 -метилурацил)
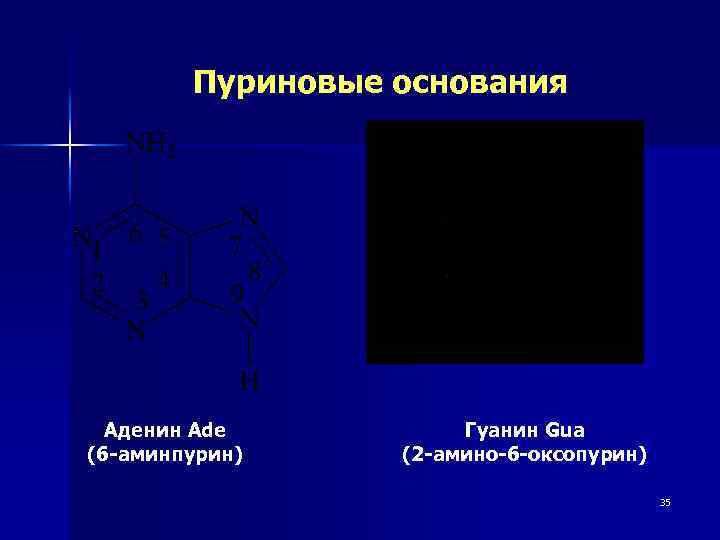
Пуриновые основания Аденин Ade (6 -аминпурин) Гуанин Gua (2 -амино-6 -оксопурин) 35
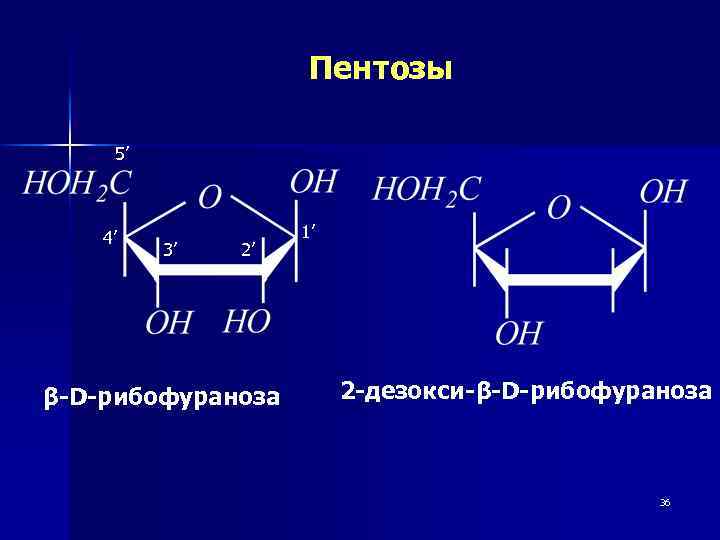
Пентозы 5’ 4’ 3’ 2’ β-D-рибофураноза 1’ 2 -дезокси-β-D-рибофураноза 36
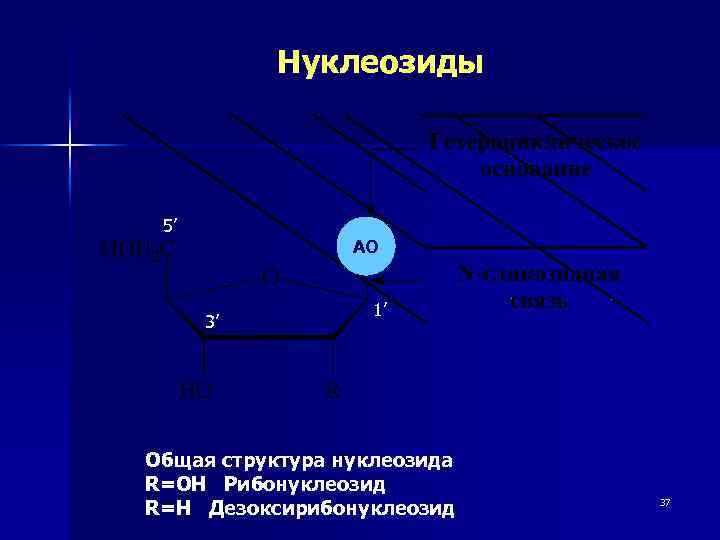
Нуклеозиды 5’ АО 3’ 1’ Общая структура нуклеозида R=OH Рибонуклеозид R=H Дезоксирибонуклеозид 37
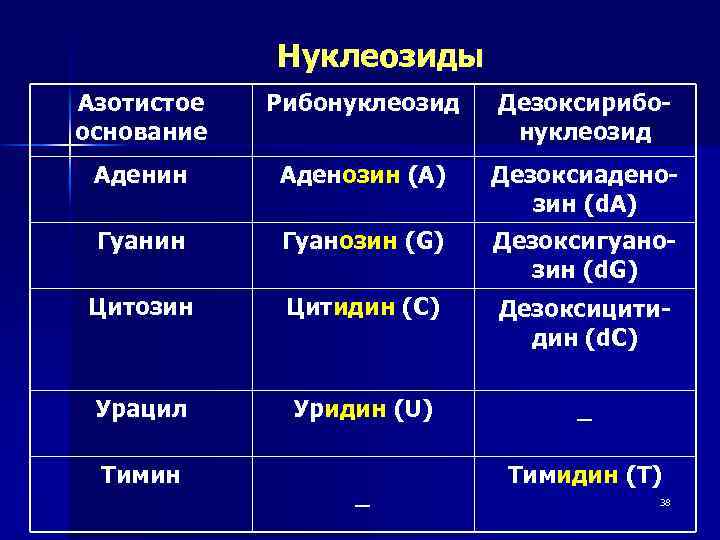
Нуклеозиды Азотистое основание Рибонуклеозид Дезоксирибонуклеозид Аденин Аденозин (А) Дезоксиаденозин (d. A) Гуанин Гуанозин (G) Дезоксигуанозин (d. G) Цитозин Цитидин (С) Дезоксицитидин (d. С) Урацил Уридин (U) _ Тимин _ Тимидин (T) 38

Нуклеозиды, входящие в состав РНК 1 1 39

Нуклеозиды, входящие в состав РНК 9 9 40

Нуклеозиды, входящие в состав ДНК 1 1 (T) 41

Нуклеозиды, входящие в состав ДНК 9 9 42
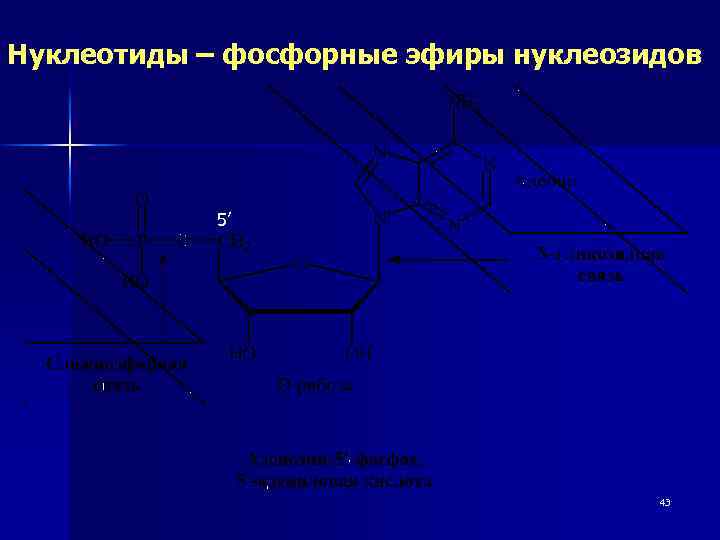
Нуклеотиды – фосфорные эфиры нуклеозидов 5’ 43

Нуклеотиды – фосфорные эфиры нуклеозидов 44
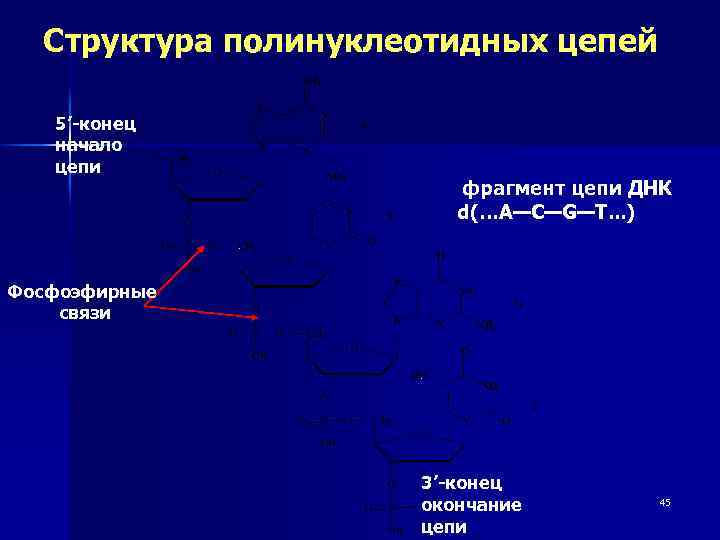
Структура полинуклеотидных цепей 5’-конец начало цепи фрагмент цепи ДНК d(…A—С—G—Т. . . ) Фосфоэфирные связи 3’-конец окончание цепи 45
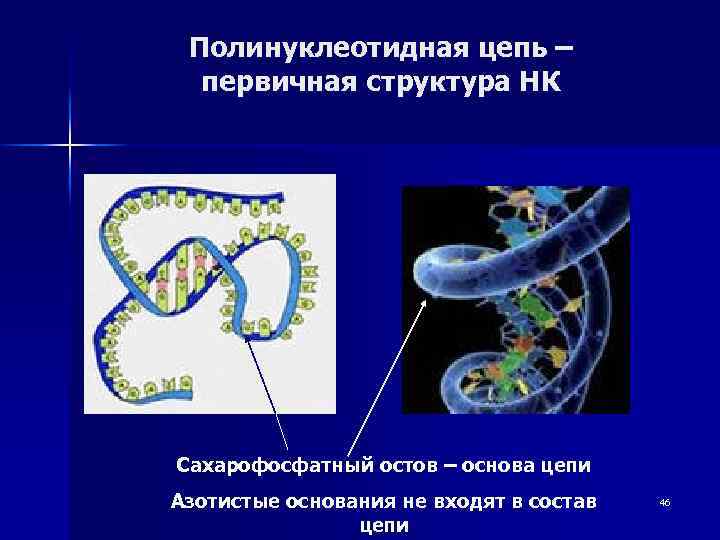
Полинуклеотидная цепь – первичная структура НК Сахарофосфатный остов – основа цепи Азотистые основания не входят в состав цепи 46

Вторичная структура ДНК 1953 г. Джеймс Уотсон и Френсис Крик (М. Уилкинс, Э. Чаргафф, А. Тодд, Л. Полинг) 1962 г. - Нобелевская премия по физиологии и медицине 47
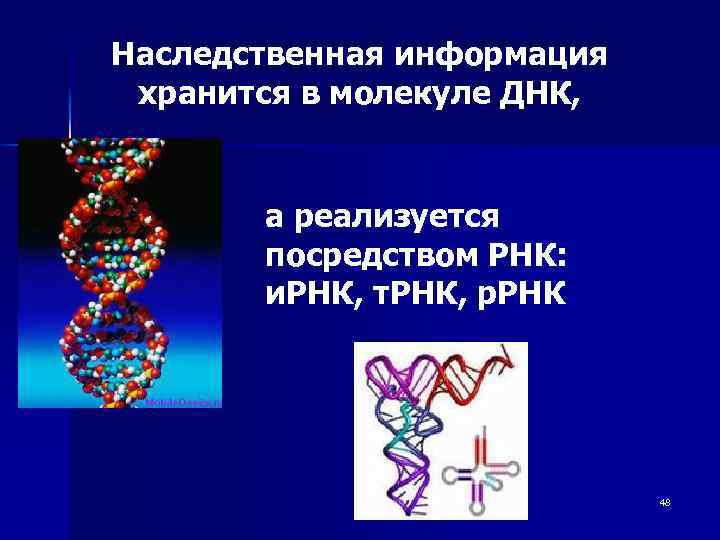
Наследственная информация хранится в молекуле ДНК, а реализуется посредством РНК: и. РНК, т. РНК, р. РНК 48
Биополимеры.ppt