(biopharmacia;


(biopharmacia; био- + фармация) наука, изучающая ЭКЗОГЕННЫЕ (окружающая среда) влияние фармацевтических, биологических и других факторов на ЭНДОГЕННЫЕ (физиологические, клинические, транспорт лекарственного вещества фармацевтические) в организме и проявление его биологической Самостоятельное направление фармации с 1950 -1960 гг. активности Гален (131 -201) степень измельчения влияет на терапевтическую эффективность. Авиценна (980 -1037), Гороховцев (1877), Манассеин (1878), Шацкий (1901), Боткин и фармаколог Николаев (1948) состояние лекарственного вещества, вид лекарственной формы и способ её применения влияют на терапевтическую эффективность. Впервые основные положения биофармации сформулированы в работах Вагнера. Работы профессоров П. Л. Сенова, А. И. Тенцовой, И. С. Ажгихина.

Биологическая неэквивалентность лекарств — несоответствие терапевтической эффективности равных доз одних и тех же лекарственных препаратов (в одинаковых лекарственных формах, при одной схеме назначения), изготовленных различными производителями. (бисгидроксикумарин, дигоксин, преднизолон, ацетилсалициловая кислота, теофиллин и др. ) Яркие факты биологической эквивалентности Таблетки бисгидроксикумарина – антикоагулянта (США) Таблетки фенитоина (дифенина) – противоэпилептического средства (Автралия) Таблетки дигоксина (Германия) Основнная задача биофармации - теоретическое обоснование и создание оптимальной лекарственной формы, обеспечивающей максимальный терапевтический эффект ЛВ с минимальным побочным действием на организм
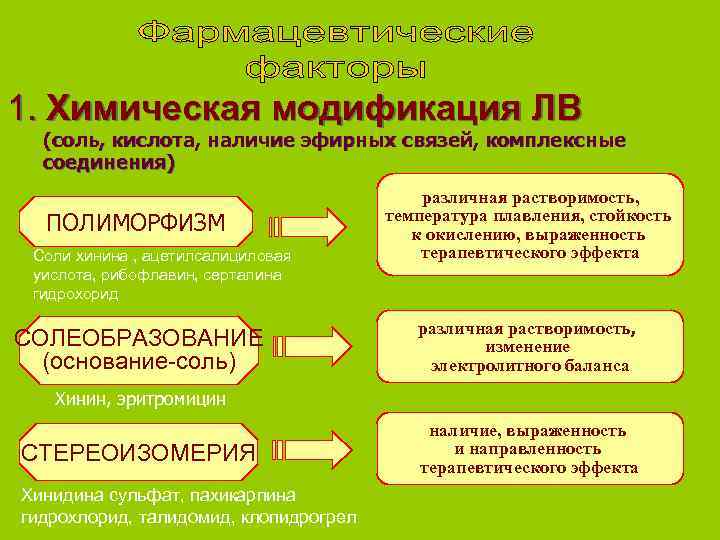
1. Химическая модификация ЛВ (соль, кислота, наличие эфирных связей, комплексные соединения) различная растворимость, температура плавления, стойкость ПОЛИМОРФИЗМ к окислению, выраженность Соли хинина , ацетилсалициловая терапевтического эффекта уислота, рибофлавин, серталина гидрохорид различная растворимость, СОЛЕОБРАЗОВАНИЕ изменение (основание-соль) электролитного баланса Хинин, эритромицин наличие, выраженность СТЕРЕОИЗОМЕРИЯ и направленность терапевтического эффекта Хинидина сульфат, пахикарпина гидрохлорид, талидомид, клопидрогрел

2. Физико-химические состояние ЛВ (форма кристалла, размеры частиц, наличие или отсутствие заряда на их 30 -60% сульфаниламидов, 70% барбитуратов полиморфны, поверхности и т. д. ) 1/3 всех органических соединений имеет по крайней мере две кристаллические формы Сульфадимезин [С max] на 2 часа раньше, сверхтонкого измельчения: содержание ЛВ на 40 % выше, всосавшееся количество на 20 % больше, дисперсность чем сульфадимезина обычного измельчения Ацетилсалициловая к-та микронизированная увеличение в 2 раза дисперсность анальгетического, жаропонижающего и противовоспалительного действия. • Увеличение степени дисперсности частиц эритромицина и пенициллина снижение противомикробной активности, • Увеличение степени дисперсности частиц нитрофурантоина

3. Вспомогательные вещества (ВВ) ü Молочный сахар тормозит эффект изониазида ü Всасывание салицилата натрия замедляется в присутствии метилцеллюлозы, но возрастает с пектинами ü Желатин, крахмалы, полиэтиленоксиды, производные целлюлозы, неионоактивные ПАВ способны вступать в реакции взаимодействия (комплексообразования) ü Кислота борная не оказывает бактериостатического действия при использовании жировых основ, но эффективна при изготовлении мазей на гидрофильных основах ü Натрия лаурилсульфат способствует увеличению резорбции микрокристаллического сульфапиридазина из гидрофильной основы. ü Диметилсульфоксид легко проникает через неповрежденную кожу, транспортирует, депонирует и пролонгирует поступление ЛВ в организм. ü Коллаген образует соединение–включение типа клатратов, + обеспечивая тем самым пролонгированное действие. снижение, конверсия изменение скорости и полноты всасывания или полная потеря лечебного действия
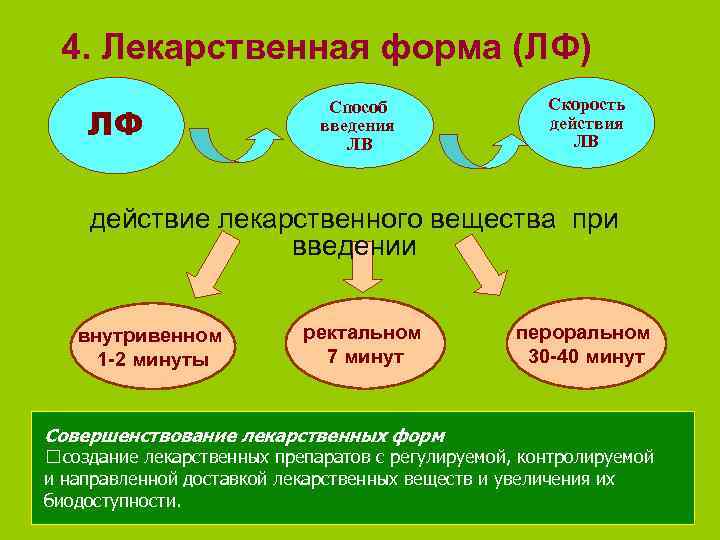
4. Лекарственная форма (ЛФ) Способ Скорость ЛФ введения ЛВ действия ЛВ действие лекарственного вещества при введении внутривенном ректальном пероральном 1 -2 минуты 7 минут 30 -40 минут Совершенствование лекарственных форм создание лекарственных препаратов с регулируемой, контролируемой и направленной доставкой лекарственных веществ и увеличения их биодоступности.

5. Технология изготовления Наиболее критические технологии сушка ТАБЛЕТИРОВАНИЕ: • размер грануляция • температура сушки кристаллизация • время сушки гранул • количество жидкости, используемой для грануляции прессование • распределение гранул в соответствии с их размерами лиофилизация • давление прессования • скорость нарастания давления Способ получения определяет: стабильность препарата скорость высвобождения препарата из ЛФ интенсивность всасывания ЛВ терапевтическую эффективность препарата

Экзогенные факторы : сезоны года, температура, время суток. Эндогенные факторы: 1. физиологические функциональное состояние желудочно-кишечного тракта (ЖКТ) - р. H, интенсивность моторики; наличие пресистемного метаболизма, масса тела, пол, возраст, характер пищи, физическая активность, беременность, биологические ритмы 2. патофизиологические патологические состояния желудочно-кишечного тракта, печени, почек, сердечно- сосудистой системы, уровень транспортных белков в крови, генетически обусловленная разница в биотрансформации лекарственных веществ с пресистемным метаболизмом, 3. клинические выбор схемы дозирования, интеракция одновременно или последовательно вводимых лекарственных веществ).

Структура кожи
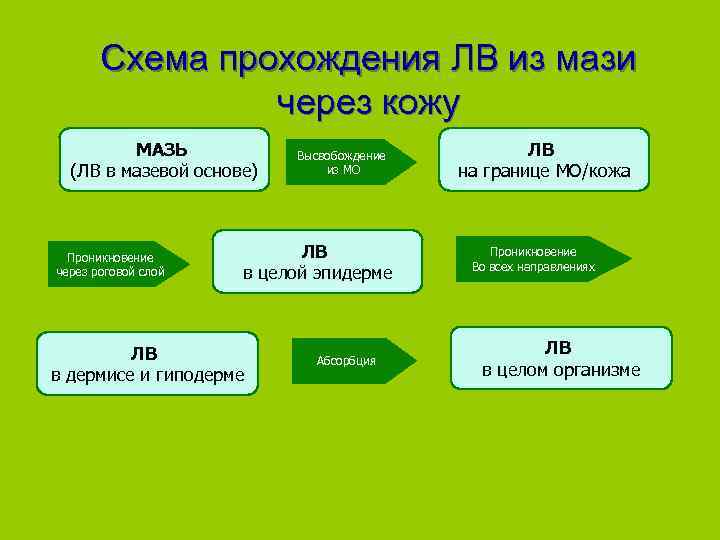
Схема прохождения ЛВ из мази через кожу МАЗЬ Высвобождение ЛВ (ЛВ в мазевой основе) из МО на границе МО/кожа Проникновение ЛВ Проникновение Во всех направлениях через роговой слой в целой эпидерме ЛВ Абсорбция в дермисе и гиподерме в целом организме
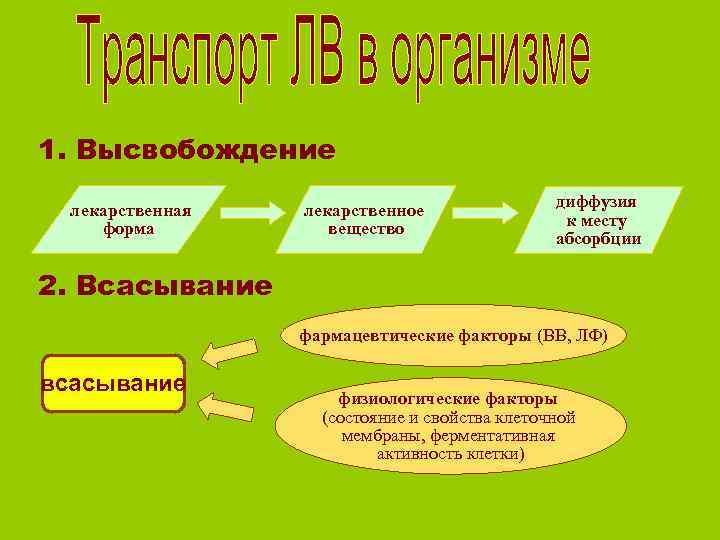
1. Высвобождение лекарственная лекарственное диффузия форма вещество к месту абсорбции 2. Всасывание фармацевтические факторы (ВВ, ЛФ) всасывание физиологические факторы (состояние и свойства клеточной мембраны, ферментативная активность клетки)
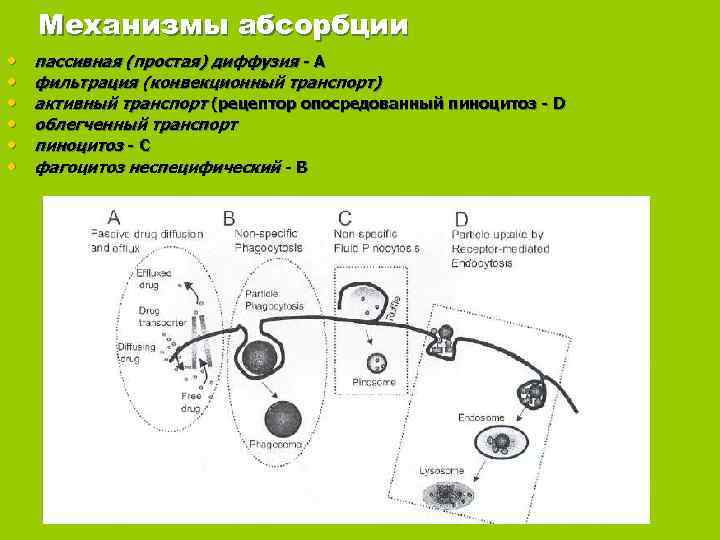
Механизмы абсорбции • пассивная (простая) диффузия - А • фильтрация (конвекционный транспорт) • активный транспорт (рецептор опосредованный пиноцитоз - D • облегченный транспорт • пиноцитоз - C • фагоцитоз неспецифический - В

пассивная (простая) диффузия – прохождение липофильных низкомолекулярных соединений через биологические мембраны; осуществляется по градиенту концентрации и зависит от степени липофильности вещества; фильтрация (конвекционный транспорт) – прохождение молекул лекарственного вещества через поры мембран, что имеет достаточно ограниченное значение в связи с незначительной величиной пор (в среднем до 1 нм); кроме величины молекул фильтрация зависит от их гидрофильности, способности к диссоциации, соотношения заряда частиц и пор, а также от гидростатического, осмотического и онкотического давлений; таким путем всасываются вода, некоторые ионы и мелкие гидрофильные молекулы;

активный транспорт – осуществляется с помощью транспортных систем клеточных мембран (специальными носителями с потреблением энергии) и может протекать против градиента концентрации; характерны избирательность, конкуренция двух веществ за один носитель и «насыщаемость» , то есть достижение максимальной скорости процесса, лимитируемой количеством носителя и не увеличивающейся при дальнейшем повышении концентрации абсорбируемого вещества ( гидрофильные полярные молекулы, ряд неорганических ионов, сахаров, аминокислот и др. ); облегченный транспорт – подобен активному транспорту, но не сопровождается потреблением энергии, хотя и может осуществляться против градиента концентрации (всасывание в кишечнике витамина В 12); пиноцитоз – сходен с фагоцитозом: в результате инвагинации клеточной мембраны образуются вакуоли, содержащие крупные молекулы вещества; вакуоли мигрируют по цитоплазме к противоположной стенке и опорожняются наружу.

Факторы, определяющие абсорбцию ЛВ А. Относящиеся к Б. Относящиеся к веществу организму • размер молекулы • площадь всасывающей • липо/гидрофильность поверхности • наличие/отсутствие • р. Н среды электрического заряда • степень гидратации и • зависимость заряда от гемоконцентрации р. Н среды • состояние • создаваемый веществом микроциркуляции уровень р. Н

3. Распределение ЛВ и его метаболитов в тканях и органах ЛВ разносятся кровью по всему организму и равномерно распределяются во всем объеме крови до установления состояния подвижного равновесия в соответствующем органе. 4. Биотрансформация (метаболизм) ЛВ Метаболизм - сумма химических превращений, которые претерпевает ЛВ в организме 5. Элиминация (выведение, экскреция) ЛВ ► Ренальная экскреция ► Экстраренальная экскреция

Период полураспада, период полувыведения Т 1/2 (полупериод нахождения) ЛВ в организме - время, в течение которого концентрация ЛВ в крови снижается на половину Лекарственное Период вещество полураспада Пенициллин 28 мин Стрептомицин 1 ч 12 мин Амидопирин 3 ч Аспирин 6 ч Барбитал 4, 8 дн. Сульфодиметоксин 41 ч Ампициллин 11 ч Этанол 1 ч 30 мин

Биологическая доступность показывает: Ø Какая часть дозы ЛП всосалась? Ø Как быстро происходило всасывание? Ø Как долго и в какой концентрации ЛВ находится в организме? БД выражается в процентах (%): БД S × 100 S 1
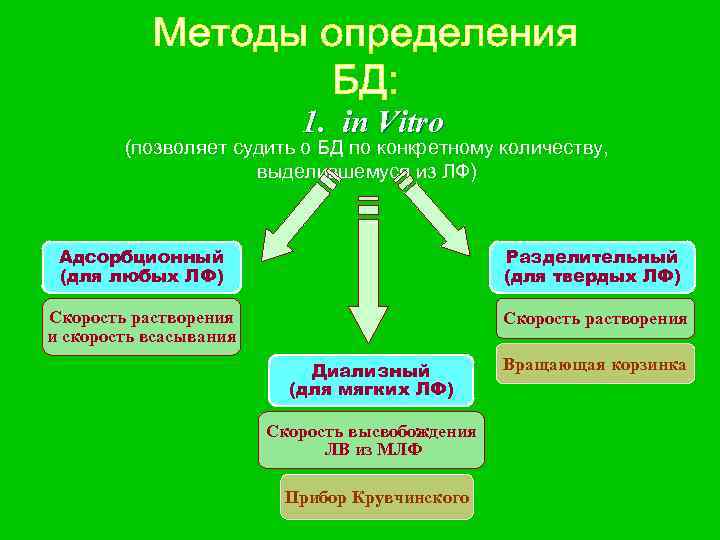
1. in Vitro (позволяет судить о БД по конкретному количеству, выделившемуся из ЛФ) Адсорбционный Разделительный (для любых ЛФ) (для твердых ЛФ) Скорость растворения Скорость растворения и скорость всасывания Диализный Вращающая корзинка (для мягких ЛФ) Скорость высвобождения ЛВ из МЛФ Прибор Крувчинского

Модельные системы in vitro для исследования распределения и всасывания. 1. Прибор для определения растворения и 2 -хфазного распределения (Resomat -1) А – искусственный желудочный или кишечный сок Б – липофильная фаза (хлороформ) В – магнитная мешалка Г – туфовый фильтр Высвобождение ЛВ из исследуемой ЛФ происходит в водной фазе при постепенно меняющемся значении ph (от 1, 2 до 7, 8). Это позволяет имитировать аналогичные показатели в ЖКТ организма при движении ЛФ из желудка ( ph 1, 5) в двенадцатиперстную кишку ( ph 4, 0) и далее в тонкий кишечник ( ph 7, 6)

2. Прибор для определения абсорбции с использованием липидной мембраны (Resoman -2) 3. ДК – искусственный желудочный или кишечный сок 4. Б – липидная мембрана (полиамидная пленка, пропитанная трибутилфосфатом и лецитином) 5. АК – раствор буфера с ph – 7, 4 (имитация сыворотки крови) В данной модели оценивается одновременно растворение и транспорт лекарственного вещества из лекарственной формы в кровь
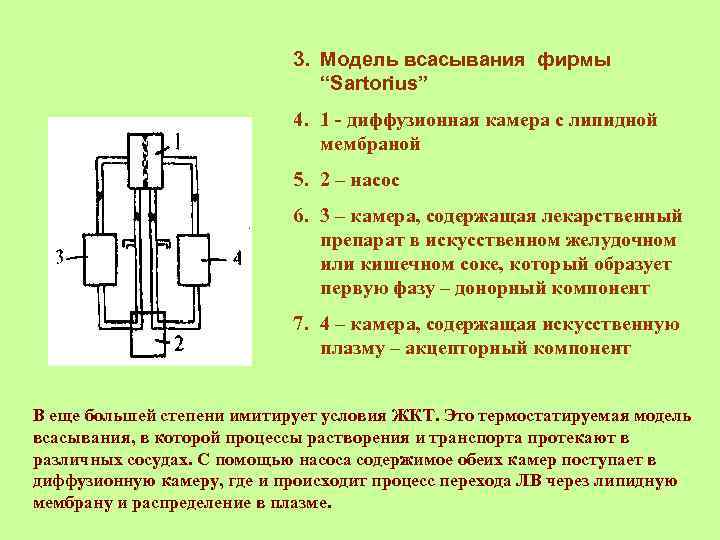
3. Модель всасывания фирмы “Sartorius” 4. 1 - диффузионная камера с липидной мембраной 5. 2 – насос 6. 3 – камера, содержащая лекарственный препарат в искусственном желудочном или кишечном соке, который образует первую фазу – донорный компонент 7. 4 – камера, содержащая искусственную плазму – акцепторный компонент В еще большей степени имитирует условия ЖКТ. Это термостатируемая модель всасывания, в которой процессы растворения и транспорта протекают в различных сосудах. С помощью насоса содержимое обеих камер поступает в диффузионную камеру, где и происходит процесс перехода ЛВ через липидную мембрану и распределение в плазме.

Диффузия в гель 2% агаровый гель на стандартном растворителе + 5% реактива Эрлиха ( n- диметиламинобензальдегид + хлороводородная кислота концентрированная + 95% этанол + н. бутанол) в чашке Петри. После застывания агара в чашку помещают три металлических (стеклянных) цилиндра и заливают второй слой агара. Метод диализа через полупроницаемую мембрану Ццеллофан, яичная оболочка, слепая кишка ягнёнка, брюшина рогатого скота и т. д. Метод окрашенных комплексов Для мазей с водо- и жирорастворимыми лекарственными веществами на эмульсионных основах. 100 г основы гомогенизируют с 5 кап 2 % водного раствора метиленового синего или 5 кап 5 % масляного раствора судана III. Окраску сравнивают с эталонами. Метод микроскопии Предназначен для рационального выбора диспергирующих сред и основ для мазей-суспензий на гидрофобных основах. Описано в лабораторной работе № 1.

2. in Vivo: фармакокинетический и фармакодинамический (Определяет содержание ЛВ в биожидкости) На животных На добровольцах üМужчины 20 -40 лет üЛабораторные животные (крысы, мыши, кролики, ü патологий Без морские свинки) ü 1 мес. прекращается прием За üБиожидкости – кровь, моча ЛП, влияющих на активность и др. ферментов и гормонов ü принимается пища за 4 ч. до Не опыта и 2 ч. после него

Биоэквивалентность - один из видов клинических испытаний Особенности исследований биоэквивалентности: Нетерапевтические исследования Субъекты исследования - здоровые добровольцы Объект исследования - генерические препараты

Оценка биоэквивалентности лекарственных средств — основной вид медико-биологического контроля качества препаратов, принятого для стран европейского сообщества, США и др. В России требования о включении данных по испытаниям биоэквивалентности в материалах на представляемые для регистрации препараты-генерики приняты в 1992 г. ,
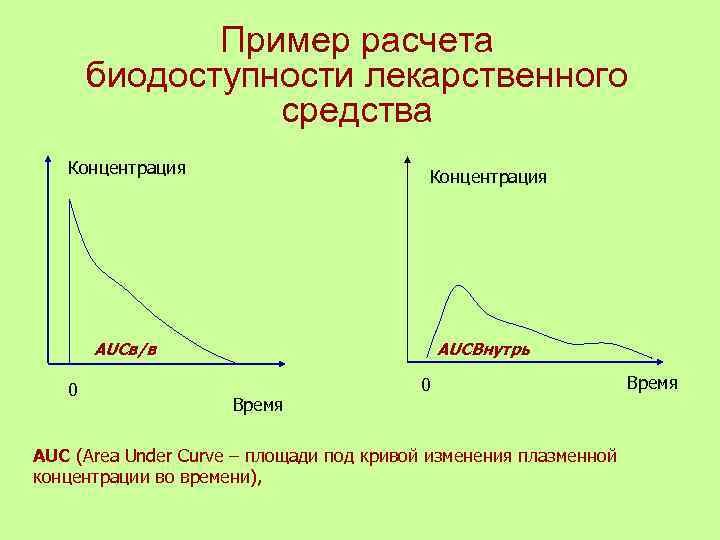
Пример расчета биодоступности лекарственного средства Концентрация AUCв/в AUCВнутрь 0 0 Время AUC (Area Under Curve – площади под кривой изменения плазменной концентрации во времени),

С (мкг/мл) 3 -4 точки – на период увеличения и на максимуме концентрации 5 -6 точек – на период снижения концентрации AUC 0 Показатели: T(час) Сmax - максимум концентрации вещества в крови Tmax - время достижения максимальной концентрации AUC о-t - площадь под кривой «концентрация - время» (от момента введения до момента времени t) AUC - площадь под кривой «концентрация - время» (от момента введения до момента последней определяемой концентрации)

объем распределения или кажущийся (условный) объем распределения —гипотетический объем жидкости, в котором введенная доза создаст концентрацию, равную концентрации в крови. Объем распределения некоторых ЛВ • метиленового синего – 0, 043 л/кг, • фуросемида [лазикса] – 0, 11 л/кг, • дигоксина – 8, 6 л/кг, • хлорохина - 171, 4 л/кг.

