Спирты, тиолы, фенолы, карбонильные соединения.ppt
- Количество слайдов: 28

Биоорганические активные соединения: спирты, тиолы, фенолы, амины.

Спирты, свойства Спирты - производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на гидроксильные группы.

Классификация спиртов 1. По числу гидроксильных групп спирты подразделяются на • одноатомные (одна группа -ОН), • многоатомные (две и более групп -ОН). Современное название многоатомных спиртов - полиолы (диолы, триолы и т. д). Примеры: двухатомный спирт – этиленгликоль (этандиол) HO–СH 2–CH 2–OH трехатомный спирт – глицерин (пропантриол-1, 2, 3) HO–СH 2–СН(ОН)–CH 2–OH 2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты 3. 3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на • предельные, или алканолы (например, СH 3 CH 2–OH) • непредельные, или алкенолы (CH 2=CH–CH 2–OH) • ароматические (C 6 H 5 CH 2–OH).

СВОЙСТВА СПИРТОВ При изучении реакционной способности органических соединений, имеющих различные функциональные группы, в первую очередь необходимо рассмотреть кислотно-основные свойства органических соединений, которые во многом определяют их химические свойства.

1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют с щелочными металлами: С увеличением длины углеводородного радикала скорость этой реакции замедляется 2. Образование сложных эфиров протекает по механизму присоединения-отщепления:
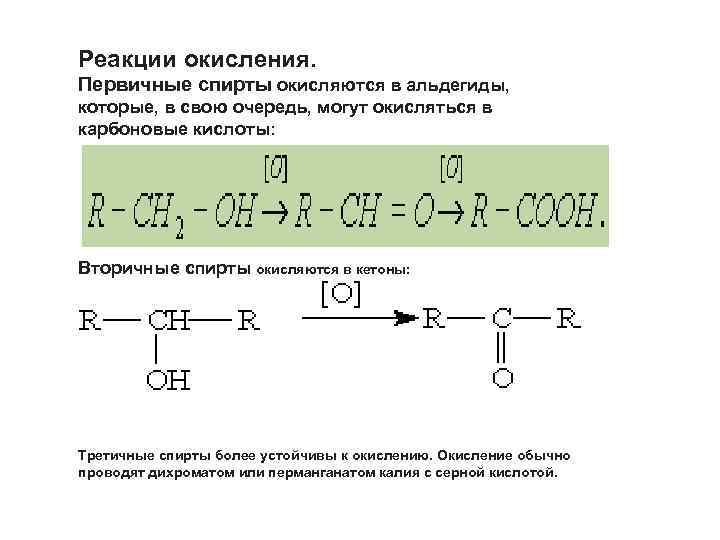
Реакции окисления. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты: Вторичные спирты окисляются в кетоны: Третичные спирты более устойчивы к окислению. Окисление обычно проводят дихроматом или перманганатом калия с серной кислотой.

Окисление спирта в клетке: (дегидрирование) Образование ацетальдегида из этанола катализируется специфическим ферментом алкогольдегидрогеназой, связанной с НАД (кофермент) НАД+ CH 3 -CH 2 -OH CH 3 -CH=O + НАДН+ Н+ Алькогольдегидрогеназа окисляет и метанол до формальдегида (сильный яд) СН 3 ОН НСН=О +2 Н

Дегидратация спиртов Межмолекулярная дегидратация 1. спиртов. При нагревании спирта в присутствии каталитических количеств сильной кислоты происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир: Простые эфиры — это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'—О—R", где R' и R" — радикалы, которые могут быть различными или одинаковыми. Диэтиловый эфир используется в медицине при хирургических операциях, так как обладает анестезирующим действием. 2. Реакция элиминирования, или внутримолекулярной дегидратации .
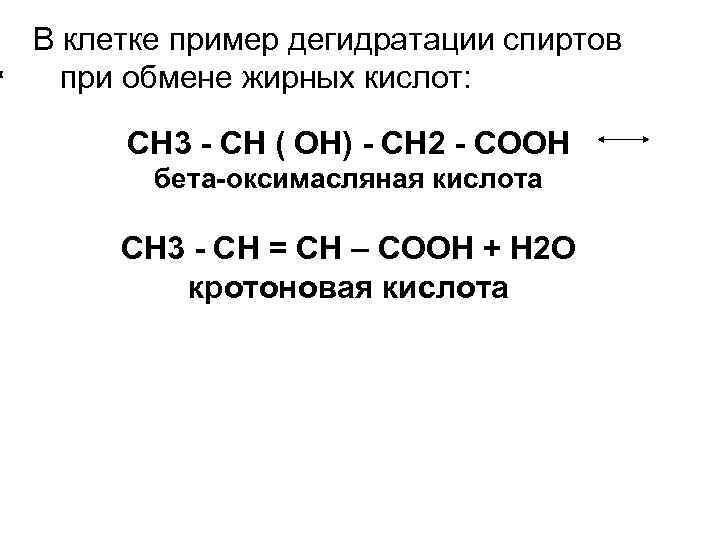
В клетке пример дегидратации спиртов при обмене жирных кислот: СН 3 - СН ( ОН) - СН 2 - СООН бета-оксимасляная кислота СН 3 - СН = СН – СООН + Н 2 О кротоновая кислота
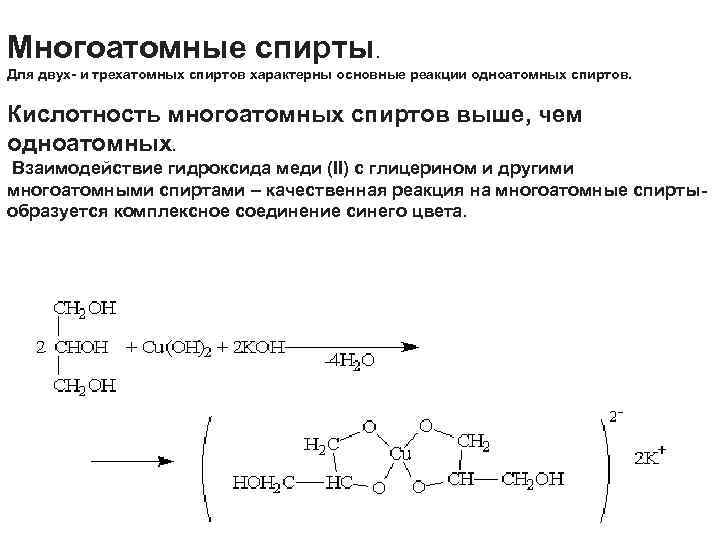
Многоатомные спирты. Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. Кислотность многоатомных спиртов выше, чем одноатомных. Взаимодействие гидроксида меди (II) с глицерином и другими многоатомными спиртами – качественная реакция на многоатомные спирты- образуется комплексное соединение синего цвета.
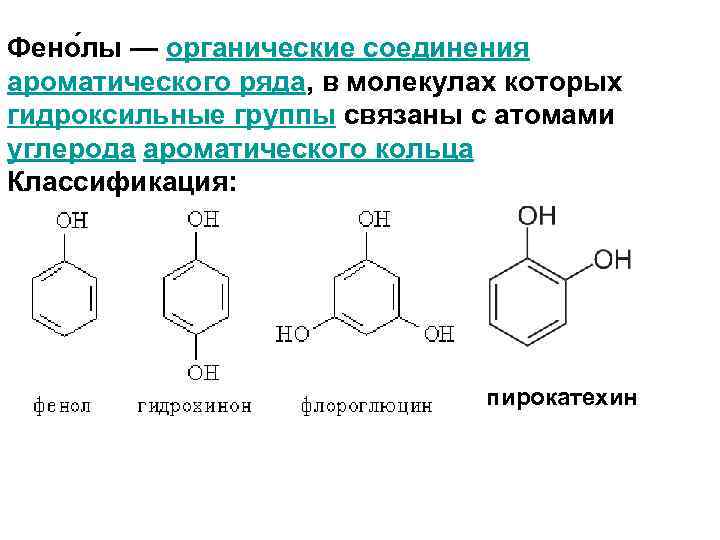
Фено лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца Классификация: пирокатехин

Свойства фенолов Кислотные свойства фенола значительно выше кислотности спиртов и проявляются в реакциях со щелочами (сохранилось старинное название “карболовая кислота”): Фенол – слабая кислота Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
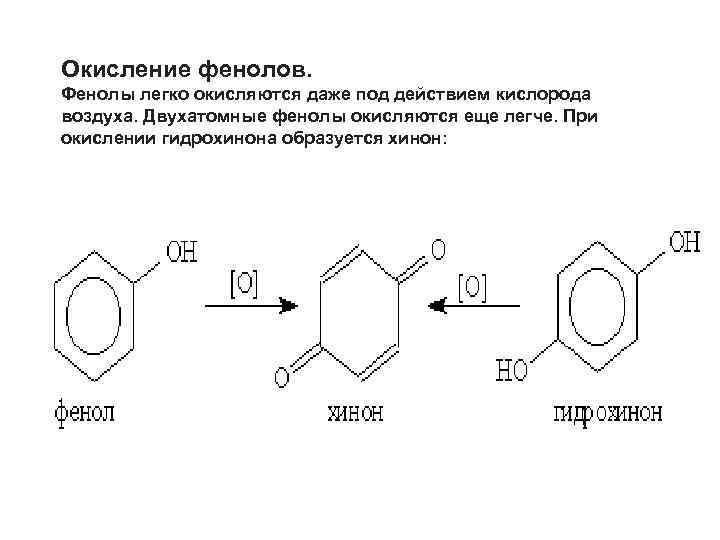
Окисление фенолов. Фенолы легко окисляются даже под действием кислорода воздуха. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
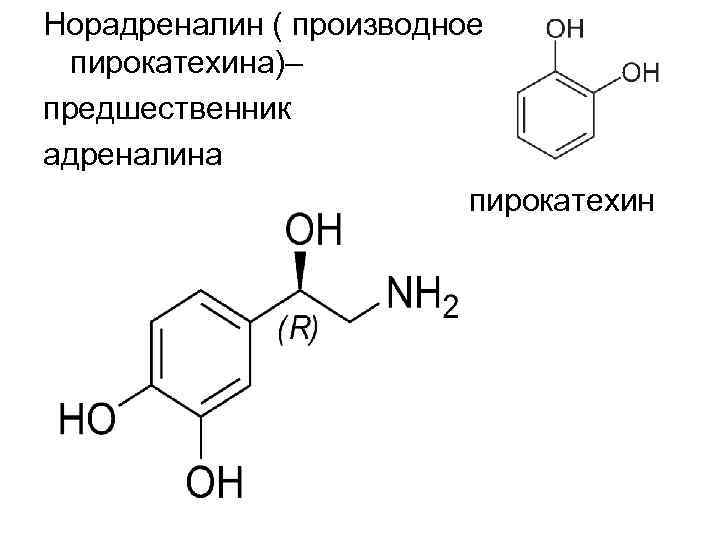
Норадреналин ( производное пирокатехина)– предшественник адреналина пирокатехин
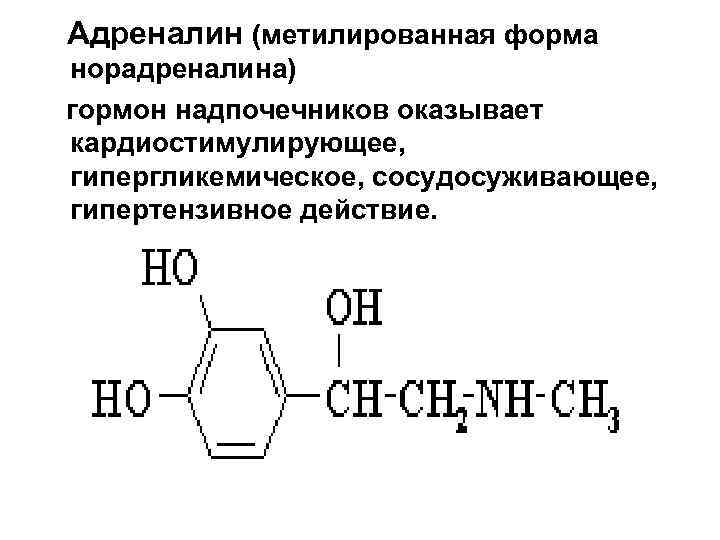
Адреналин (метилированная форма норадреналина) гормон надпочечников оказывает кардиостимулирующее, гипергликемическое, сосудосуживающее, гипертензивное действие.

Тиолы или меркаптаны — органические вещества, имеющие общую формулу R-SH, где R — углеводородный радикал, например, метантиол (метилмеркаптан) (CH 3 SH), этантиол (этилмеркаптан) (C 2 H 5 SH) и т. д.

Тиолы представляют интерес в плане химического поведения биологически активных веществ, содержащих тиоловую группу [цистеин, глутатион, дигидролипоевая кислота, кофермент А]. Биологическая роль этих соединений обусловлена реакционной способностью сулъфгидрильной группы: для формирования третичной структуры белков осуществляется окислительно восстановительная реакция с участием цистеина. Глутатион и дигидролипоевая кислота участвуют в окислительно восстановительных процессах, происходя щих в клетках. Активной частью всех выше перечисленных соединений является –SH группа. Кислотные свойства тиоловой группы проявляются при отравлении солями тяжелых металлов, называемых в данном случае «тиоловыми ядами» .

Кислотность тиолов. Тиолы обладают слабыми кислотными свойствами, с металлами образуют тиоляты (меркаптиды), но являются значительно более сильными кислотами, чем соответствующие спирты
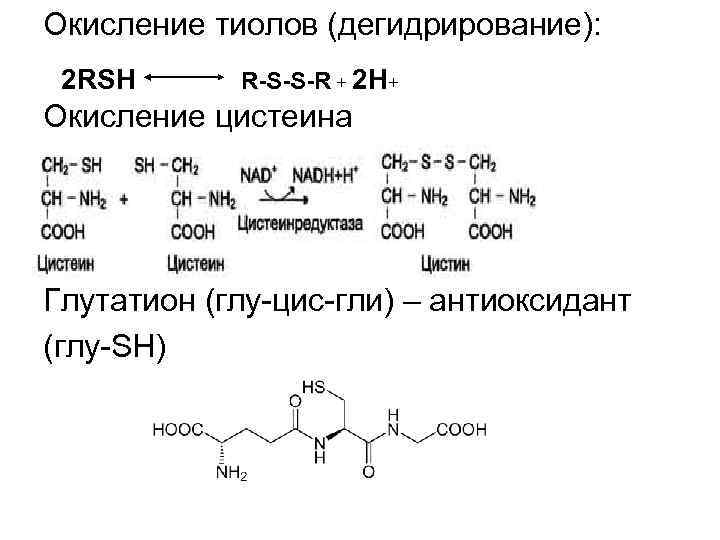
Окисление тиолов (дегидрирование): 2 RSH R-S-S-R + 2 H+ Окисление цистеина Глутатион (глу цис гли) – антиоксидант (глу SH)
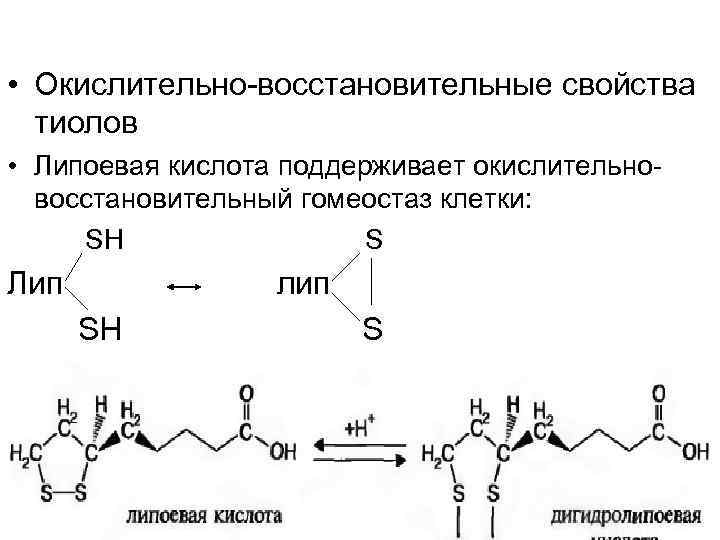
• Окислительно восстановительные свойства тиолов • Липоевая кислота поддерживает окислительно восстановительный гомеостаз клетки: SH S Лип лип SH S

Липоевая кислота — один из наиболее мощных антиоксидантов. Это единственный антиоксидант способный попасть непосредственно в мозг; липоевая кислота может растворяться и в воде, и в жире и, соответственно, одинаково эффективно работает и в водной и в жирной частях мозга; липоевая кислота повышает эффективность работы митохондрий — энергетических фабрик клеток. липоевая кислота является регулятором уровня инсулина и сахара в крови
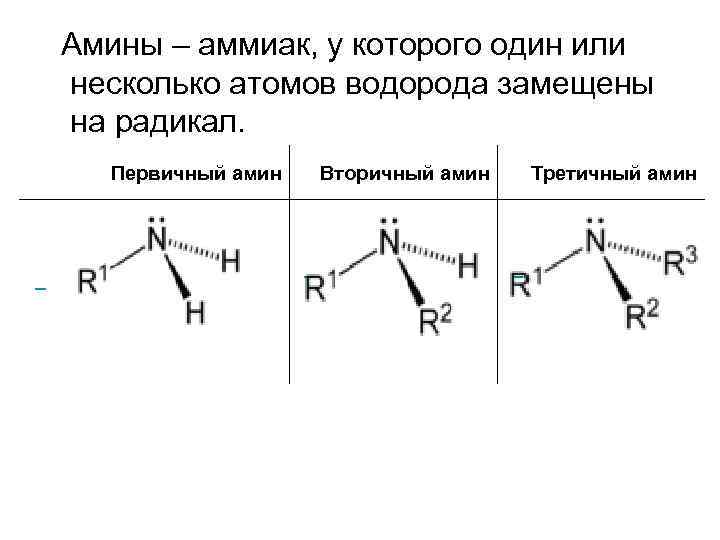
Амины – аммиак, у которого один или несколько атомов водорода замещены на радикал. Первичный амин Вторичный амин Третичный амин

Алкиламины являются сильными основаниями, ариламины менее основны. Взаимодействие с водой. Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония: C 2 H 5 NH 2 + H 2 O → [C 2 H 5 NH 3]+OH- Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде : RNH 2 + HCl → [RNH 3]+Cl− C 6 H 5 NH 2 + HCl → [C 6 H 5 NH 3]+Cl−
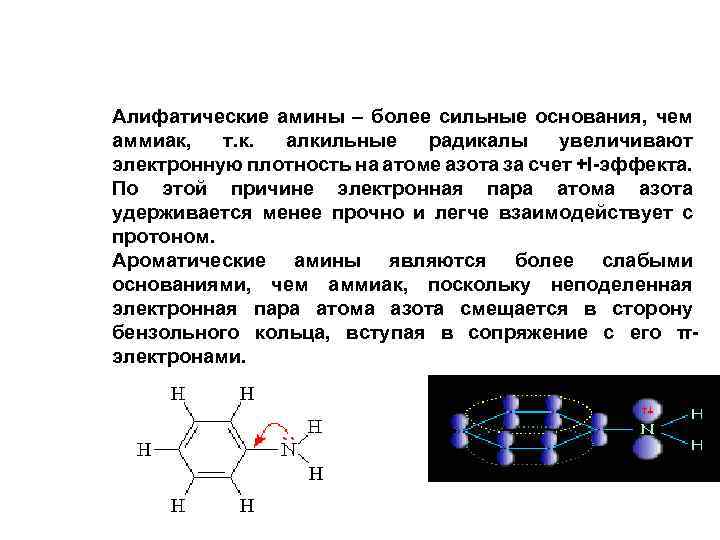
Алифатические амины – более сильные основания, чем аммиак, т. к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном. Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его πэлектронами. или

Первичные алифатические амины реагируют с азотистой кислотой с выделением газообразного азота и спирта. Вторичные амины образуют с азотистой кислотой устойчивые нитрозамины – жидкие или твердые продукты желтого цвета. R 2 NH + Na. NO 2 + HCl ® R 2 N-N=O + Na. Cl + H 2 O нитрозамин Нитрозамины являются сильными канцерогенами. Показана возможность синтеза нитрозаминов в желудке человека из содержащихся в пище и лекарственных препаратах вторичных аминов и нитритов. Канцерогенное действие нитрозаминов основано на их способности алкилировать ДНК, что приводит к онкогенным мутациям. Третичные алифатические амины при обычной температуре с азотистой кислотой не взаимодействуют.
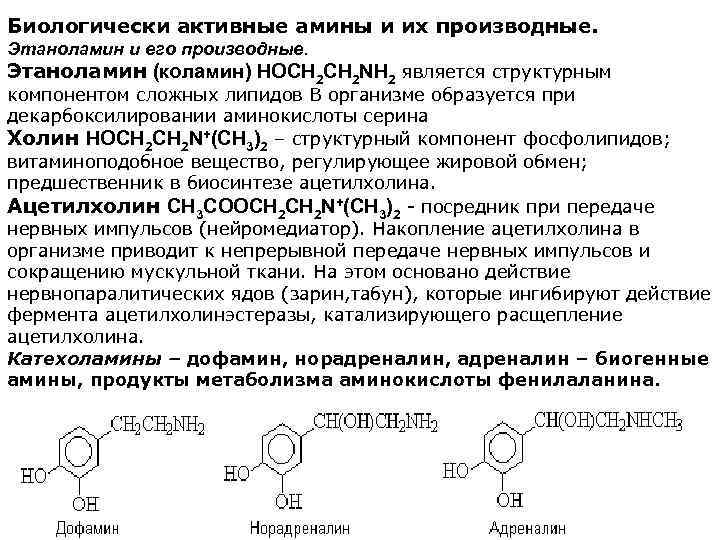
Биологически активные амины и их производные. Этаноламин и его производные. Этаноламин (коламин) HOCH 2 NH 2 является структурным компонентом сложных липидов В организме образуется при декарбоксилировании аминокислоты серина Холин HOCH 2 N+(CH 3)2 – структурный компонент фосфолипидов; витаминоподобное вещество, регулирующее жировой обмен; предшественник в биосинтезе ацетилхолина. Ацетилхолин CH 3 COOCH 2 N+(CH 3)2 - посредник при передаче нервных импульсов (нейромедиатор). Накопление ацетилхолина в организме приводит к непрерывной передаче нервных импульсов и сокращению мускульной ткани. На этом основано действие нервнопаралитических ядов (зарин, табун), которые ингибируют действие фермента ацетилхолинэстеразы, катализирующего расщепление ацетилхолина. Катехоламины – дофамин, норадреналин, адреналин – биогенные амины, продукты метаболизма аминокислоты фенилаланина.
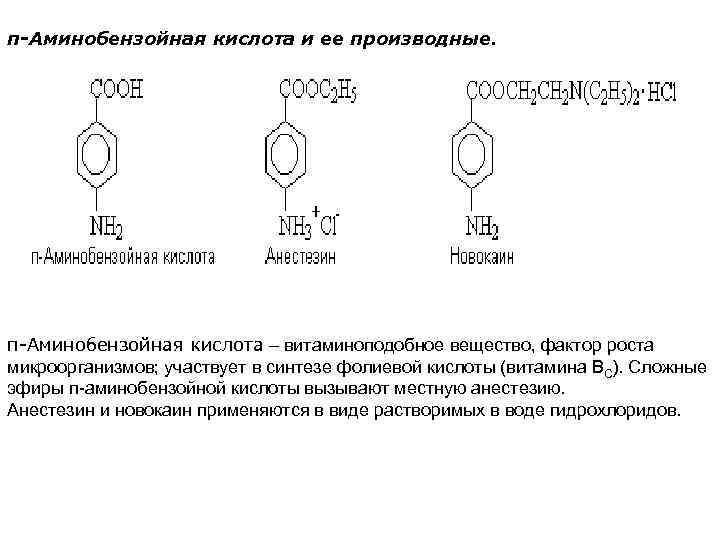
п-Аминобензойная кислота и ее производные. п-Аминобензойная кислота – витаминоподобное вещество, фактор роста микроорганизмов; участвует в синтезе фолиевой кислоты (витамина ВС). Сложные эфиры п аминобензойной кислоты вызывают местную анестезию. Анестезин и новокаин применяются в виде растворимых в воде гидрохлоридов.
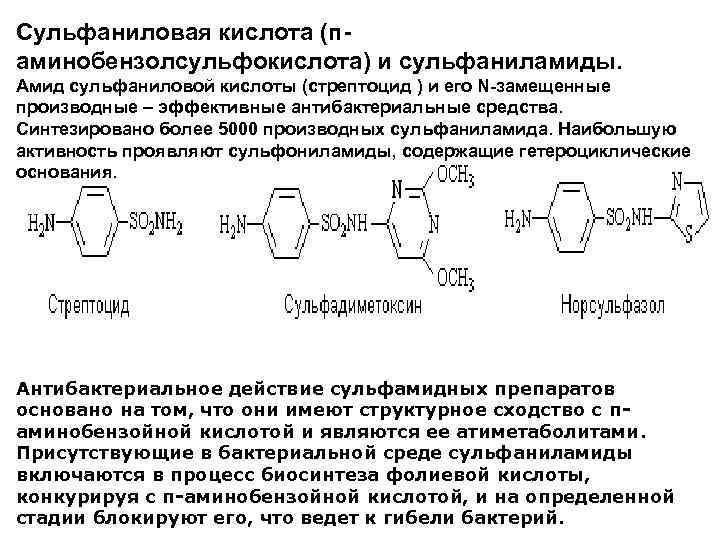
Сульфаниловая кислота (п аминобензолсульфокислота) и сульфаниламиды. Амид сульфаниловой кислоты (стрептоцид ) и его N-замещенные производные – эффективные антибактериальные средства. Синтезировано более 5000 производных сульфаниламида. Наибольшую активность проявляют сульфониламиды, содержащие гетероциклические основания. Антибактериальное действие сульфамидных препаратов основано на том, что они имеют структурное сходство с паминобензойной кислотой и являются ее атиметаболитами. Присутствующие в бактериальной среде сульфаниламиды включаются в процесс биосинтеза фолиевой кислоты, конкурируя с п-аминобензойной кислотой, и на определенной стадии блокируют его, что ведет к гибели бактерий.
Спирты, тиолы, фенолы, карбонильные соединения.ppt