Биология опухолевого роста.pptx
- Количество слайдов: 64

Биология опухолевого роста Журиков Руслан Первый МГМУ им И. М. Сеченова 6 курс, лечебный факультет

Определение Опухоль – это патологическое разрастание тканей, состоящих из качественно изменившихся клеток, ставших атипичными в отношении дифференцировки, характера роста и передающих эти свойства при последующем делении. Медицинский словарь Cancer is a disease of uncontrolled cell growth, of excessive and chronic expansion of previously well-behaved cells in our body. Douglas Hanahan

Основные этапы опухолевого роста

Hallmarks of cancer

Поддержка сигнала к пролиферации Деление клеток в популяции контролируется ростовыми факторами (митогенами). Ростовые факторы, связываются с рецепторами, в состав которых обычно входит внутриклеточный тирозинкиназный домен.

Протоонкоген – онкопротеин

Онкогенные вирусы

Рецепторы факторов роста

Способы поддержки постоянного сигнала к пролиферации 1. Самостоятельная секреция факторов роста клетками опухоли 2. Стимулирование близлежащих стромальных клеток к секреции факторов роста 3. Увеличение количества рецепторов факторов роста на поверхности клетки 4. Появление рецепторов, которые постоянно активированы из-за изменения их структуры. 5. Постоянная активация белков, участвующих в сигнальных путях.

Сигнальные пути MAPK



Уклонение от супрессоров пролиферации В нормальных клетках существуют системы защиты, подавляющие бесконтрольный рост клеток. Данные системы представлены генами, кодирующими белки-супрессоры опухолевого роста (p 53, p 21, p 16, RB, PTEN). Данные белки приводят к остановке клеточного цикла и репликации ДНК, в некоторых случаях к апоптозу клетки. В случае делеции генов данных белков или их мутации, рост клетки становится неконтролируемым.




Уклонение от апоптоза Процесс апоптоза является естественным препятствием на пути к росту опухоли. В рамках многоклеточного организма апоптоз регулирует клеточный гомеостаз. Тем самым поддерживается правильное соотношение клеток различного типа в тканях, размер клеточных популяций, своевременное удаление генетически дефектных клеток.

Механизмы ухода от апоптоза. 1. 2. 3. 4. Нарушении функции гена p 53 Увеличение экспресии антиапоптотических регуляторов (BCL-2) Увеличение экспресии факторов роста (EGF, G-CSF) Снижение экспрессии про-апоптотических регуляторов (BAX, BAK) 5. Нарушения внешнего пути апоптоза (потеря чувствительности к TNF)

Внутренний и внешний пути апоптоза

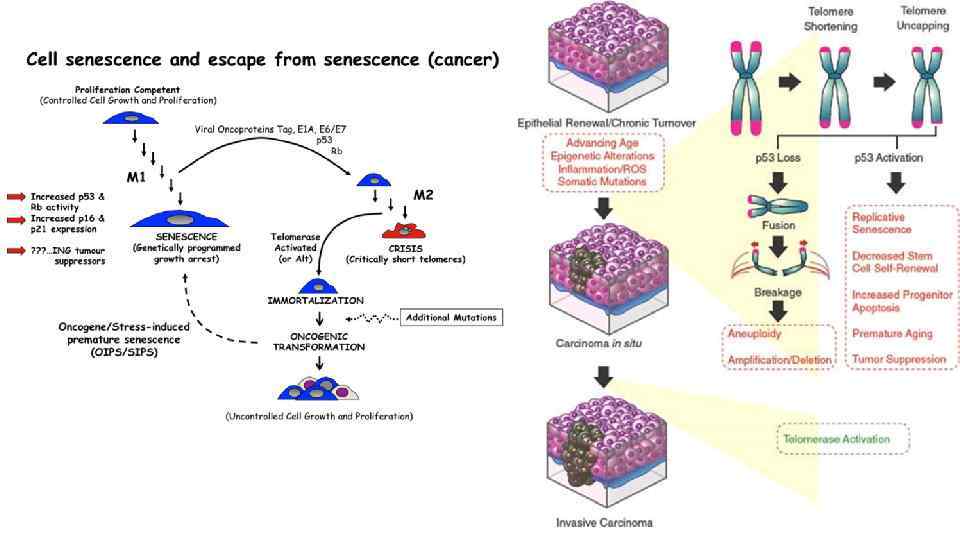
Обретение репликативного бессмертия Подавляющее большинство клеток имеют предел количеству делений (около 60 делений), после чего они перестают делиться и переходят в стационарное состояние (сенсценция, старение) или погибают. Количество делений ограничено размером теломерных участков хромосом. Исчезновение теломер приводит к тому, кто концевые участки хромосом слипаются, в следствие этого нарушается кариотип клетки, что в свою очередь вызывает апоптоз клетки. Нормальное функционирование теломеразного комплекса является необходимым компонентом защиты клетки от бесконтрольного деления. Для преодоления данного ограничения опухолевые клетки реактивируют теломеразу или используют иные механизмы удлинения хромосом, что встречается намного реже. Каталитический фермент TERT, являющийся частью теломеразного комплекса, также участвует в онкогенезе.


Предположительная модель положительной обратной связи, описывающей взаимодействие обратной транскриптазы теломеразы (TERT) с Wnt/b-catenin и NF-k. B signaling сигнальными путями в процессе канцерогенеза. Реактивированная TERT действует в качестве транскрипционного модулятора Wnt/ b-catenin и NF-k. B, что приводит к повышенной экспрессии генов Wnt и NF-k. B, которые обладают свойствами промоторов канцерогенеза: они участвуют в пролиферации, устойчивости к апоптозу и хроническом воспалении. Так как Wnt/b-catenin и NF-k. B транскрипционные активаторы TERT, предполагается наличие положительной обратной связи (обозначена голубыми стрелками), которая поддерживает Wnt/b-catenin и NF-k. B–зависимую транскрипцию, а также уровень теломеразы в раковых клетках.

Ангиогенез Опухоли необходимы новые сосуды, для поддержания её развития и выживания. Запуск ангиогенеза происходит еще на ранних стадиях развития новообразований, таких как дисплазия и carcinoma in situ, так как уже на данных стадиях присутствует недостаток кровоснабжения разросшейся ткани. Начало ангиогенеза в англоязычной литературе обозначают термином “angiogenic switch”, в этот момент баланс между проангиогенными и антиангиогенными факторами смещается в сторону первых. Прорастание сосудов приводит к ускорению развития опухоли и создает условия для метастазирования. Для активации ангиогенеза опухоли экспрессируют VEGF или иные факторы роста. Некоторые клеточные элементы микроокружения опухолей также могут включит процесс ангиогенеза или поддерживать его. Антиангиогенные факторы: ангиостатин, эндостатин, вазостатин, интерлейкин-12 ит. д. Опухоли могут высвобождать факторы роста, провоцирующие развитие лимфатических сосудов.

Angiogenic siwtch

Лимфоангиогенез и ангиогенез


Предотвращение развития сосудов в опухоли.

Инвазия и метастазирование Клетки опухолей способны терять связь с окружающим их внеклеточным матриксом и другими клетками. Они проникают в окружающие ткани, а затем распространяются по всему организму. Важным элементом данного процесса является эпителиальномезенхимальный переход – процесс изменения клетками эпителиального фенотипа на мезенхимальный. По данным литературы, EMT status (определяется профилю экспрессии генов) коррелирует с тяжестью прогноза, наиболее актуальным его определение авторы считают для рака молочной железы, рака легкого, рака яичников, остеосаркомы и меланомы.
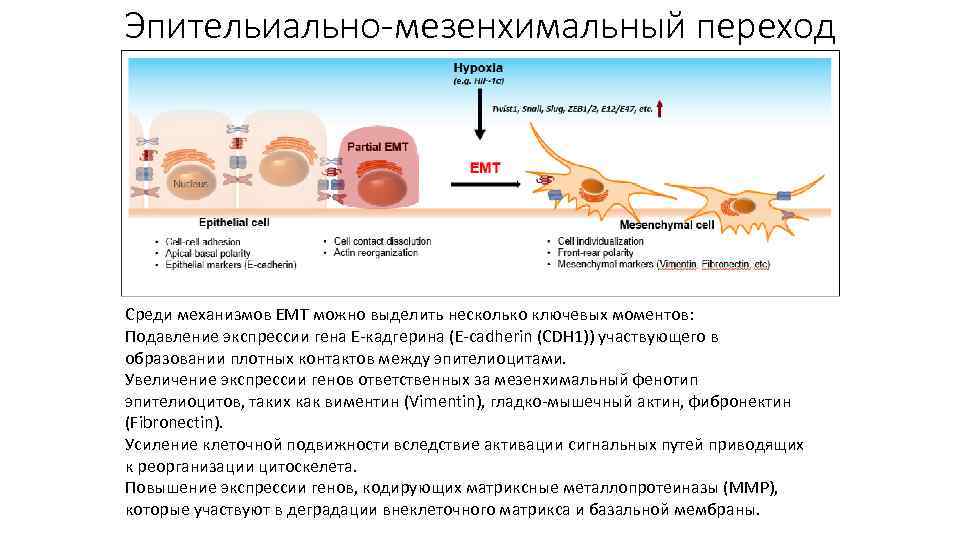
Эпительиально-мезенхимальный переход Среди механизмов EMT можно выделить несколько ключевых моментов: Подавление экспрессии гена Е-кадгерина (E-cadherin (CDH 1)) участвующего в образовании плотных контактов между эпителиоцитами. Увеличение экспрессии генов ответственных за мезенхимальный фенотип эпителиоцитов, таких как виментин (Vimentin), гладко-мышечный актин, фибронектин (Fibronectin). Усиление клеточной подвижности вследствие активации сигнальных путей приводящих к реорганизации цитоскелета. Повышение экспрессии генов, кодирующих матриксные металлопротеиназы (MMP), которые участвуют в деградации внеклеточного матрикса и базальной мембраны.

Эпителиально-мезенхимальный переход • Первый этап эпителиально - мезенхимального перехода – разрушение эпителиальных межклеточных контактов, плотных соединений, слипающихся между собой, десмосом и щелевых контактов , а также, нарушение клеточной полярности. Экспрессия эпителиальных генов подавляется, одновременно с активацией экспрессии мезенхимальных генов. • Далее эпителиальная структура актина реорганизуется и клетки приобретают подвижность и инвазивный потенциала путем формирования ламеллиподий , филоподий и инвадопий , а также, с помощью экспрессии матричной металлопротеиназы, что, в дальнейшем, может привести к снижению внеклеточных матричных белков. Процесс мезенхимально эпителиального перехода позволяет клеткам , которые подверглись EMT вернуться в эпителий. • Метастазы, возникшие на основе ЕМТ, могут приобретать морфологию исходной опухоли, а эпителий в краевых районах раны может приобретать фибробластные свойства. Но так или иначе ЕМТ выглядит как заключительный этап прогрессии эпителиальной опухоли, когда опухоль теряет эпителиальные признаки (полярность клеток, специфические клеточные контакты, характерную морфологию и тканеспецифическую антигенную структуру) и одновременно приобретает черты фибробластов (экспрессию виментина, подвижность, независимость от территории роста).

Опухолевое микроокружение

EMT – это локальный феномен в первичной опухоли, который происходит при взаимодействии клеток карциномы с микроокружением, в котором обнаруживаются CAF и клетки иммунитета, включая NK, Т-клетки и В-лимфоциты и т. д. В состав опухолевой стромы входят опухоль-ассоциированные макрофаги и другие клетки из костного мозга. Некоторые из них прибывают в месте роста опухоли еще до появления здесь метастазов или самой первичной опухоли, что говорит о сходстве опухолевого окружения с микроокружением при фиброзировании, включая воспалительный компонент. Доля клеток, проходящих через процесс EMT невелика (3 -15%). Тем не менее, большинство циркулирующих опухолевых клеток демонстрируют промежуточный EMT фенотип. Клетки с мезенхимальным фенотипом более устойчивы к деформированию, обладают более выраженной лекарственной устойчивостью и проще переносят стресс. Данные свойства позволяют им колонизировать отдаленные участки человеческого организма, после чего они возвращаются к эпителиальному фенотипу. Наибольшее количество трансформированных клеток можно выделить в участках с высокими концентрациями TGFb


Стволовые клетки опухоли Нестабильность генома, иммортализация, воспаление, изменение энергетики, отказ от самоуничтожения, гипоксия клетки приводит к дедифференцировке и образованию стволовых клеток опухоли. РСК обладают способностью к самовоспроизведению и образованию клеток других типов. Данные клетки поддерживают гетерогенность клеточных популяций, что позволяет опухоли адаптироваться к враждебному для неё окружению. Считается, что они играют основную роль в рецидиве заболевания и метастазировании.

Стволовые клетки опухоли На данный момент предполагаетсяя, что РСК, не являются истинно стволовыми клетками, они лишь обладают их некоторыми свойствами. РСК не являются тотипотентными или мультипотентными. Они коммитированны, то есть способны давать диффероны только той ткани, из которой изначально произошли. Их свойства строго регулируются нишей, в которой они находятся. Например, они могут давать начало только двум типам диифференцированных клеток. Свойствами стволовости могут обладать любые клетки находящиеся в континууме EMT. Все зависит от сигналов, поступающих из ниши. Данные стволовоподобные клетки могут дифференцироваться или дедифференцироваться и делиться в соотвествии с поступившими к ним сигналами. Предполагается, что любая клетка, начавшая EMT, находится в неком «устойчивом состоянии» и воздействие от ниши способствует её преобразованию в тот или иной тип клетки.



Метастазирование • Процесс метастазирования разделен на несколько этапов: инвазия в окружающие ткани, интравазация, экстравазация, микрометастазирование, колонизация.

Органотропность

Формирование преметастатической ниши
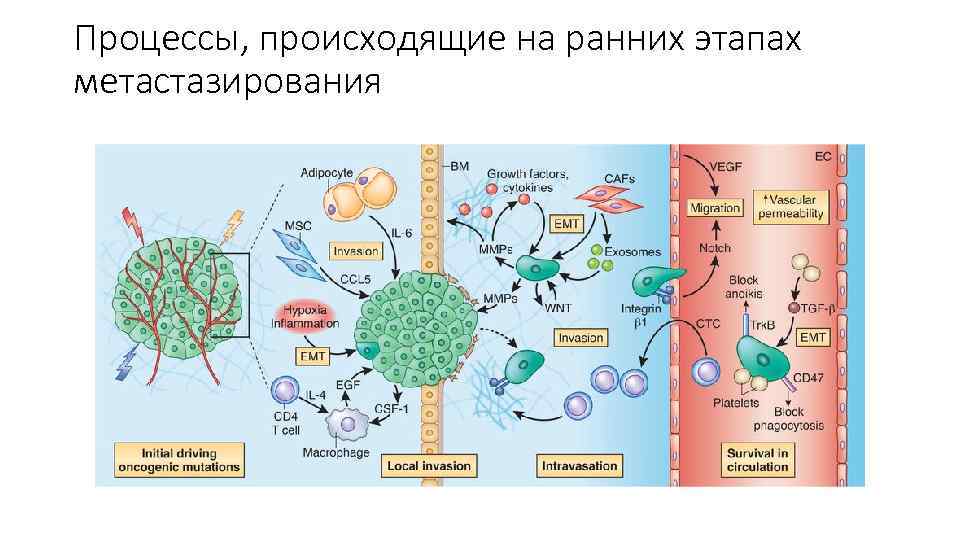
Процессы, происходящие на ранних этапах метастазирования

Процесс гематогенного дисеминирования

Hallmarks of cancer

Изменение клеточной энергетики Опухолевые клетки используют анаэробный гликолиз даже при условии доступа к достаточному количеству кислорода. Недостаточную эффективность анаэробного гликолиза они компенсируют повышенным транспортом глюкозы в клетки, увеличивая количество GLUT-1. Чем можно объяснить данный феномен? 1. Промежуточные продукты гликолиза идут на синтез нуклеозидов и аминокислот, необходимых для пролиферации. 2. Содержание кислорода внутри опухоли колеблется в следствии неравномерного роста сосудов 3. В опухоли есть популяция клеток, которая в условиях гипоксии производит лактат, а другая получает лактат от первой и использует его в Цикле Кребса, так как её потребность в кислороде удовлетворена. 4. Активированные онкогены (RAS, MYC) могут способствовать экспрессии генов ферментов, участвующих в анаэробном гликолизе.

Метаболические пути, активные в пролиферирующих клетках, напрямую управляются сигнальными путями, в которых участвуют онкогены и онкосупрессоры. Активация рецепторов к ростовым факторам приводит к включению тирозинкиназ и PI 3 K. Через AKT, активация PI 3 K стимулирует захват глюкозы и её утилизацию на ранних стадиях гликолиза. Тирозинкиназы отрицательно регулирую входящий поток глюкозы через поздние стадии гликолиза, делая промежуточные продукты гликолиза доступными для синтеза макромолекул и NADH. Myc управляет метаболизмом глутамина, который в свою очередь поддерживает продукцию NADH. LKB 1/AMPK сигнальный путь и p 53 снижают интенсивность гликолиза в ответ на клеточный стресс. Замедление гликолиза через LKB/AMPK или p 53 может быть приспособительной реакцией в виде остановки пролиферативных процессов в условиях недостатки энергии или оксидативного стресса.

A Продукция ингибиторных метаболитов, таких как R 2‑гидроксиглутарат (R-2 HG) и S-2 HG мутантной изоцитрат дегидрогеназой(IDH) и активность лактат дегидрогеназы(LDH), в свою очередь, увеличивает метилирование ДНК и гистонов при помощи конкурентного ингибирования α‑кетоглутарат (α-KG)-зависимой Jumonji‑C (JMJC) домен-содержащей гистондемиталазы(JHDMs) и TET деметилаз. b | Доступность метаболитов, используемых в качестве меток для изменения гистонов зависит от энергетического статуса клетки. Например, клетка с дефицитом нутриентов может активировать AMP-activated protein kinase (AMPK) при снижение уровней метионина и ацетил - КОА, что приводит к измененной экспрессии генов приспособительной реакции, в следствие изменений в фосфорилировании, метилировании и ацетилировании хроматина. c | Прямое рекрутирование ферментов к специфическим сайтам хроматина обеспечивает сайтспецифичную продукцию субстратов и модификацию гистонов. Например, изоформа 2 -го типа (МАТ 2 А) S‑аденозилметионин (SAM) синтазы синтезирует SAM для метилирования гистонов в определенных местах. Также, ядерная АТФ-цитрат лиаза (ACLY), ацил-Ко. А-синтетаза короткоцепочечных кислот family member 2 (ACSS 2)и пируватдегидрогеназный комплекс (PDC) производят ацетил-Ко. А в месте, где его использует лизинацетилтрансфераза (KATs)для ацетилирования гистонов, что приведет к регуляции генов. MT, метилтрансферазы; TF, транскрипционного фактора.

Нестабильность генома Приобретение черт из Hallmarks of cancer зависит от нестабильности генома клетки. Каждая вышеперечисленная мутация предоставляет клетке эволюционная преимущество, что приводит к экспансии её клонов. Развитие опухоли – это серия клональных экспансий, в результате чего опухоль состоит из гетерогенных популяций клеток. Частота мутаций в опухолевых клетках увеличивается за счет нарушения функционирования систем репарации и контроля за сохранностью ДНК (DDR – DNA damage response). В развитии гетерогенности опухоли играют роль и эпигенетические изменения.

Накопление изменений в ДНК клетки, приводит к опухолевому росту.


DNA damage response


Иммуноонкология В этом разделе объединены механизмы ухода опухоли от иммунного ответа и вклад воспаления в онкогенез. Взаимодействие иммунной и системы и опухолей на данный момент представляется противоречивым процессом. С одной стороны иммунная система способна распознавать опухолевые клетки и уничтожать их, а с другой стороны некоторые элементы иммунитета и иммунные реакции способствуют развитию и прогрессированию опухолей.

Концепция иммунного надзора
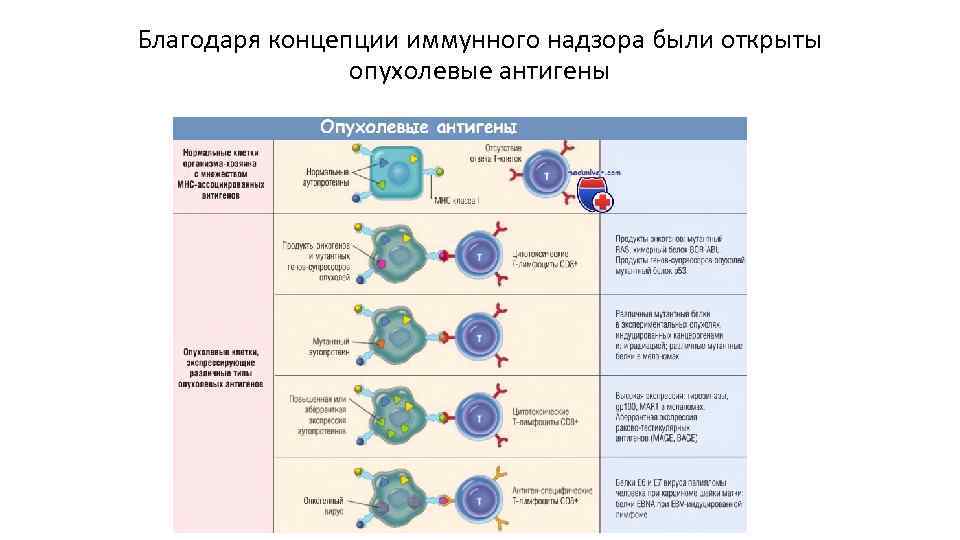
Благодаря концепции иммунного надзора были открыты опухолевые антигены

Разработаны современные иммунотерапевтические препараты

Проходят клинические испытания новые терапевтические методы

Концепция иммунного редактирования (Immunoediting)



Myeloid derived suppressor cell

Tumor associated macrophage


Спасибо за внимание!
Биология опухолевого роста.pptx