Строение белков.ppt
- Количество слайдов: 44

Биологические макромолекулы

Белки • В организме человека существует около 30 000 различных белков • В клетках одного типа у человека содержится около 10 000 белков
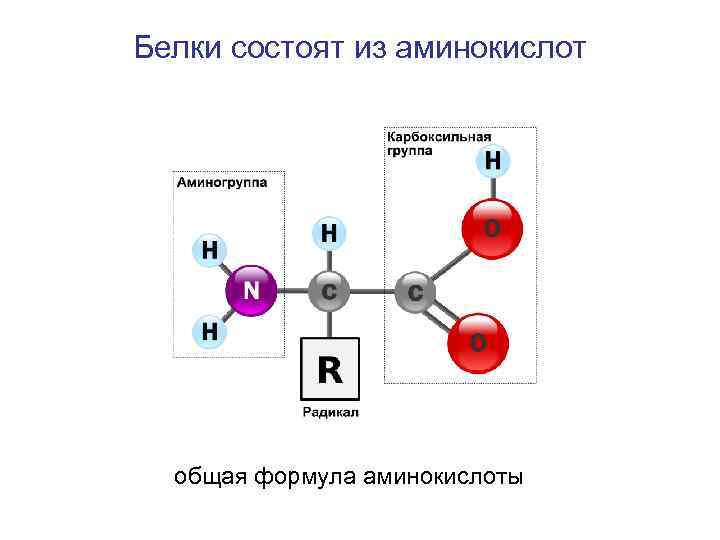
Белки состоят из аминокислот общая формула аминокислоты
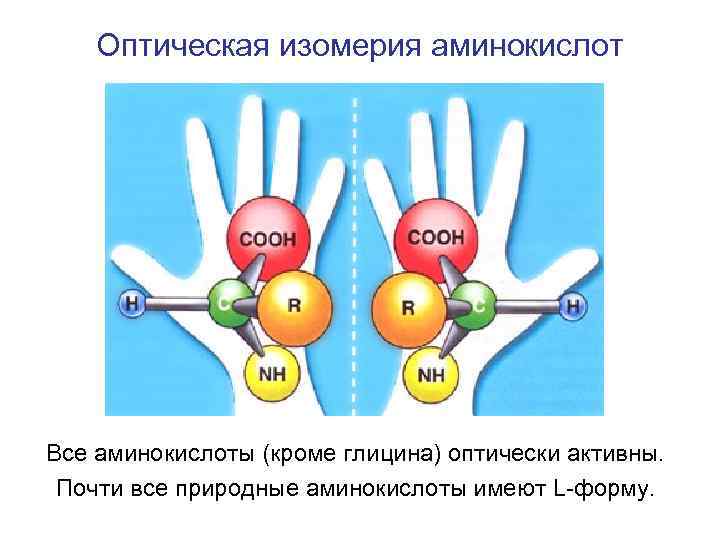
Оптическая изомерия аминокислот Все аминокислоты (кроме глицина) оптически активны. Почти все природные аминокислоты имеют L-форму.

D-аминокислоты в природе • D-аспарагиновая кислота в эмали зубов (скорость перехода из L в D форму ~ 0, 1% в год) • D-аспарагиновая кислота и D-метионин возможно являются нейромедиаторами • D-метионин и D-аланин в составе пептидов кожи филломедуз, действуют как анальгетики • D-аминокислоты входят в состав антибиотиков у бактерий Phyllomedusa boliviana

Классификация аминокислот 5 групп в зависимости от полярности

Классификация аминокислот Неполярные (гидрофобные): 1. Глицин (Gly, Гли, G) M=75, в белках 7, 5% Применяется в качестве ноотропного средства в медицине
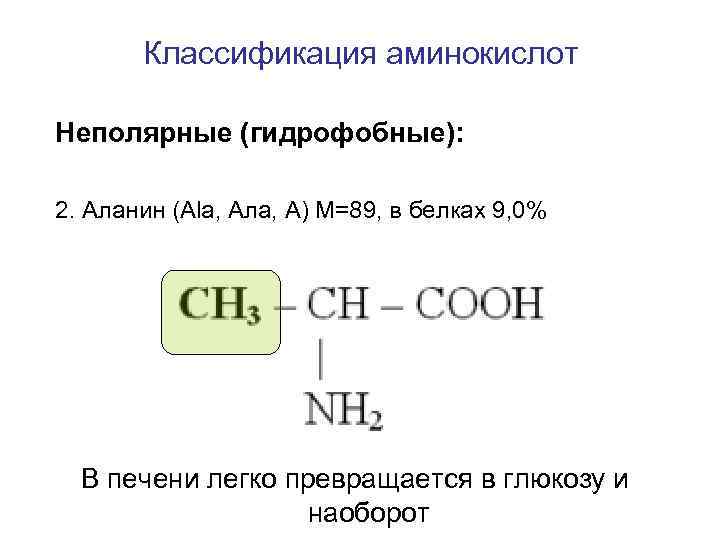
Классификация аминокислот Неполярные (гидрофобные): 2. Аланин (Ala, Ала, А) M=89, в белках 9, 0% В печени легко превращается в глюкозу и наоборот
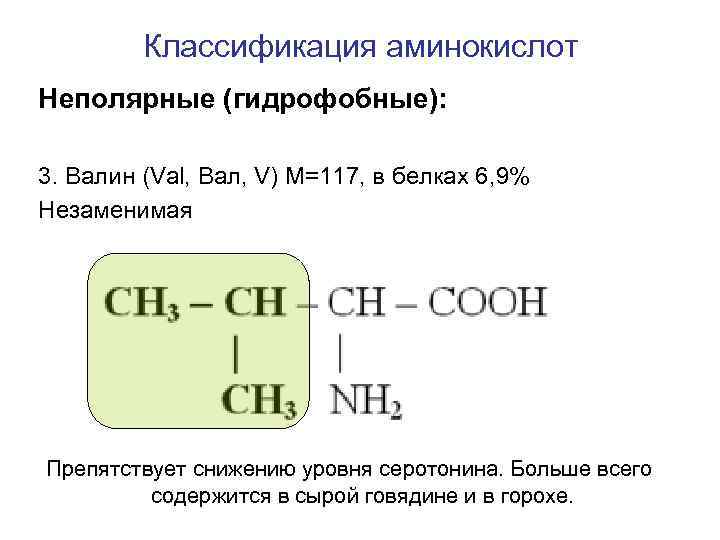
Классификация аминокислот Неполярные (гидрофобные): 3. Валин (Val, Вал, V) M=117, в белках 6, 9% Незаменимая Препятствует снижению уровня серотонина. Больше всего содержится в сырой говядине и в горохе.
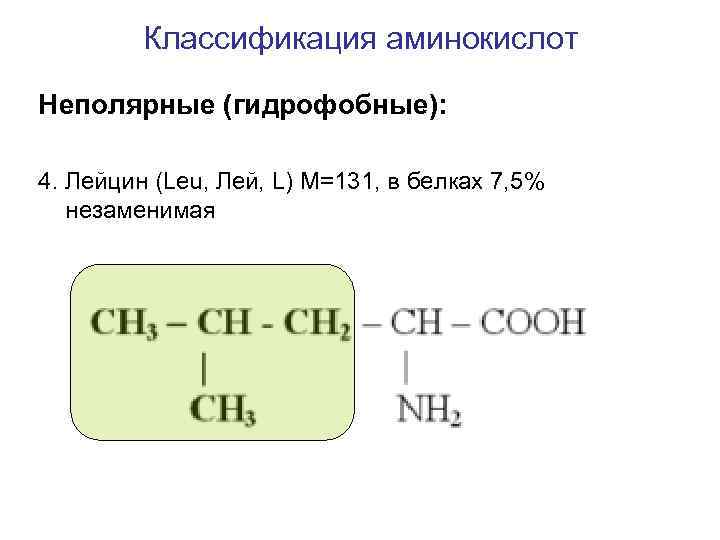
Классификация аминокислот Неполярные (гидрофобные): 4. Лейцин (Leu, Лей, L) M=131, в белках 7, 5% незаменимая
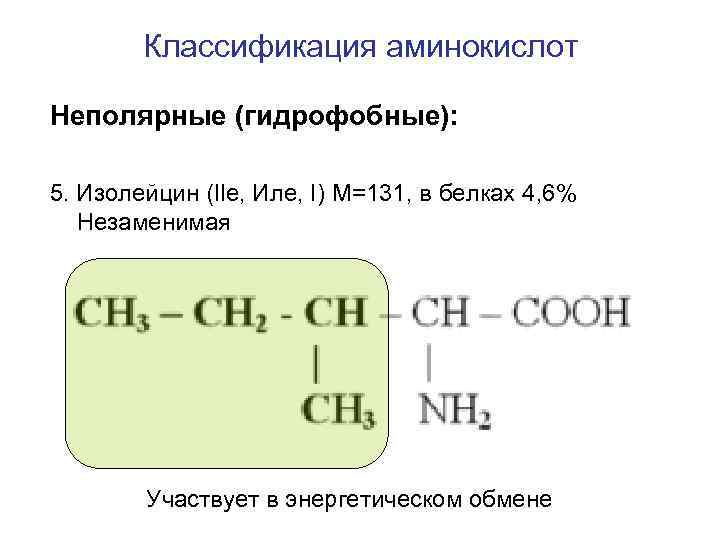
Классификация аминокислот Неполярные (гидрофобные): 5. Изолейцин (Ile, Иле, I) M=131, в белках 4, 6% Незаменимая Участвует в энергетическом обмене
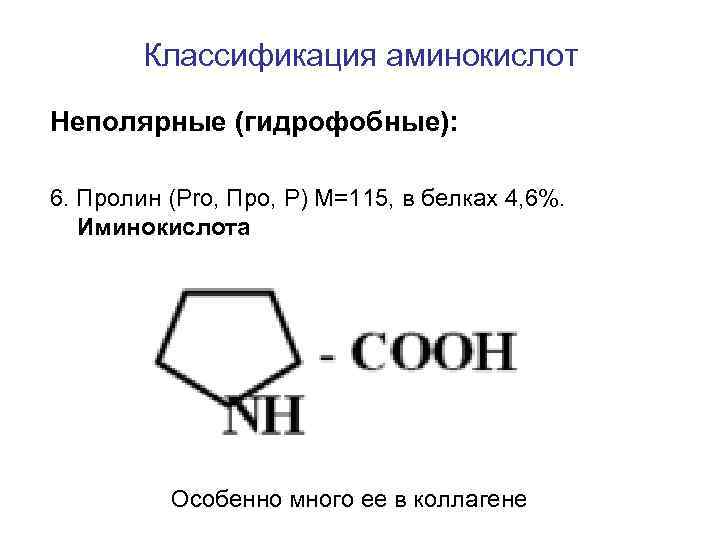
Классификация аминокислот Неполярные (гидрофобные): 6. Пролин (Pro, Про, P) M=115, в белках 4, 6%. Иминокислота Особенно много ее в коллагене
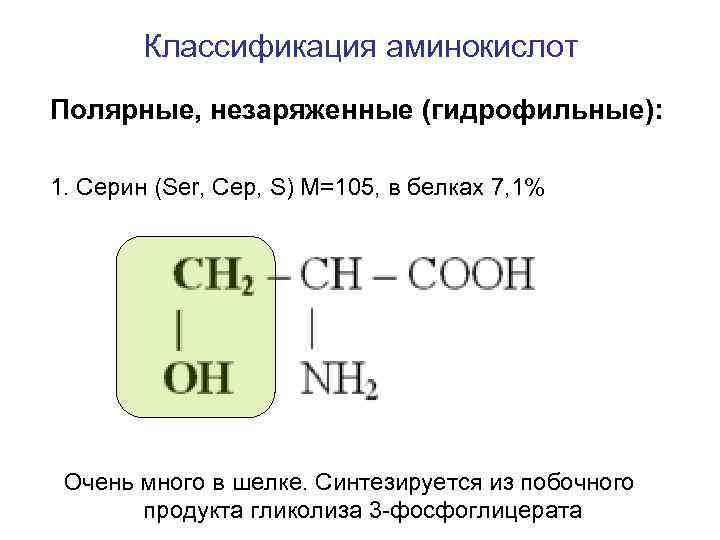
Классификация аминокислот Полярные, незаряженные (гидрофильные): 1. Серин (Ser, Сер, S) M=105, в белках 7, 1% Очень много в шелке. Синтезируется из побочного продукта гликолиза 3 -фосфоглицерата
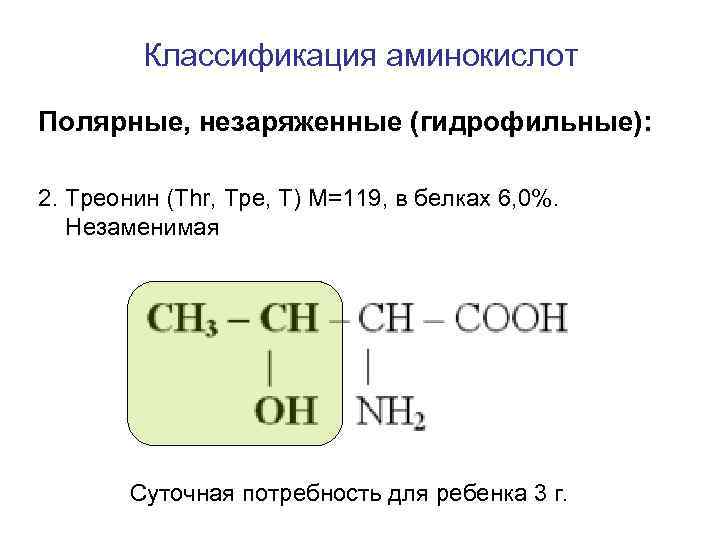
Классификация аминокислот Полярные, незаряженные (гидрофильные): 2. Треонин (Thr, Тре, T) M=119, в белках 6, 0%. Незаменимая Суточная потребность для ребенка 3 г.
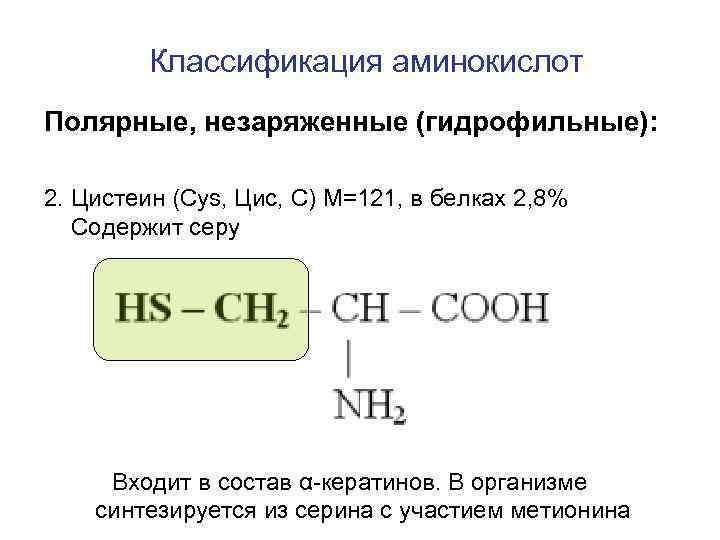
Классификация аминокислот Полярные, незаряженные (гидрофильные): 2. Цистеин (Cys, Цис, C) M=121, в белках 2, 8% Содержит серу Входит в состав α-кератинов. В организме синтезируется из серина с участием метионина

Классификация аминокислот Полярные, незаряженные (гидрофильные): 3. Метионин (Met, Мет, М) M=149, в белках 1, 7% Содержит серу, Незаменимая В организме донор метильных групп и серы. Больше всего в бразильском орехе, лососе, свинине, куриных яйцах

Классификация аминокислот Полярные, незаряженные (гидрофильные): 4. Аспарагин (Asn, Асн, N) M=132, в белках 4, 4% Содержит амидогруппу Необходим для нормального функционирования нервной системы, участвует в метаболизме аммиака. Больше всего в спарже

Классификация аминокислот Полярные, незаряженные (гидрофильные): 5. Глутамин (Gln, Глн, Q) M=146, в белках 3, 9% Содержит амидогруппу Более 15 функций в организме. Используется как добавка в пищу спортсменами.
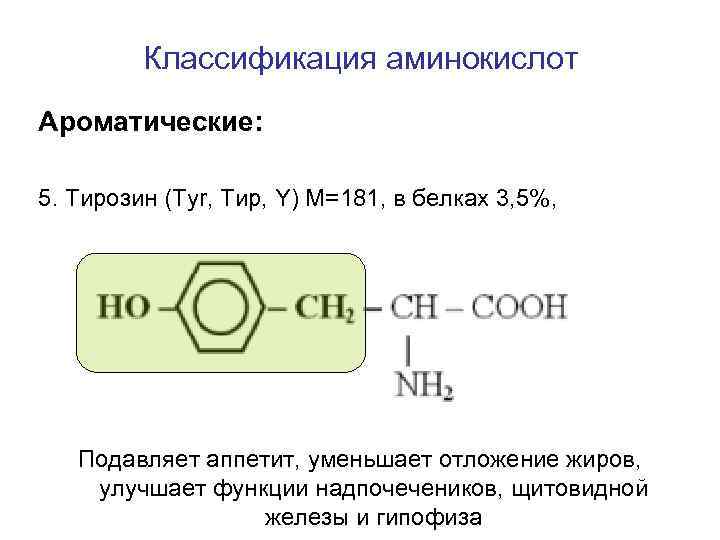
Классификация аминокислот Ароматические: 5. Тирозин (Tyr, Тир, Y) M=181, в белках 3, 5%, Подавляет аппетит, уменьшает отложение жиров, улучшает функции надпочечеников, щитовидной железы и гипофиза
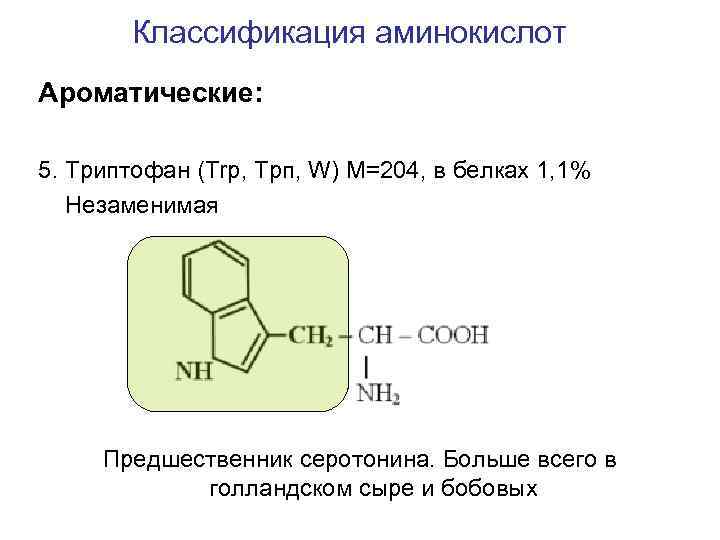
Классификация аминокислот Ароматические: 5. Триптофан (Trp, Трп, W) M=204, в белках 1, 1% Незаменимая Предшественник серотонина. Больше всего в голландском сыре и бобовых
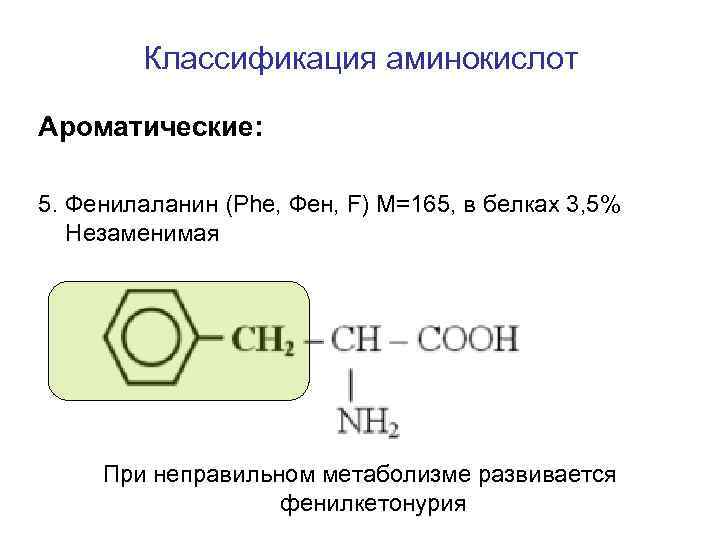
Классификация аминокислот Ароматические: 5. Фенилаланин (Phe, Фен, F) M=165, в белках 3, 5% Незаменимая При неправильном метаболизме развивается фенилкетонурия

Классификация аминокислот Отрицательно заряженные (кислые): 1. Аспарагиновая кислота (Asp, Асп, D) M=133, в белках 5, 5% Нейромедиатор. Аспаргинаты натрия и магния используются для лечения болезней сердечнососудистой системы

Классификация аминокислот Отрицательно заряженные (кислые): 2. Глутаминовая кислота (Glu, Глу, E) M=147, в белках 6, 2% Играет роль в азотистом обмене, нейромедиатор

Классификация аминокислот Положительно заряженные (основные): 1. Лизин (Lys, Лиз, К) M=146, в белках 7, 0% Незаменимая Оказывает противовирусное действие. Дефицит приводит к слабости, раздражительности, потере волос и т. п. Источники – баранина, свинина, пармезан, бобовые

Классификация аминокислот Положительно заряженные (основные): 2. Аргинин (Arg, Арг, R) M=174, в белках 4, 7% Незаменима для детей Один из ключевых метаболитов азотистого обмена. Больше всего в тыквенных семечках, орехах и свинине
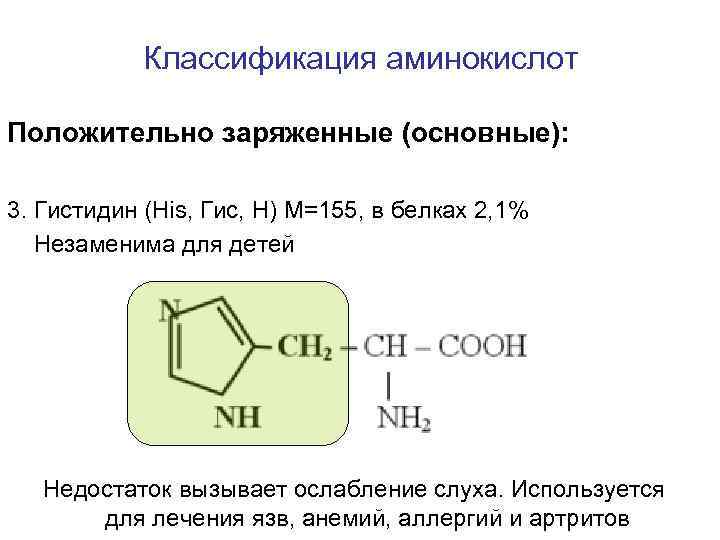
Классификация аминокислот Положительно заряженные (основные): 3. Гистидин (His, Гис, H) M=155, в белках 2, 1% Незаменима для детей Недостаток вызывает ослабление слуха. Используется для лечения язв, анемий, аллергий и артритов

Эмиль Фишер
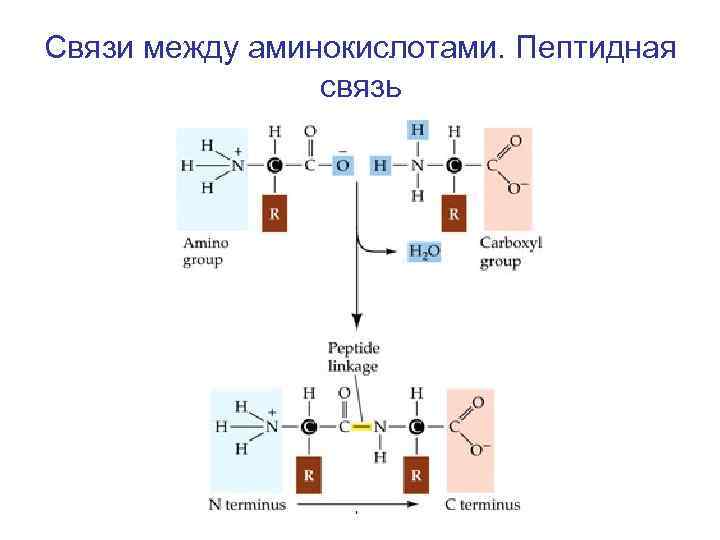
Связи между аминокислотами. Пептидная связь
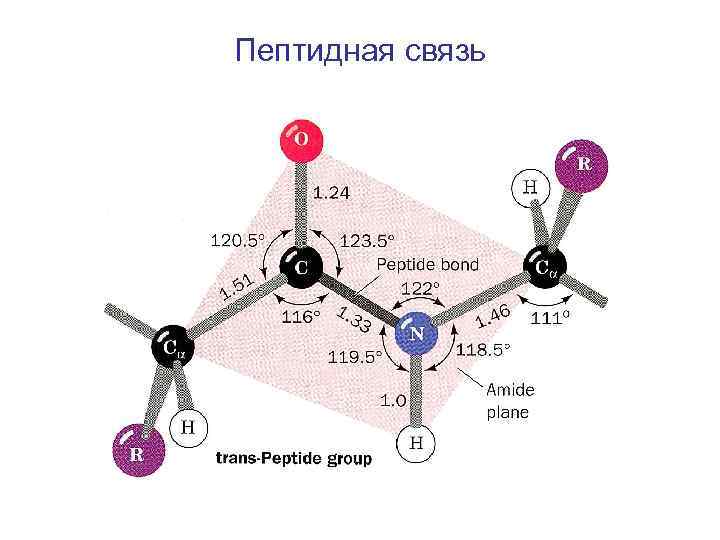
Пептидная связь

Бумажная хроматография

Фредерик Сэнгер и Инсулин
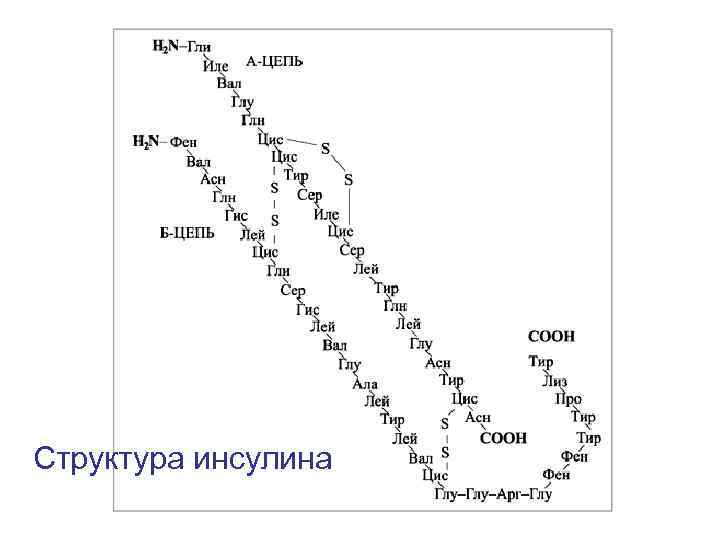
Структура инсулина
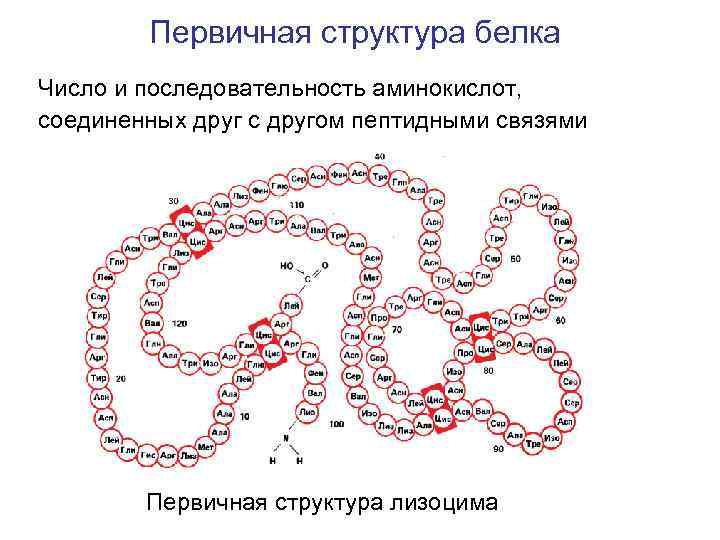
Первичная структура белка Число и последовательность аминокислот, соединенных друг с другом пептидными связями Первичная структура лизоцима
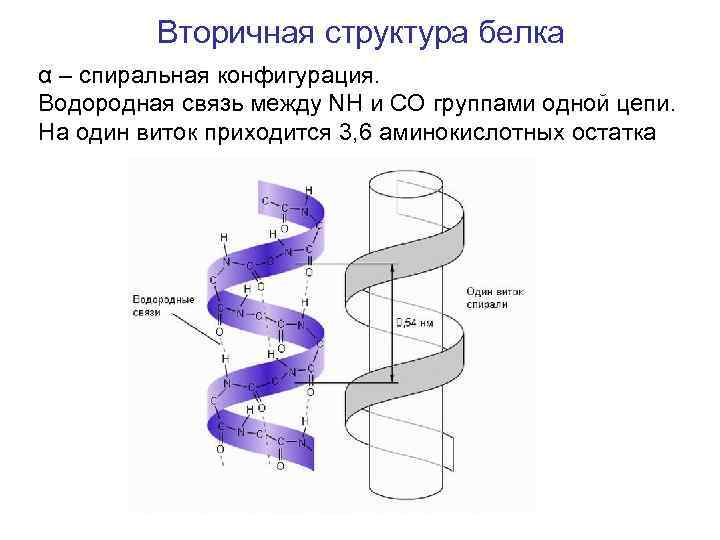
Вторичная структура белка α – спиральная конфигурация. Водородная связь между NH и CO группами одной цепи. На один виток приходится 3, 6 аминокислотных остатка
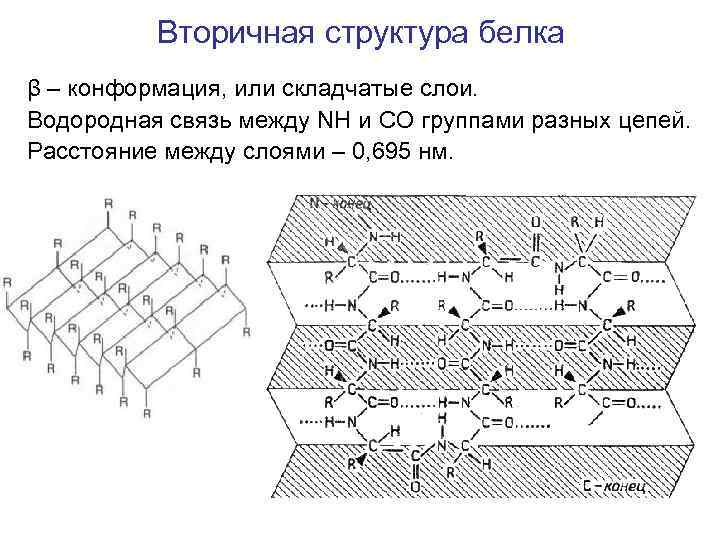
Вторичная структура белка β – конформация, или складчатые слои. Водородная связь между NH и CO группами разных цепей. Расстояние между слоями – 0, 695 нм.
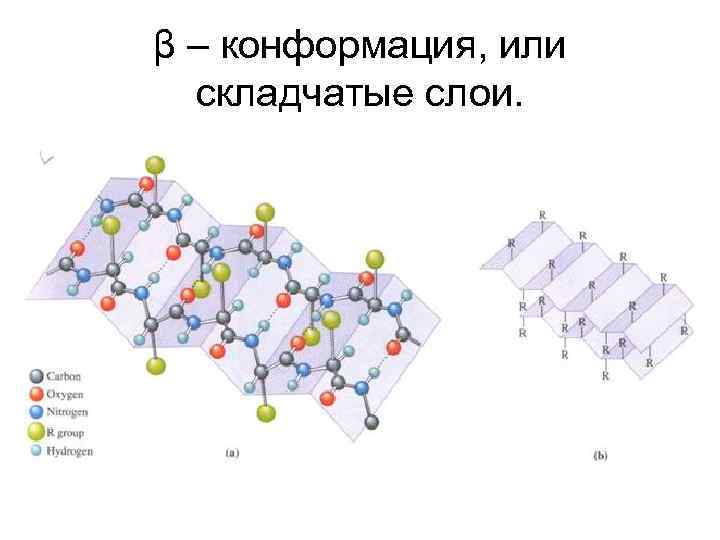
β – конформация, или складчатые слои.

Чередование α и β – слоев в белке
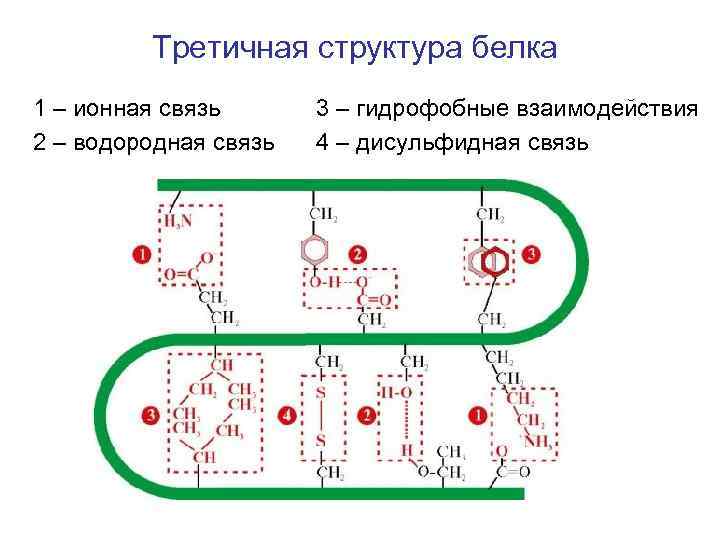
Третичная структура белка 1 – ионная связь 2 – водородная связь 3 – гидрофобные взаимодействия 4 – дисульфидная связь

Третичная структура белка Конформация миоглобина
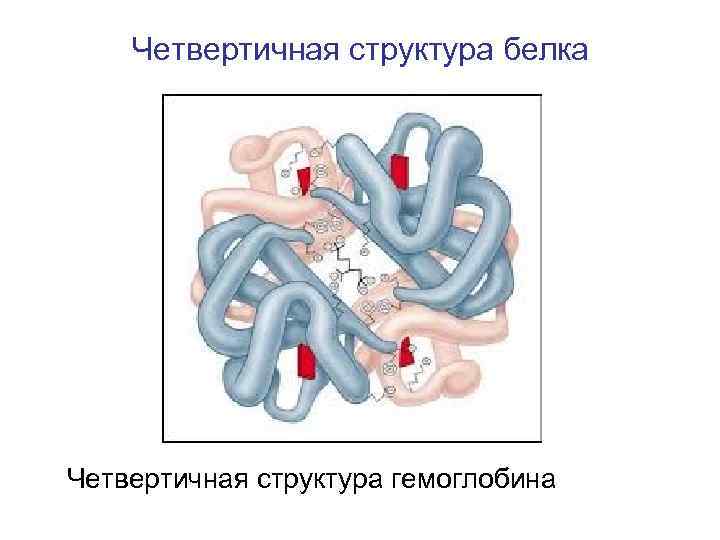
Четвертичная структура белка Четвертичная структура гемоглобина
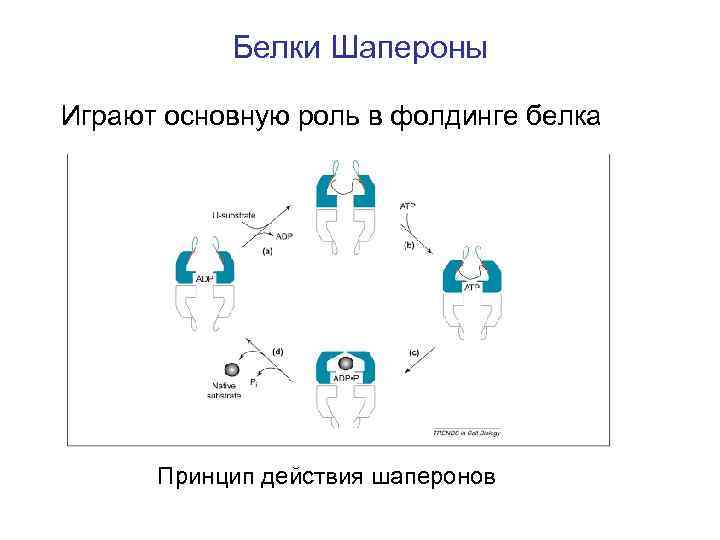
Белки Шапероны Играют основную роль в фолдинге белка Принцип действия шаперонов

Как узнать пространственную конфигурацию белка? Для белка в 100 аминокислот существует 100100 конформаций. Белок находит подходящую за 10 -13 секунды Кристаллы очищенных белков
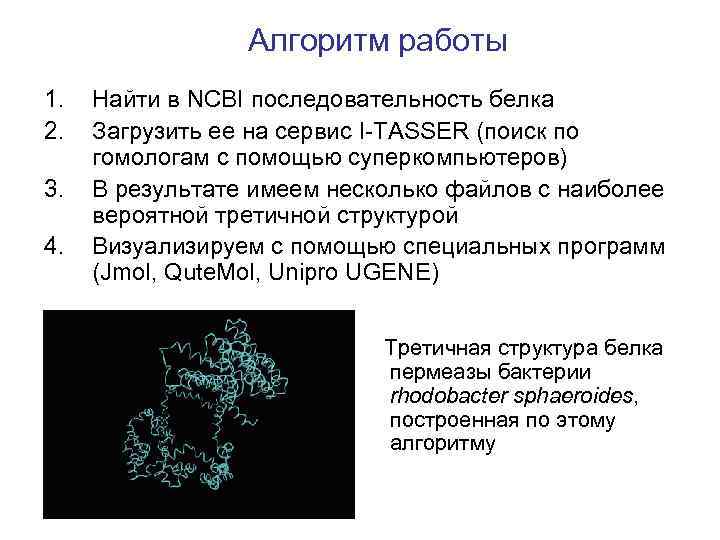
Алгоритм работы 1. 2. 3. 4. Найти в NCBI последовательность белка Загрузить ее на сервис I-TASSER (поиск по гомологам с помощью суперкомпьютеров) В результате имеем несколько файлов с наиболее вероятной третичной структурой Визуализируем с помощью специальных программ (Jmol, Qute. Mol, Unipro UGENE) Третичная структура белка пермеазы бактерии rhodobacter sphaeroides, построенная по этому алгоритму
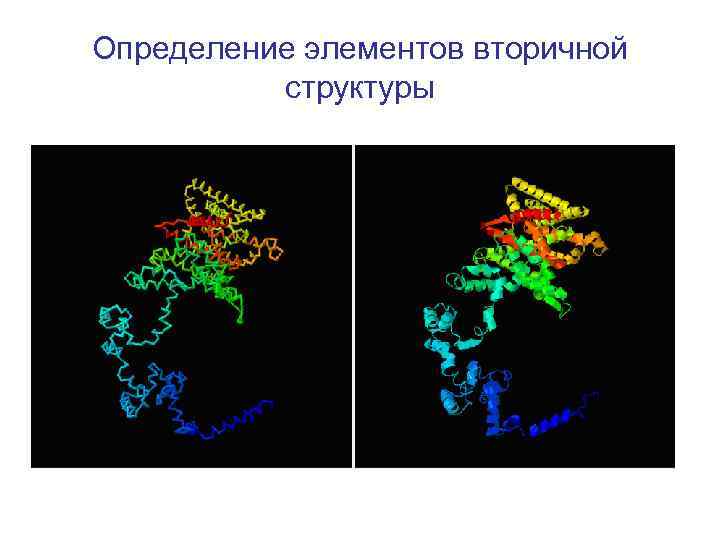
Определение элементов вторичной структуры
Строение белков.ppt