Лекция 8 Высокомолекулярные орг.соед..ppt
- Количество слайдов: 66

Биологически активные высокомолекулярные вещества Лекция 7 Кафедра медицинской и биологической химии ХМГМА

План лекции l l l Пептиды. Белки. Кислотный и щелочной гидролиз пептидов. Углеводы. Гомополисахариды. Гетерополисахариды. Липиды. Классификация. Омыляемые липиды. Стероиды. Нуклеиновые кислоты. Понятие о смешанных биополимерах (гликопротеины, гликолипиды, липопротеины). Полимеры. Понятие о полимерах медицинского (стоматологического) назначения.

l l l Высокомолекулярными называются химические соединения с высокой молекулярной массой (от нескольких тысяч до многих миллионов), молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок (мономерных звеньев). Высокомолекулярные соединения живой природы называют биополимерами. Важнейшие биополимеры: белки, полисахариды, сложные липиды, нуклеиновые кислоты. Основной реакцией их получения служит реакция поликонденсации. Синтетические полимеры получают реакциями полимеризации и поликонденсации.

Пептиды. Белки. Кислотный и щелочной гидролиз пептидов. Пептиды – соединения, содержащие в молекуле до 100 аминокислотных остатков. Пептиды, содержащие менее 10 остатков аминокислот называются олигопептидами, более 10 – полипептидами. Белки – высокомолекулярные соединения, содержащие в молекуле свыше 100 аминокислотных остатков.
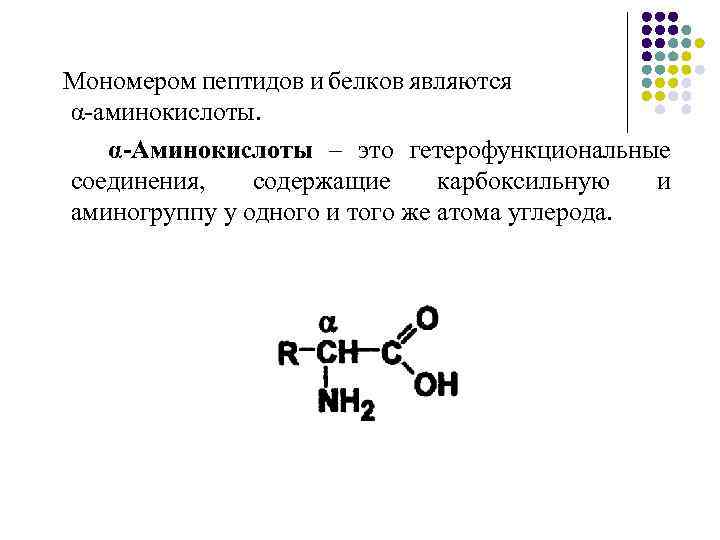
Мономером пептидов и белков являются α-аминокислоты. α-Аминокислоты – это гетерофункциональные соединения, содержащие карбоксильную и аминогруппу у одного и того же атома углерода.

Классификация основных аминокислот белков по их химическому строению

Структура пептидов и белков l l l Пептиды и белки образуются в результате взаимодействия карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты. Аминокислотная последовательность, то есть порядок чередования α-аминокислотных остатков определяет первичную структуру пептидов и белков. Данный вид связи называется пептидной или карбамидной (ковалентная химическая связь). Помимо пептидной связи в первичной структуре присутствуют и дисульфидные связи.
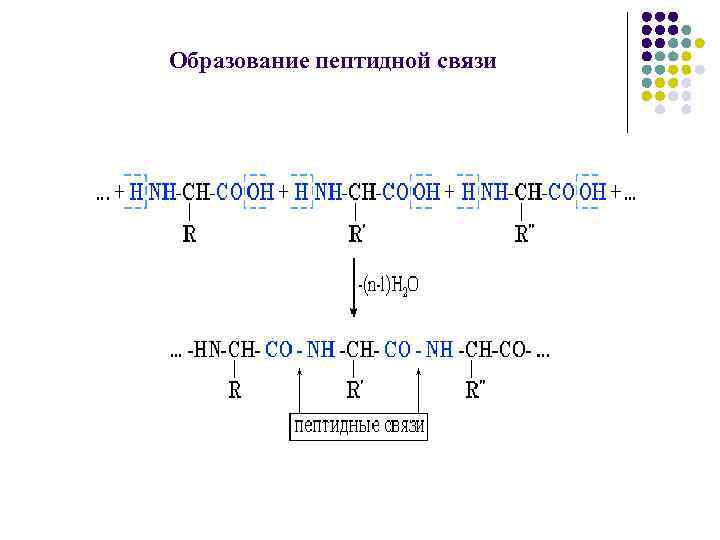
Образование пептидной связи
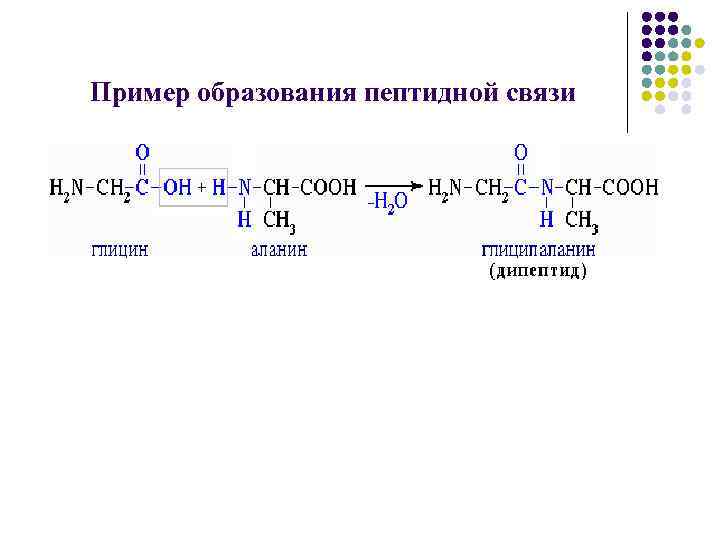
Пример образования пептидной связи
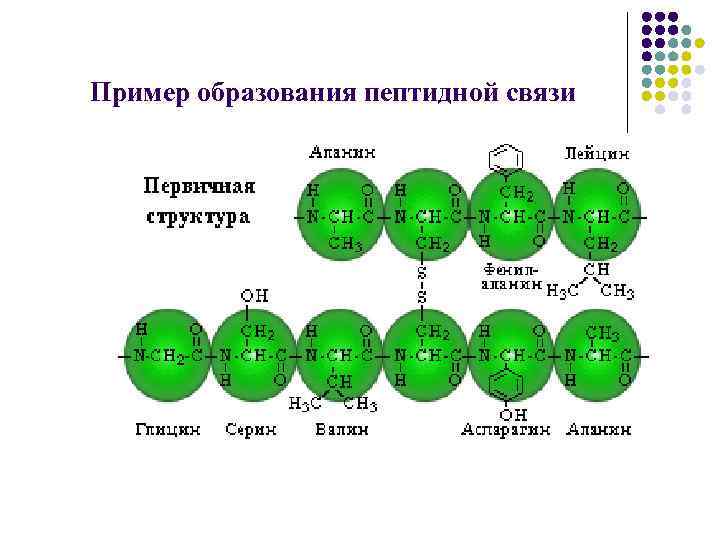
Пример образования пептидной связи
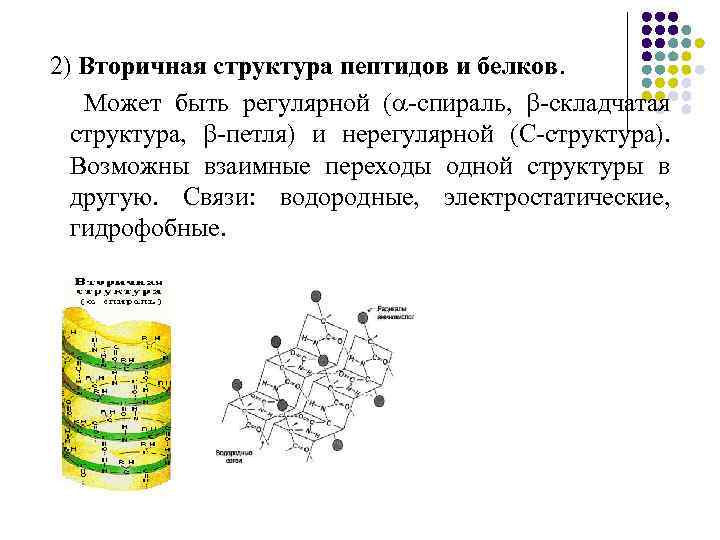
2) Вторичная структура пептидов и белков. Может быть регулярной ( -спираль, -складчатая структура, -петля) и нерегулярной (С-структура). Возможны взаимные переходы одной структуры в другую. Связи: водородные, электростатические, гидрофобные.
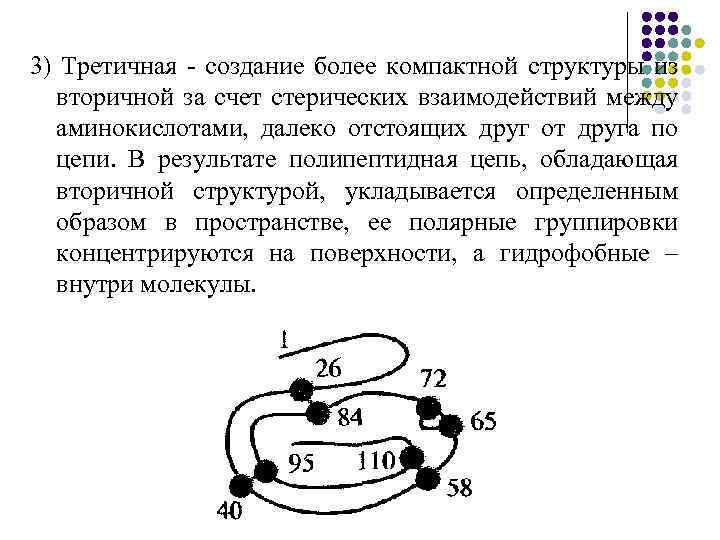
3) Третичная - создание более компактной структуры из вторичной за счет стерических взаимодействий между аминокислотами, далеко отстоящих друг от друга по цепи. В результате полипептидная цепь, обладающая вторичной структурой, укладывается определенным образом в пространстве, ее полярные группировки концентрируются на поверхности, а гидрофобные – внутри молекулы.
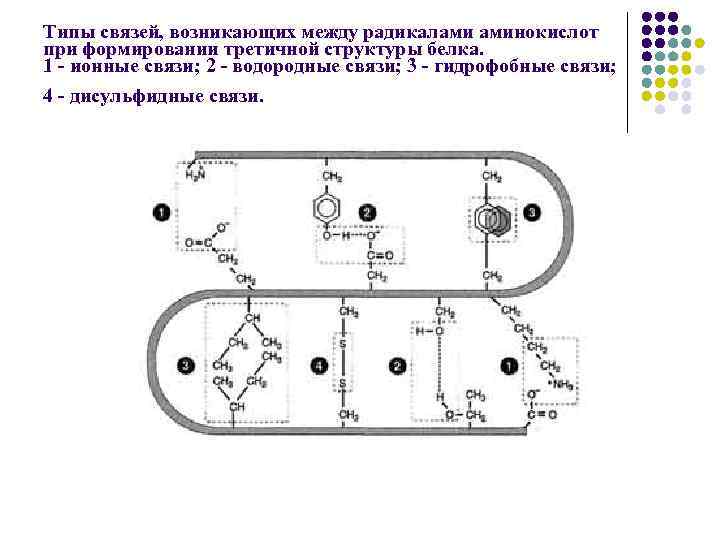
Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка. 1 - ионные связи; 2 - водородные связи; 3 - гидрофобные связи; 4 - дисульфидные связи.
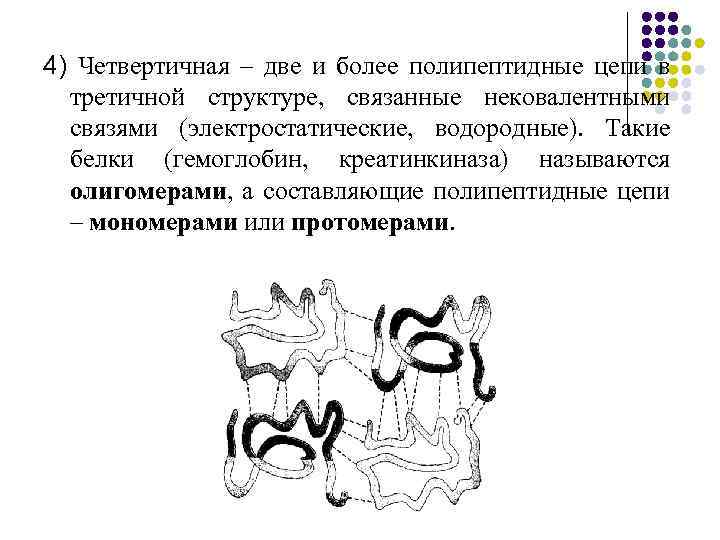
4) Четвертичная – две и более полипептидные цепи в третичной структуре, связанные нековалентными связями (электростатические, водородные). Такие белки (гемоглобин, креатинкиназа) называются олигомерами, а составляющие полипептидные цепи – мономерами или протомерами.
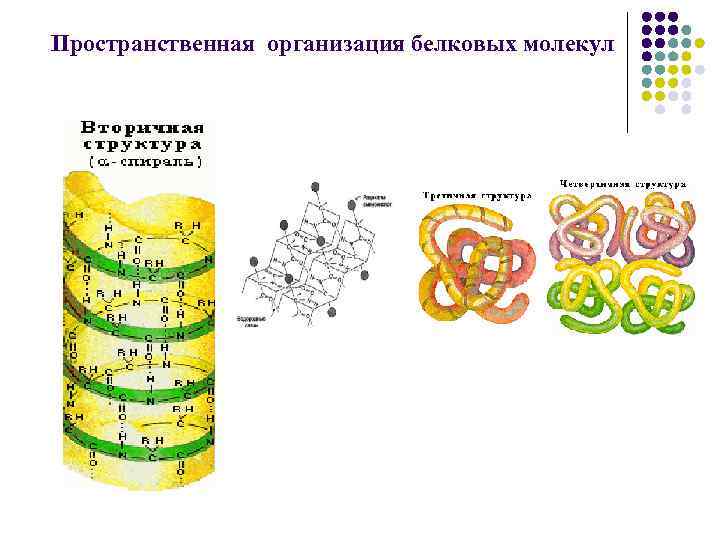
Пространственная организация белковых молекул
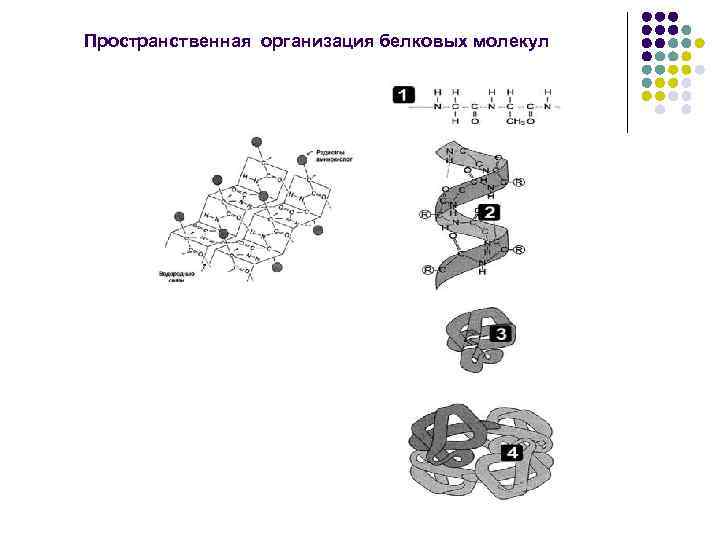
Пространственная организация белковых молекул

l На долю белков внутри клетки приходится более половины их сухого вещества. В организме человека насчитывают около 50 000 индивидуальных белков. Видовая и индивидуальная специфичность набора белков в данном организме определяет особенности его строения и функционирования. Набор белков в дифференцирующихся клетках одного организма определяет морфологические и функциональные особенности каждого типа клеток.

По форме белки делятся на глобулярные (соотношение продольной и поперечной осей менее 10, шарообразная форма, растворимы в воде и солевых растворах) и фибриллярные (имеют волокнистую структуру, практически не растворимы в воде и солевых растворах). В некоторых белках (>200 аминокислот) присутствуют домены – участки цепи, пространственно сформированные отдельно друг от друга, но соединенные между собой полипептидной цепью. l l Доменная структура белков Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи кон-формацию глобулярного белка. Так, лёгкая цепь иммуноглобулина G состоит из двух доменов. В

Функции белков: Ø Пластическая; Ø Каталитическая; Ø Транспортная; Ø Механохимическая; Ø Функция управления (гормоны и регуляторы различных процессов, анальгетики); Ø Защитная (свертывание крови, антитела).

Классификация белков До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать: l по форме молекул (глобулярные или фибриллярные); l по молекулярной массе (низкомолекулярные, высокомолекулярные и др. ); l по химическому строению (наличие или отсутствие небелковой части); l по выполняемым функциям (транспортные, защитные, структурные белки и др. ); l по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др. ); l по локализации в организме (белки крови, печени, сердца и др. ); l по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные); l по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т 1/2 менее 1 ч, до очень медленно обновляющихся белков, Т 1/2 которых исчисляют неделями и месяцами); l по схожим участкам первичной структуры и родственным функциям (семейства белков).

1. Ферменты l l Ферменты - специализированные белки, ускоряющие течение химических реакций. Благодаря ферментам в клетке скорости химических реакций возрастают в миллионы раз. Так как ферменты, как и любые белки, имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип химического превращения данной молекулы. В настоящее время известно около 2000 различных ферментов, ускоряющих различные химические реакции. Например, протеолитический фермент трипсин разрушает в белках пептидные связи, образованные карбоксильной группой основных аминокислот - аргинина или лизина. Фермент рибонуклеаза расщепляет фосфоэфирную связь между нуклеотидами в полинуклеотидной цепи. Благодаря набору ферментов в клетках превращения поступающих в них веществ протекают не хаотично, а в строго определённых направлениях.

2. Регуляторные белки l l l К регуляторным белкам относят большую группу белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки-мишени. Например, гормон инсулин выделяется в кровь при повышении концентрации глюкозы в крови после еды и, стимулируя использование глюкозы клетками, снижает концентрацию глюкозы до нормы, т. е. восстанавливает гомеостаз. Кроме того, к регуляторным относят белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию. Например, белок кальмодулин в комплексе с четырьмя ионами Са 2+ может присоединяться к некоторым ферментам, меняя их активность. Регуляторные ДНК-связывающие белки, присоединяясь в определённые моменты к специфичным участкам ДНК, могут регулировать скорость считывания генетической информации (они описаны в разделе 4).

3. Рецепторные белки l Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки -мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток.

4. Транспортные белки l l Многие белки крови участвуют в переносе специфических лигандов из одного органа к другому. Часто в комплексе с белками переносятся молекулы, плохо растворимые в воде. Так, белок плазмы крови альбумин переносит жирные кислоты и билирубин (продукт распада гема), а гемоглобин эритроцитов участвует в переносе О 2 от лёгких к тканям. Стероидные гормоны переносятся в крови специфическими транспортными белками. Транспортные белки участвуют также в переносе гидрофильных веществ через гидрофобные мембраны. Так как транспортные белки обладают свойством специфичности взаимодействия с лигандами, их набор в клеточной мембране определяет, какие гидрофильные молекулы могут пройти в данную клетку. С помощью белковпереносчиков в клетку проникают глюкоза(ГЛЮТ), аминокислоты, ионы и другие молекулы.

5. Структурные белки l Некоторые белки, расположенные определённым образом в тканях, придают им форму, создают опору, определяют механические свойства данной ткани. Например, главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий высокую прочность. Другой структурный белок (эластин) благодаря своему уникальному строению обеспечивает определённым тканям свойство растягиваться во всех направлениях (сосуды, лёгкие).

6. Защитные белки l l Некоторые белки, в частности иммуноглобулины, обладают способностью узнавать и связывать чужеродные молекулы, вирусные частицы и бактерии, в результате чего происходит их нейтрализация. Кроме того, комплекс чужеродной частицы с иммуноглобулином легко узнаётся и уничтожается клетками иммунной системы. Защитными свойствами обладают белки свёртывающей системы крови, например фибриноген, тромбин. Они участвуют в формировании тромба, который закупоривает повреждённый сосуд и препятствует потере крови.

7. Сократительные белки l Некоторые белки при выполнении своих функций наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин - фибриллярные белки, участвующие в сокращении скелетных мышц. Другой пример таких белков - тубулин, из которого построены клеточные органеллы - микротрубочки. Микротрубочки в период деления клетки регулируют расхождение хроматид. Микротрубочки - важные элементы ресничек и жгутиков, с помощью которых клетки передвигаются.

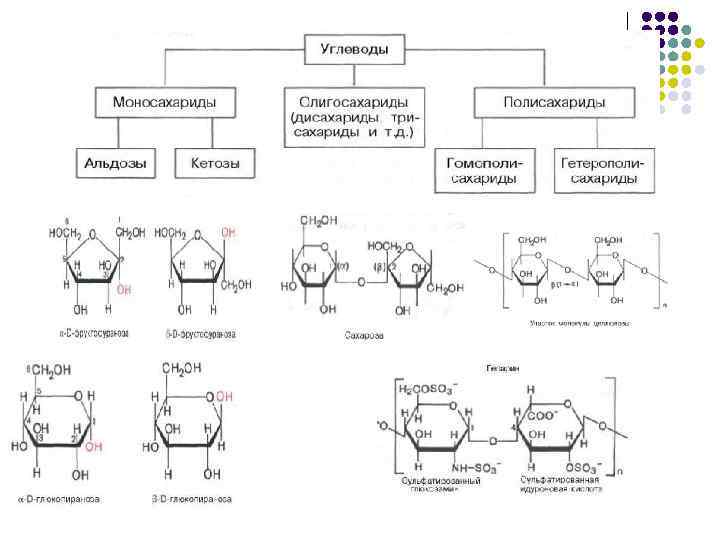
Углеводы l Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода. Водород и кислород, как правило, находятся в таком же соотношении, что и в молекуле воды, поэтому общую формулу записывают так: Сn(Н 2 О)n. l Углеводы по способности гидролизоваться делят на: Моносахариды – углеводы не гидролизующиеся с образованием более простых углеводов. Олигосахариды – углеводы, содержащие 2 -10 моносахаридных остатков. Полисахариды – гликаны – углеводы, в структуре которых более 10 моносахаридных остатков l l l Гомополисахариды – состоят из углеводных остатков одного моносахарида (целлюлоза, гликоген, пектиновые вещества). Гетерополисахариды – состоят из углеводных остатков разных моносахаридов (гиалуроновая кислота, хондроитинсульфат).
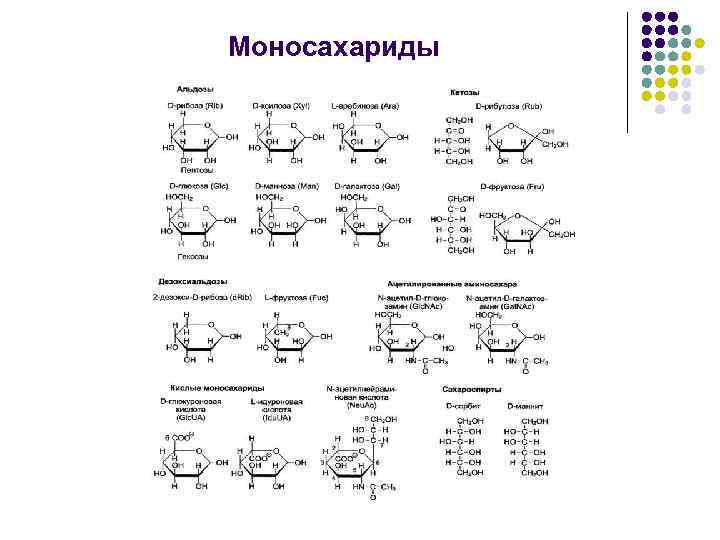
Моносахариды
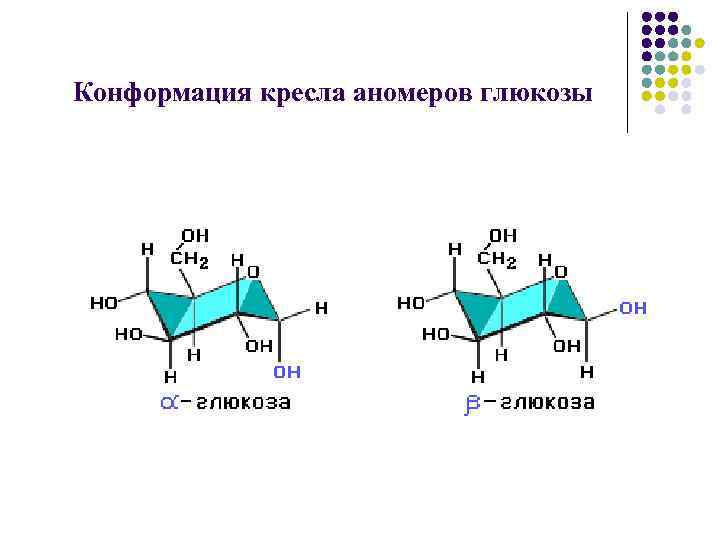
Конформация кресла аномеров глюкозы

Полисахариды Гомополисахариды l Крахмал состоит из двух полимеров, состоящих из молекул D-глюкозы, связанных α-1 -4 и α-1 -6 гликозидными связями: l Амилоза (линейная форма); l Амилопектин (разветвленная форма). Источники: зерна злаков, клубни, луковицы. Продукты гидролиза: декстрины, мальтоза и глюкоза. l Гликоген (животный крахмал) состоит из молекул D-глюкозы, связанных α-1 -4 и α-1 -6 гликозидными связями. l Целлюлоза состоит из молекул D-глюкозы, связанных β-1 -4 -гликозидными связями
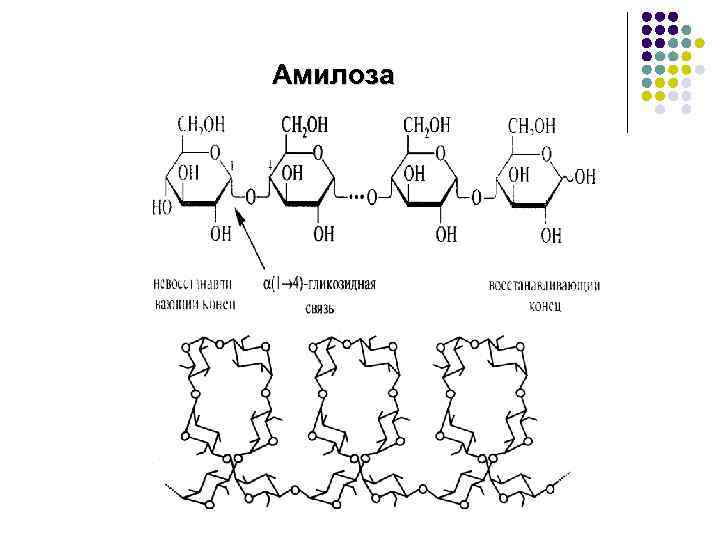
Амилоза

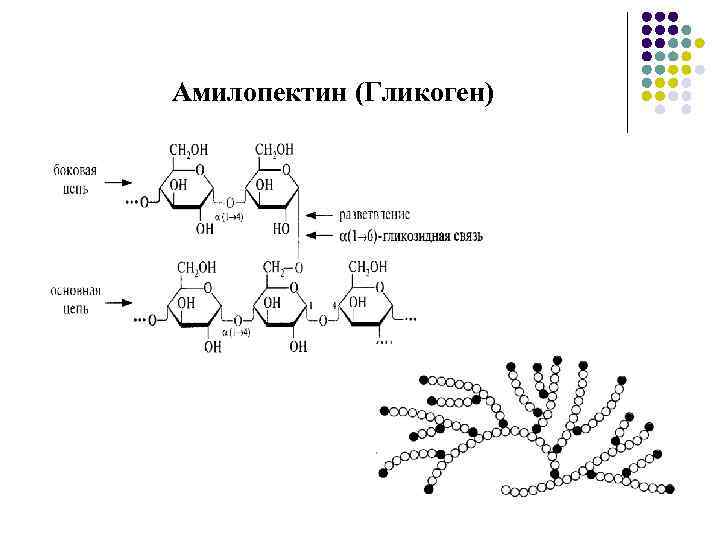
Амилопектин (Гликоген)
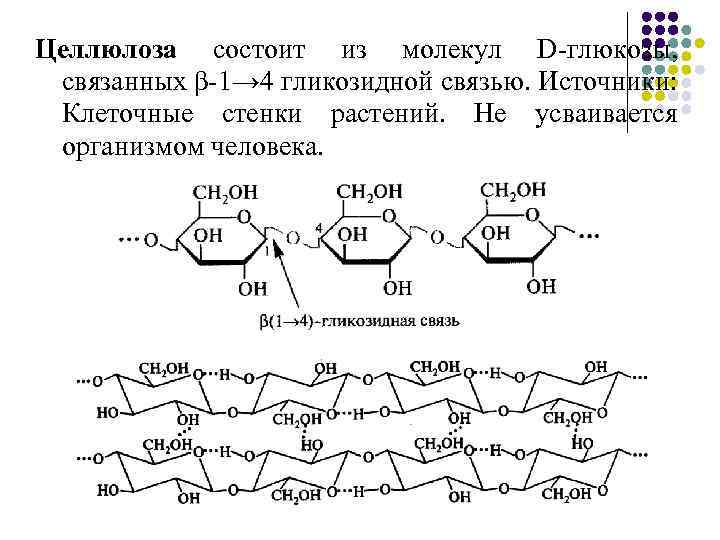
Целлюлоза состоит из молекул D-глюкозы, связанных β-1→ 4 гликозидной связью. Источники: Клеточные стенки растений. Не усваивается организмом человека.

Гетерополисахариды – мукополисахариды Это углеводы построенные из повторяющихся дисахаридных единиц. Компоненты межклеточного матрикса. В эту группу входят хондроитинсульфаты, гиалуроновая кислота, гепарин, гепаритинсульфат, мурамин и другие.
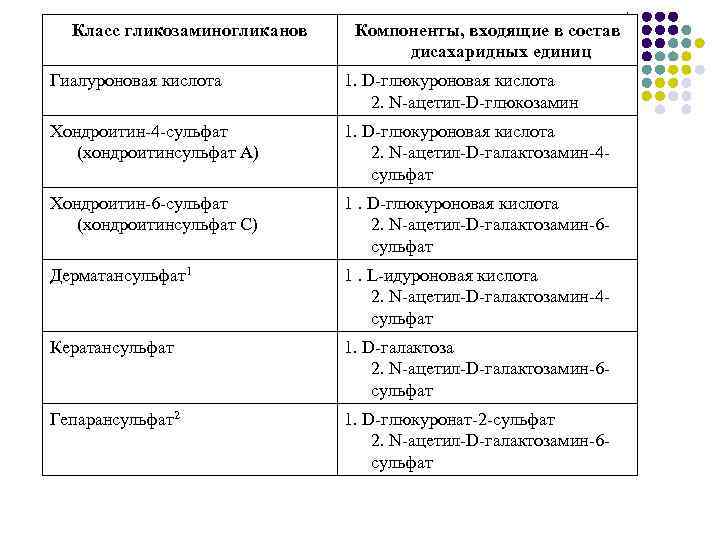
Класс гликозаминогликанов Компоненты, входящие в состав дисахаридных единиц Гиалуроновая кислота 1. D-глюкуроновая кислота 2. N-ацетил-D-глюкозамин Хондроитин-4 -сульфат (хондроитинсульфат А) 1. D-глюкуроновая кислота 2. N-ацетил-D-галактозамин-4 - сульфат Хондроитин-6 -сульфат (хондроитинсульфат С) 1. D-глюкуроновая кислота 2. N-ацетил-D-галактозамин-6 сульфат Дерматансульфат1 1. L-идуроновая кислота 2. N-ацетил-D-галактозамин-4 сульфат Кератансульфат 1. D-галактоза 2. N-ацетил-D-галактозамин-6 сульфат Гепарансульфат2 1. D-глюкуронат-2 -сульфат 2. N-ацетил-D-галактозамин-6 сульфат

Углеводсодержащие смешанные биополимеры: Гликопротеины – соединения в которых с белковыми молекулами ковалентно связаны олигосахаридные цепи N-гликозидной связью (муцин, иммуноглобулины, к ним относятся вещества, определяющие групповую принадлежность крови).

Протеогликаны l l Протеогликаны - высокомолекулярные соединения, состоящие из белка (5 -10%) и гликозаминогликанов (90 -95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани. Протеогликаны с низкой молекулярной массой, содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани.

l Пептидогликаны – содержат короткие пептидные цепи (муреин – пептидогликан, является опроно-механическим компонентом клеточных стенок бактерий). l Гликолипиды – углевод-липидный биополимер (ганглиозиды, цереброзиды или сфинголипиды).

Строение агрекана. ГК - гиалуроновая кислота; 1 - хондроитинсульфат; 2 - кератансульфат; 3 - сердцевинный белок.

Функции углеводов l l l Энергетическое обеспечение процессов жизнедеятельности организма. Следует отметить и структурную роль углеводов. Так, в виде гликозаминогликанов углеводы входят в состав межклеточного матрикса. Большое число белков (ферменты, белки-транспортёры, белки-рецепторы, гормоны) - гликопротеины, углеводная составляющая которых повышает их специфичность. Различия в строении олигосахаридных фрагментов клеточной оболочки эритроцитов обеспечивают групповую принадлежность крови. Из углеводов в процессе метаболизма образуется большое число органических соединений, которые служат исходными субстратами для синтеза липидов, аминокислот, нуклеотидов. Производные углеводов - глюкурониды - участвуют в детоксикации ксенобиотиков и инактивации веществ эндогенного происхождения.
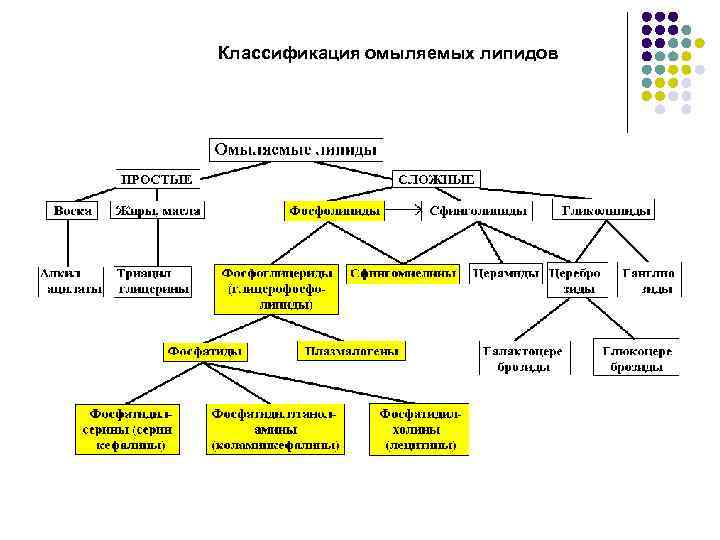
Классификация омыляемых липидов
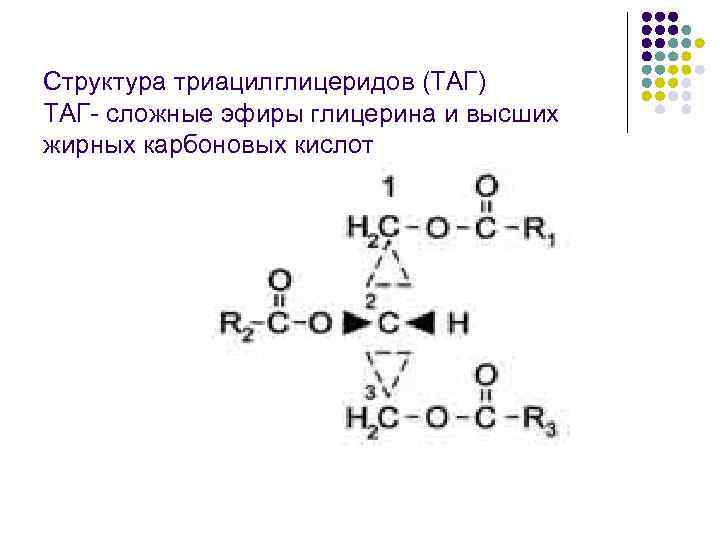
Структура триацилглицеридов (ТАГ) ТАГ- сложные эфиры глицерина и высших жирных карбоновых кислот

Высшие жирные карбоновые кислоты Насыщенные Миристиновая 14: 0 СН 3(СН 2)12 СООН Пальмитиновая 16: 0 CH 3(CH 2)14 COOH Стеариновая 18: 0 СН 3(СН 2)16 СООН l Моноеновые Пальмитоолеиновая 16: 1Δ 9 СН 3(СН 2)5 СН=СН-(СН 2)7 -СООН Олеиновая 18: 1Δ 9 СН 3(СН 2)7 СН=СН-(СН 2)7 СООН l Полиеновые Линолевая* 18: 2Δ 9, 12 ω6 СН 3(СН 2)4 -СН=СН-СН 2 -СН=СН-(СН 2)7 -СООН Линоленовая* 18: 3Δ 9, 12, 15 ω3 СН 3 -СН 2 -СН=СН-СН 2 -СН=СН-(СН 2)7 -СООН Эйкозатриеновая 20: 3 Δ 8, 11, 14 ω6 Арахидоновая** 20: 4 Δ 5, 8, 11, 14 ω6 Эйкозапентаеновая (тимнодоновая) 20: 5 Δ 5, 8, 11, 14, 17 ω 3 Докозопентаеновая (клупанодоновая) 22: 5 Δ 7, 10, 13, 16, 9 ω3 Докозагексаеновая 22: 6 Δ 4, 7, 10, 13, 16, 9 ω3 l
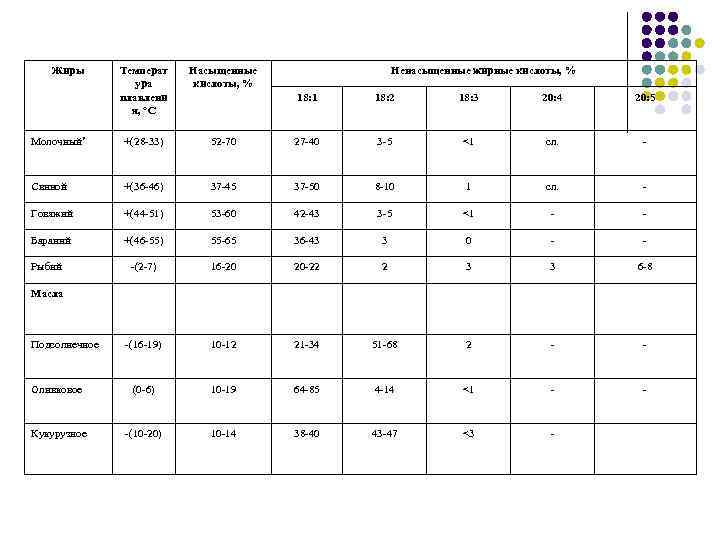
Жиры Температ ура плавлени я, °С Насыщенные кислоты, % Молочный* +(28 -33) Свиной Ненасыщенные жирные кислоты, % 18: 1 18: 2 18: 3 20: 4 20: 5 52 -70 27 -40 3 -5 <1 сл. - +(36 -46) 37 -45 37 -50 8 -10 1 сл. - Говяжий +(44 -51) 53 -60 42 -43 3 -5 <1 - - Бараний +(46 -55) 55 -65 36 -43 3 0 - - -(2 -7) 16 -20 20 -22 2 3 3 6 -8 -(16 -19) 10 -12 21 -34 51 -68 2 - - Оливковое (0 -6) 10 -19 64 -85 4 -14 <1 - - Кукурузное -(10 -20) 10 -14 38 -40 43 -47 <3 - Рыбий Масла Подсолнечное
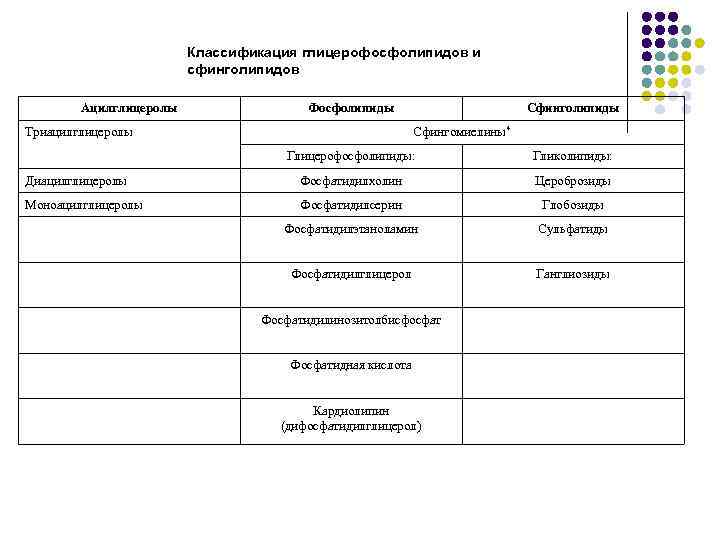
Классификация глицерофосфолипидов и сфинголипидов Ацилглицеролы Фосфолипиды Триацилглицеролы Сфинголипиды Сфингомиелины* Глицерофосфолипиды: Гликолипиды: Диацилглицеролы Фосфатидилхолин Цероброзиды Моноацилглицеролы Фосфатидилсерин Глобозиды Фосфатидилэтаноламин Сульфатиды Фосфатидилглицерол Ганглиозиды Фосфатидилинозитолбисфосфат Фосфатидная кислота Кардиолипин (дифосфатидилглицерол)
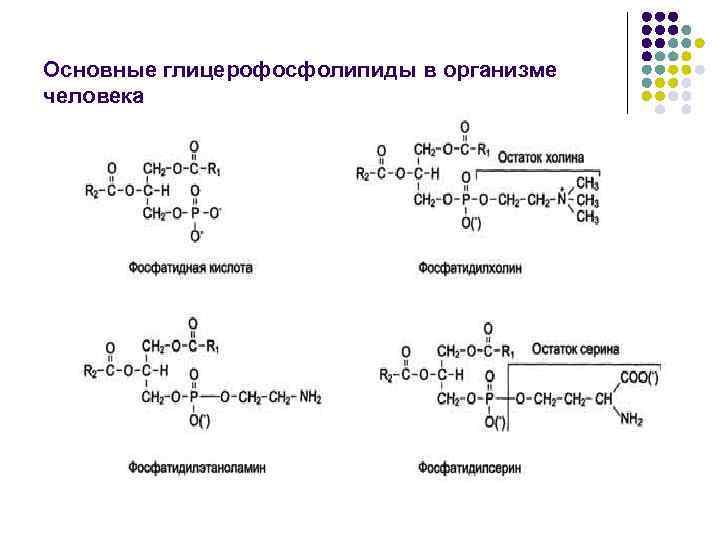
Основные глицерофосфолипиды в организме человека
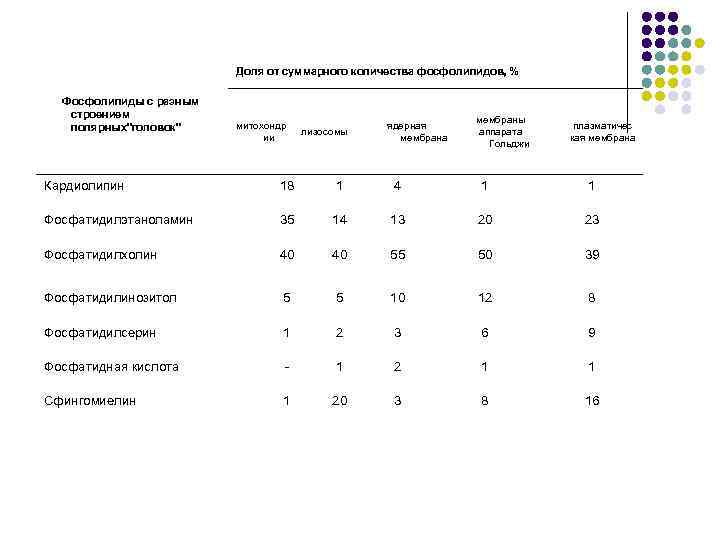
Доля от суммарного количества фосфолипидов, % Фосфолипиды с разным строением полярных"головок" митохондр ии лизосомы ядерная мембрана мембраны аппарата Гольджи плазматичес кая мембрана Кардиолипин 18 1 4 1 1 Фосфатидилэтаноламин 35 14 13 20 23 Фосфатидилхолин 40 40 55 50 39 Фосфатидилинозитол 5 5 10 12 8 Фосфатидилсерин 1 2 3 6 9 Фосфатидная кислота - 1 2 1 1 Сфингомиелин 1 20 3 8 16
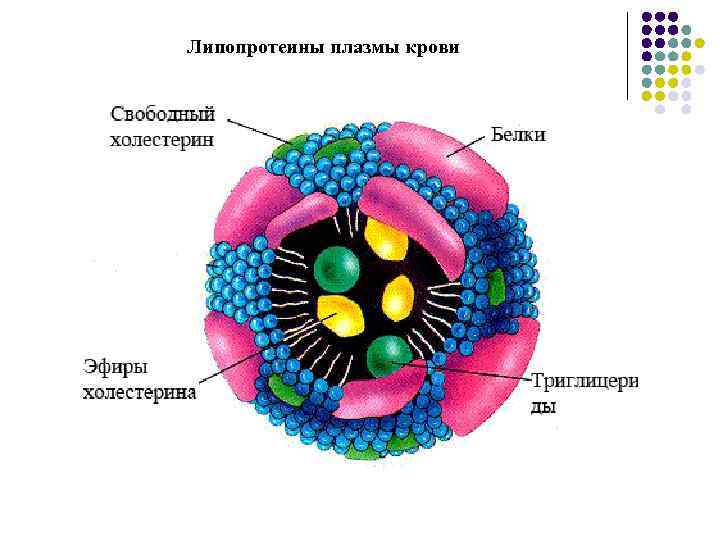
Липопротеины плазмы крови
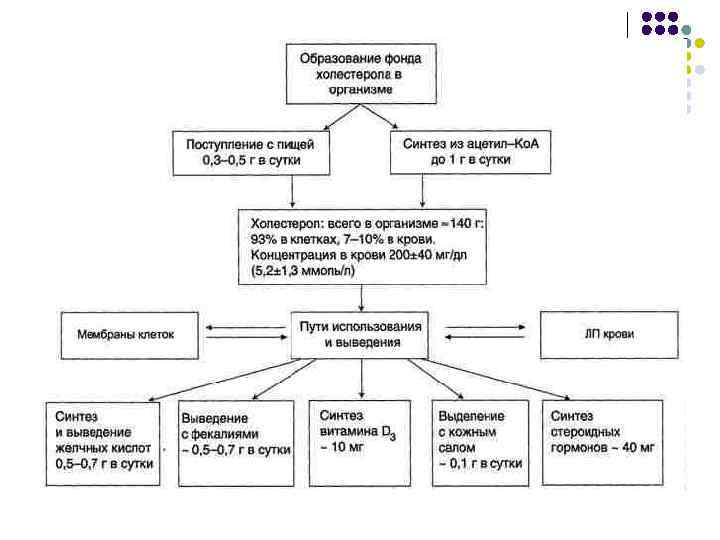
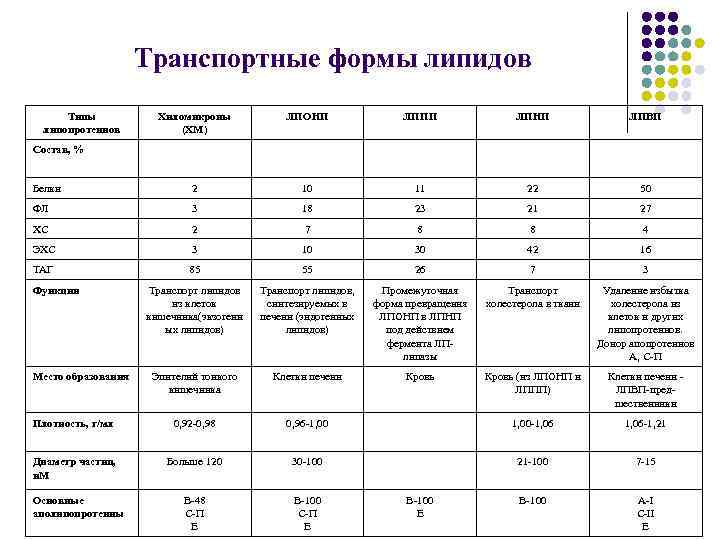
Транспортные формы липидов Типы липопротеинов Хиломикроны (ХМ) ЛПОНП ЛППП ЛПНП ЛПВП Белки 2 10 11 22 50 ФЛ 3 18 23 21 27 ХС 2 7 8 8 4 ЭХС 3 10 30 42 16 ТАГ 85 55 26 7 3 Транспорт липидов из клеток кишечника(экзогенн ых липидов) Транспорт липидов, синтезируемых в печени (эндогенных липидов) Промежуточная форма превращения ЛПОНП в ЛПНП под действием фермента ЛПлипазы Транспорт холестерола в ткани Удаление избытка холестерола из клеток и других липопротеинов. Донор апопротеинов А, С-П Эпителий тонкого кишечника Клетки печени Кровь (из ЛПОНП и ЛППП) Клетки печени - ЛПВП-предшественники Плотность, г/мл 0, 92 -0, 98 0, 96 -1, 00 -1, 06 -1, 21 Диаметр частиц, н. М Больше 120 30 -100 21 -100 7 -15 Основные аполипопротеины В-48 С-П Е В-100 A-I С-II Е Состав, % Функции Место образования В-100 Е

Нуклеиновые кислоты l l Нуклеиновые кислоты называют полинуклеотидами, полимерные цепи построены из мономерных единицнуклеотидов. Нуклеотид состоит из азотистого основания, углеводного компонента(рибоза, дезоксирибоза), остатка фосфорной кислоты.
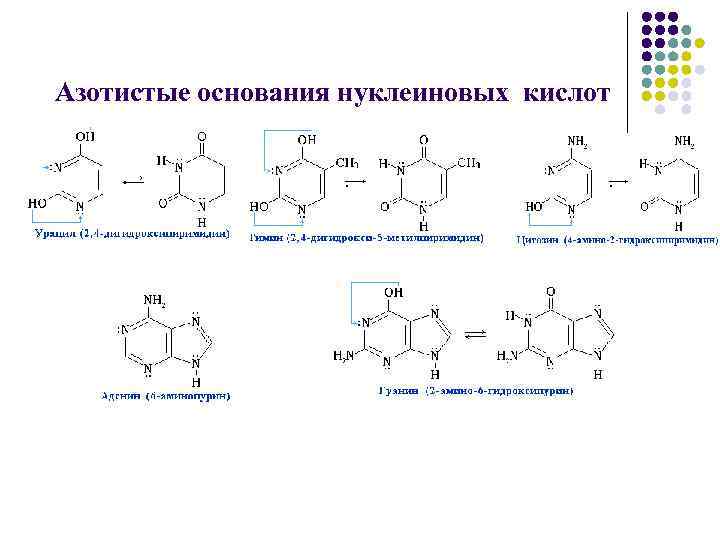
Азотистые основания нуклеиновых кислот
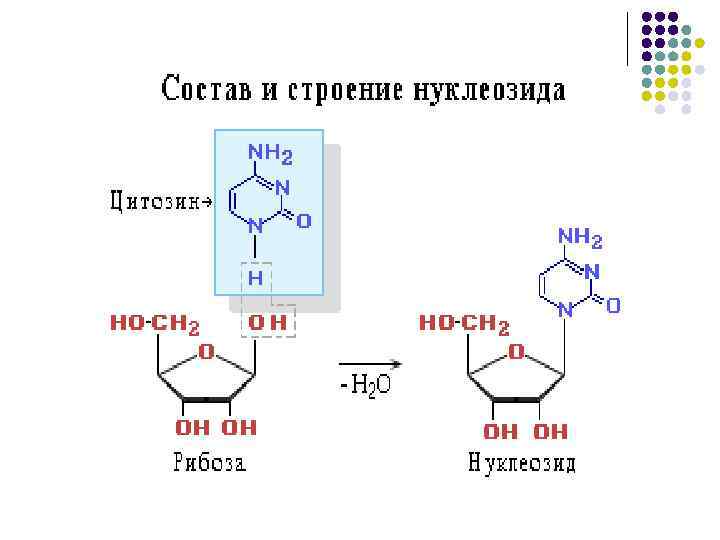
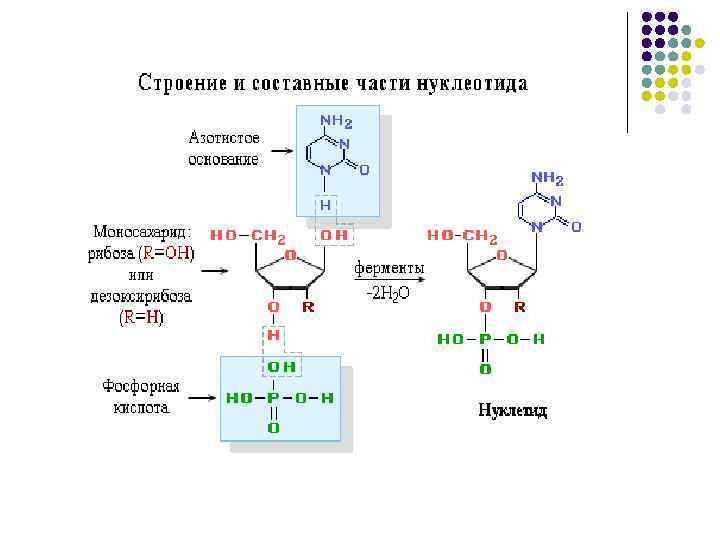
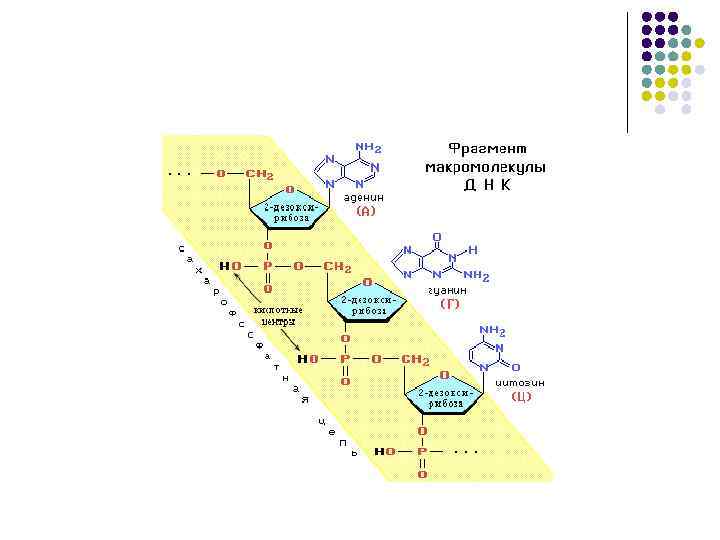
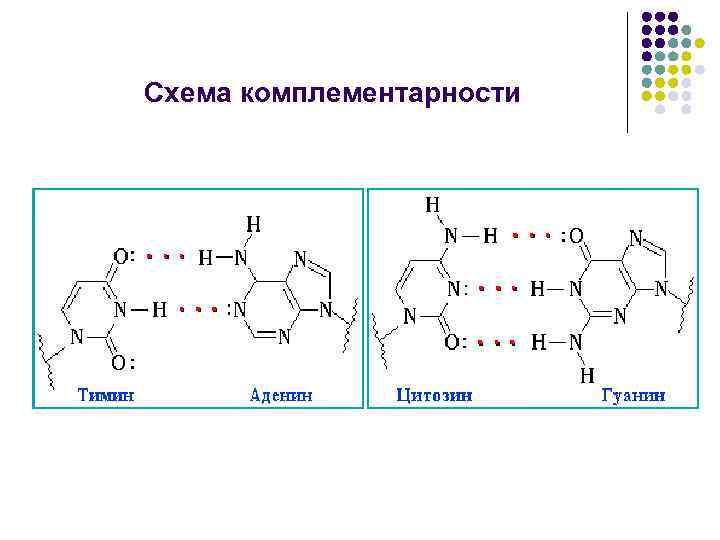
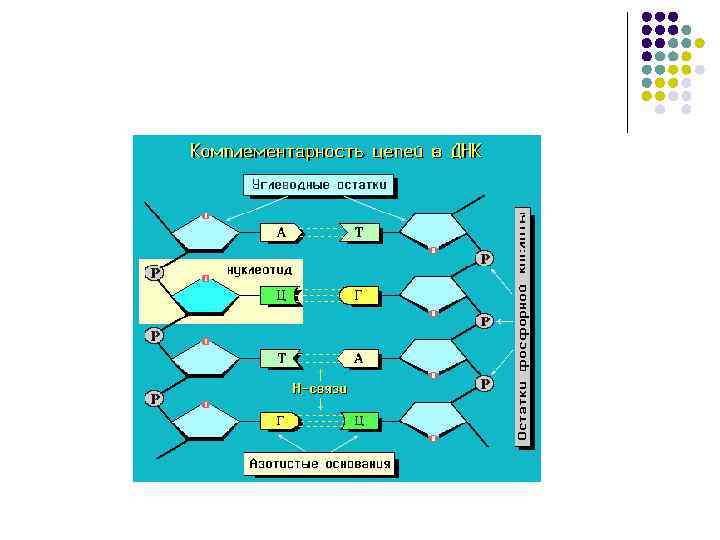
Схема комплементарности
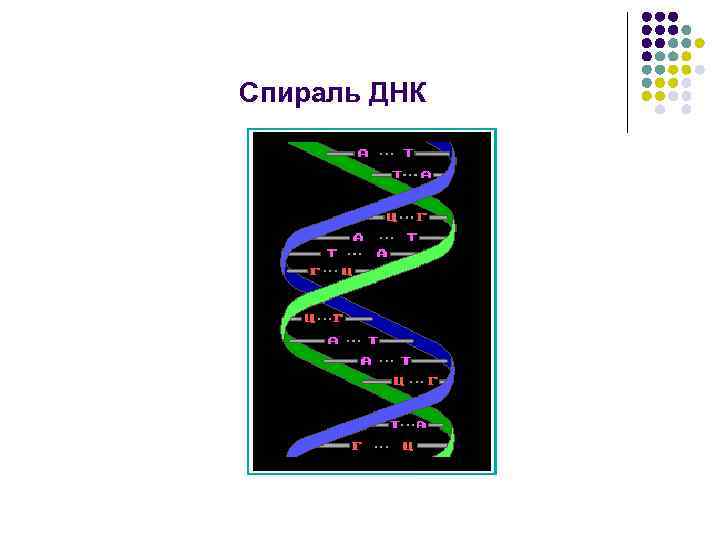
Спираль ДНК

l Для медицинских целей используют П. м. общетехнического назначения, а также специальное П. м. медицинского назначения (рис. ). Из первых изготавливают строительное и санитарнотехническое оборудование лечебных учреждений, белье, посуду, предметы ухода за пациентами, детали различных приборов, исследовательской и лечебной аппаратуры, инструментов, посуды для аналитических лабораторий и др. Применение П. м. вместо традиционных материалов (металлов, стекла) обусловлено их лучшими технологическими свойствами, комплексом физикомеханических характеристик, возможностью переработки в изделия массового выпуска и однократного применения. Помимо общетехнических к этим полимерным материалам предъявляются дополнительные санитарно-гигиенические требования — минимальное выделение в окружающую среду газообразных продуктов, не превышающее ПДК; нерастворимость в моющих растворах; возможность стерилизации дезинфицирующими растворами, газами, УФ-облучением, гамма-излучением и др.

l l Наиболее широко применяются П. м. на основе поливинилхлорида. сополимеров стирола, полипропилена, полиметилметакрилата, полиуретанов, фенол-, мочевино-меламино-формальдегидных смол. Из них выпускают изделия различного назначения, а также плиты, листы, пленки, трубы, тканые и нетканые материалы на основе волокон, пасты, герметики, лаки, клеи. Специальные П. м. медицинского назначения предназначены для непосредственного контакта с живым организмом — в эндопротезах и материалах для восстановительной хирургии, в материалах и изделиях для службы крови, в виде инструментов для внутриорганных исследований, аппаратуры, заменяющей функции сдельных органов, компонентов терапевтических и диагностических средств. Основу таких П. м составляют синтетические и природные высокомолекулярные соединения, не оказывающие на живой организм вредного воздействия. По характеру взаимовлияния с организмом П. м. разделяют на биоинертные, биосовместимые и биоактивные.

l Биоинертные П. м. (полиэтилен, полипропилен, фторопласт, силиконы, полиметилметакрилат и др. ) практически не изменяют своих свойств под влиянием сред живого организма. В виде готовых изделий или материалов их используют для создания искусственных сосудов (полиэтилентерефталат, полипропилен, фторопласт), клапанов сердца (силикон, фторопласт, полипропилен, полиэтилентерефталат), хрусталиков глаз (полиметилметакрилат), частей эндопротезов суставов (полиамиды, фторопласт), в качестве искусственных сухожилий, мышечных связок (полипропилен, полиэтилентерефталат), деталей аппаратов искусственная почка, искусственное сердце — легкое (полиэтилен, полипропилен, полиакрилаты, силиконы, эфиры целлюлозы) и др.

l l Биосовместимые П. м. способны постепенно подвергаться биодеструкции или растворению в биологических средах, что позволяет наиболее благоприятно осуществлять восстановительные хирургические операции, используя регенераторные функции организма. Материалы сополимеров винилпирролидона, акриламида, акрилатов, полиамидов, полигликолидов и др. в виде комбинированных протезов, сеток, пленок, листовых материалов, пеноматериалов, клеящих композиций, рассасывающихся шовных материалов применяют для временного замещения тканей при резекциях, укрепления стенок полых органов, закрытия раневых поверхностей внутренних органов, заполнения послеоперационных полостей, соединения резецированных тканей. В травматологии биосовместимые П. м. из сополимеров винилпирролидона и метилметакрилата, цианакрилатов применяют для замещения дефектов костной ткани, в виде различных соединительных элементов, для склеивания костных отломков и др. В сердечнососудистой хирургии аналогичные П. м. из сополимеров винилпирролидона и бутилметакрилата используют при протезировании сосудов, укреплении сердечной стенки, герметизации анастомозов.

Биоактивные П. м. могут обладать направленной физиологической активностью благодаря лекарственным препаратам, содержащимся в них в виде компонента. Применяют готовые лекарственные формы в виде композиций, где высокомолекулярные соединения либо играют роль основы-носителя (глазные лекарственные пленки с различными препаратами — сульфапиридазином, пилокарпином, канамицином и др. , тринитролонг, динитросорбилонг), либо обладают собственной физиологической активностью макромолекул — полимерные лекарства, антитромбогенные П. м. , искусственные плазмо- и кровезаменители, энтеро- и гемосорбенты (гемодез, полидез, аминопептид, полиглюкин и др. ). Для биосовместимых и биоактивных П. м. используют высокомолекулярные соединения на основе N-винилпирролидона, акриламида, некоторых акрилатов, гликолида, лактидов, N-окисей. производных целлюлозы, коллагена и др.
Лекция 8 Высокомолекулярные орг.соед..ppt