Лекция 3-4. Ферменты и витамины.ppt
- Количество слайдов: 64

Биологически активные вещества: Ферменты, витамины, гормоны. 1

Понятие о ферментах Практически все реакции в живом организме протекают с участием природных биокатализаторов, называемых ферментами, или энзимами. Слово «фермент» происходит от лат. fеrmеntum – закваска (предложил Ван Гельмонт в нач. XVII в – термин обозначал вещества влияющие на спиртовое брожение), а «энзим» – от греч. еn – в, внутри и zyme – дрожжи (предложил Кюне в 1878 г). В настоящее время известно более 3700 ферментов. 2

Роль ферментов в жизнедеятельности всех живых организмов огромна. И. П. Павлов писал: «Ферменты есть, так сказать, первый акт жизненной деятельности. Все химические процессы направляются в теле именно этими веществами, они есть возбудители всех химических превращений. Все эти вещества играют огромную роль, они обусловливают собою те процессы, благодаря которым проявляется жизнь, они и есть в полном смысле возбудители жизни. 3

Ферменты и катализаторы неорганической природы подчиняются общим законам катализа и имеют сходные признаки: • 1) катализируют только энергетически возможные реакции, т. е. те реакции, которые могут протекать и без них; • 2) не изменяют направление реакции; • 3) не сдвигают равновесие обратимой реакции, а лишь ускоряют его наступление; • 4) не расходуются в процессе реакции и выходят из реакции в первоначальном виде. 4

Отличия ферментов от небиологических катализаторов заключаются в том, что: 1) скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами (эффективность действия ферментов); 2) ферменты обладают высокой специфичностью действия – катализируют либо единственную реакцию, либо группу реакций одного типа; 3) ферменты катализируют реакции в очень мягких условиях (обычное давление, нейтральная р. Н, невысокая t); 4) активность ферментов в клетках строго регулируется как на генетическом уровне, так и посредством определённых низкомолекулярных соединений (субстратов и продуктов реакции, катализируемых этими же ферментами); 5) скорость ферментативной реакции прямопропорциональна количеству фермента. 5
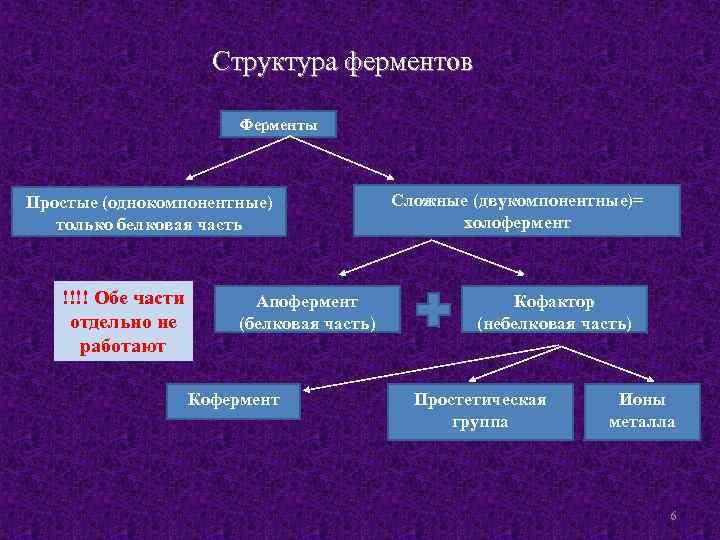
Структура ферментов Ферменты Простые (однокомпонентные) только белковая часть !!!! Обе части отдельно не работают Апофермент (белковая часть) Кофермент Сложные (двукомпонентные)= холофермент Кофактор (небелковая часть) Простетическая группа Ионы металла 6
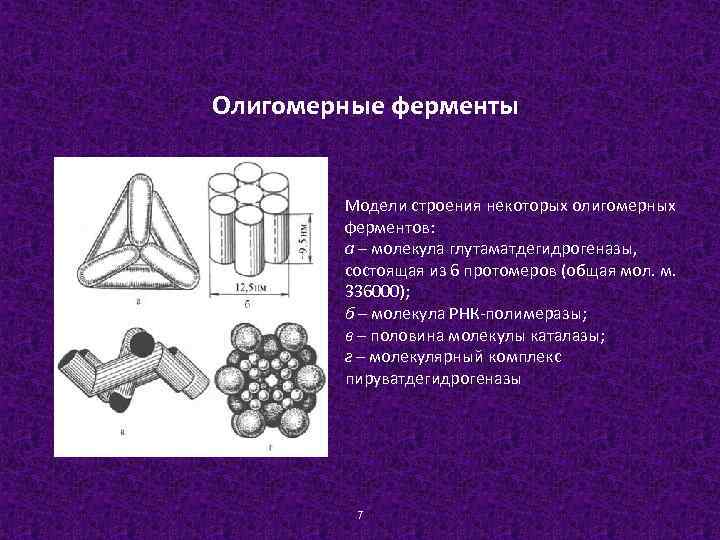
Олигомерные ферменты Модели строения некоторых олигомерных ферментов: а – молекула глутаматдегидрогеназы, состоящая из 6 протомеров (общая мол. м. 336000); б – молекула РНК-полимеразы; в – половина молекулы каталазы; г – молекулярный комплекс пируватдегидрогеназы 7

Изоферменты ЛДГ Распределение и относительные количества изоферментов ЛДГ в различных органах. Экстракты нанесены на линию, отмеченную надписью «Старт» . При заданных условиях опыта (р. Н) 4 изофермента ЛДГ движутся к аноду, а один (ЛДГ 5) к катоду. 8

Структура ферментов Все коферменты и простетические группы условно можно подразделить на 2 группы: – производные витаминов; – невитаминные кофакторы. 9
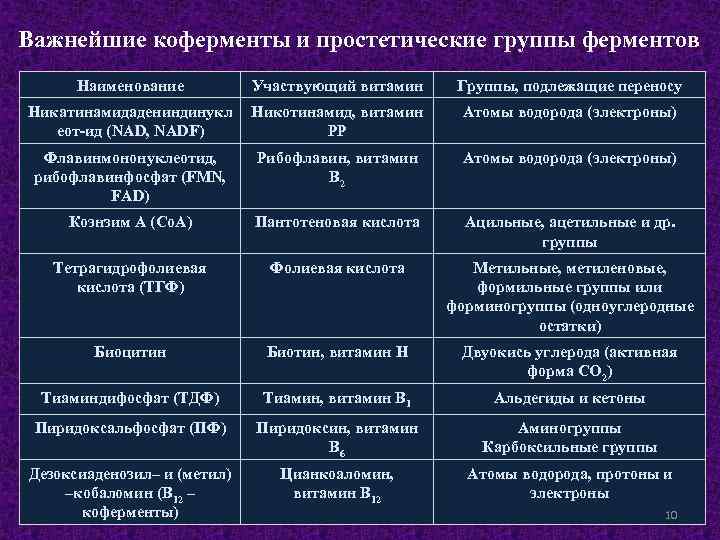
Важнейшие коферменты и простетические группы ферментов Наименование Участвующий витамин Группы, подлежащие переносу Никатинамидадениндинукл еот-ид (NAD, NADF) Никотинамид, витамин РР Атомы водорода (электроны) Флавинмононуклеотид, рибофлавинфосфат (FMN, FAD) Рибофлавин, витамин В 2 Атомы водорода (электроны) Коэнзим А (Со. А) Пантотеновая кислота Ацильные, ацетильные и др. группы Тетрагидрофолиевая кислота (ТГФ) Фолиевая кислота Метильные, метиленовые, формильные группы или форминогруппы (одноуглеродные остатки) Биоцитин Биотин, витамин Н Двуокись углерода (активная форма СО 2) Тиаминдифосфат (ТДФ) Тиамин, витамин В 1 Альдегиды и кетоны Пиридоксальфосфат (ПФ) Пиридоксин, витамин В 6 Аминогруппы Карбоксильные группы Дезоксиаденозил– и (метил) –кобаломин (В 12 – коферменты) Цианкоаломин, витамин В 12 Атомы водорода, протоны и электроны 10

Невитаминные кофакторы К невитаминным кофакторам относят следующие соединения: – НS-глутатион, – АТФ, – липоевая кислота, – производные нуклеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат), – порфиринсодержащие вещества, – т. РНК, которые в составе ферментов аминоацил-т. РНК-синтетаз принимают активное участие в транспорте аминокислот к рибосоме, где осуществляется синтез белка. 11

В составе как простого, так и сложного фермента, выделяют субстратный, аллостерический и каталитический центры. Каталитический центр (КЦ) простого фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, расположенных на разных участках полипептидной цепи. Образование КЦ происходит при формировании третичной структуры. В сложных ферментах роль КЦ выполняет как правило – кофермент. Субстратный центр (СЦ) простого фермента — это участок белковой молекулы фермента, который отвечает за связывание субстрата. СЦ образно называют «якорной площадкой» , где субстрат прикрепляется к ферменту за счет различных взаимодействий между определенными боковыми радикалами аминокислотных остатков и 12 соответствующими группами молекулы субстрата.
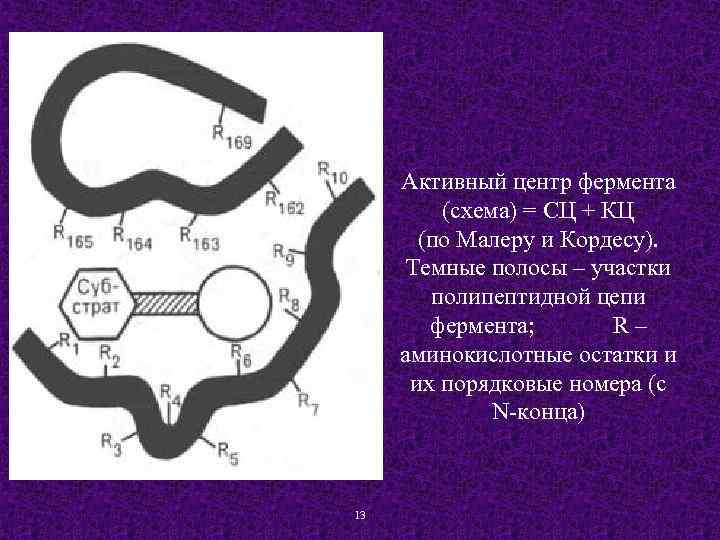
Активный центр фермента (схема) = СЦ + КЦ (по Малеру и Кордесу). Темные полосы – участки полипептидной цепи фермента; R – аминокислотные остатки и их порядковые номера (с N-конца) 13
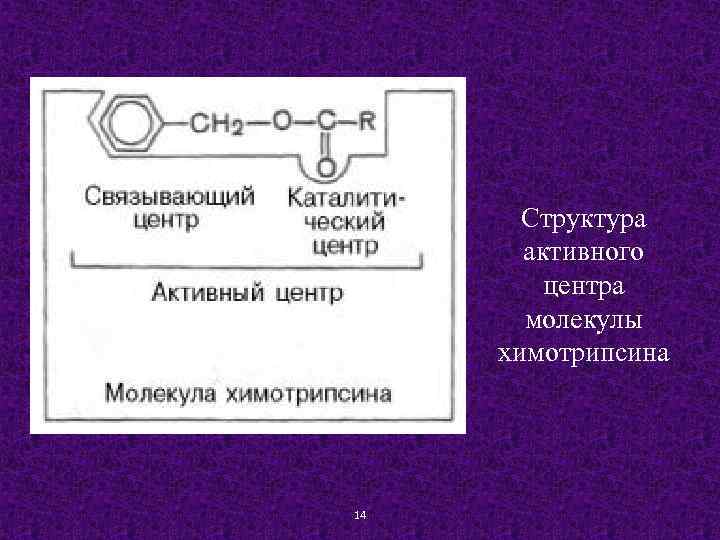
Структура активного центра молекулы химотрипсина 14

Аллостерический центр (или центры) (от греч. allos- другой, иной и steros– пространственный, структурный) – участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. 15

Химическая кинетика В соответствии с законом действующих масс для реакции А + В С + Д скорость может выражаться уравнением v = К [A]·[B], где v – скорость реакции; К – константа скорости, отражающая влияние химической природы вещества и условий, в которых протекает реакция, на ее скорость; [A] и [B] – концентрация реагентов. 16

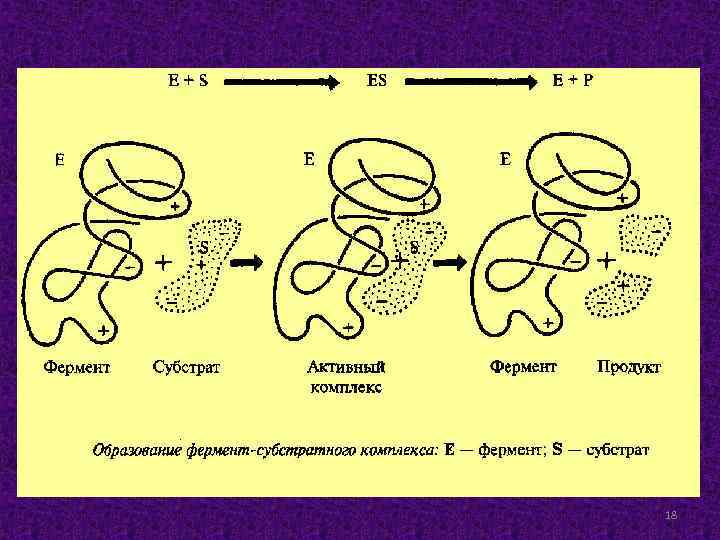
Кинетика ферментативных реакций Вещества, реакцию превращения которых ускоряют ферменты (E), называются субстратами (S). В ходе ферментативной реакции образуется ферментсубстратный комплекс (ES). Фермент-субстратный комплекс становится нестабильным и затем преобразуется в комплекс «фермент – продукт» , который распадается на фермент и продукты реакции (P): S + E ES E + P. 17
18
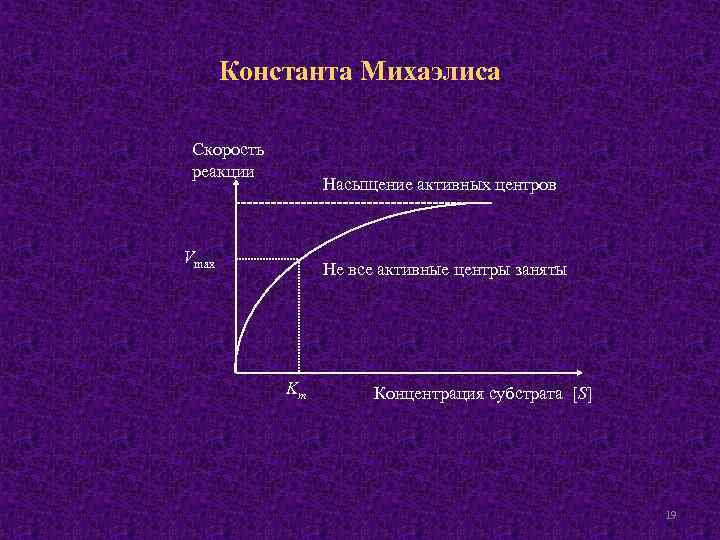
Константа Михаэлиса Скорость реакции Насыщение активных центров Vmax Не все активные центры заняты Km Концентрация субстрата [S] 19

Фермент увеличивает скорость реакции • понижая свободную энергию переходного состояния путем стабилизации активированного комплекса; • увеличивая энергию субстрата, когда тот связывается с ферментом при образовании фермент-субстратного комплекса; • поддерживая микроокружение активного центра в состоянии, отличном от такового в водной среде; • располагая реагирующие атомы в правильной ориентации и на необходимом расстоянии друг от друга так, чтобы обеспечить оптимальное протекание реакции. 20
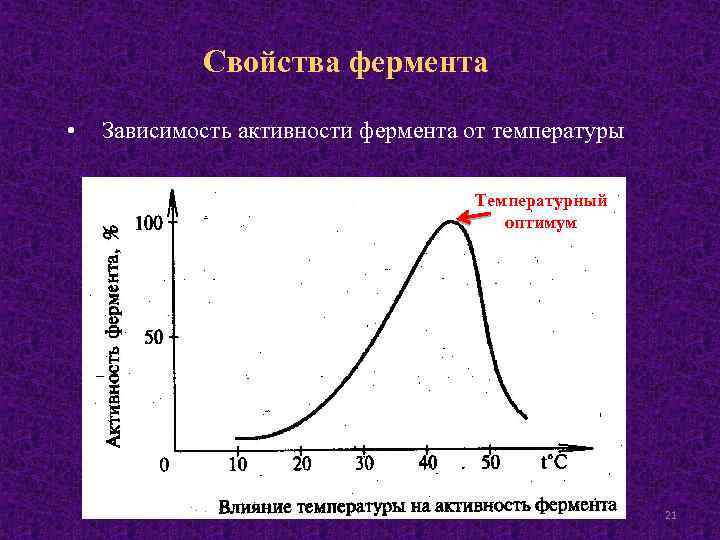
Свойства фермента • Зависимость активности фермента от температуры Температурный оптимум 21
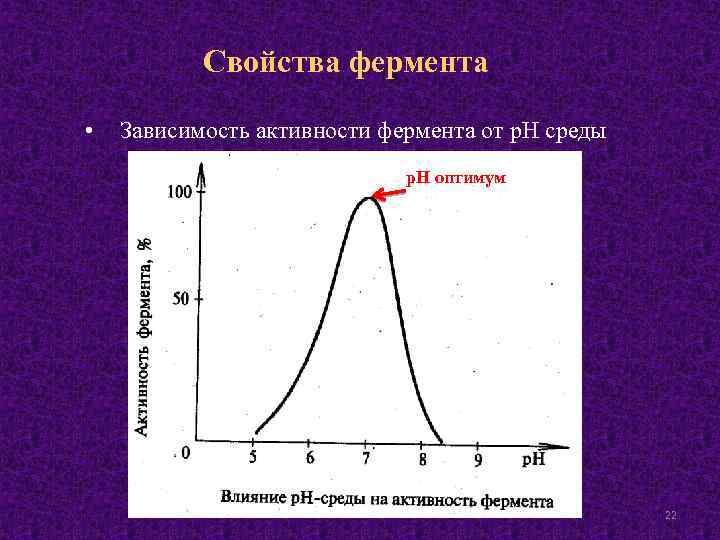
Свойства фермента • Зависимость активности фермента от р. Н среды р. Н оптимум 22

Свойства фермента • Влияние на активность ферментов активаторов и ингибиторов К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg 2+, Mn 2+, Zn 2+, К+ и Со 2+, а из анионов — Сl-. Катионы действуют на фермент по-разному. В одних случаях они облегчают образование фермент-субстратного комплекса, в других — способствуют присоединению кофермента к апоферменту, либо присоединяются к аллостерическому центру фермента и изменяют его третичную структуру, в результате чего субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию. Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Механизмы ингибирующего действия различных химических соединений 23 разнообразны.

Роль металлов в функционировании ферментов 1. Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур: а) ионы металлов – стабилизаторы молекулы субстрата; б) ионы металлов – стабилизаторы активного центра фермента; в) роль металлов в стабилизации третичной и четвертичной структуры фермента; 2. Ионы металлов могут принимать непосредственное участие в акте катализа: а) участие в электрофильном катализе; б) участие в окислительно-восстановительных реакциях; 3. Роль металлов в регуляции aктивности ферментов. 24

Оксидоредуктазы (окислительно-восстановительные реакции) Оксидоредуктазы осуществляют перенос атомов Н и О или электронов от одного вещества к другому. Дегидрогеназы катализируют окислительно-восстановительные реакции, происходящие путем отнятия электронов и протонов от одного субстрата и переноса их на другой: АН + В А + ВН. Оксидазы катализируют перенос водорода с субстрата на кислород: АН 2 +1/2 О 2 А + Н 2 О Гидроксилазы и оксигеназы ускоряют некоторые реакции биологического окисления, протекающие с присоединением гидроксила или кислорода к окисляемому веществу. 25

Классификация активности ферментов Трансферазы (перенос функциональных групп) Ускоряют перенос определенной группы атомов от одного вещества к другому: АВ + С А + ВС Метилтрансферазы переносят метильную группу, Ацилтрансферазы – кислотный остаток (ацил), Гликозилтрансферазы – моносахаридный остаток (гликозил), Аминотрансферазы – аминную группу, Фосфотрансферазы – остаток фосфорной кислоты (фосфорил). 26

Гидролазы (реакции гидролиза) Ускоряют реакции гидролиза, при которых из субстрата образуются 2 продукта. К гидролазам относятся все пищеварительные ферменты: АВ + Н 2 О АОН + ВН Эстеразы ускоряют гидролиз сложных эфиров (различных липидов) на спирты и кислоты. Фосфатазы катализируют гидролитическое отщепление фосфорной кислоты от нуклеотидов и фосфорных эфиров углеводов. Глюкозидазы ускоряют гидролиз сложных углеводов. Пептидгидролазы ускоряют гидролиз пептидных связей в белках и пептидах. 27

Лиазы ускоряют негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи: С–С, С–N, C–O, C–S. 28

Классификация активности ферментов Изомеразы (реакции изомеризации) Внутримолекулярные перестройки: АВ ВА 29

Лигазы (образование связей за счет АТФ) Лигазы катализируют реакции синтеза высокомолекулярных полимеров из мономеров за счет энергии гидролиза АТФ: X + Y + АТФ XY + AДФ + Фн 30

ВИТАМИНЫ 31

Витамины представляют собой сборную в химическом отношении группу низкомолекулярных органических веществ, жизненно необходимых для сбалансированного питания. Витамины не синтезируются в организме человека и животных или синтезируются, но в малых количествах, тканями, а также микрофлорой кишечника, присущей организму, что недостаточно для нормальной жизнедеятельности. В норме суточная потребность в витаминах мала, однако на количество витаминов может существенно влиять увеличение физической нагрузки, интенсивность умственного труда, физиологическое состояние, возраст, пол, условия окружающей среды. 32

Нарушение баланса витаминов в организме Недостаток поступления витаминов с пищей, нарушение всасывания или их использования организмом приводит к развитию патологического состояния – первичные авитаминозы и гиповитаминозы. Напротив, чрезмерное потребление пищевых витаминных форм и/или несбалансированное питание может вызвать гипервитаминозное состояние, которое также относится к патологическим. Авитаминозы в нормальных условиях питания являются редкими, чаще наблюдаются гиповитаминозы, связанные с недостаточным количеством того или иного витамина. Гиповитаминоз может развиться не только из-за не сбалансированного питания, а в результате нарушения всасывания витамина при патологиях ЖКТ или печени, при различных эндокринных или инфекционных заболеваниях. 33

Классификация, антивитамины В медицинской и биологической литературе витамины подразделяются на две группы: витамины, растворимые в воде, и витамины, растворимые в жирах. Отдельным витаминам присваивается буквенная, химическая и физиологическая номенклатура. Витамины делят на водорастворимые и жирорастворимые. К водорастворимым относятся: В 1, В 2, В 3, В 5, В 6, В 9, В 12, Н, С, Р. Кжирорастворимым относятся: А, Д, Е, К. Кроме витаминов существуют соединения, обладающие антивитаминными свойствами: структурные аналоги или соединения, препятствующие образованию витаминов микрофлорой кишечника. 34

Водорастворимые витамины Витамин В 1 (тиамин) - АНТИНЕВРИТНЫЙ 35

Источником витамина В 1 являются продукты растительного происхождения, особенно его много в пекарских и пивных дрожжах, в оболочках семян хлебных злаков и риса, в горохе, сое. В организме животных витамин В 1 содержится преимущественно в виде дифосфорного эфира. Фосфорилирование тиамина происходит в печени, почках, сердечной мышце, мозге при участии тиаминкиназы и АТФ. Суточная доза для взрослого человека в среднем составляет 2 – 3 мг витамина В 1. Преобладание углеводов в пищи повышает потребность организма в витамине; жиры, наоборот, резко уменьшают эту потребность. Биологическая функция. Пирофосфорный эфир представляет собой кофермент карбоксилазы и дегидрогеназ, катализирующих окислительное дскарбоксилирование кетокислот (например, пирувата). В отсутствие тиамина невозможен нормальный углеводный обмен. Нарушаются и другие виды обмена. В отсутствие витамина увеличивается количество пирувата и лактата в крови. Особенно резко нарушается углеводный обмен в мозгу. Витамин оказывает специфическое угнетающее действие на холинэстсразу - фермент, 36 расщепляющий ацетилхолин.
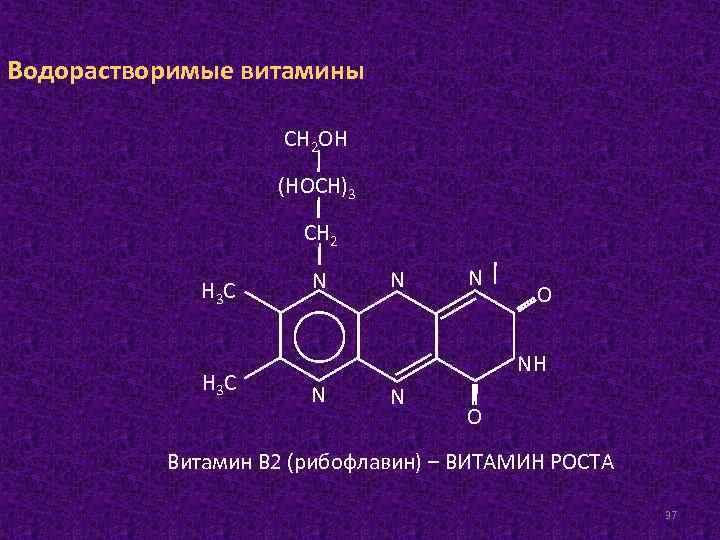
Водорастворимые витамины СН 2 ОН (НОСН)3 СН 2 Н 3 С N N N О NН N N О Витамин В 2 (рибофлавин) – ВИТАМИН РОСТА 37

Источником витамина В 2 для человека являются молоко и молочные продукты, яйца, печень, почки, сердце животных, пивные и пекарские дрожжи, в меньшей степени крупы и овощи. Суточная потребность в витамине В 2 взрослого человека составляет 1, 8– 2, 6 мг. Частично человек получает рибофлавин как продукт жизнедеятельности микрофлоры кишечника. Биологическая функция. Молекула рибофлавина обладает окислительно-восстановительными свойствами, что выражается в способности присоединять два атома водорода (при этом восстанавливаясь) и легко отдавать два электрона и два протона (окисляясь). Рибофлавин функционирует в составе флавинмононуклеотида (ФМН) или флавинадениндинуклеотида (ФАД). 38

Витамин РР (В 5). Никотинамид - АНТИПЕЛЛАРГИЧЕСКИЙ О N С N Никотиновая кислота О ОН N С NН 2 N Никотинамид 39

Никотиновая кислота является β-пиридинкарбоновой кислотой, а никотинамид – её амидом. Источником витамина РР являются печень, почки, сердце, мясо животных, рыба, из продуктов растительного происхождения – пшеничные и рисовые отруби, бобовые. Никотинамид может образовываться из триптофана при его увеличении в пище. Суточная потребность в этом витамине составляет 15– 25 мг для взрослых и для детей 15 мг. Биологическая роль никотиновой кислоты и её производного никотинамида связаны с коферментной функцией НАД и НАДФ различных дегидрогеназ, куда она входит как составляющее звено. 40
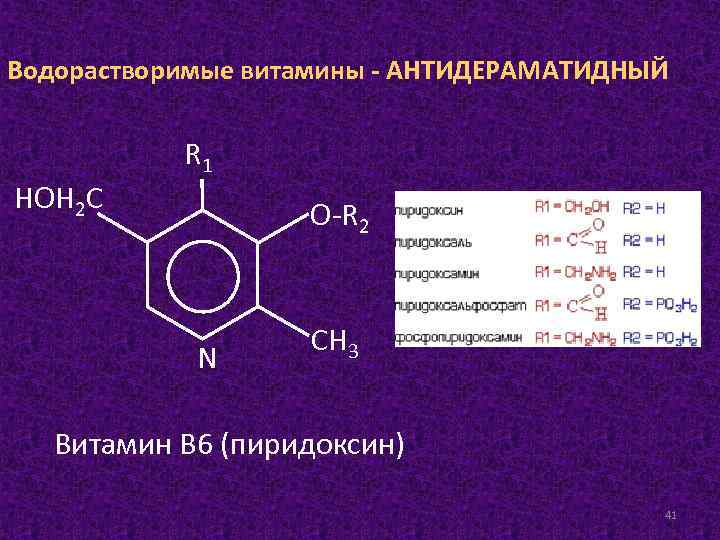
Водорастворимые витамины - АНТИДЕРАМАТИДНЫЙ НОН 2 С R 1 О-R 2 N СН 3 Витамин В 6 (пиридоксин) 41

Источники. Наиболее богаты витамином В 6 сухие дрожжи, печень, почки, сердце, мясо, рыба, цельное зерно злаковых и их отруби, горох, бобы, свежий зеленый перец. Суточная потребность составляет 2– 3 мг. Биологическая роль. Витамин В 6 выполняет коферментную функцию в виде пиридоксальфосфата и пиридоксаминфосфата, для образования которых расходуется АТФ при участии фермента пиридоксалькиназы. Пиридоксалевые ферменты играют ключевую роль в обмене аминокислот, катализируя реакции трансаминирования и декарбоксилирования. Выявлена каталитическая функция пиридаксальфосфата в действии фосфорилазы, играющей, как известно, центральную роль в метаболизме гликогена в организме. 42
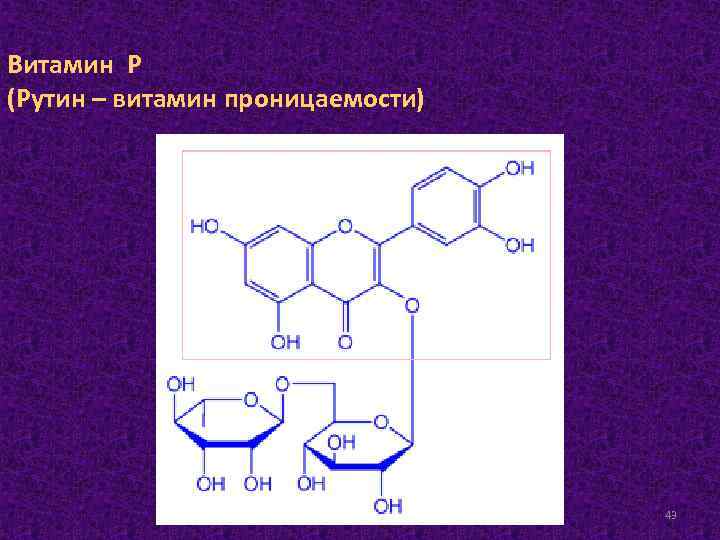
Витамин Р (Рутин – витамин проницаемости) 43

Термин витамин Р - собирательное понятие. Под этим термином имеется в виду большая группа веществ, обладающих сходным биологическим действием. Эти вещества принадлежат в основном к флавоновым пигментам - желтым и оранжевым веществам растительного происхождения, относящихся к классу гликозидов. Практическое значение в настоящее время играют: 1) рутин, получаемый из листьев гречихи, 2) «витамин Р» - препарат, выделяемый из листьев чайного дерева, 3) цитрин, выделяемый из кожуры цитрусовых. Витамин Р находится в тех же продуктах, что и витамин С, поэтому при недостатке витамина С часто наблюдается недостаток и витамина Р. При отсутствии витамина Р повышается проницаемость кровеносных сосудов. Этот витамин вместе с аскорбиновой кислотой оказывает влияние на ход окислительно-восстановительных процессов. Биологическая роль флавоноидов заключается в стабилизации межклеточного матрикса соединительной ткани и уменьшении проницаемости капилляров. У витамина Р есть антивитамины, к которым относится ацетилсалициловая кислота. Физиологическое влияние биофлавоноидов на сосудистую стенку связывают с их участием в тканевом дыхании, со способностью воздействовать на некоторые ферментные системы через эндокринные железы. 44
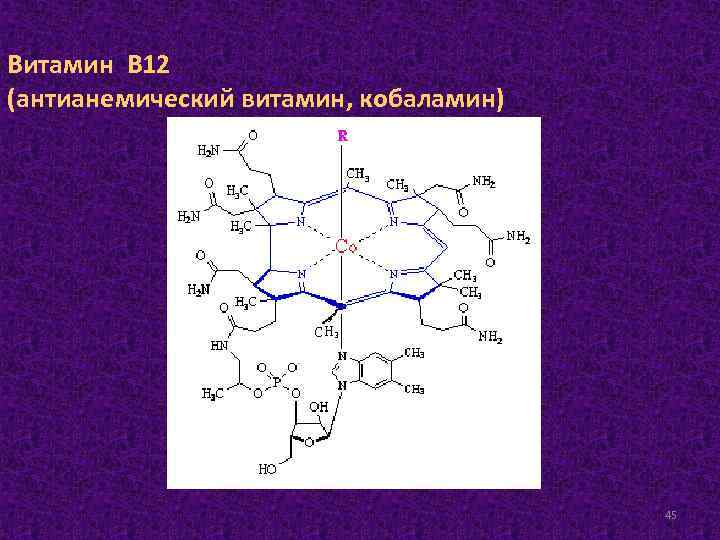
Витамин В 12 (антианемический витамин, кобаламин) 45

Ни животные, ни растения не могут синтезировать витамин В 12. Это единственный витамин, который синтезируется почти исключительно бактериями, актиномицетами и сине-зелёными водорослями. Из животных тканей наиболее богаты витамином В 12 печень и почки. Суточная доза очень мала и составляет всего 1– 2 мкг. Витамин В 12 участвует в образовании двух коферментов: метилкобаламина в плазме и дезоксиаденозилкобаламина в митохондриях. Дезоксиаденозилкобаламин в качестве кофермента участвует в метаболизме жирных кислот с нечетным числом атомов углерода и аминокислот с разветвленной углеводородной цепью. 46
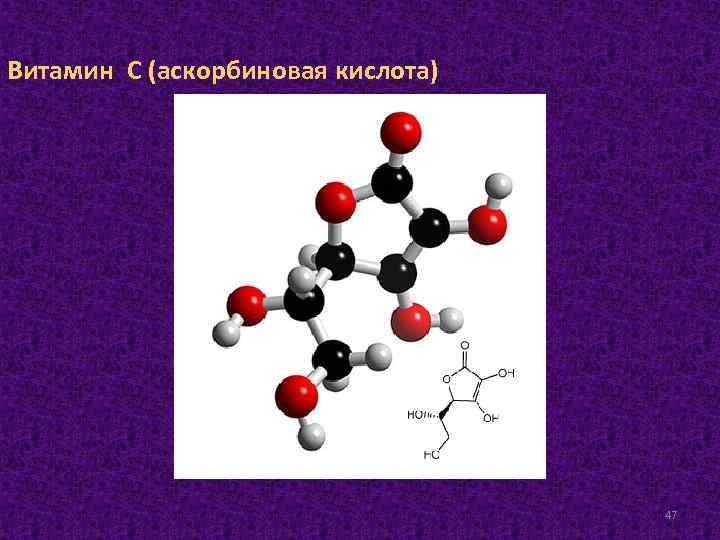
Витамин C (аскорбиновая кислота) 47

В организме человека и животных восстановленная форма аскорбиновой кислоты (АК) и окисленная форма – дигидроаскорбиновая кислота (ДАГ) могут быстро и обратимо переходить друг в друга. Источником витамина С для человека являются плоды и корни шиповника, черная смородина, лимоны, апельсины, яблоки, свежий картофель, томаты, молоко, мясо. Суточная потребность человека в витамине С является предметом спора. По рекомендациям одних, необходимо принимать 50– 75 мг аскорбиновой кислоты в сутки, другие исследователи считают за необходимое количество – 100– 500 мг. Биологическая роль. Аскорбиновая кислота участвует во многих реакциях гидроксилирования, и, прежде всего, пролина и лизина при синтезе коллагена и функции соединительной ткани. При определенных концентрациях может выступать в роли прооксиданта и антиоксиданта. 48
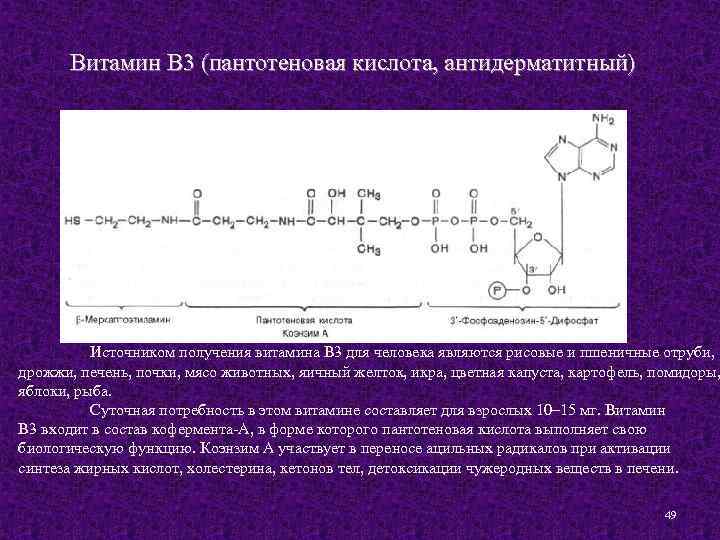
Витамин В 3 (пантотеновая кислота, антидерматитный) Источником получения витамина В 3 для человека являются рисовые и пшеничные отруби, дрожжи, печень, почки, мясо животных, яичный желток, икра, цветная капуста, картофель, помидоры, яблоки, рыба. Суточная потребность в этом витамине составляет для взрослых 10– 15 мг. Витамин В 3 входит в состав кофермента-А, в форме которого пантотеновая кислота выполняет свою биологическую функцию. Коэнзим А участвует в переносе ацильных радикалов при активации синтеза жирных кислот, холестерина, кетонов тел, детоксикации чужеродных веществ в печени. 49
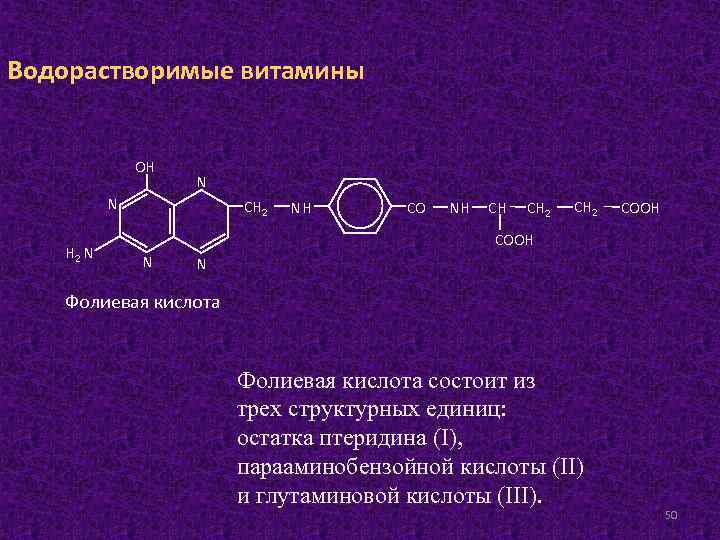
Водорастворимые витамины ОН N N Н 2 N СН 2 NН СО NН СН СН 2 СООН N N Фолиевая кислота состоит из трех структурных единиц: остатка птеридина (I), парааминобензойной кислоты (II) и глутаминовой кислоты (III). 50

Источниками фолиевой кислоты служат свежие овощи: салат, шпинат, капуста, лук, помидоры, морковь. Из продуктов животного происхождения наиболее богаты фолиевой кислотой печень, почки, яичный желток, сыр, а также пивные и пекарские дрожжи. Синтезируется микрофлорой кишечника. Суточная потребность в фолиевой кислоте варьирует от 50 до 200 мкг однако из-за плохой всасываемости этого витамина рекомендуется суточная доза – 400 мкг. Биологическая роль. Фолиевая кислота входит в состав коферментов, участвующих в синтезе холина, урацила, тимина, пуринов, преобразовании глицина, синтезе серина. Наиболее характерный признак авитаминоза - нарушение кроветворения, что приводит к анемиям. 51
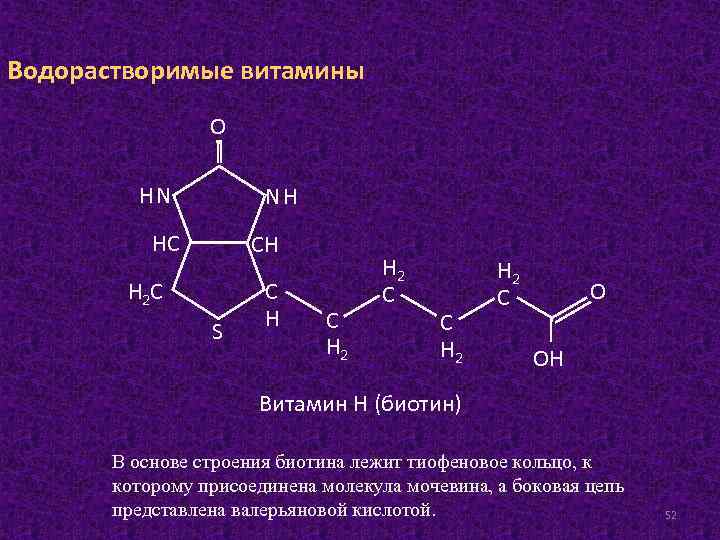
Водорастворимые витамины О НN NН НС СН Н 2 С S С Н 2 Н 2 C С Н 2 C О ОН Витамин Н (биотин) В основе строения биотина лежит тиофеновое кольцо, к которому присоединена молекула мочевина, а боковая цепь представлена валерьяновой кислотой. 52

Наиболее богаты биотином печень, почки, сердце быка, яичный желток, бобы, рисовые отруби, пшеничная мука, цветная капуста, соя. В обычных условиях человек получает достаточное количество биотина в результате бактериального синтеза в кишечнике. Суточная доза биотина не превышает 10 мкг. Биологическая функция биотина связана с выполнением коферментной функции. В составе карбоксилаз, участвующей в образовании активной формы СО 2. В организме биотин используется для образования малонил-Ко. А из ацетил-Ко. А, в синтезе пуринового кольца, а также в реакциях карбоксилирования пирувата с образованием оксалоацетата. 53
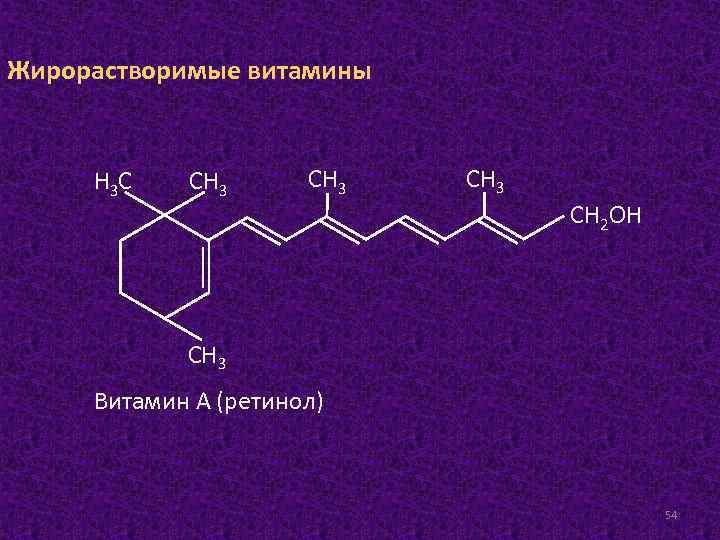
Жирорастворимые витамины Н 3 С СН 3 СН 2 ОН СН 3 Витамин А (ретинол) 54

Витамин А содержится только в животных продуктах. Особенно им богаты рыбий жир, сливочное масло, печень, яичный желток. В растениях, главным образом в овощах, содержатся провитамины, к которым относятся α-, β-, γ-каротины. Провитамины витамина А в организме человека и животных превращаются под воздействием каротиндиокигеназы в ретинол. Суточная потребность в витамине А взрослого человека составляет от 1 до 2, 5 мг или 2– 5 мг β-каротина. Обычно активность витамина А в пищевых продуктах выражается в международных единицах (МЕ), одна международная единица витамина А эквивалентна 0, 6 мкг β-каротина и 0, 3 мкг витамина А. При инфекционных заболеваниях и в профессиях требующих повышенной остроты зрения потребность возрастает. 55

Биологическая роль. Наличие двойных связей позволяют витамину участвовать в окислительно-восстановительных процессах. После добавления его усиливается окисление ненасыщенных жирных кислот и происходит усиление дыхания. Местное применение витамина приводит к быстрой регенерации эпителия. Структура витамина А позволяет принимать ему цис- и транс-конфигурации. Одним из первых симптомов авитаминоза А у молодых организмов является остановка роста и падение веса. Но основная картина характеризуется изменениями в коже и слизистых оболочках. Появляется ороговение, сухость кожи, увеличивается слущивание поверхностных слоев эпителия. Снижается сопротивляемость инфекциям. Эпителий слезных желез прекращает свою деятельность, в результате развивается сухость роговицы глаза - кератомаляция. Дальнейший авитаминоз приводит потере зрения. При авитаминозе развивается куриная слепота. Заболевание выражается в том, что человека хорошо видит днем, но ночью зрение очень сильно снижено. При гипервитаминозе у животных развивается воспаление глаз, выпадение волос и другие патологические изменения. 56
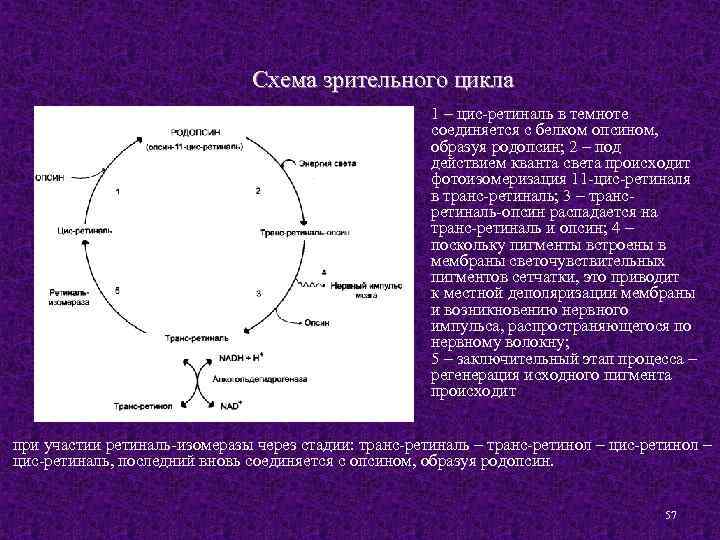
Схема зрительного цикла 1 – цис-ретиналь в темноте соединяется с белком опсином, образуя родопсин; 2 – под действием кванта света происходит фотоизомеризация 11 -цис-ретиналя в транс-ретиналь; 3 – трансретиналь-опсин распадается на транс-ретиналь и опсин; 4 – поскольку пигменты встроены в мембраны светочувствительных пигментов сетчатки, это приводит к местной деполяризации мембраны и возникновению нервного импульса, распространяющегося по нервному волокну; 5 – заключительный этап процесса – регенерация исходного пигмента происходит при участии ретиналь-изомеразы через стадии: транс-ретиналь – транс-ретинол – цис-ретиналь, последний вновь соединяется с опсином, образуя родопсин. 57

Жирорастворимые витамины СН 3 НС СН 3 СН 2 С СН СН СН 3 НО Витамин D (антирахитический) 58

Кальциферолы – группа химически родственных соединений, относящихся к производным стеринов. Наиболее биологически активные витамины – D 2 и D 3. Витамин D 2 (эргокальциферол) – производное эргостерина, растительного стероида, встречающегося в некоторых грибах, дрожжах и растительных маслах. Наибольшее количество витамина D 3 содержится в продуктах животного происхождения: сливочном масле, желтке яиц, рыбьем жире. Суточная потребность для детей 12– 25 мкг (500– 1000 МЕ), для взрослого человека потребность значительно меньше. В организме человека витамин D 3 гидроксилируется в положениях 25 и 1, превращаясь в биологически активное соединение 1 -25 -дигидрохолекальциферол (кальцитриол). Кальцитрион выполняет гормональную функцию, участвуя в регуляции обмена Са 2+ и фосфатов, стимулируя всасывание Са 2+ в кишечнике и кальцификацию костной ткани, реабсорбцию Са 2+ и фосфатов в почках. При низкой концентрации Са 2+ или высокой концентрации D 3 он стимулирует мобилизацию Са 2+ из костей. 59
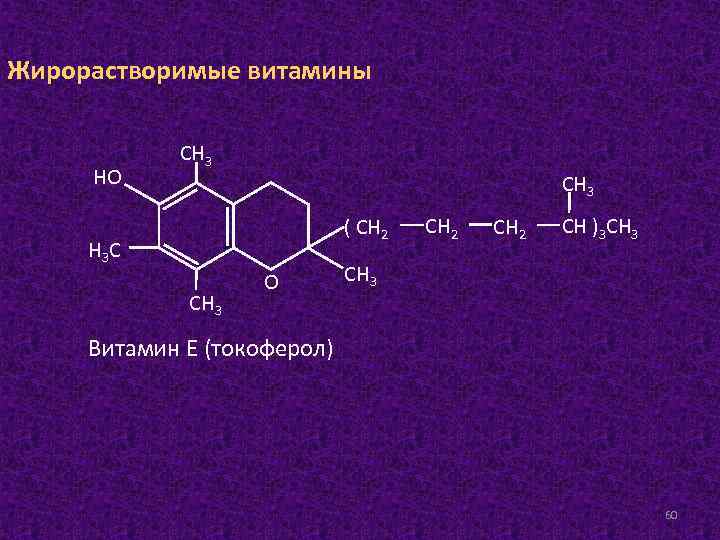
Жирорастворимые витамины НО СН 3 ( СН 2 Н 3 С СН 3 О СН 2 СН )3 СН 3 Витамин Е (токоферол) 60

Источником витамина Е для человека являются растительные масла, салат, капуста, семена злаков, сливочное масло, ягоды шиповника, яичный желток. Суточная потребность в витамине у взрослого человека составляет по разным рекомендациям от 5 до 10 мг. В настоящее время витамину Е уделяется большое внимание как антиоксиданту, который ингибирует свободнорадикальные процессы в клетке и, таким образом, препятствует развитию цепных реакций перекисного окисления ненасыщенных жирных кислот, защищает молекулы ДНК от повреждений. 61
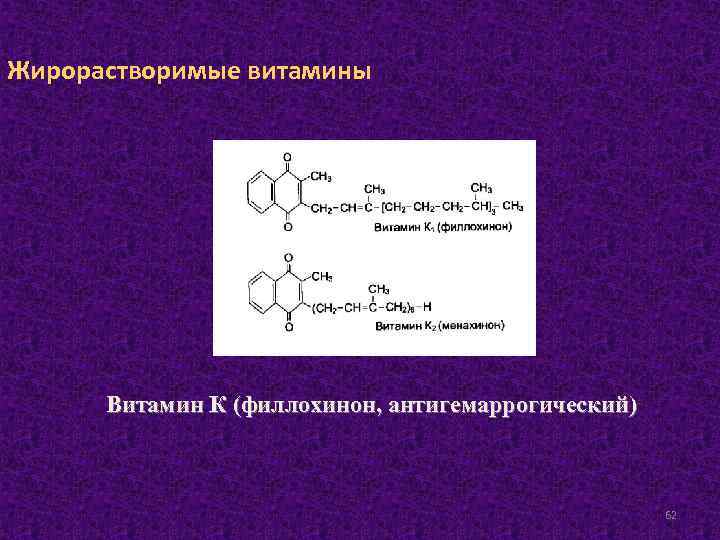
Жирорастворимые витамины Витамин К (филлохинон, антигемаррогический) 62

Витамин К в природе существует в двух витамерных формах: филлохинон (К 1), выделенный из растений и менахинон (К 2) в клетках кишечной флоры. Источником витамина К служат продукты растительного происхождения, к которым относятся: капуста, шпинат, корнеплоды, продукты животного происхождения, богатые витамином К (печень). Суточная потребность в витамине К составляет 1– 2 мг. 63

Роль витамина К в свертывании крови Биологическая функция витамина К связана с его участием в процессе свертывания крови. В этой многокомпонентной системе витамину К отведена роль активатора факторов свёртывания крови: протромбина (фактор II), проконвертина (фактор VII), фактора Кристмаса (фактор IX) и фактора Стюарта (фактор X). Эти белковые факторы синтезируются в организме в виде неактивных предшественников. Один из этапов активирования связан с карбоксилированием их γ-карбоксиглутаминовой кислоты, необходимой для связывания ионов кальция. Витамин К участвует в реакции карбоксилирования как кофермент. 64
Лекция 3-4. Ферменты и витамины.ppt