1.Основные понятия и определения.ppt
- Количество слайдов: 50

Биокатализ Основные понятия и определения Лекция 1 1

В 1835 году Берцелиус впервые использовал термин «катализатор» Йёнс Якоб Берцелиус 2

• «Вещества, которые способные пробудить сродство, дремлющее при данной температуре, лишь одним своим присутствием, а не в силу своего собственного сродства» Berzelius J. , Jahresberichte, 15, 237 (1835) 3

Практически современное качественное определение термину «Катализатор» дал Оствальд Вильгельм Фридрих Нобелевская премия по химии 1909 г. 4

• «вещества, изменяющие скорость реакции, но не влияющие на ее энергетические характеристики» Ostwald W. , Chemische Betrachungen, Die. Aula, no. 1 (1895) Уточнив позже: • «Катализатор есть вещество, которое изменяет скорость химической реакции, но не входит в состав конечного продукта реакции» Ostwald W. , Phys. Z. , 3, 313 (1902) 5

Э. Абель (1913): “Я пришел к выводу, что катализ осуществляется в результате реакции, а не простого присутствия вещества”. Л. Гурвич (1916): “Каталитически действующие тела, притягивая к себе движущиеся молекулы гораздо сильнее, чем тела, лишенные каталитического действия, тем самым увеличивают силу удара, попадающих на их поверхность молекул”. 6

Г. К. Боресков (1968): “Когда-то катализ рассматривался как особое, немного таинственное явление, со специфическими законами, раскрытие которых должно было сразу в общей форме решить задачу подбора. Сейчас мы знаем, что это не так. Катализ по своей сущности - химическое явление. Изменение скорости реакции при каталитическом воздействии обусловлено промежуточным химическим взаимодействием реагирующих веществ с катализатором”. 7

Количественное определение • «Катализатор реакции (гомогенной)– вещество, концентрация которого входит в выражение для скорости в степени, превышающий стехиометрический коэффициент этого вещества в уравнении реакции» Bell R. P. , Oxford Univ. Press, Oxford, 1941, p. 3 8

Иначе катализатор можно определить как: • «вещество, увеличивающее скорость приближения системы к любому состоянию, которое кинетически и термодинамически доступно в отсутствии данного вещества» 9

Определение катализатора как вещества, в присутствии которого энергия активации понижается неверно Hughes E. D. , et. al. , J. Chem. Soc. 1525 (1953) катализатор направляет реакцию по другому, с более низкой энергией активации «по более быстрому пути» Hinshelwood C. N. , Oxford Univ. Press, Oxford, 1951, p. 369 10
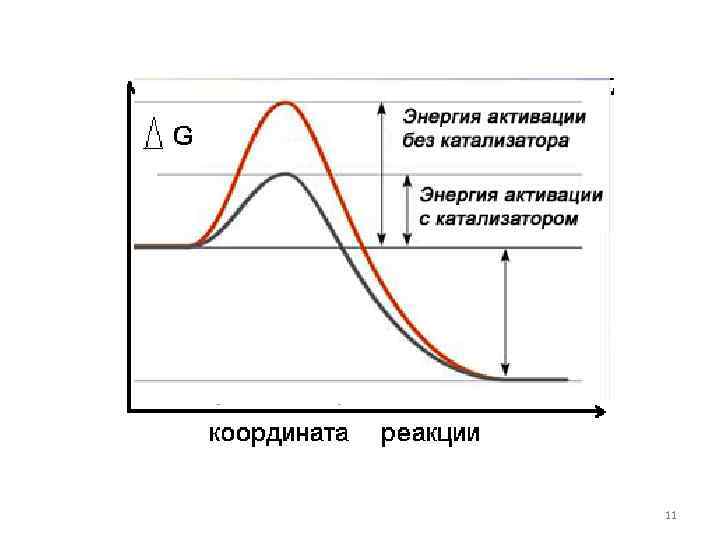
11

Катализатор ускоряет достижение равновесия, но не изменяет его положения! Повлиять на выход реакции присутствие катализатора не может. 12

Константа равновесия реакции зависит только от начального и конечного состояния системы и не зависит от пути реакции. 13

Типы катализаторов: • • • Гомогенный Гетерогенный Межфазный Мицеллярный Ферментативный Спиновый А. Л. Бучаченко, В. Л. Бердинский, Успехи химии, 73, 1123 (2004). 14

Ферменты –биологические катализаторы 15

КФ 1 Оксидоредуктазы; катализируемая реакция - Окислительно-восстановительные реакции. Перенос атомов H и O или электронов от одного субстрата на другой; тип реакции AH + B → A + BH (восстановленный), A + O → AO (окисленный) • • • КФ 1. 1 включает ферменты, взаимодействующие с CH—OH группой доноров; КФ 1. 2 включает ферменты, взаимодействующие с альдегидной или оксогруппой доноров; КФ 1. 3 включает ферменты, взаимодействующие с CH—CH группой доноров; КФ 1. 4 включает ферменты, взаимодействующие с CH—NH 2 группой доноров; КФ 1. 5 включает ферменты, взаимодействующие с CH—NH группой доноров; КФ 1. 6 включает ферменты, взаимодействующие с НАД · H или НАДФ · H; КФ 1. 7 включает ферменты, взаимодействующие с другими азотосодержащими соединениями в качестве доноров; КФ 1. 8 включает ферменты, взаимодействующие с сероусодержащей группой доноров; КФ 1. 9 включает ферменты, взаимодействующие с гемовой группой доноров; 16

• КФ 1. 10 включает ферменты, взаимодействующие с дифенолами и родственными соединениями в качестве доноров; • КФ 1. 11 включает ферменты, взаимодействующие с пероксидом в качестве акцептора (пероксидазы); • КФ 1. 12 включает ферменты, взаимодействующие с водородом в качестве донора; • КФ 1. 13 включает ферменты, взаимодействующие с одиночными донорами со встраиванием молекулярного кислорода (оксигеназы); • КФ 1. 14 включает ферменты, взаимодействующие с парными донорами со встраиванием молекулярного кислорода; • КФ 1. 15 включает ферменты, взаимодействующие с супероксид-радикалами в качестве акцепторов; 17

• КФ 1. 16 включает ферменты, окисляющие ионы металлов; • КФ 1. 17 включает ферменты, взаимодействующие с CH или CH 2 группами; • КФ 1. 18 включает ферменты, взаимодействующие с железосерными белками в качестве доноров; • КФ 1. 19 включает ферменты, взаимодействующие с восстановленным флаводоксином в качестве донора; • КФ 1. 20 включает ферменты, взаимодействующие с фосфором или мышьяком в качестве донора; • КФ 1. 21 включает ферменты, взаимодействующие с молекулами вида X—H и Y—H с образованием связи X—Y; • КФ 1. 97 включает другие оксидоредуктазы 18

КФ 2 Трансферазы Перенос функциональной группы от одного субстрата на другой. Это может быть метильная, ацильная, фосфатная группа или аминогруппа. AB + C → A + BC • • • КФ 2. 1 включает ферменты, переносящие одноуглеродные группы; КФ 2. 2 — ферменты, переносящие альдегидные и кетонные группы; КФ 2. 3 — переносящие ацильные остатки (ацилтрансферазы); КФ 2. 4 — переносящие остатки сахаров (гликозилтрансферазы); КФ 2. 5 — переносящие алкильные и арильные группы за исключеним метильного остатка; КФ 2. 6 — переносящие группы атомов, содержащие азот; КФ 2. 7 — переносящие фосфор-содержащие остатки; КФ 2. 8 — переносящие группы, содержащие серу; КФ 2. 9 — переносящие группы, содержащие селен. 19

КФ 3 Гидролазы Образование двух продуктов из одного субстрата в результате гидролиза. → AOH + BH • • • • AB + H 2 O КФ 3. 1 сложноэфирная связь эстеразы: нуклеаза, фосфодиэстераза, липаза, фосфатаза КФ 3. 2 сахара гликозидазы: амилаза, гиалуронидаза, лизоцим и др. КФ 3. 3 простая эфирная связь КФ 3. 4 пептидная связь протеазы: трипсин, химотрипсин, эластаза, тромбин, ренин и др. КФ 3. 5 непептидная углерод-азотная связь КФ 3. 6 кислотный ангидрид-гидролаза (хеликаза, ГТФаза) КФ 3. 7 углерод-углеродная связь (C-C) КФ 3. 8 галогенная связь КФ 3. 9 азотно-фосфорная связь (P-N) КФ 3. 10 азотно-серная связь (S-N) КФ 3. 11 углеродно-фосфорная связь (C-P) КФ 3. 12 дисульфидная связь (S-S) КФ 3. 13 серо-углеродная связь (C-S) 20

КФ 4 Лиазы (синтазы) Негидролитическое добавление или удаление группы к или от субстрата. Образование C-C, C-N, C-O или C-S связи. RCOCOOH → RCOH + CO 2 • КФ 4. 1 включает ферменты, которые расщепляют углерод-углеродные связи, например, декарбоксилазы (карбокси-лиазы); • КФ 4. 2 — ферменты, расщепляющие углерод-кислородные связи, например, дегидратазы; • КФ 4. 3 — ферменты, расщепляющие углерод-азотные связи (амидинлиазы); • КФ 4. 4 — ферменты, расщепляющие углерод-серные связи; • КФ 4. 5 — включает ферменты, расщепляющие связи углерод — галоген, например, ДДТ-дегидрохлориназа; • КФ 4. 6 — ферменты, расщепляющие фосфор-кислородные связи, например, аденилатциклаза; • КФ 4. 99 — включает другие лиазы. 21

КФ 5 Изомеразы Внутримолекулярная перестановка, то есть изомеризация молекулы субстрата. AB → BA • КФ 5. 1 включает ферменты, катализирующие рацемизацию (рацемазы) и эпимеризацию (эпимеразы) • КФ 5. 2 включает ферменты, катализирущие геометрическую изомеризацию (цис-транс изомеразы) • КФ 5. 3 включает внутримолекулярные оксидоредуктазы • КФ 5. 4 включает трансферазы (мутазы) • КФ 5. 5 включает внутримолекулярные лиазы • КФ 5. 99 включает другие изомеразы, в том числе, топоизомеразы 22

КФ 6 Лигазы (синтетазы) Соединение двух молекул в результате синтеза новой C-O, C-S, C-N или C-C связи, сопряжённое с одновременным гидролизом АТФ. X + Y+ ATP → XY + ADP + Pi • ДНК-лигаза I: лигирует Фрагменты Оказаки в ходе репликации отстающей цепи ДНК и некоторых фрагментов в ходе рекомбинации. • ДНК-лигаза II: форма альтернативного сплайсинга ДНК-лигазы III, найденная в неделящихся клетках. • ДНК-лигаза III: белковые комплексы с белком репарации ДНК en: XRCC 1, образуются в ходе эксцизионной репарации оснований ДНК и при рекомбинации. • ДНК-лигаза IV: образует комплексы с en: XRCC 4. Катализирует окончательный этап негомологичного соединения концов (nonhomologous end joining) двунитевых разрывов ДНК при соответствующем пути репарации. Также требуется для V(D)J рекомбинации генов иммуногл 23

Строение ферментов 24
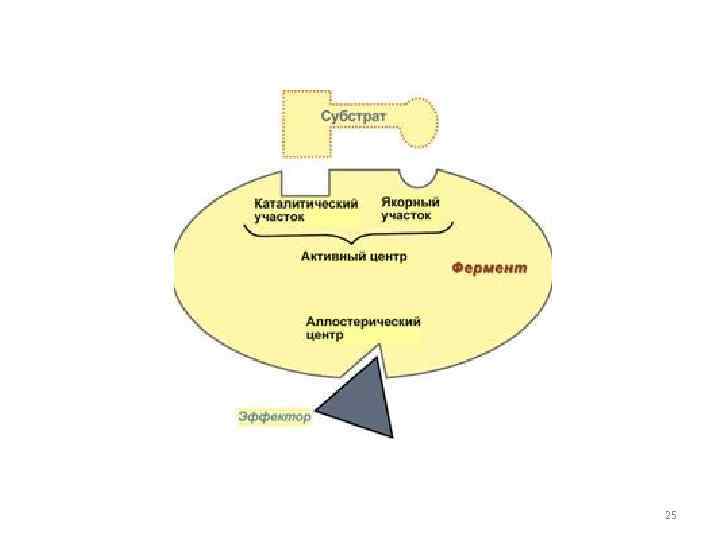
25

• Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента. В его пределах различают Адсорбционный участок (центр) и каталитический участок (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр. 26

Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. 27

Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями. Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошленд положил в основу теории индуцированного соответствия (или наведенного соответствия), которая преодолела ограниченность существовавшей ранее теории ключа и замка (жесткого соответствия структуры субстрата структуре адсорбционного центра). 28

Аллостерическими центрами называют такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит обратимо) с тем или иным веществом (лигандом). Причем такое связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами или аллостерическими ингибаторами данного фермента. 29

Типы ферментативных реакций 30

• 1. Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты (Трансаминирование). 31
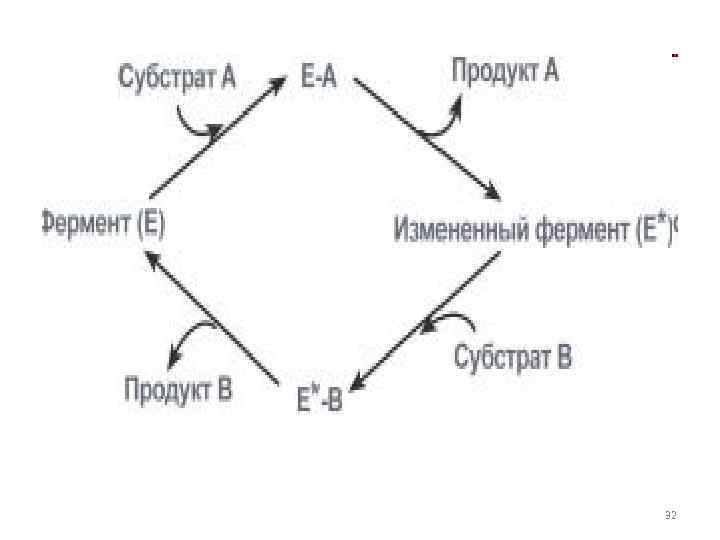
32

• 2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента. 33
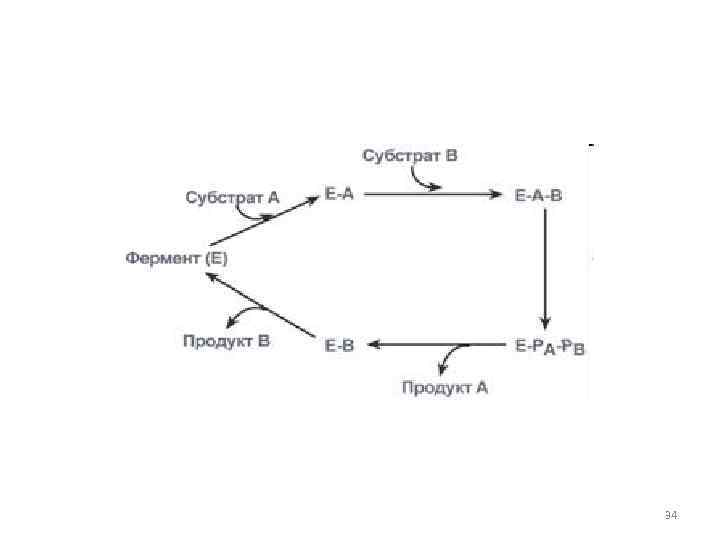
34

• 3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются. 35
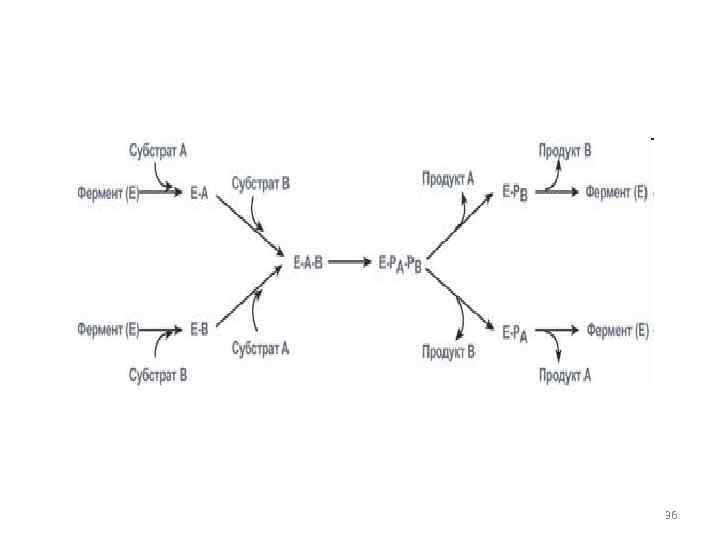
36

Сходство и отличия ферментов и неорганических катализаторов 37

Сходство • 1. Катализируют только энергетически возможные реакции. • 2. Не изменяют направления реакции. • 3. Ускоряют наступление равновесия реакции, но не сдвигают его. • 4. Не расходуются в процессе реакции. 38

Отличия • 1. Скорость ферментативной реакции намного выше. • 2. Высокая специфичность. • 3. Мягкие условия работы (внутриклеточные). • 4. Возможность регулирования скорости реакции. • 5. Скорость ферментативной реакции пропорциональна количеству фермента. 39

Некоторые кинетические аспекты ферментативных реакций 40

Уравнение Михаэлиса–Ментен, выражает количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции: где v – наблюдаемая скорость реакции при данной концентрации субстрата [S]; KS– константа диссоциации фермент-субстратного комплекса, моль/л; Vmax– максимальная скорость реакции при полном насыщении фермента субстратом. 41

Следует указать, что уравнение Михаэлиса–Ментен в его классическом виде не учитывает влияние на скорость ферментативного процесса продуктов реакции, например в реакции и носит несколько ограниченный характер. Поэтому были предприняты попытки усовершенствовать его. Так, было предложено уравнение Бриггса. Холдейна: где Кm представляет собой константу Михаэлиса, являющуюся экспериментально определяемой величиной. 42
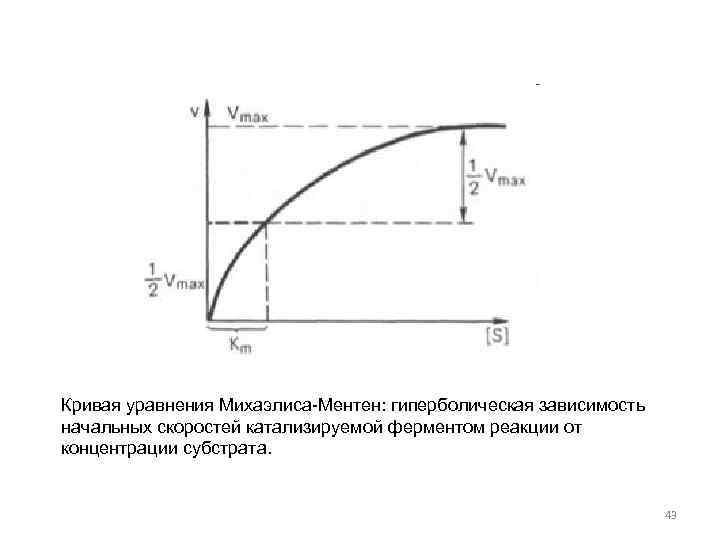
Кривая уравнения Михаэлиса-Ментен: гиперболическая зависимость начальных скоростей катализируемой ферментом реакции от концентрации субстрата. 43

Пользоваться графиком, построенным в прямых координатах зависимости начальной скорости реакции v 0 от начальной концентрации субстрата [S 0], неудобно, поскольку максимальная скорость Vmax является в данном случае асимптотической величиной и определяется недостаточно. Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк предложили уравнение, которое получило название уравнения Лайнуивера–Бэрка 44
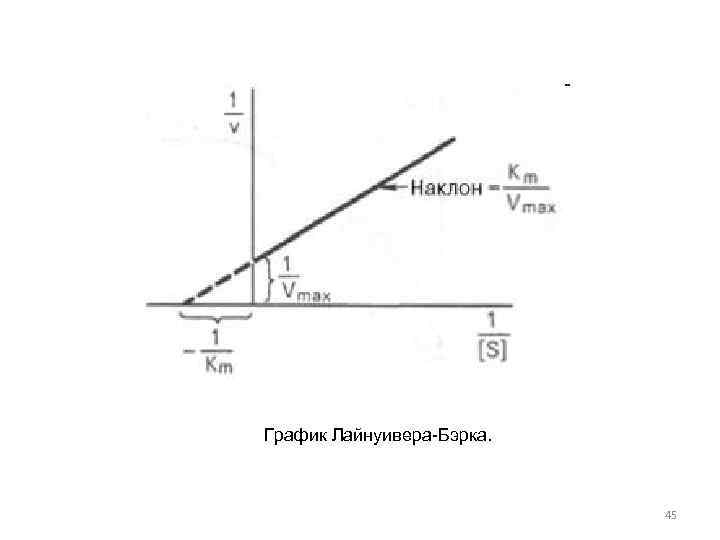
График Лайнуивера-Бэрка. 45
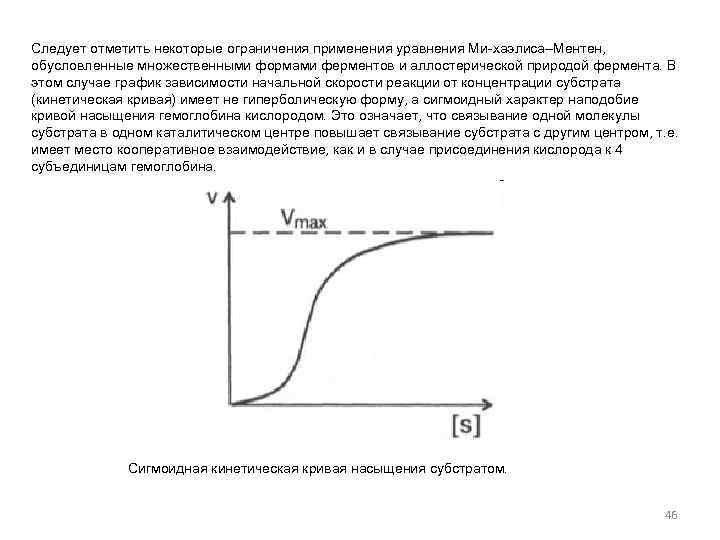
Следует отметить некоторые ограничения применения уравнения Ми-хаэлиса–Ментен, обусловленные множественными формами ферментов и аллостерической природой фермента. В этом случае график зависимости начальной скорости реакции от концентрации субстрата (кинетическая кривая) имеет не гиперболическую форму, а сигмоидный характер наподобие кривой насыщения гемоглобина кислородом. Это означает, что связывание одной молекулы субстрата в одном каталитическом центре повышает связывание субстрата с другим центром, т. е. имеет место кооперативное взаимодействие, как и в случае присоединения кислорода к 4 субъединицам гемоглобина. Сигмоидная кинетическая кривая насыщения субстратом. 46

Для оценки концентрации субстрата, при которой скорость реакции составляет половину максимальной, в условиях сигмоидного характера кинетической кривой обычно применяют преобразованное уравнение Хилла: где К' – константа ассоциации; n – число субстратсвязывающих центров. 47

Каталитически совершенный фермент (catalytically perfect enzyme, kinetically perfect enzyme) — это фермент, который совершает катализ настолько эффективно, что практически каждый раз, когда фермент встречает субстрат, происходит реакция. kcat/Km фактор для данного фермента имеет порядок от 108 до 109 M− 1 с− 1. Такая реакция лимитируется только скоростью диффузии субстрата. Примерами каталитически совершенных ферментов являются триозо-фосфат изомераза, карбоангидраза, ацетилхолинэстераза, каталаза, фумараза, β-лактамаза и супероксиддисмутаза. 48
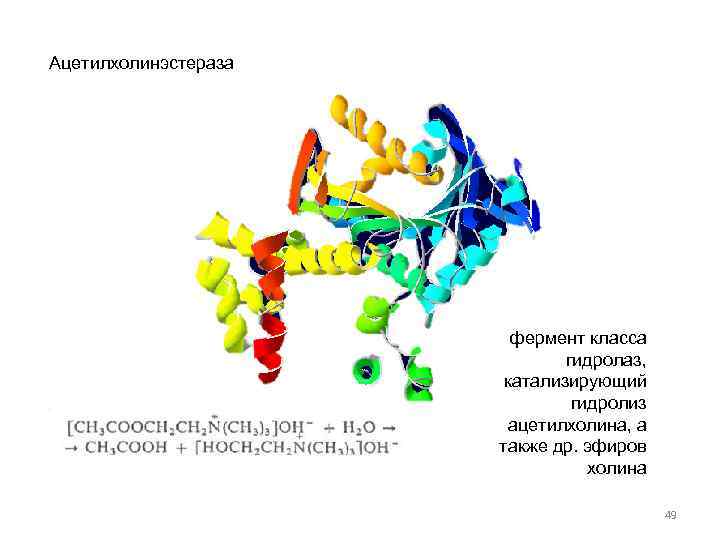
Ацетилхолинэстераза фермент класса гидролаз, катализирующий гидролиз ацетилхолина, а также др. эфиров холина 49

Спасибо за внимание! 50
1.Основные понятия и определения.ppt