лек1 стом.ppt
- Количество слайдов: 33

Біогенні елементи. Кислотно-основні рівноваги в біологічних рідинах. Лекція 1

Біогенні елементи – це хімічні елементи, які беруть участь у біологічних процесах живих організмів. 11 біогенних елементів: О, С, N, Н, S, Са, Mg, К, Na, Сl, Р – 99. 5% маси організму Решта – 0, 5% За кількісним складом розподіляються: - макроелементи – більше 0, 01% (С, Н, О, N, Р, S, Na, Са, К, Cl) - мікроелементи – 10– 2– 10– 12% (Mg, Cu, Zn, Mn, Co, Fe, I, Al, Mo) - ультрамікроелементи - менше 10– 12% - всі решта.

За електронною будовою розподіляються на: s-, р-, d-елементи. За фізіологічною активністю: - незамінні С, Н, О, N, Р, S, Na, Са, К, Cl - біокаталітичні Cu, Zn, Mn, Co, Fe, I - токсичні (пригнічують життєдіяльність) As, Hg, Sb.

Розподіл елементів в природі нерівномірний. Біохімічні провінції – зони у яких тварини і рослини характеризуються визначеним хімічним елементним складом. Ендемічні хвороби – викликані надлишком чи дефіцитом елементів в деякій провінції. Недостатність I – зоб F – карієс (західні області України) Надлишок F – флуороз (Полтавська обл. )

Розчини – це гомогенні термодинамічна стійкі системи змінного складу, які складаються з двох або більше компонентів та продуктів їх взаємодії. Розчини – плазма крові, лімфа, сеча, спинномозкова рідина Плазма крові: 90 -92% води 8 -10% сухої речовини Вміст води: в ембріоні – 97% в новонародженого- 77% у зрілому віці- 50 -60%

Добова потреба води в середньому 2, 5 л. Аномальні властивості: • Висока теплоємність – терморегуляція • Мінімальна теплоємність при 36, 790 С • Мала в’язкість • Висока діелектрична проникність

Електроліти - це речовини, які в розчиненому (чи розплавленому) стані проводять електричний струм. Електропровідність обумовлена дисоціацією на йони Електроліти ділять на 2 типи: сильні і слабкі. Електроліти визначають величину осмотичного тиску фізіологічних рідин. Наявність електролітів впливає на розчинність білків, амінокислот

В нормальному стані організму вміст електролітів: Катіонів в плазмі крові – 154 ммоль/л в основному це йони Nа+, К+, Са 2+ і Мg 2+. Аніонів – 154 ммоль/л в основному це - Cl–, HCO 3–, а також багатозарядні макройони білків.
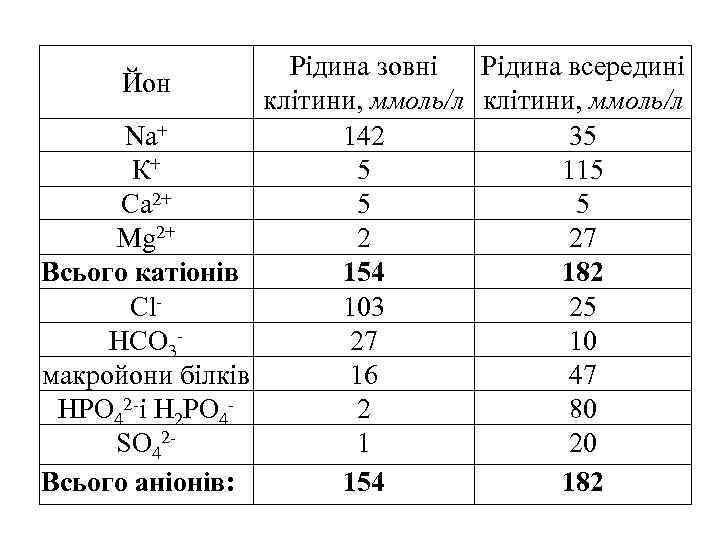
Рідинa зовні Рідина всередині Йон клітини, ммоль/л Nа+ 142 35 К+ 5 115 Са 2+ 5 5 Мg 2+ 2 27 Всього катіонів 154 182 Сl 103 25 НСО 327 10 макройони білків 16 47 НРО 42 -і Н 2 РО 42 80 SО 421 20 Всього аніонів: 154 182

Порушення нормального електролітного балансу має негативні наслідки. Відомі патології обумовлені як недостатністю цих йонів в організмі (зниження осмoтичного тиску), так і їх надлишком (гіпертонія). Прикладом антагонізму є взаємний вплив катіонів калію і кальцію. Синергізм йонів є підсилення дії одного йона іншим.

Слабкі електроліти в розчинах дисоціюють не повністю. СН 3 СООН СН 3 СОО- + Н+ Швидкість прямої реакції 1 = К 1 [СНз. СООН] зворотної реакції 2 = К 2 [СНз. СОО-] [Н+] При встановленні рівноваги 1 = 2

Оствальд встановив зв’язок між константою дисоціації (К), ступенем дисоціації (α) і молярною концентрацією розчину (С) Для оцтової кислоти, яка дисоціює не повністю, а лише певна її частина (α) - СН+ = ССН 3 СОО– = С. α концентрація недисоційованих молекул С – С. α = С (1 -α)

Для слабких електролітів (α < 3%) 1 -α = 1 - 0, 03 ≈ 1. рівняння константи спрощується К = Сα 2 звідки 1/С -розведення

Закон розведення Оствальда Ступінь дисоціації слабих бінарних електролітів обернено пропорційна кореню квадратному із їх концентрації або прямо пропорційна їх розведенню. Наслідки: • Чим більш розведений розчин, тим більша ступінь електролітичної дисоціації розчиненого електроліту. • Ступінь електролітичної дисоціації двох електролітів однакової концентрації розчину більша у того електроліту, в якого більша константа

Теорія кислот і основ Сучасні уявлення про природу кислот і основ дали Дж. Бренстед та І. Льюїс (1923 р). За протонною теорією кислота - це речовина, що віддає протон (донор протону), а основа - речовина, що приймає протон (акцептор протона). НCl. О + Н 2 О Сl. O- + H 3 O+ спряжена кислота основа кислота І II

Дисоціація води Згідно з теорією Бренстеда вода відносно самої себе є одночасно і кислотою і основою (амфоліт) Н 2 О ОН- + Н+ Н 2 О + Н+ = Н 3 О+ Н 2 О = Н 3 О+ + ОНця реакція називається автопротолізом води: кількісно визначається йонним добутком води.

Константи рівноваги К=3, 24. 10 -18 при 290 К К=1, 84. 10 -16 при 273 К з 550 млн. молекул води - дисоціює тільки одна Маса 1 л води при 25°С - 997, 07 г [H 3 O+]. [OH-]=K. [H 2 O]2=1, 84. 10 -16. 55, 242=1. 10 -14
![[H 3 O+]. [OH-] = 1. 10 -14 – йонний добуток води. В нейтральному [H 3 O+]. [OH-] = 1. 10 -14 – йонний добуток води. В нейтральному](https://present5.com/presentation/121216610_130089411/image-18.jpg)
[H 3 O+]. [OH-] = 1. 10 -14 – йонний добуток води. В нейтральному розчині [H 3 O+]=[OH]= В кислому середовищі [H 3 O+]>[OH-] [H 3 O+]>10 -7, а [OH-]<10 -7 В лужному середовищі [H 3 O+]<[OH-] [H 3 O+]<10 -7, [OH-]>10 -7
![якщо в розчині [Н 3 О+] = 10 -3 моль/л, то середовище розчину кисле, якщо в розчині [Н 3 О+] = 10 -3 моль/л, то середовище розчину кисле,](https://present5.com/presentation/121216610_130089411/image-19.jpg)
якщо в розчині [Н 3 О+] = 10 -3 моль/л, то середовище розчину кисле, а концентрація Водневий показник р. Н - це десятковий логарифм концентрації йонів гідроксонію, взятий з від’ємним знаком. Аналогічно p. H = -lg[H 3 O+] р. ОН = -lg[OH-] р. Кводи = р. Н + р. ОН = 14

Для розчинів слабких кислот і основ, в яких кількість йонів значно менша за концентрацію кислоти чи основи, треба знати значення ступеня і константи йонізації. р. Н=-lg c∙α згідно з законом Оствальда де Ка - константа йонізації с - концентрація.

для слабких основ р. ОН = -lg c∙α Для розчину СН 3 СООН з См = 0. 1 моль/л
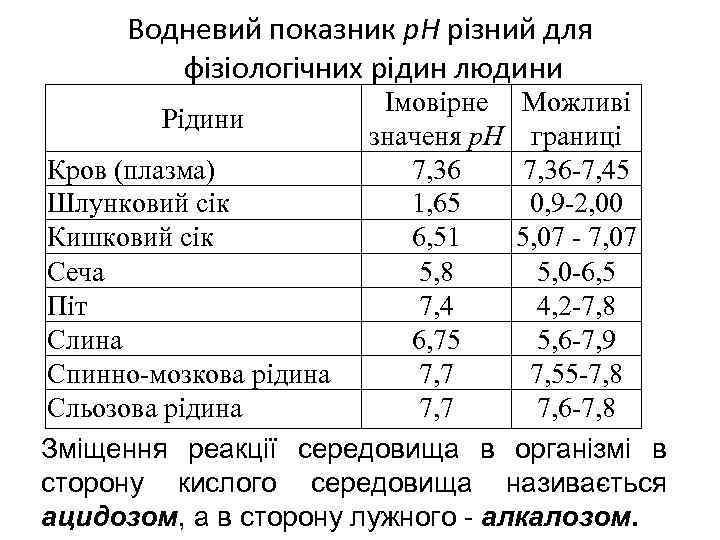
Водневий показник р. Н різний для фізіологічних рідин людини Імовірне Можливі Рідини значеня р. Н границі Кров (плазма) 7, 36 -7, 45 Шлунковий сік 1, 65 0, 9 -2, 00 Кишковий сік 6, 51 5, 07 - 7, 07 Сеча 5, 8 5, 0 -6, 5 Піт 7, 4 4, 2 -7, 8 Слина 6, 75 5, 6 -7, 9 Спинно-мозкова рідина 7, 7 7, 55 -7, 8 Сльозова рідина 7, 7 7, 6 -7, 8 Зміщення реакції середовища в організмі в сторону кислого середовища називається ацидозом, а в сторону лужного - алкалозом.

Буферні розчини - здатні зберігати значення р. Н при розведенні або при додаванні невеликих кількостей кислоти чи лугу, а також при їх концентруванні. До таких розчинів належать: 1) розчини, що містять слабку кислоту і сіль цієї кислоти з сильною основою: СН 3 СООН + СН 3 СООNa - ацетатний буфер р. Н (3, 72 -5, 57) (4, 65) 2) розчини, що містять слабку основу і сіль цієї основи з сильною кислотою NН 4 ОН + NH 4 Cl - аміачний буфер p. Н (8, 43 -10, 28) (9, 37) 3) розчини, що містять солі багатоосновних слабких кислот Nа 2 НРО 4 + Nа. Н 2 PО 4 - фосфатний буфер p. Н( 5, 91 -7, 73) (6, 81)

Механізм дії буферних розчинів В ацетатному буфері кислота і сіль піддаються дисоціації СН 3 СООН СН 3 СОО- +Н+ СН 3 СООNа СН 3 СОО- + Nа+ кислота в розчині протолізується НСІ + Н 2 О = СІ- + Н 3 О+ СН 3 СОО- + Н 3 О+ СН 3 СООН + Н 2 О Якщо ж до цього самого розчину додати сильну основу Nа. ОН, то електролітична дисоціація Nа. ОН = Na+ + ОНпротоліз СН 3 СООН+Н 2 О СН 3 СОО- +Н 3 О+ нейтралізація Н 3 О++ ОН- = 2 Н 2 О реакція середовища майже не змінюється.

рівняння Гендерсона-Гассельбаха Для розрахунку p. Н кислотного буферного основного буферу

Буферна ємність - це розрахункова величина, яка визначається кількістю еквівалентів сильної кислоти n (1/1 НСІ) чи n(1/2 Н 2 SО 4) або сильної основи n (1/1 Nа. ОН), n(1/2 Вa(ОН)2) що треба додати до 1 л буферного розчину, щоб p. Н змінився на одиницю. Якщо В - буферна ємність, а n (Н 3 О+) і n (ОН-) — молярні концентрації еквівалентів відповідно кислоти і основи, то

БУФЕРНІ СИСТЕМИ ОРГАНІЗМУ Гідрогенкарбонатна: Н 2 СО 3+Na. HCO 3 (в еритроцитах і позаклітинних рідинах) Фосфатна: Na. H 2 PO 4+ Na 2 HPO 4 (у клітинах, сечі, плазмі) Гемоглобінова: HРb+HHb. O 2 (в еритроцитах) Білкова: альбуміни плазми крові (у клітинах і тканинах)

Осмос - направлене переміщення розчинника із розчину меншої концентрації в розчин більшої концентрації якщо розчини різної концентрації розділити напівпроникною перегородкою. Осмос протікає проти градієнту концентрації. осмотичний тиск - тиск, який треба прикласти до розчину, щоб зупинити осмос
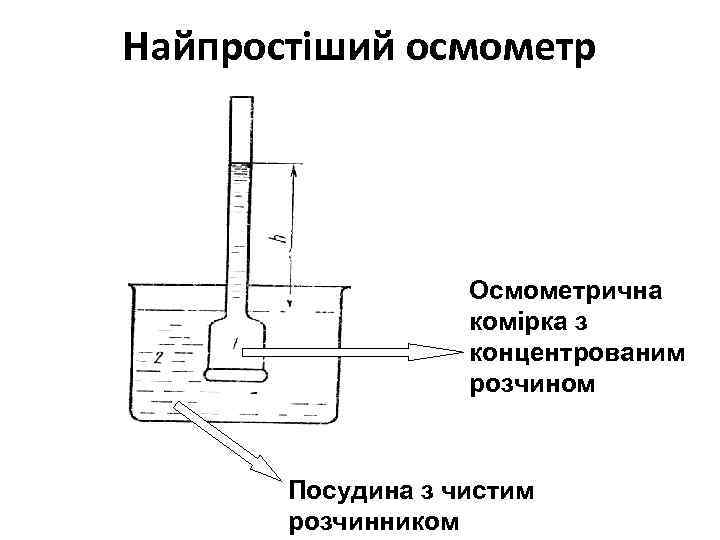
Найпростіший осмометр Осмометрична комірка з концентрованим розчином Посудина з чистим розчинником
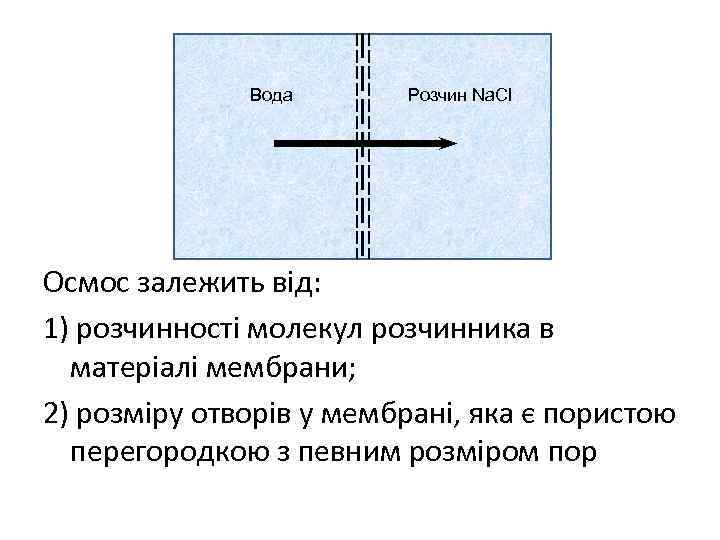
Вода Розчин Na. Cl Осмос залежить від: 1) розчинності молекул розчинника в матеріалі мембрани; 2) розміру отворів у мембрані, яка є пористою перегородкою з певним розміром пop

закон Вант-Гоффа осмотичний тиск розчину прямо пропорційний молярній концентрації і абсолютній температурі розчину. Для неелектролітів: π=CRT Для електролітів: π=іCRT Осмотичний тиск крові людини при 37 °С (310 К) 7, 4 - 7, 7 атм, або 740 -780 к. Па.

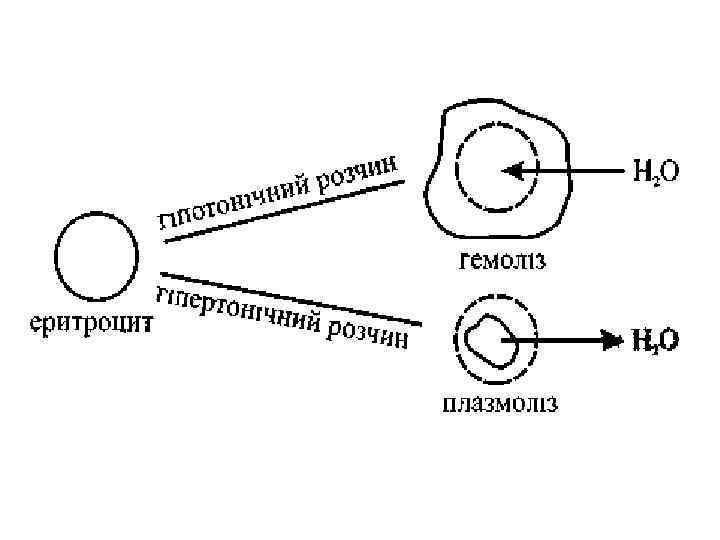
онкотичний тиск 3, 5 — 3, 9 к. Па. 0, 5% загального тиску крові складають білки осмомолярна концентрація розчинених в плазмі речовин 0, 287 -0, 303 моль/л. ізотонічний розчин з осмотичним тиском, що дорівнює осмотичному тиску прийнятого за стандарт гіпертонічний розчин з осмотичним тиском вищим, гіпотонічний – нижчим за стандарт. В медицині ізотонічними називають розчини з осмотичним тиском плазми крові. 0, 85%-0, 90% Na. Cl (0, 146 моль/л) розчин глюкози 4, 5 - 5% (0, 3 моль/л).
лек1 стом.ppt