д-елементи (мс).ppt
- Количество слайдов: 45

Біогенні d-елементи Підготував викладач Петрушка С. Б.

1. Загальна характеристика dелементів І групи До елементів ІВ групи періодичної системи належать Купрум Сu, Аргентум Аg та Аурум А u. Вони належать до малопоширених у земній корі. Вони існують як у вільному стані, так і у вигляді сполук. Купрум найчастіше знаходиться у природі у формі сульфідів (Сu 2 S — мідний блиск, Сu. Fе. S 2 — мідний колчедан) та кисневмісних сполук (Сu 2 О — куприт, (Сu. ОН)2 СО 3 — малахіт). Крім аргентиту Аg 2 S Аргентум міститься в поліметалічних рудах.

Ø Мідь, срібло та золото — м'які блискучі метали. Мідь має червоний колір, срібло — сріблясто-білий, золото — жовтий. Усі ці метали дуже пластичні. Золоті пластинки можна прокатати до товщини 10 -4 мм. Срібло має найвищу серед металів теплопровідність та електропровідність. На цьому засновано його використання у приладобудуванні.

Реакції якісного виявлення елементів підгрупи Купруму Ø Виявлення іонів Купруму Ø При додаванні аміаку до розчинів солей купруму (ІІ) спочатку утворюється блакитний осад основної солі, який розчиняється в надлишку аміаку з утворенням катіонів тетраамінкупруму(ІІ) [Сu(NН 3)4]2+, забарвлених в інтенсивно синій колір:

Ø Виявлення іонів Аргентуму Ø Іони аргентуму утворюють з хлоридною кислотою та розчинними хлоридами білий сирнистий осад Аg. С 1, який легко розчиняється в розчинах аміаку, карбонату амонію, тіосульфату натрію, ціаніду натрію (калію): Ø Аg+ + Cl- = Аg. Сl↓, Ø Аg. Сl↓ + 2 NH 3 = [Аg(NН 3)2]С 1.

Біологічна роль та використання в медицині сполук Купруму, Аргентуму і Ауруму Купрум належить до життєво необхідних мікроелементів та відіграє важливу біологічну роль в усіх процесах, які протікають в організмі людини. Ø Як правило, в жіночому організмі купруму більше, ніж у чоловічому. У дитячому організмі купруму міститься у три рази більше, ніж у дорослому, що визначається більшою інтенсивністю процесу метаболізму. Найбільший вміст купруму зосереджений у жовчному міхурі та печінці. Ø

Ø Купрум специфічно діє на синтез гемоглобіну та утворення еритроцитів. Солі купруму позитивно впливають на ріст та розвиток організму, приймаючи участь у білковому обміні. Добова потреба в Купрумі близько 2 мг, вона з надлишком перекривається, якщо в раціоні харчування людини є теляча печінка, хліб грубого помолу, насіння стручкових рослин. Велика кількість купруму міститься у дріжджах.

Ø В організмі людини Купрум утворює комплексні сполуки з біологічно активними субстратами — амінокислотами та білками, сприяючи процесам кровотворення, утворення кісткової тканини, розумовому та фізичному розвитку. Комплекси купруму з багатьма лікарськими препаратами підвищують їх фармакологічну активність.

Ø Ø Сульфат купруму(ІІ) використовують як зовнішній антисептичний, в'яжучий або припікаючий засіб у вигляді розчинів з масовою часткою 0, 25 % в очній та урологічній практиці. Аргентум. Фізіологічна та біологічна роль аргентуму мало вивчена. Залежно від концентрації аргентум здійснює в'яжучу, припікаючу, протизапальну та бактерицидну дію. Аргентуму нітрат Аg. NO 3 у вигляді водних розчинів з масовою часткою 1 -2 % використовують як антисептичний засіб зовнішньо для лікування очних хвороб та захворювань шкіри. Колоїдні розчини Аргентуму — протаргол (комплексна сполука білка з Аргентумом), коларгол (колоїдне срібло) використовують для промивання сечовивідних шляхів, в очній практиці та дерматології як в'яжучі та антисептичні засоби. Бактерицидні властивості Аргентуму використовують для знезараження питної води.

Аурум. Існує розділ медицини, який вивчає методи лікування препаратами Ауруму — хризотерапія. Біологічна роль Ауруму вивчена недостаньо. Кризаніл застосовують для лікування кісткового туберкульозу. Усі сульфурвмісні препарати Ауруму проявляють лікарську дію при введенні внутрішньом'язово. Ø Фосфоровмісні препарати Ауруму менш токсичні. Вони виявилися активними протиартритними засобами. Оскільки ці сполуки добре всмоктуються у шлунку, їх можна застосовувати у вигляді таблеток. Ø


ПІДГРУПА ЦИНКУ (ЦИНК, КАДМІЙ, РТУТЬ) Ø Побічну підгрупу ІІ групи періодичної системи Менделєєва складають елементи цинк (30 Zn), кадмій (48 Cd) і ртуть (80 Hg). Ø Ртуть розчиняє в собі метали, утворюючи сплави – амальгами. Деякі амальгами мають важливе технічне значення, наприклад амальгама Au i Cu.

Ø У металічному стані Zn, Cd, Hg – сріблясто-білі речовини, причому ртуть за звичайних умов знаходиться в рідкому стані; цинк і кадмій також належать до м яких і легкоплавких металів. Ø Легкоплавкість і висока леткість металів ряду Zn–Cd–Hg відрізняє елементи підгрупи від типових перехідних елементів, які, як правило, важкоплавкі.

Ø Метали підгрупи цинку надзвичайно отруйні. Особливо це відноситься до металічної ртуті, отруйність якої збільшується через високий тиск пари навіть при звичайній температурі ( 0. 1 Па): відбувається забруднення ртуттю всього приміщення, якщо, наприклад, металічну ртуть розлили, або зберігають у відкритій посудині. Розлиту ртуть необхідно зібрати мідною фольгою – на поверхні фольги утворюється амальгама міді – або посипати порошком сірки чи залити розчином хлористого заліза. Металічна ртуть при цьому переходить малорозчинні сульфід Hg. S і каломель Hg 2 Cl 2, що зменшує тиск пари, локалізує забруднення ртуттю і полегшує його усунення.

Біологічна роль сполук Цинку, Кадмію, Меркурію Ø Цинк належить до незамінних мікроелементів організму людини. Добова потреба в цинку складає 10 -15 мг. У організм людини сполуки Цинку потрапляють як з рослинною, так і тваринною їжею. Біологічна роль його пов’язана з діяльністю залоз внутрішньої секреції. Як складова частина деяких ферментів Цинк впливає на процеси розмноження, жирового та вуглецевого обмінів. При недостачі цинку виникає цироз печінки, ураження шкіри та очей.

Ø Zn. O – оксид цинку – білий порошок. Використовують у медичній практиці, у дерматології у вигляді мазей та присипок як в’яжучий, підсушуючий та антимікробний засіб. Ø Zn. SO 4 – у вигляді очних крапель з масовою часткою 0, 25 і 0, 3%. Сульфат цинку пригнічує розмноження мікроорганізмів.

Біологічна роль Кадмію досліджена недостатньо. Сполуки Кадмію токсичні та кумулюються в печінці та нирках. Ø Ртуть відома з стародавніх часів. Її препарати використовують ще з XVI сторіччя. Сполуки меркурію виявляють антисептичну, протипаразитарну, сечогінну та послаблюючу дію. Оксид меркурію (Hg. O) використовують в офтальмології, а також в дерматології у вигляді мазей. Ø Хлорид меркурію (ІІ) Hg. Cl 2 (сулема) у концентрації 1: 1000 – для дезінфекції. Ø Хлорид меркурію (І) Hg 2 Cl 2 (каломель) певний час використовували як сечогінний та послаблюючий засіб. Ртуть та її розчинні солі дуже токсичні. Ø


2. Загальна характеристика dелементів VI групи Ø До d-елементів VIB групи періодичної системи відносяться Хром Cr, Молібден Mo та Вольфрам W. Ø Як і інші d-елементи, Хром, Молібден та Вольфрам утворюють комплексні сполуки з координаційним числом 6 (рідше 4).

Ø У природі Хром та його аналоги зустрічаються виключно у зв'язаному стані. Ø Хром, молібден та вольфрам — білі блискучі метали. Вони дуже тверді та тугоплавкі. Вольфрам — найбільш тугоплавкий з металів, його температура плавлення +3395 °С.

Виявлення хромат-іонів Ø Утворення осадів Ba. Cr. O 4 і Pb. Cr. O 4 жовтого кольору: Ø Для утворення пероксиду хрому Cr. O 5 до розчину дихромату калію додають 2— 3 краплі розчину H 2 O 2, ефір та 2— 3 краплі розчину H 2 SO 4. У присутності Хроматчи дихромат-іонів утворюється оксиддипероксид хрому блакитного кольору.

Біологічне значення елементів VIB групи Ø Хром відіграє важливу біологічну роль в організмі людини. Він позитивно впливає на процеси кровотворення, а також на ферментативні системи. У складі ферменту трипсину Хром приймає участь у процесі травлення. Додавання Хрому до їжі хворим на діабет нормалізує вуглеводний обмін. Хром в організм людини потрапляє з такими продуктами харчування, як соя, кукурудзяна та вівсяна крупи.

Масова частка Молібдену в організмі людини складає 1 ∙ 10 -5 %. Добова потреба організму в Молібдені втричі менша, ніж у Хромі. Молібден міститься у деяких ферментних системах організму людини. Він цілюще впливає на синтез гемоглобіну. Ø Надмірний вміст Молібдену сприяє накопиченню в організмі сечової кислоти, яка спричиняє розвиток подагри — хвороби, що призводить до змін у суглобах, кістках та хрящах. Ø Вольфрам також міститься в організмах людини та тварин, але його біологічна роль не вивчена. Ø


3. d - елементи VІІ групи Ø До елементів VІІВ групи періодичної системи належать Манган Мn, Технецій Тс та Реній Rе. Комплексні сполуки Мангану та його аналогів мають координаційні числа 6 і 4. Ø Манган — один з найпоширеніших елементів на Землі. Реній самостійних родовищ не утворює. Він міститься як домішка у рудах різних металів.

Ø Манган, технецій та реній — сріблясто- білі, тверді, стійкі на повітрі, тугоплавкі метали. Ø Перманганат калію, як сильний окисник, здатний окиснювати багато органічних речовин.

Біологічне значення і використання в медицині сполук Мангану Ø Манган є важливим елементом для життєдіяльності усіх живих організмів. Добова потреба людини у марганці 5— 7 мг. Він потрапляє в організм, головним чином, з рослинними харчовими продуктами. Найбільша його кількість міститься у вівсяній, пшеничній крупі та рисі. Багато Мангану знаходиться в мигдальних горіхах, молочному шоколаді.

Біологічна дія Мангану обумовлена його здатністю до комплексоутворення з кисне- та Нітрогеновмісними лігандами ферментів, гормонів та вітамінів. Завдяки цьому він впливає на жировий, білковий та вуглеводний обмін. Нестача Мангану призводить до відкладення жиру в організмі, викликаючи патологічне ожиріння. Ø Манган впливає на мінеральний обмін: солі Мангану сприяють засвоєнню Фосфору і Кальцію, приймають участь у засвоєнні Йоду та синтезі гормонів щитовидної залози. У комбінації з солями Купруму Манган стимулює процеси кровотворення. Ø

Ø Солі Мангану входять до складу багатьох полівітамінів з мікроелементами. Широке застосування у медичній практиці має перманганат калію. Розчини КМn. О 4 з масовою часткою 0, 01— 0, 1 % використовують в урології та гінекології для полоскань і спринцювань, для промивання шлунку при отруєннях. Розчини більш високих концентрацій (0, 1— 0, 5 %) — для промивання ран. При опіках першого ступеня рекомендують обробляти поверхню розчином КМn. О 4 з масовою часткою 2, 5— 4 %.

Добування мангану

d-елементи VIII групи Ø Fe – ферум, Co-кобальт, Ni-нікол Ø У природі Ферум — один з найпоширеніших елементів, що після Алюмінію займає друге місце серед металів, які містяться в земній корі. Кобальт і Ніколу природі зустрічаються лише в сполуках.

Ø Біологічна роль Феруму надзвичайно важлива, вона зумовлена здатністю Феруму утворювати різні комплексні сполуки, що виконують важливі функції в організмі. Ферумвмісний білок гемоглобін транспортує О 2 від легенів до тканин усіх органів. Ферум, який входить у порфіринові комплекси цитохромів, переносить електрони від флавінових ферментів до кисню повітря.

Ø Фізіологічний розпад еритроцитів, що містять Ферум, супроводжується щоденним звільненням 40— 80 мг Феруму, який депонується в печінці та селезінці. У печінці, селезінці, кістковому мозку та слизовій оболонці кишечника міститься запасний тривалентний Ферум у вигляді сполуки, яка називається ферритином. При синтезі гемоглобіну тривалентний Ферум (Fe 3+) переходить у двовалентний (Fe 2+).

Міоглобін м'язової тканини, подібно до гемоглобіну, зв'язує невелику кількість кисню, який потрапляє в організм. Особливо багато ферумвмісного міоглобіну в серцевому м'язі, оскільки навантаження на нього надзвичайно велике. Ø Комплексна сполука, що містить Ферум, входить до складу ферментів каталази й пероксидази. Ці ферменти в організмі людини прискорюють окисно-відновні процеси в 100 млн разів. Добова потреба у Ферумі дорослої людини становить 11 -30 мг та значно зростає при інтенсивних м'язових навантаженнях, у жінок — під час вагітності та годуванні малят. Ø

Знижений вміст Fe 2+ в організмі спостерігається у 80 % всіх жінок дітородного віку та майже в 40 % вагітних. Причиною такого стану є втрата організмом жінки частини крові під час менструацій за забирання Феруму дитиною в лоні матері для побудови власного організму. Ø Якщо вміст Феруму в організмі різко зменшується, в людини з'являються втома, порушується концентрація уваги, послаблюється імунітет, виникають депресивні явища, з'являється сухість шкіри, крихкість нігтів, починає випадати волосся, тьмяніють губи. Нестача Феруму в продуктах харчування призводить до анемії. Ø


Ø Токсичний вплив Феруму. Небезпечними для дітей є ліки, які містять Ферум та ферум сульфат. У разі потрапляння в організм Fe. SO 4 або чистого заліза (для дорослої людини 200 -250 мг/кг) вражаються печінка, слизова оболонка кишково-шлункового тракту, можлива смерть.

Ø Кобальт є життєво необхідним мікроелементом. Відомо лише один металовмісний вітамін — ціакобаламін. Кобаламінові комплекси, що синтезуються кишковими бактеріями, одержали загальну назву вітамін В 12. Його антианемічна дія виявляються в мізерних кількостях, а тому він належить до числа найбільш біологічно активних речовин. За участі В 12 відбувається синтез білків і нуклеїнових кислот. Вітамін В 12 — це кровотворний вітамін. З його участю відбувається дозрівання еритроцитів в кістковому мозку. За відсутності або нестачі Кобальту в організмі розвивається перніціозна анемія. Фізіологічна доза Со 2+ сприяє збільшенню кількості еритроцитів на 90 %, гемоглобіну — на 73 % і загальної маси циркулюючої крові — на 53 %.

Ø Вітамін В 12 позитивно впливає на процеси росту й розвитку організму, на функціональний стан центральної нервової системи, виявляє ліпотропний ефект, виступаючи в ролі стимулятора синтезу холіну і метіоніну. Ø Токсичний вплив Кобальту. Вдихання парів сполук Кобальту викликає гостре отруєння, а саме болі в суглобах, сухий кашель, вражаються бронхи й легені. Пил кобальту і Со. О призводить до паралічу й смерті.

Ø Нікол — необхідний мікроелемент, бо входить до складу багатьох ферментів. Ферменти, що містять Нікол, активізують реакції окислення білків, жирів, вуглеводів. Нікол бере участь у регуляції метаболізму гема в печінці й нирках. Ø Нікол належать до елементів, що найбільш токсично впливають на довкілля.

Залізна колона Катуб Мінар коло Делі
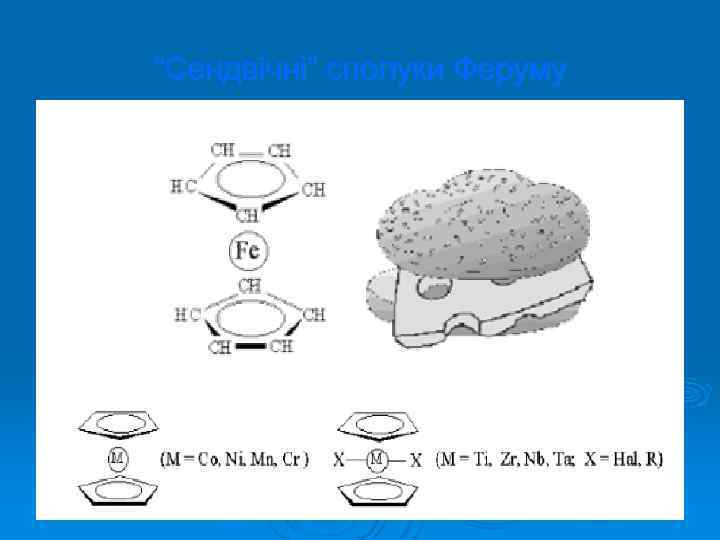
“Сендвічні” сполуки Феруму
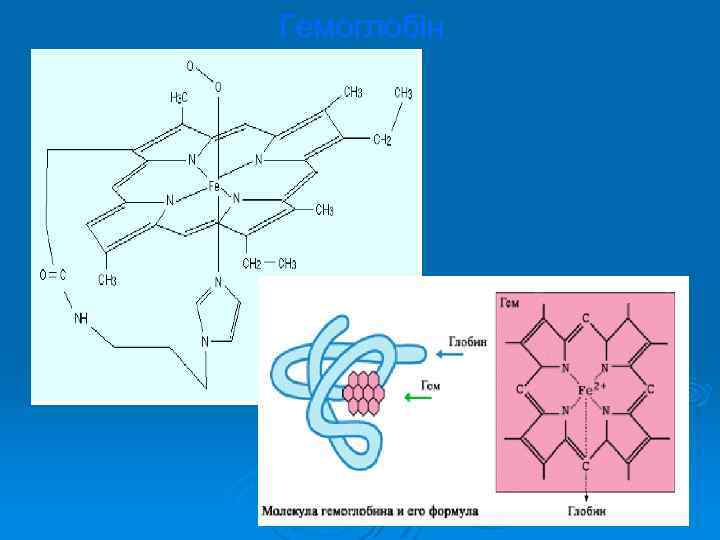
Гемоглобін
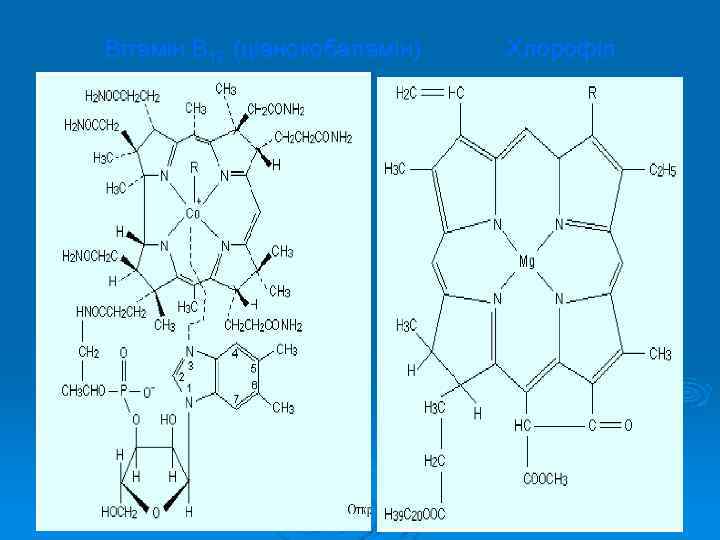
Вітамін В 12 (ціанокобаламін) Хлорофіл

Дякую за увагу!
д-елементи (мс).ppt