сердце.ppt
- Количество слайдов: 81
Биофизика сердца


Функции сердца: 1. Резервуарная 2. Насосная 3. Распределительная 4. Эндокринная

САРКОЛЕММА. n n Поверхностная мембрана кардиомиоцитов состоит из наружного слоя (гликокаликса) и внутреннего слоя (основной мембраны), представленного бислойным липидным матриксом с включениями белков и гликопротеинов. Гликокаликс имеет рыхлый наружный и более плотный внутренний слой, состоит из олигосахаридов и карбогидратных цепочек, образованных из гликопротеинов, включенных в основную мембрану. Благодаря отрицательному заряду олигосахаридов (сиаловая кислота) и полярному расположению головок фосфолипидов, сарколемма содержит преимущественно анионные места, формирующие на поверхности клеток регионы, связывающие катионы, в частности Са 2+.

n n Основная функция сарколеммы - сохранение и генерация трансмембранных градиентов Na, К и Са, которые необходимы для нормального возбуждения и регуляции концентрации внутриклеточнного свободного Са 2+. Перемещение этих ионов через мембрану осуществляется потенциалозависимыми каналами и различными переносчиками: Nа+, К+, Са 2+ Cl- - каналами; Nа-К и Са – насосами; Nа+/Са 2+, Nа+/Н+, Cl-/НСО 3 - и Nа+, К+, 2 Cl- - переносчиками. Другая важная функция сарколеммы - регенерация и трансформация гуморальных и нейротрансмиттерных сигналов в изменении концентрации вторичных мессенджеров, что осуществляется в виде последовательности следующих взаимодействий: Аденилатциклаза>ц. АМФ Гуанилатциклаза

n В отличие от скелетных мышц, продольные канальцы СПР в некоторых местах плотно примыкают к поверхностной сарколемме (расстояние около 100 Ǻ), эти области заполнены электронно-плотным веществом и формируют периферические контакты. Канальцы не являются строго продольными, образуя непрерывно ветвящуюся сеть трубочек диаметром 350 Ǻ, которая тянется вдоль всего саркомера, располагаясь между миофибриллами и митохондриями, сливаясь в области цистерн L-тубул Т-системы.

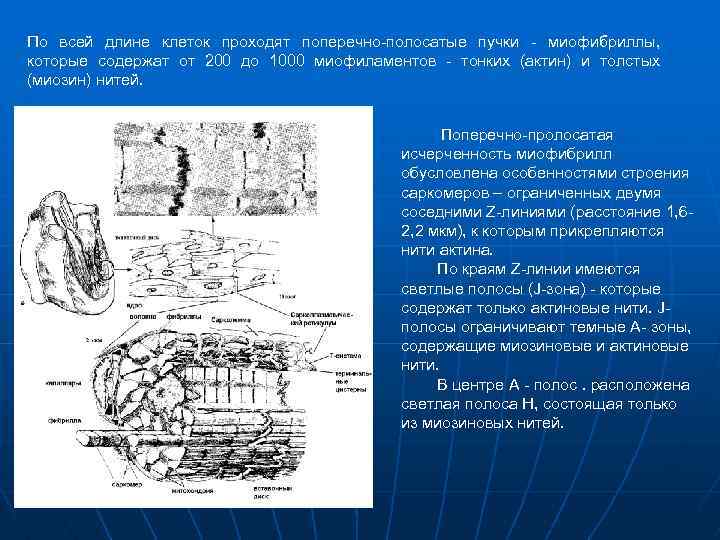
По всей длине клеток проходят поперечно-полосатые пучки - миофибриллы, которые содержат от 200 до 1000 миофиламентов - тонких (актин) и толстых (миозин) нитей. Поперечно-пролосатая исчерченность миофибрилл обусловлена особенностями строения саркомеров – ограниченных двумя соседними Z-линиями (расстояние 1, 62, 2 мкм), к которым прикрепляются нити актина. По краям Z-линии имеются светлые полосы (J-зона) - которые содержат только актиновые нити. Jполосы ограничивают темные А- зоны, содержащие миозиновые и актиновые нити. В центре А - полос. расположена светлая полоса H, состоящая только из миозиновых нитей.

САРКОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ n Мембраны сарколеммы и саркоплазматического ретикулума (около 3% объема клеток) формируют систему трубочек или тубул, связанных в единую коллекторную сеть: поперечные Т-тубулы, являющиеся инвагинациями сарколеммы в области Zлиний и продольные L-тубулы СПР, идущие вдоль каждой миофибриллы, представлены продольными канальцами, которые, сливаясь, образуют бляшкообразные расширения (терминальные цистерны), тесно контактирующие с мембраной Т-тубул в области Z-линии, формируя Т-систему, в виде диад и триад. Между мембранами Т-системы имеются электронно-плотные образования (внутренние контакты или синапсы), обеспечивающие электротоническую передачу ПД с мембраны Т-тубул на мембрану L-тубул, вызывая синхронную деполяризацию продольного СПР соседних саркомеров.
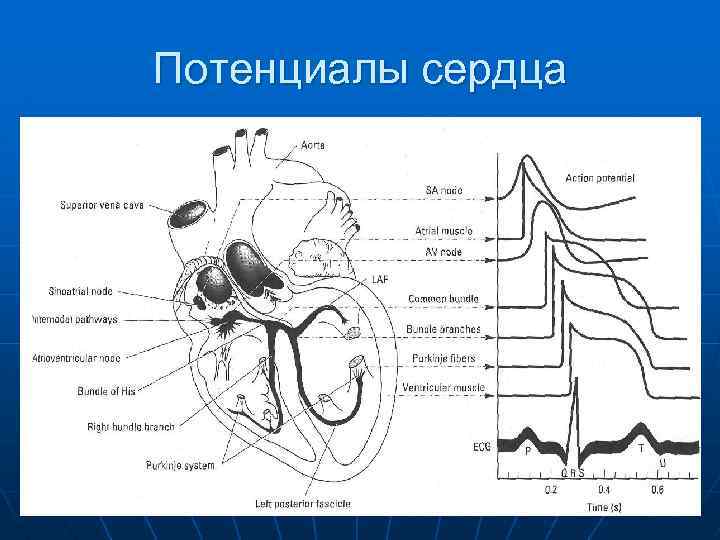
Потенциалы сердца
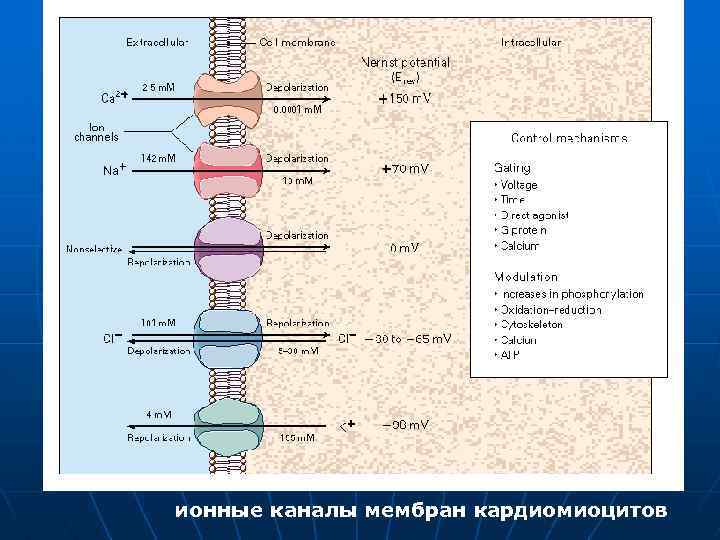
ионные каналы мембран кардиомиоцитов
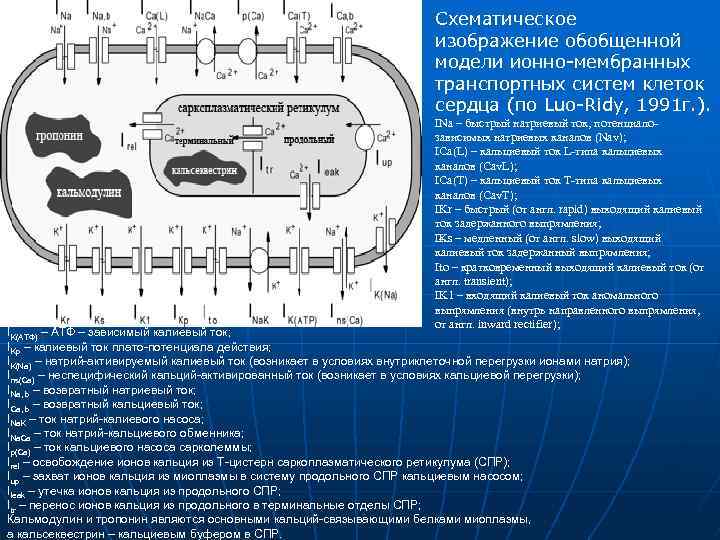
Схематическое изображение обобщенной модели ионно-мембранных транспортных систем клеток сердца (по Luo-Ridy, 1991 г. ). INa – быстрый натриевый ток, потенциало зависимых натриевых каналов (Nav); ICa(L) – кальциевый ток L типа кальциевых каналов (Cav. L); ICa(T) – кальциевый ток Т типа кальциевых каналов (Cav. T); IKr – быстрый (от англ. rapid) выходящий калиевый ток задержанного выпрямления; I s – медленный (от англ. slow) выходящий K калиевый ток задержанный выпрямления; Ito – кратковременный выходящий калиевый ток (от англ. transient); IK 1 – входящий калиевый ток аномального выпрямления (внутрь направленного выпрямления, от англ. inward rectifier); IK(АТФ) – АТФ – зависимый калиевый ток; IKp – калиевый ток плато-потенциала действия; IK(Na) – натрий-активируемый калиевый ток (возникает в условиях внутриклеточной перегрузки ионами натрия); Ins(Ca) – неспецифический кальций-активированный ток (возникает в условиях кальциевой перегрузки); INa, b – возвратный натриевый ток; ICa, b – возвратный кальциевый ток; INa. K – ток натрий-калиевого насоса; INa. Ca – ток натрий-кальциевого обменника; Ip(Ca) – ток кальциевого насоса сарколеммы; Irel – освобождение ионов кальция из Т-цистерн саркоплазматического ретикулума (СПР); Iup – захват ионов кальция из миоплазмы в систему продольного СПР кальциевым насосом; Ileak – утечка ионов кальция из продольного СПР; Itr – перенос ионов кальция из продольного в терминальные отделы СПР; Кальмодулин и тропонин являются основными кальций-связывающими белками миоплазмы, а кальсеквестрин – кальциевым буфером в СПР.
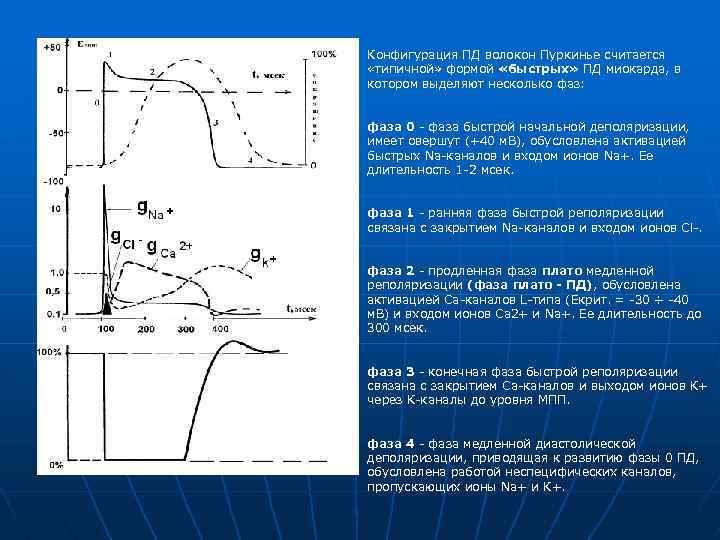
Конфигурация ПД волокон Пуркинье считается «типичной» формой «быстрых» ПД миокарда, в котором выделяют несколько фаз: фаза 0 - фаза быстрой начальной деполяризации, имеет овершут (+40 м. В), обусловлена активацией быстрых Nа-каналов и входом ионов Nа+. Ее длительность 1 -2 мсек. фаза 1 - ранняя фаза быстрой реполяризации связана с закрытием Nа-каналов и входом ионов Сl-. фаза 2 - продленная фаза плато медленной реполяризации (фаза плато - ПД), обусловлена активацией Са-каналов L-типа (Екрит. = -30 ÷ -40 м. В) и входом ионов Са 2+ и Nа+. Ее длительность до 300 мсек. фаза 3 - конечная фаза быстрой реполяризации связана с закрытием Са-каналов и выходом ионов К+ через К-каналы до уровня МПП. фаза 4 - фаза медленной диастолической деполяризации, приводящая к развитию фазы 0 ПД, обусловлена работой неспецифических каналов, пропускающих ионы Nа+ и К+.

n Nа+ - потенциалозависимые каналы, аналогичны таковым в мембране нервного и скелетного мышечного волокна, характеризуются, как время - так и потенциалозависимостью. Активируются на уровне ≈ -60 м. В, полностью инактивируются уже при деполяризации мембраны до ≈ -40 м. В. Их работа подчиняется закону цикла Ходжкина - Хаксли и обеспечивает кратковременный, но мощный быстрый входящий Nа- ток (JNa+). Блокируются ТТХ, однако, чувствительность их намного ниже, чем в нервных и скелетных мышечных волокнах.
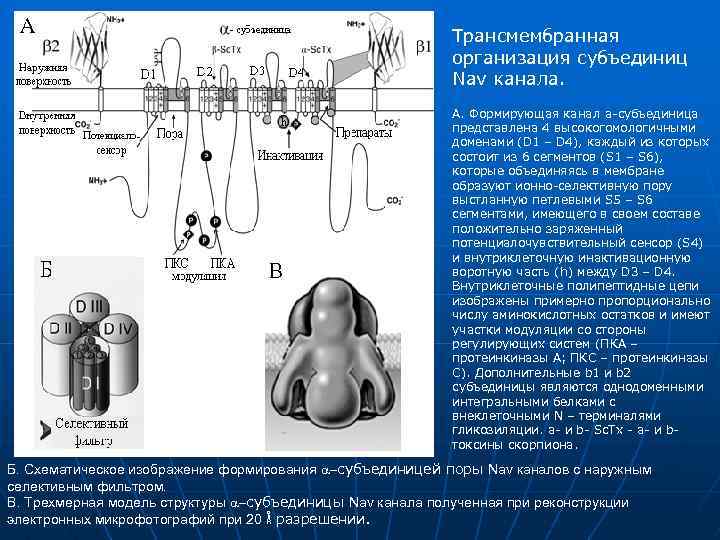
Трансмембранная организация субъединиц Nav канала. А. Формирующая канал a-субъединица представлена 4 высокогомологичными доменами (D 1 – D 4), каждый из которых состоит из 6 сегментов (S 1 – S 6), которые объединяясь в мембране образуют ионно-селективную пору выстланную петлевыми S 5 – S 6 сегментами, имеющего в своем составе положительно заряженный потенциалочувствительный сенсор (S 4) и внутриклеточную инактивационную воротную часть (h) между D 3 – D 4. Внутриклеточные полипептидные цепи изображены примерно пропорционально числу аминокислотных остатков и имеют участки модуляции со стороны регулирующих систем (ПКА – протеинкиназы А; ПКС – протеинкиназы С). Дополнительные b 1 и b 2 субъединицы являются однодоменными интегральными белками с внеклеточными N – терминалями гликозиляции. a- и b- Sc. Tx - a- и b- токсины скорпиона. Б. Схематическое изображение формирования a субъединицей поры Nav каналов с наружным селективным фильтром. В. Трехмерная модель структуры a субъединицы Nav канала полученная при реконструкции электронных микрофотографий при 20 Å разрешении.
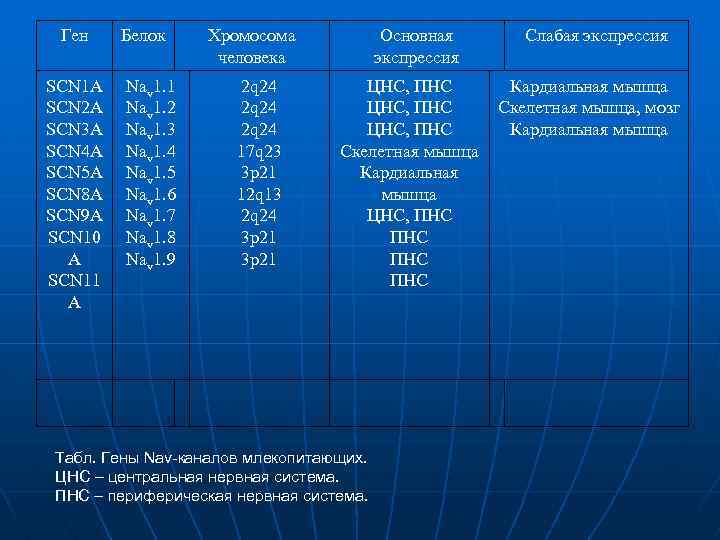
Ген SCN 1 A SCN 2 A SCN 3 A SCN 4 A SCN 5 A SCN 8 A SCN 9 A SCN 10 A SCN 11 A Белок Nav 1. 1 Nav 1. 2 Nav 1. 3 Nav 1. 4 Nav 1. 5 Nav 1. 6 Nav 1. 7 Nav 1. 8 Nav 1. 9 Хромосома человека 2 q 24 17 q 23 3 p 21 12 q 13 2 q 24 3 p 21 Основная экспрессия ЦНС, ПНС Скелетная мышца Кардиальная мышца ЦНС, ПНС ПНС Табл. Гены Nav-каналов млекопитающих. ЦНС – центральная нервная система. ПНС – периферическая нервная система. Слабая экспрессия Кардиальная мышца Скелетная мышца, мозг Кардиальная мышца
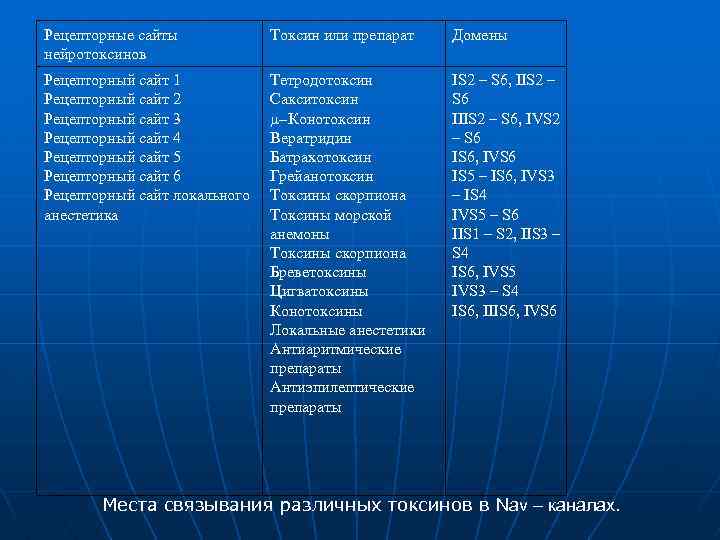
Рецепторные сайты нейротоксинов Токсин или препарат Домены Рецепторный сайт 1 Рецепторный сайт 2 Рецепторный сайт 3 Рецепторный сайт 4 Рецепторный сайт 5 Рецепторный сайт 6 Рецепторный сайт локального анестетика Тетродотоксин Сакситоксин m Конотоксин Вератридин Батрахотоксин Грейанотоксин Токсины скорпиона Токсины морской анемоны Токсины скорпиона Бреветоксины Цигватоксины Конотоксины Локальные анестетики Антиаритмические препараты Антиэпилептические препараты IS 2 – S 6, IIS 2 – S 6 IIIS 2 – S 6, IVS 2 – S 6 IS 6, IVS 6 IS 5 – IS 6, IVS 3 – IS 4 IVS 5 – S 6 IIS 1 – S 2, IIS 3 – S 4 IS 6, IVS 5 IVS 3 – S 4 IS 6, IIIS 6, IVS 6 Места связывания различных токсинов в Nav – каналах.
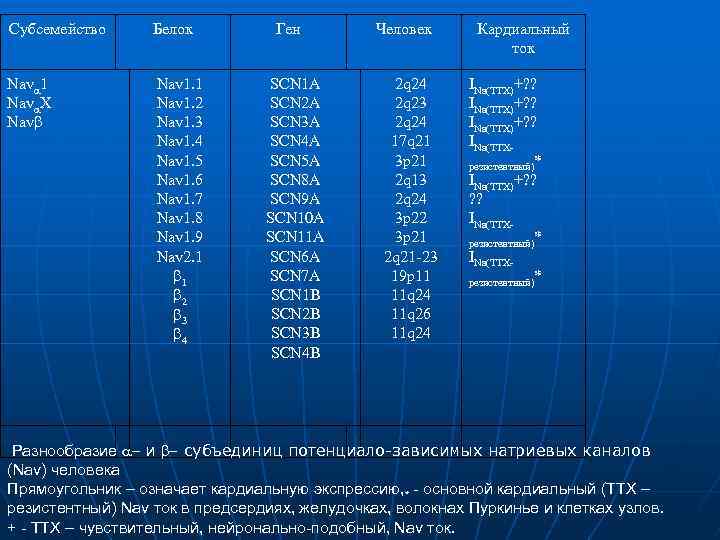
Субсемейство Белок Nava 1 Nava. X Navb Nav 1. 1 Nav 1. 2 Nav 1. 3 Nav 1. 4 Nav 1. 5 Nav 1. 6 Nav 1. 7 Nav 1. 8 Nav 1. 9 Nav 2. 1 b 2 b 3 b 4 Ген SCN 1 A SCN 2 A SCN 3 A SCN 4 A SCN 5 A SCN 8 A SCN 9 A SCN 10 A SCN 11 A SCN 6 A SCN 7 A SCN 1 B SCN 2 B SCN 3 B SCN 4 B Человек 2 q 24 2 q 23 2 q 24 17 q 21 3 p 21 2 q 13 2 q 24 3 p 22 3 p 21 2 q 21 23 19 p 11 11 q 24 11 q 26 11 q 24 Кардиальный ток INa(TTX)+? ? INa(TTX резистентный)* INa(TTX)+? ? INa(TTX резистентный)* Разнообразие a и b субъединиц потенциало-зависимых натриевых каналов (Nav) человека Прямоугольник – означает кардиальную экспрессию, * - основной кардиальный (ТТХ – резистентный) Nav ток в предсердиях, желудочках, волокнах Пуркинье и клетках узлов. + - ТТХ – чувствительный, нейронально-подобный, Nav ток.
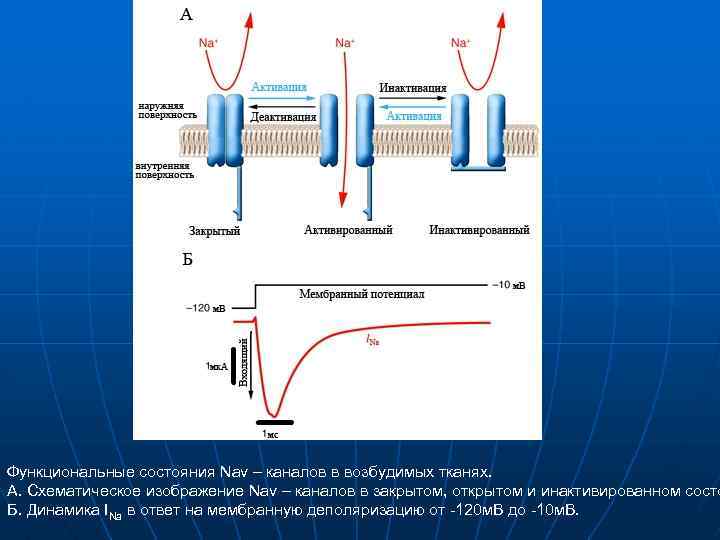
Функциональные состояния Nav – каналов в возбудимых тканях. А. Схематическое изображение Nav – каналов в закрытом, открытом и инактивированном состо Б. Динамика INa в ответ на мембранную деполяризацию от -120 м. В до -10 м. В.
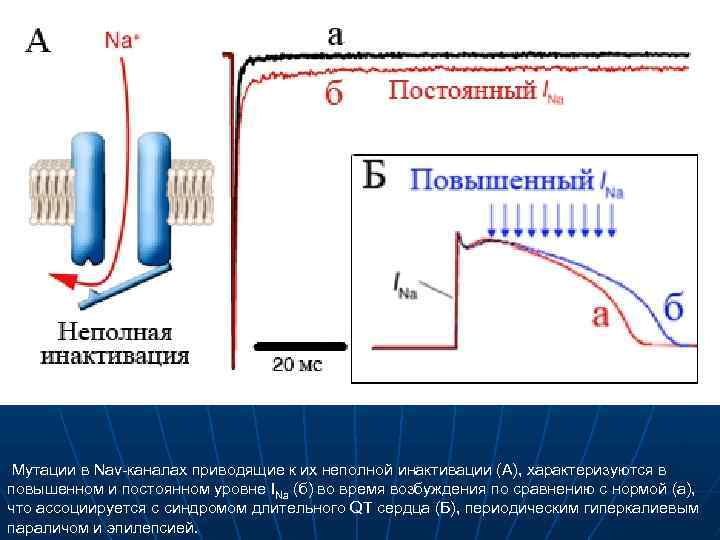
Мутации в Nav-каналах приводящие к их неполной инактивации (А), характеризуются в повышенном и постоянном уровне INa (б) во время возбуждения по сравнению с нормой (а), что ассоциируется с синдромом длительного QT сердца (Б), периодическим гиперкалиевым параличом и эпилепсией.

Са+ - каналы n Са 2+- каналы L-типа, аналогичны описанным выше, их работа обеспечивает формирование плато потенциала действия (фаза 2) и развитие медленного входящего тока ионов Са 2+ (JСa 2+L ). Они обладают не только потенциало-, но и токозависимой инактивацией. Это означает, что Са 2+- каналы медленного входящего тока инактивируются не только деполяризацией (как и Nа+- каналы), но и ионами Са 2+, вошедшими в клетку во время развития этого тока, т. е. наблюдается кальцийзависимая инактивация. Чем больше будет JCa. L, тем сильнее будет выражена кальцийзависимая инактивация Са 2+- каналов. Важной особенностью является их высокая чувствительность к ряду медиаторов и физиологически активных веществ, изменяющих внутриклеточный уровень ц. АМФ и ц. ГМФ.

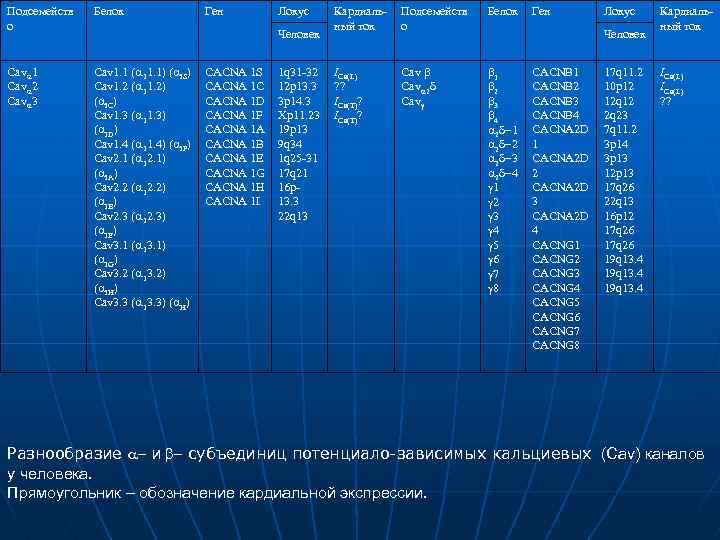
Подсемейств о Белок Cava 1 Cava 2 Cava 3 Cav 1. 1 (a 11. 1) (a S) Cav 1. 2 (a 11. 2) (a C) Cav 1. 3 (a 11. 3) (a D) Cav 1. 4 (a 11. 4) (a F) Cav 2. 1 (a 12. 1) (a A) Cav 2. 2 (a 12. 2) (a B) Cav 2. 3 (a 12. 3) (a E) Cav 3. 1 (a 13. 1) (a G) Cav 3. 2 (a 13. 2) (a H) Cav 3. 3 (a 13. 3) (a. H) Ген Локус Человек CACNA 1 S CACNA 1 C CACNA 1 D CACNA 1 F CACNA 1 A CACNA 1 B CACNA 1 E CACNA 1 G CACNA 1 H CACNA 1 I 1 q 31 32 12 p 13. 3 3 p 14. 3 Xp 11. 23 19 p 13 9 q 34 1 q 25 31 17 q 21 16 p 13. 3 22 q 13 Кардиаль ный ток Подсемейств о Белок ICa(L) ? ? ICa(T)? Cav b Cava 2 d Cavg b 1 b 2 b 3 b 4 a 2 d 1 a 2 d 2 a 2 d 3 a 2 d 4 g 1 g 2 g 3 g 4 g 5 g 6 g 7 g 8 Ген Локус Человек CACNB 1 CACNB 2 CACNB 3 CACNB 4 CACNA 2 D 1 CACNA 2 D 2 CACNA 2 D 3 CACNA 2 D 4 CACNG 1 CACNG 2 CACNG 3 CACNG 4 CACNG 5 CACNG 6 CACNG 7 CACNG 8 17 q 11. 2 10 p 12 12 q 12 2 q 23 7 q 11. 2 3 p 14 3 p 13 12 p 13 17 q 26 22 q 13 16 p 12 17 q 26 19 q 13. 4 Кардиаль ный ток ICa(L) ? ? Разнообразие a и b субъединиц потенциало-зависимых кальциевых (Cav) каналов у человека. Прямоугольник – обозначение кардиальной экспрессии.







Потенциалозависимые К+ - каналы 1. К+- каналы утечки, участвующие в формировании МПП клеток. 2. К+ - каналы аномального выпрямления, инактивируются при деполяризации от больших исходных величин МПП, обеспечивая снижение К+- проводимости мембраны в начальный момент фазы 0 ПД ( ранний инактивируемый выходящий К+- ток ). Работа этих каналов облегчает развитие фазы деполяризации, крутизну ее нарастания и формирование фаз 1 и 2 ПД. 3. К+ - каналы задержанного выпрямления, аналогичны таковым в мембране нервного и скелетного мышечного волокна, и обеспечивают формирование задержанного выходящего калиевого тока, который появляется при деполяризации мембраны до - 50 ÷ - 40 м. В, и, в дальнейшем, по мере роста деполяризации - увеличивается. По мере того, как во время конечной фазы быстрой реполяризации (фаза 3) мембранный потенциал становится все более отрицательным, т. е. приближается к уровню МПП, каналы выходящего К+ - тока - деактивируются, а задержанный выходящий ток уменьшается.

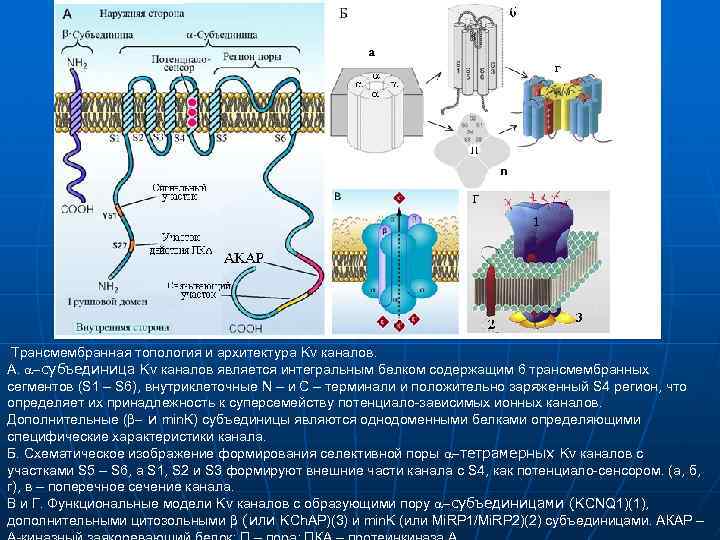
Трансмембранная топология и архитектура Kv каналов. А. a субъединица Kv каналов является интегральным белком содержащим 6 трансмембранных сегментов (S 1 – S 6), внутриклеточные N – и C – терминали и положительно заряженный S 4 регион, что определяет их принадлежность к суперсемейству потенциало-зависимых ионных каналов. Дополнительные (b и min. K) субъединицы являются однодоменными белками определяющими специфические характеристики канала. Б. Схематическое изображение формирования селективной поры a тетрамерных Kv каналов с участками S 5 – S 6, a S 1, S 2 и S 3 формируют внешние части канала с S 4, как потенциало-сенсором. (а, б, г), в – поперечное сечение канала. В и Г. Функциональные модели Kv каналов с образующими пору a субъединицами (KCNQ 1)(1), дополнительными цитозольными b (или KCh. AP)(3) и min. K (или Mi. RP 1/Mi. RP 2)(2) субъединицами. АКАР –
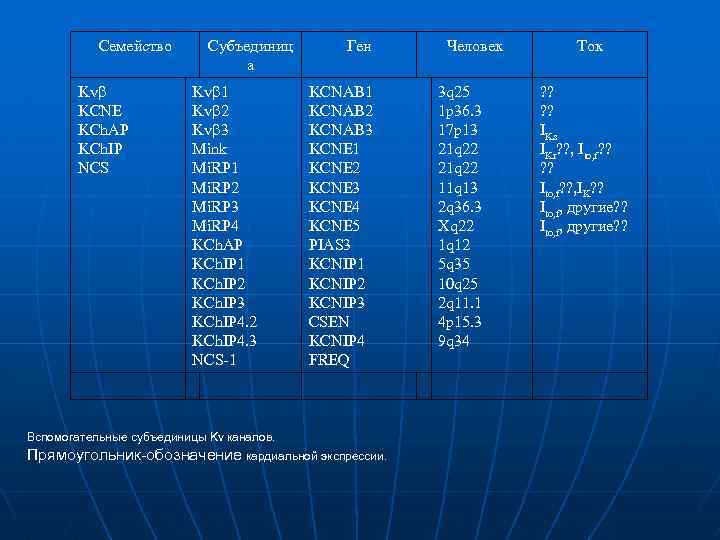
Семейство Kvb KCNE KCh. AP KCh. IP NCS Субъединиц а Kvb 1 Kvb 2 Kvb 3 Mink Mi. RP 1 Mi. RP 2 Mi. RP 3 Mi. RP 4 KCh. AP KCh. IP 1 KCh. IP 2 KCh. IP 3 KCh. IP 4. 2 KCh. IP 4. 3 NCS 1 Ген KCNAB 1 KCNAB 2 KCNAB 3 KCNE 1 KCNE 2 KCNE 3 KCNE 4 KCNE 5 PIAS 3 KCNIP 1 KCNIP 2 KCNIP 3 CSEN KCNIP 4 FREQ Вспомогательные субъединицы Kv каналов. Прямоугольник-обозначение кардиальной экспрессии. Человек 3 q 25 1 p 36. 3 17 p 13 21 q 22 11 q 13 2 q 36. 3 Xq 22 1 q 12 5 q 35 10 q 25 2 q 11. 1 4 p 15. 3 9 q 34 Ток ? ? IKs IKr? ? , Ito, f? ? , IK? ? Ito, f, другие? ?


Рецепторзависимые К+ - каналы: n n 1. Са 2+ - активируемые К+ - каналы - аналогичны описанным выше, обеспечивают развитие кальцийиндуцируемого выходящего калиевого тока (JKCa), который участвует в формировании 2 и 3 фаз ПД проводящих волокон. По мере снижения свободного цитозольного Са 2+, каналы закрываются. 2. Nа+ - активируемые К+ - каналы. (см. выше). 3. АТФ - чувствительные К+ - каналы - внутриклеточный АТФ ингибирует, а низкое соотношение концентраций АТФ/АДФ открывает каналы. Активность их зависит также от градиента р. Н снаружи и внутри клеток, очень слабо - от мембранного потенциала. 4. АЦХ – активируемые К+ - каналы - обеспечивают формирование Jкацх при активации М 2 - мускариновых рецепторов кардиомиоцитов, которые через сопрягающий G-белок открывают специальные К+ - каналы, противодействующие снижению Jк, вызывая гиперполяризацию мембраны.

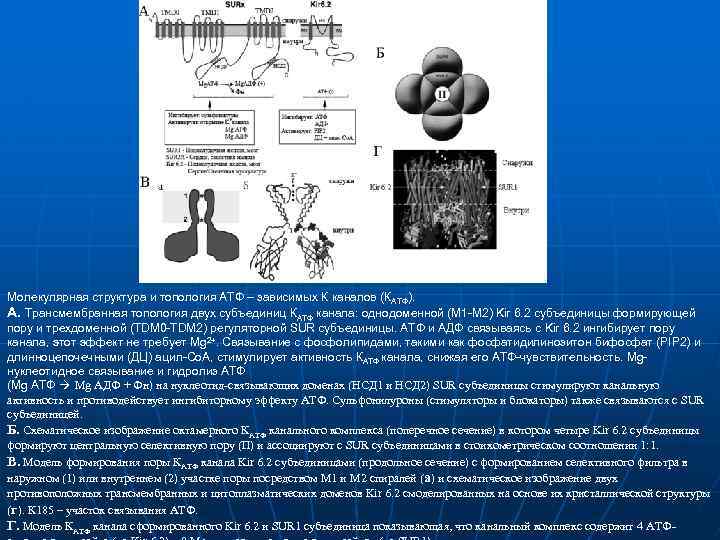
Молекулярная структура и топология АТФ – зависимых К каналов (КАТФ). А. Трансмембранная топология двух субъединиц КАТФ канала: однодоменной (М 1 -М 2) Kir 6. 2 субъединицы формирующей пору и трехдоменной (TDM 0 -TDM 2) регуляторной SUR субъединицы. АТФ и АДФ связываясь с Kir 6. 2 ингибирует пору канала, этот эффект не требует Mg 2+. Связывание с фосфолипидами, такими как фосфатидилинозитон бифосфат (PIP 2) и длинноцепочечными (ДЦ) ацил-Co. A, стимулирует активность КАТФ канала, снижая его АТФ-чувствительность. Mgнуклеотидное связывание и гидролиз АТФ (Mg АТФ Mg АДФ + Фн) на нуклеотид связывающих доменах (НСД 1 и НСД 2) SUR субъединицы стимулируют канальную активность и противодействует ингибиторному эффекту АТФ. Сульфонилуроны (стимуляторы и блокаторы) также связываются с SUR субъединицей. Б. Схематическое изображение октамерного КАТФ канального комплекса (поперечное сечение) в котором четыре Kir 6. 2 субъединицы формируют центральную селективную пору (П) и ассоциируют с SUR субъединицами в стоихометрическом соотношении 1: 1. В. Модель формирования поры КАТФ канала Kir 6. 2 субъединицами (продольное сечение) с формированием селективного фильтра в наружном (1) или внутреннем (2) участке поры посредством М 1 и М 2 спиралей (а) и схематическое изображение двух противоположных трансмембранных и цитоплазматических доменов Kir 6. 2 смоделированных на основе их кристаллической структуры (г). К 185 – участок связывания АТФ. Г. Модель КАТФ канала сформированного Kir 6. 2 и SUR 1 субъединица показывающая, что канальный комплекс содержит 4 АТФ
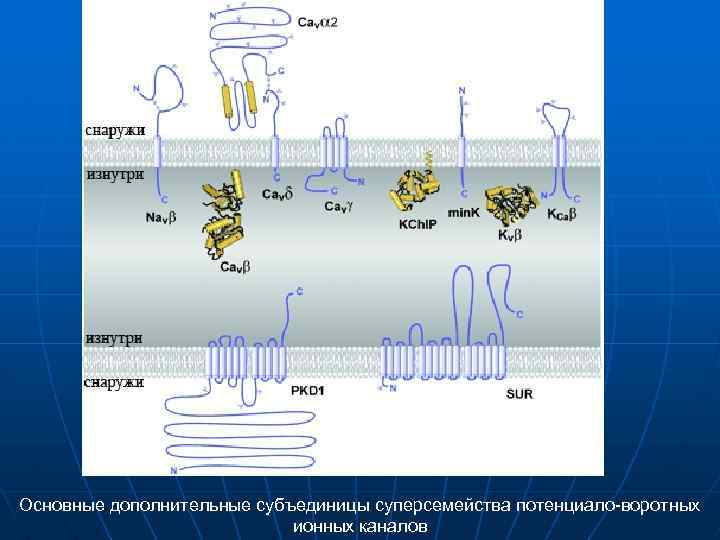
Основные дополнительные субъединицы суперсемейства потенциало-воротных ионных каналов


ЭЛЕКТРОГЕНЕЗ СОКРАТИТЕЛЬНОГО МИОКАРДА ПРЕДСЕРДИЙ И ЖЕЛУДОЧКОВ n n n Величина МПП клеток рабочего миокарда лягушек составляет – 90 ÷ 95 м. В, теплокровных животных – 75 ÷ -85 м. В. Эта величина является стабильной, не обнаруживает спонтанных колебаний и близка к калиевому равновесному потенциалу (Ек. ). Конфигурация ПД миокарда предсердий и желудочков аналогична таковым волокон Пуркинье. Однако, величина овершута составляет всего +30 м. В, фаза 1 может быть менее выраженной, а фаза 4 не обнаруживает МДД. При этом продолжительность ПД предсердий составляет около 100 мсек, а желудочков 300 мсек. Соответственно этому, длительность рефрактерного периода в рабочих клетках предсердий меньше, чем в желудочках. Считается, что природа и механизмы генерации ПД в сократительном миокарде, аналогичны таковым в волокнах Пуркинье. Необходимо отметить, что характерной особенностью «быстрых» потенциалов действия является укорочение их плато при увеличении частоты сердечных сокращений. Это связано с активацией выходящего К-тока, ускоряющего развитие фазы 3 ПД. Этот эффект обусловлен, главным образом, тем, что К-проницаемость мембраны после окончания реполяризации еще повышена и, лишь через некоторое время, постепенно возвращается к исходному уровню. В этом случае, если интервал между ПД мал, это повышение проницаемости для К+ приводит к ускорению реполяризации (фаза 3) в очередных циклах возбуждения.

n n В общем виде генерация ПД в волокнах Пуркинье связана с приходом возбуждения от вышележащих участков проводящей системы. Возникающие локальные токи вызывают деполяризацию мембраны до Екрит ≈ -60 м. В и активацию Nа+ - каналов. Это приводит к появлению большого входящего Nа+ - тока, генерирующего быструю восходящую фазу (фазу 0) ПД с овершутом (+40 м. В). Одновременно с этим инактивируются К+ - каналы аномального выпрямления, что снижает калиевую проводимость мембраны и облегчает процесс деполяризации мембраны. Развивающаяся деполяризация ПД в фазе 0 смещает МП к уровню -40 м. В, при которой Nа+- каналы инактивируются. Это ведет к значительному уменьшению входящего Nа+- тока, что соответствует началу фазы 1 ПД. На фоне овершута в клетку входят ионы Cl-- по открытым Cl- каналам и довершают фазу быстрой начальной реполяризации. Одновременно с этим, когда МП смещается до уровня -30 ÷ -40 м. В и ниже, открываются кальциевые каналы L-типа, определяя медленный входящий JCa. L и активируются К+ - каналы задержанного выпрямления, обуславливающие медленно- нарастающий задержанный калиевый ток JКз. в. Динамика этих токов определяет формирование фазы плато ПД (фаза 2). Задержка спада Na- проницаемости мембраны в фазу плато ПД обусловлена тем, что Са- каналы L - типа пропускают и ионы Na+. По мере течения фазы плато ПД кальциевый входящий ток ослабевает вследствии развивающейся инактивации Са 2+- каналов L-типа (потенциало - и токозависимая инактивация), а выходящий потенциалозависимый задержанный калиевый ток усиливается. Кроме этого, в это время активируются Са 2+- зависимые и Nа+- зависимые К+ - каналы мембраны миоцитов, довершая фазу 2 и ускоряя развитие фазы 3 ПД.

n n n Комбинация инактивации кальциевого входящего тока и активации выходящего калиевого тока, а также развития их во времени дает результирующий выходящий ток, ведущий к развитию конечной фазы быстрой реполяризации ПД (фаза 3). Относительный вклад инактивации кальциевого медленного входящего тока и активации калиевого выходящего тока в продолжительность фазы плато ПД неодинаков и зависит от типа волокон. Так, в волокнах Пуркинье продолжительность плато ПД зависит, главным образом, от активации выходящего К- тока, тогда как в миоцитах желудочка главную роль играет инактивация медленного входящего Са- тока. По мере реполяризации ПД (фаза 3) мембранный потенциал становится все более отрицательным и происходит деактивация калиевых каналов. Одновременно с этим Са- каналы L-типа (на уровне -40 м. В) и Nа-каналы (на уровне от ≈ -40 до -75 м. В) реактивируются, т. е. переходят из инактивированного состояния, в закрытое состояние. Это и определяет продолжительность фаз абсолютной и относительной рефрактерности, а также форму и продолжительность ПД вызванных внеочередным раздражением

n n n Кроме Са- каналов L-типа, определяющих величину медленного входящего тока, некоторый вклад в его развитие вносит электрогенный компонент Nа+/Са 2+ - обменного механизма мембраны кардиомиоцитов, осуществляющий транспорт ионов в соотношении 3: 1. Эта система работает обратимо и на фоне деполяризации мембраны (фаза 2), наряду с уменьшением трансмембранного градиента ионов Nа+, перенос ионов меняет свое направление ( реверсирует ). Это приводит к тому, что происходит вход ионов Са 2+ снаружи в обмен на внутриклеточный Nа+. В миокарде, белок, обеспечивающий Nа+/Са 2+-обмен, фосфорилируется Са 2+- кальмодулин зависимой протеинкиназой, в результате чего скорость обмена возрастает в несколько раз. Селективные ингибиторы Nа+/Са 2+- обмена не описаны. Чаще всего используются амилорид и доксорубицин. После достижения величины максимальной диастолической поляризации фазы 3 в миоцитах проводящей системы желудочков, развивается МДД фазы 4, до прихода новой волны возбуждения. Определенный вклад в величину максимальной диастолической поляризации и временное развитие реполяризации (фаза 3) может вносить выходящий ток, генерируемый электрогенным натриевым насосом.


ЭЛЕКТРОМЕХАНИЧЕСКОЕ СОПРЯЖЕНИЕ В КАРДИОМИОЦИТАХ. n n n n В отличии от проводящей системы, клетки сократительного миокарда предсердий и желудочков, имеют удлиненную форму (40 -100 мкм в длину и 10 -20 мкм в диаметре) и зигзагообразные концы, увеличивающие контактную поверхность с последовательно расположенными смежными клетками. Между концами клеток имеются вставочные диски, некоторые участки которых (nexus) обладают низким сопротивлением, что позволяет проводить возбуждение от клеток к клеткам электротоническим образом. Кардиомиоциты имеют сложную клеточную структуру, которая по функциональному назначению может быть разделена на следующие элементы: Сарколемму и саркоплазматический ретикулум (СПР), отвечающих за электрогенез и сопряжение процессов возбуждения-сокращениярасслабления. Сократительные и регуляторные белки (миозин, актин, тропомиозин и тропонин, в соотношении 7: 3: 1: 0, 5), осуществляющие механизм сокращения клеток. Митохондрии и лизосомы, обеспечивающие энергетику электрогенеза и электромеханического сопряжения. Ядра и рибосомы, ответственные за обменное восстановление клеточных структур. По всей длине клеток проходят поперечно-полосатые пучки - миофибриллы, которые содержат от 200 до 1000 миофиламентов - тонких (актин) и толстых (миозин) нитей







n n Основная функция продольных канальцев СПР состоит в способности быстро перемещать большие количества Са 2+ из миоплазмы в свой просвет против концентрационного градиента, посредством Са-насоса, который обладает большим сродством к Са 2+ и кальцийстимулируемой АТФазе. На внутренней поверхности просвета канальцев имеются протеины - калсеквестрины, обладающие относительно низким аффинитетом , но большой связывающей способностью к Са 2+ , что позволяет этому белку аккумулировать Са 2+ , а в последующем перемещать его вдоль просвета канальцев в цистерны СПР.


n n Кальсеквестрин - Са-связывающий белок (м. В 54 к. Да) имеет большое количество Сасвязывающих центров (более 40 на молекулу) и низкое сродство к ионам Са 2+ ( Кдисс. лежит в области 10 -3 М). Локализуется, преимущественно, в терминальных цистернах СПР, что позволяет им накапливать большие количества Са 2+ без образования нерастворимого осадка. Терминальные цистерны Т-тубул СПР способны накапливать большие концентрации ионов Са 2+ (до 10 -2 М) и высвобождать их в миоплазму при активации Са-каналов мембраны этих образований.
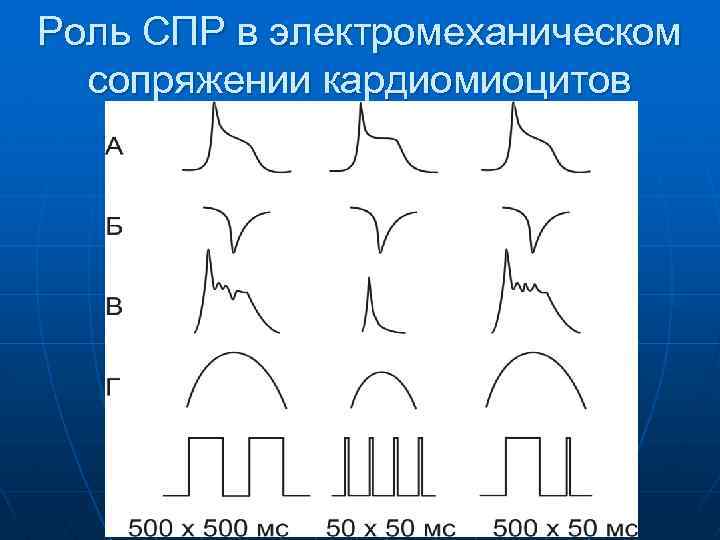
Роль СПР в электромеханическом сопряжении кардиомиоцитов

СОКРАТИТЕЛЬНЫЕ БЕЛКИ n n В миоцитах различают 2 группы белков растворимые и нерастворимые. Растворимые входят в состав саркоплазмы и представлены миоглобином и ферментами, осуществляющими внутриклеточные биохимические реакции. К нерастворимым относятся сократительные белки - миозин, актин, тропонин и тропомиозин. Миозин (МВ = 500 к. Да) - гексамерный, ассиметричный протеин, длиной 140 н. М и толщиной 2 н. М. Состоит из 2 тяжелых и 4 легких цепочек. Тяжелые цепочки, скручиваясь между собой, образуют удлиненное тело миозиновой молекулы, заканчивающееся элипсовидной головкой. Под действием трипсина расщепляется на легкий меромиозин (ЛММ - тело миозина МВ = 150 к. Да) и тяжелый меромиозин (ТММ - головка миозина МВ = 350 к. Да). Под действием папаина ТММ расщепляется на фрагменты С 1(МВ = 120 к. Да) - собственно головки миозина, и фрагмент С 2 (МВ = 61 к. Да) - это хвост головки миозина. ЛММ и С 2 - двухспиральные структуры, которые в месте стыковки расплетают суперспираль, обладающую АТФазной активностью. С 1 - фрагмент имеет головку, в состав которой входят низкомолекулярные компоненты, имеющие 2 разновидности LC 1, или А - легкая миозиновая цепочка, и LС 2, или Р - фосфорилируемая легкая цепочка. Отдельные миозиновые молекулы, соединяясь задними концами образуют разнонаправленные пары, которые, примыкая боковами поверхностями друг к другу, формируют толстые нити (толщиной 15 -17 нм) - полимер миозиновых молекул



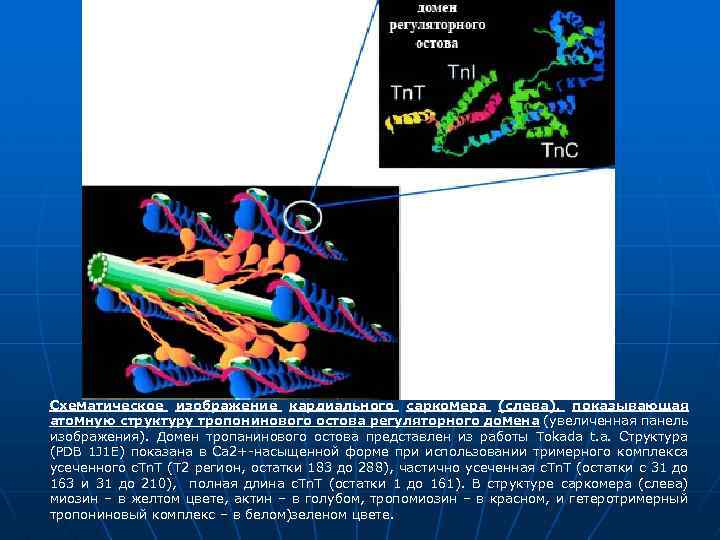
Схематическое изображение кардиального саркомера (слева), показывающая атомную структуру тропонинового остова регуляторного домена (увеличенная панель изображения). Домен тропанинового остова представлен из работы Tokada t. a. Структура (PDB 1 J 1 E) показана в Са 2+-насыщенной форме при использовании тримерного комплекса усеченного с. Tn. T (Т 2 регион, остатки 183 до 288), частично усеченная с. Tn. T (остатки с 31 до 163 и 31 до 210), полная длина с. Tn. T (остатки 1 до 161). В структуре саркомера (слева) миозин – в желтом цвете, актин – в голубом, тропомиозин – в красном, и гетеротримерный тропониновый комплекс – в белом)зеленом цвете.


n n Тонкие, актиновые нити (толщина около 6 нм) представлены в виде двух скрученных цепочек полимеризированного глобулярного актина (G-актин, МВ = 42 - 45 к. Да). Каждая цепочка фибриллярного (F-актин) состоит из 200 молекул - шариков G-актина, соединенных АДФ, и напоминает вытянутое ожерелье. Полный перекрут этих цепочек осуществляется через 36 - 40 нм, то есть через 7 молекул G-актина. Молекулы двух нитей F-актина, как и молекулы миозина, представляют собой двойную спираль с той лишь разницей, что она состоит не из полипептидных цепей, как в миозине, а из двух линейных полимеров G-актина.


n n n В бороздках актиновой спирали, по обеим сторонам, располагается в виде ленты белок тропомиозин (Тм), перекрывающий 7 актиновых молекул. На концах тропомиозиновых молекул располагается белковый комплекс - тропонин (Тн), состоящий из трех протеинов: тропонина Т (Тн. Т МВ = 38 к. Да) - белка, присоединяющего Тн - комплекс к Тм и актину; тропонина J (Тн. J МВ = 18 к. Да) - белка, ингибирующего Мg-стимулируемую АТФазу актомиозина; тропонина С (Тн. С МВ = 22 к. Да) - белка, чувствительного к Са 2+, аналогичного кальмодулину. К нити F-актина они присоединены посредством Тм и располагаются от него в такой последовательности : Тн. Т, Тн. С и Тн. J. В расслабленной мышце, при низком уровне Са 2+ в саркоплазме (менее 10 -7 М) Тн. J, кроме связи с Тн. С, соединен с активным центром актина и тропомиозином. Таким образом, он блокирует возможность контакта головок молекул миозина с F-актином. При освобождении ионов Са 2+ из СПР при возбуждении, они активно связываются с Тн. С, что влечет за собой изменение конформации всего комплекса и перемещению его вместе с концевой частью Тм на 20 , по сравнению с прежним ее положением. Эти перемещения Тм обнажают активные места тонких нитей, способные взаимодействовать с головками миозина, с образованием поперечных актомиозиновых мостиков, что ведет к скольжению актиновых нитей вдоль миозиновых.
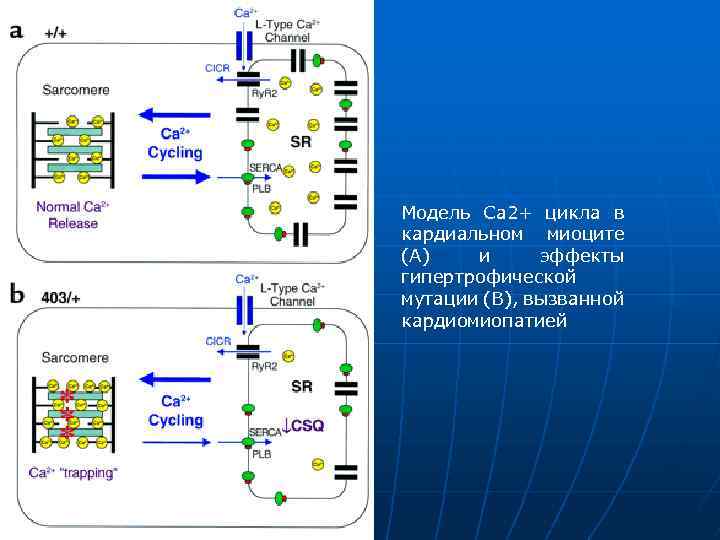
Модель Са 2+ цикла в кардиальном миоците (А) и эффекты гипертрофической мутации (В), вызванной кардиомиопатией
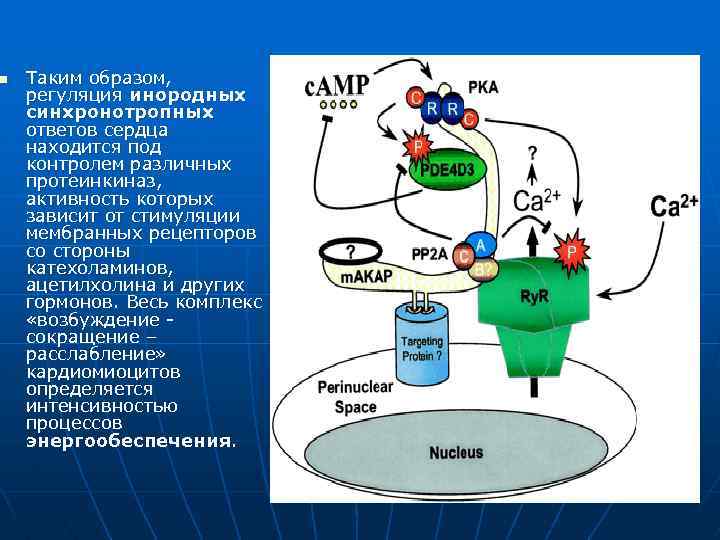
n Таким образом, регуляция инородных синхронотропных ответов сердца находится под контролем различных протеинкиназ, активность которых зависит от стимуляции мембранных рецепторов со стороны катехоламинов, ацетилхолина и других гормонов. Весь комплекс «возбуждение - сокращение – расслабление» кардиомиоцитов определяется интенсивностью процессов энергообеспечения.

Ат =Аф + PIEA – NIEA. Если Ат Аф лестница Боудича; Ат Аф – Вудвордса.

Предположительные (гипотетические) факторы, влияющие на хроноинотропию n n n n 1. Параметры ПД (увеличивается амплитуда и длительность ПД) - не соответствует экспериментальным данным, так как все наоборот. 2. Влияние нейрогуморальных факторов, но изопротероинол, резерпин (истощение кальциевого депо катехоламинами), атропин – все не действуют на хроноинотропию. 3. Турпаев предположил участие метаболитов в хроноионотропном эффекте. 4. Участие ионов калия, которые ингибируют образование актомиозинового комплекса. При частой стимуляции теряется Кint, за счёт активации а+/К+-АТФ-азы и увеличивается амплитуда сокращения. Но после эстрасистолы – эффект облегчения, хотя К int – та же. 5. Чем больше ионов кальция, тем больше амплитуда сокращения. Кальций может поступать либо извне, либо из депо. Предпочтительней второй путь. Чем меньше потеря кальция в среду, тем больше его выйдет из СПР при втором стимуле и усилит второе сокращение. 6. Изаков отмечает роль Nа+/К+-АТФазы. При ПД входит много Nа+, который скапливается в примембранных слоях и активирует Nа/КАТФазу. Это тормозит Iвых. К и наступает поздняя реполяризация, которая увеличивает поступление кальция в клетку и сокращение. 7. Nа+/Са 2+-обмен. При увеличении Nаi за счёт ПД создаётся локальный grad Nai Nae и усливает работу Nа+/Са 2+ -обмена в обратном режиме, что увеличивает поступление кальция в клетку и сокращение.
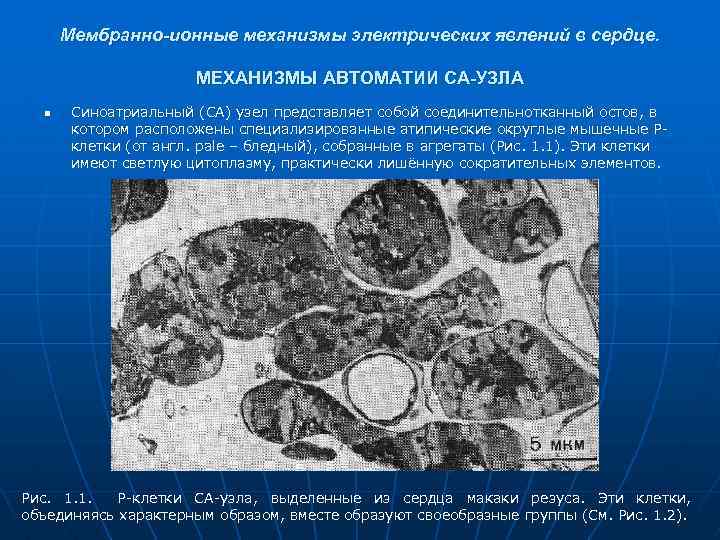
Мембранно-ионные механизмы электрических явлений в сердце. МЕХАНИЗМЫ АВТОМАТИИ СА-УЗЛА n Синоатриальный (СА) узел представляет собой соединительнотканный остов, в котором расположены специализированные атипические округлые мышечные Рклетки (от англ. рale – бледный), собранные в агрегаты (Рис. 1. 1). Эти клетки имеют светлую цитоплазму, практически лишённую сократительных элементов. Рис. 1. 1. Р-клетки СА-узла, выделенные из сердца макаки резуса. Эти клетки, объединяясь характерным образом, вместе образуют своеобразные группы (См. Рис. 1. 2).
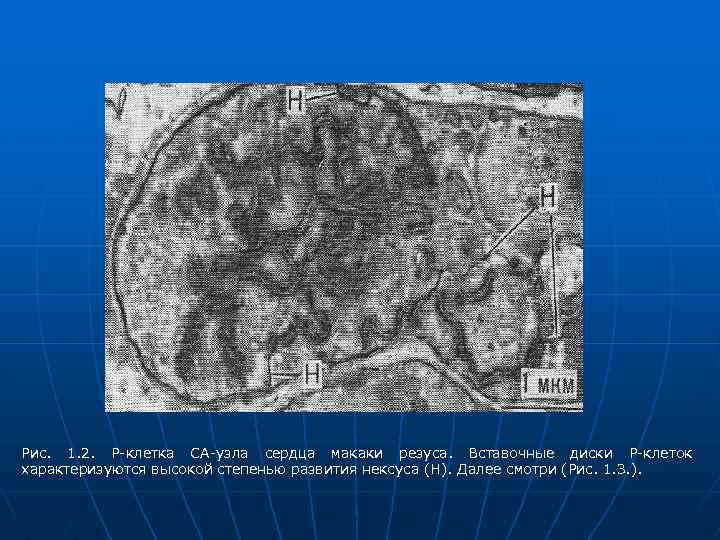
Рис. 1. 2. Р-клетка СА-узла сердца макаки резуса. Вставочные диски Р-клеток характеризуются высокой степенью развития нексуса (Н). Далее смотри (Рис. 1. 3. ).
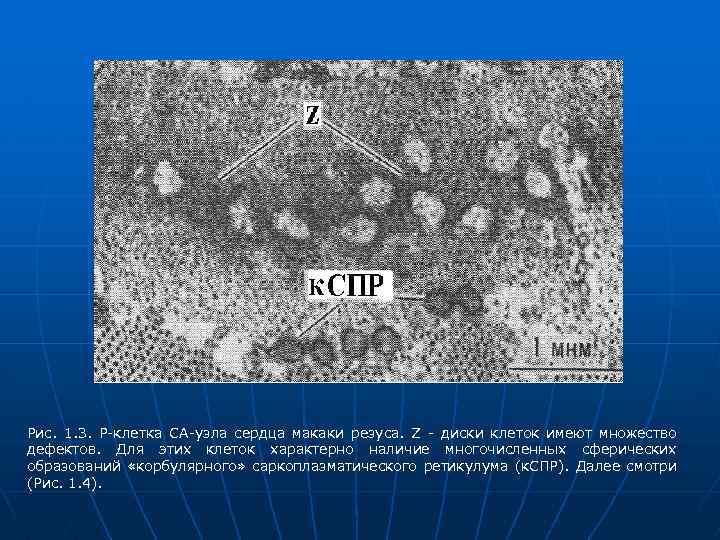
Рис. 1. 3. Р-клетка СА-узла сердца макаки резуса. Z - диски клеток имеют множество дефектов. Для этих клеток характерно наличие многочисленных сферических образований «корбулярного» саркоплазматического ретикулума (к. СПР). Далее смотри (Рис. 1. 4).
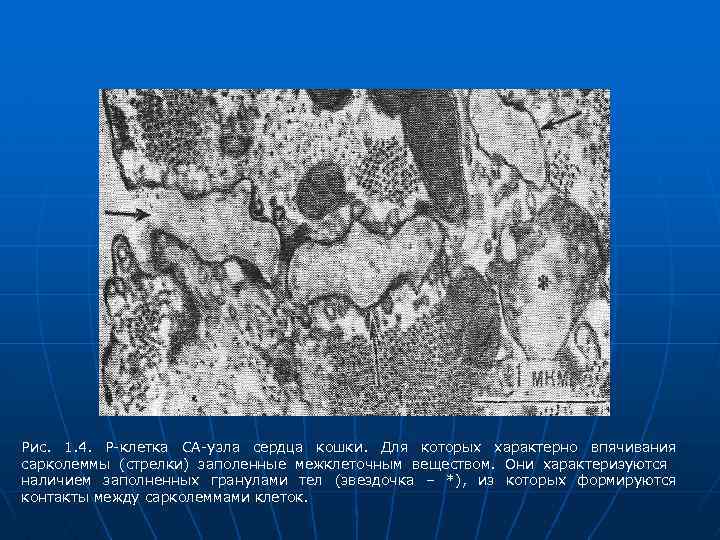
Рис. 1. 4. Р-клетка СА-узла сердца кошки. Для которых характерно впячивания сарколеммы (стрелки) заполенные межклеточным веществом. Они характеризуются наличием заполненных гранулами тел (звездочка – *), из которых формируются контакты между сарколеммами клеток.

n n До настоящего времени остаются неясными многие механизмы, приводящие к развитию МДД и генерации спонтанных ПД, хотя понятно, что они связаны с особенностями функционирования мембранных ионтранспортирующих систем клеток. Тем не менее, считается, что единый пейсмекерный ритм СА-узла строится на основе интегративного взаимодействия всех элементов гетерогенного пейсмекера. Роль водителя ритма 1 -го порядка огромна, так как все регулирующие воздействия, меняющие автоматию, оказывают свое влияние посредством воздействия на Рклетки СА-узла. Если этот водитель ритма «выходит» из работы, то ни симпатическая, ни парасимпатическая системы, сами по себе не могут запустить деятельность сердца. А в тех случаях, когда СА-узел повреждается, то больному вживляют электростимулятор, задающий самостоятельный ритм работы сердца.
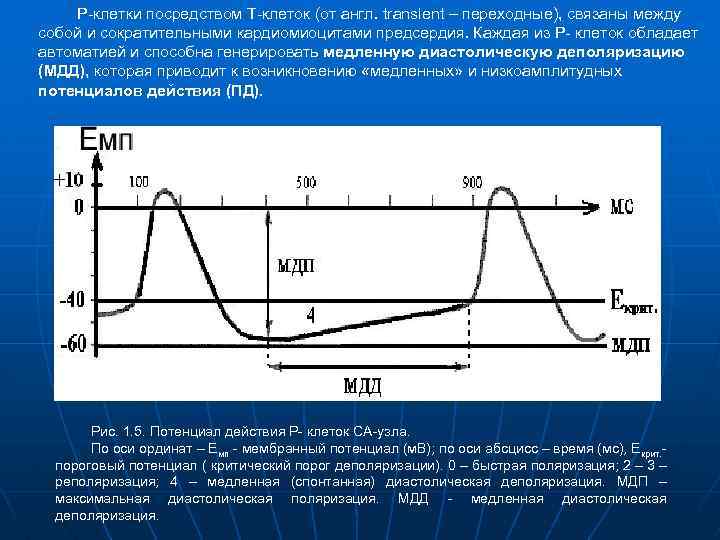
Р-клетки посредством Т-клеток (от англ. transient – переходные), связаны между собой и сократительными кардиомиоцитами предсердия. Каждая из P- клеток обладает автоматией и способна генерировать медленную диастолическую деполяризацию (МДД), которая приводит к возникновению «медленных» и низкоамплитудных потенциалов действия (ПД). Рис. 1. 5. Потенциал действия Р- клеток СА-узла. По оси ординат – Емп - мембранный потенциал (м. В); по оси абсцисс – время (мс), Екрит. пороговый потенциал ( критический порог деполяризации). 0 – быстрая поляризация; 2 – 3 – реполяризация; 4 – медленная (спонтанная) диастолическая деполяризация. МДП – максимальная диастолическая поляризация. МДД - медленная диастолическая деполяризация.

n n n Р-клетки, составляющие основу СА-узла, имеют ряд существенных особенностей электрогенеза, отличающих их от клеток сократительного миокарда, скелетных и нервных клеток: 1. Низкий уровень мембранного потенциала (МП), около -50 ÷ -60 м. В на пике максимальной диастолической поляризации (МДП) - то есть он значительно ниже равновесного К+- потенциала (Ек). 2. Генерируют, так называемые «медленные» ПД, по своей форме приближающиеся к пикообразным, длительностью до 300 мсек. 3. Имеется спонтанное снижение уровня мембранного потенциала (МДД) до критического уровня деполяризации мембраны (Екрит). -30 ÷ -40 м. В, в результате чего происходит генерация спонтанного ПД. 4. Амплитуда ПД очень низкая (ЕПД 30 ÷ 50 м. В) и часто без явления реверсии заряда - (овершута).

n n n n n Все эти особенности электрической активности Р- клеток СА-узла объясняются тем, что: В условиях «покоя» мембрана имеет очень высокую проницаемость для ионов Nа+; РК+: РNа+: РCl- = 1: 0, 58: 0, 02. Для сравнения в нервных волокнах; в скелетных мышцах. Аксон кальмара: 1: 0, 04: 0, 45 Фаза деполяризации ПД, от Екрит. до пика овершута, обусловлена активацией только медленных потенциалозависимых Са-каналов Lтипа (L-Са-каналы или JCa. L), частично проницаемых для ионов Nа+, так как быстрые потенциалозависимые Nа+- каналы уже в исходном состоянии инактивированы (Екрит. Na-каналов -60 м. В). Фаза спонтанной МДД до Екрит. обусловлена снижением К+проводимости мембраны (закрытие Са-активируемых К+-каналов или снижение JKCа, закрытием Nа-зависимых К-каналов или снижением JKNa+) и активацией быстрых потенциалозависимых Са-каналов Т-типа (Т-Са-каналы или JСа. Т) мембраны клеток. Максимальная диастолическая поляризация Р-клеток, обусловлена значительно высокой К+-проводимостью мембраны во время фазы 3 ПД, за счет работы Са-активируемых К+- каналов (JKCа) и Nазависимых К-каналов (JKNa). Фаза реполяризации ПД Р-клеток обусловлена активацией К+проводимости мембраны за счет работы 3 основных типов калиевых каналов : а. потенциалозависимых К-каналов задержанного выпрямления (JКз. в. ); б. Са-активируемых К+-каналов (JКСа); в. Nа-зависимых-К-каналов (JKNa).

Механизмы автоматии n n n основаны на том, что состоянии покоя сумма входящих и выходящих ионных токов равна: вх = вых Для возникновения МДД необходимо, чтобы вх вых достаточного для достижения уровня порога и возникновения ПД. Согласно гипотезе Бабского смещение Nc в сторону более отрицательного ЕМ, например, до 70 м. В, при ПП в – 55 -60 м. В будет приводить к усилению вх. Согласно гипотезе Ходорова этого же эффекта можно достичь при снижении выходящего калиевого тока . Согласно гипотезе Noble, Tsien (1980) в этом процессе задействованы к 2 – каналы аномального выпрямления, которые кратковременно активируются при гиперполяризации мембраны, а затем их инактивация может привести к развитию МДД.
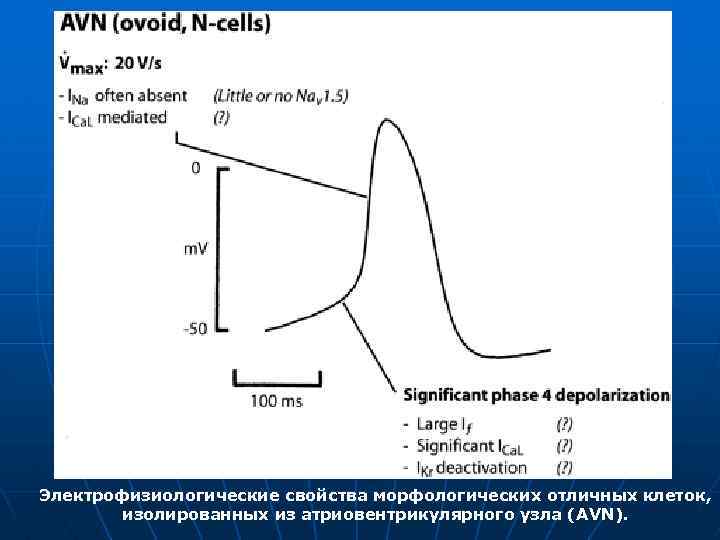
Электрофизиологические свойства морфологических отличных клеток, изолированных из атриовентрикулярного узла (AVN).

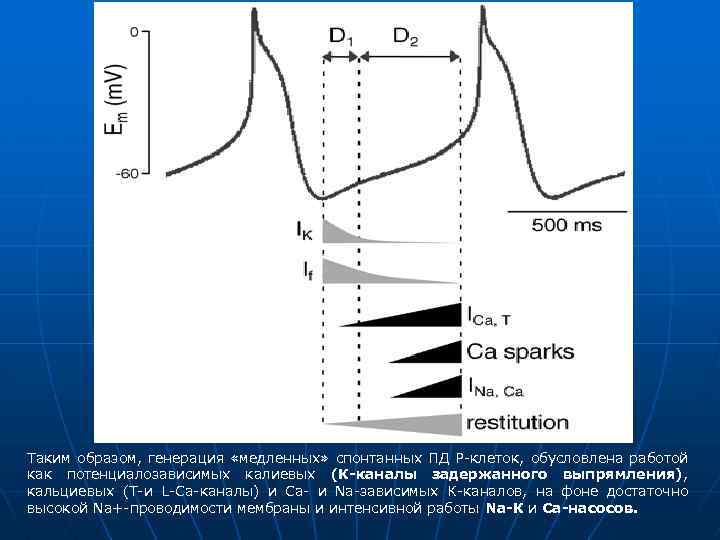
Таким образом, генерация «медленных» спонтанных ПД Р-клеток, обусловлена работой как потенциалозависимых калиевых (К-каналы задержанного выпрямления), кальциевых (Т-и L-Са-каналы) и Са- и Nа-зависимых К-каналов, на фоне достаточно высокой Nа+-проводимости мембраны и интенсивной работы Nа-К и Са-насосов.

Спасибо за внимание
сердце.ppt