FFM_2013_lec_3.ppt
- Количество слайдов: 36

Биофармацевтика, занятие 3 Организация биофармацевтического производства Иван И. Воробьев, к. х. н. ptichman@gmail. com МГУ, ФФМ 02. 04. 13

Основные факторы, определяющие надлежащую производственную практику • Конструкция и планировка производственных помещений • Качество исходных веществ и материалов • Управляемость и эффективность процесса производства • Квалификация и подготовка производственного персонала • Функционирование структур по обеспечению качества

Надлежащая производственная практика (GMP) Текущая редакция GMP РФ - ГОСТ Р 52249 -2009, соответствует GMP EU от 31. 01. 2009 Основные разделы: 1. Организация работы по обеспечению качества 2. Персонал 3. Помещения и оборудование 4. Документация 5. Производство 6. Контроль качества 7. Работа по контрактам на производство продукции и проведение анализов 8. Рекламации и отзыв продукции 9. Самоинспекции

GMP - Организация работы по обеспечению качества I. Лекарственные средства разработаны с учетом требований настоящего стандарта (правил GMP). II. На все производственные и контрольные операции разработана документация, соответствующая требованиям настоящего стандарта. III. Ответственность и обязанности всех работников четко определены. IV. Предусмотрены меры, обеспечивающие производство, поставку и использование исходных и упаковочных материалов, соответствующих установленным требованиям. V. Контроль промежуточной продукции и технологического процесса (внутрипроизводственный контроль), аттестация (испытания) процессов и оборудования проводятся в необходимом объеме. VI. Производство и контроль готовой продукции выполняются по утвержденным инструкциям (методикам). VII. Реализация лекарственных средств до выдачи уполномоченным лицом разрешения на выпуск не допускается. Уполномоченное лицо должно подтвердить, что каждая серия продукции произведена и проверена в соответствии с требованиями, установленными при государственной регистрации лекарственного средства. VIII. Существующая система мер обеспечивает качество лекарственных средств при их хранении, отгрузке и последующем обращении в течение всего срока годности. IX. Порядок проведения самоинспекции и/или аудита качества позволяет регулярно оценивать эффективность системы обеспечения качества.

GMP - Помещения и оборудование 3. 1. Риск загрязнения материалов и продукции, создаваемый окружающей средой производственных помещений (зданий), должен быть минимальным при условии соблюдения всех мер защиты. 3. 2. …Проведение технического обслуживания и ремонта не должно оказывать отрицательного влияния на качество продукции. Уборка и дезинфекция помещений должны проводиться в соответствии с письменными инструкциями. 3. 3. Освещение, температурный режим, влажность воздуха и вентиляция должны […] не оказывать прямого или косвенного отрицательного влияния на работу оборудования и лекарственные средства во время их изготовления и хранения. 3. 4. При проектировании и эксплуатации помещений должна быть обеспечена защита от проникания в них насекомых или животных. 3. 5. В помещения не должны допускаться лица, не имеющие права доступа в них… Типы помещений: • Производственная зона • Зоны складирования • Зоны контроля качества • Вспомогательные зоны

GMP - Документация 4. 1. Виды документов Спецификация (specification): документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств. Промышленный регламент, технологическая инструкция и инструкция по упаковке (manufacturing formulae, processing and packaging instructions): документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции. Инструкция, методика, процедура (procedure): документ, содержащий указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования). Протокол на серию (record): документ, отражающий процесс производства каждой серии продукции, в т. ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции.

GMP часть II, прил. 18 - АФС, производимые путем культивирования клеток (ферментации) 18. 16. В целом, технологический контроль должен учитывать: - поддерживание в рабочем состоянии рабочего банка клеток; - правильную инокуляцию и развитие культуры клеток; - контроль критических рабочих параметров во время ферментации/культивирования клеток; - непрерывный контроль процесса роста клеток, их жизнеспособности (для большинства процессов культивирования клеток) и продуктивности; - методы сбора и очистки, при которых происходит удаление клеток, клеточного дебриса и компонентов питательной среды с одновременной защитой промежуточного продукта или АФС от загрязнения (в частности, микробиологического характера) и потери качества; - непрерывный контроль микробного загрязнения и, при необходимости, уровня эндотоксинов на определенных стадиях производства и - вопросы защиты от вирусного загрязнения, описанные в Руководстве ICH Q 5 A <*>.

Технология чистых помещений

Технология чистых помещений

Технология чистых помещений

Технология чистых помещений
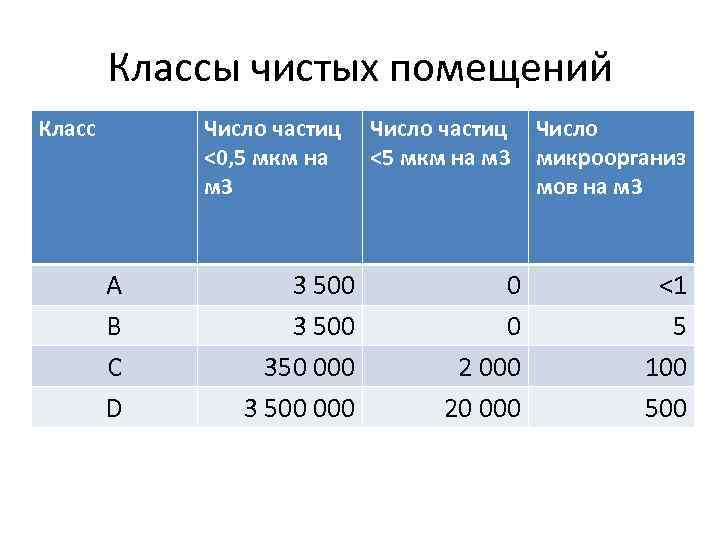
Классы чистых помещений Класс Число частиц Число <0, 5 мкм на <5 мкм на м 3 микроорганиз м 3 мов на м 3 A B C D 3 500 350 000 3 500 0 0 2 000 20 000 <1 5 100 500
Установки по получению и распределению воды Классы очистки воды для фармпроизводства: • Вода питьевая • Вода очищенная • Вода для инъекций

Очистка, деконтаминация, санитарная обработка оборудования CDS – cleaning, decontamination, sanitation CIP/SIP – cleaning in place / sanitation in place Растворы для санитарной обработки хроматографических сорбентов • Na. Cl 0, 5– 2 M • Неионогенные детергенты 0. 1– 1. 0% • Na. OH 0, 1 -1 M • Уксусная кислота 20– 50% • Этанол 20 -50% • Изопропанол 10 -30% • ЭДТА 1 -50 м. М • Растворы протеиназ

Основные продуценты – E. coli K 12 Свойства продуцента: Особенности производства: § Быстрый рост, простая среда для культивации § Содержание целевых белков 1 -10 г/л § Целевые белки в нерастворимой форме § Эндогенные липополисахариды § Около 1, 5 тыс. детектируемых белков штамма-продуцента § Инокуляция 1/30 -1/100 объема – простая подготовка посевного материала § Стерилизация культуральной среды в ферментере автоклавированием § Аппараты для разрушения клеток и отделения телец включения § Процессы солюбилизации и рефолдинга § Удаление эндотоксинов при очистке § Не нужна аффинная хроматография
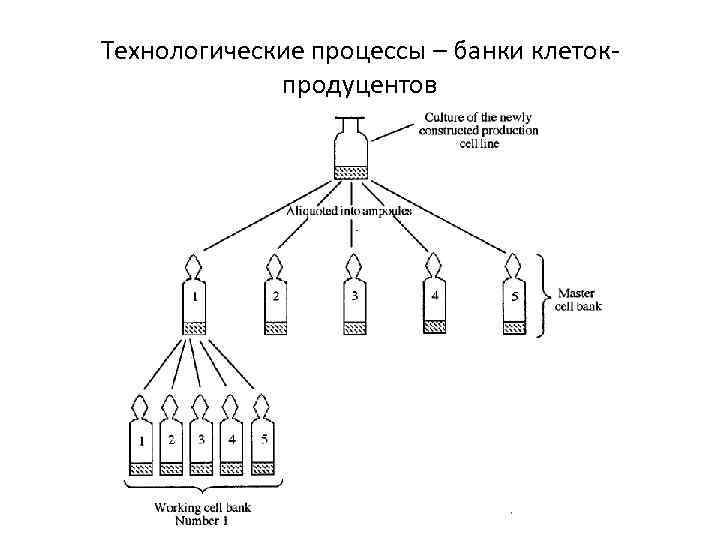
Технологические процессы – банки клетокпродуцентов

Технологические процессы – подготовка посевного материала и ферментация E. coli CHO

Технологические процессы – ферментация
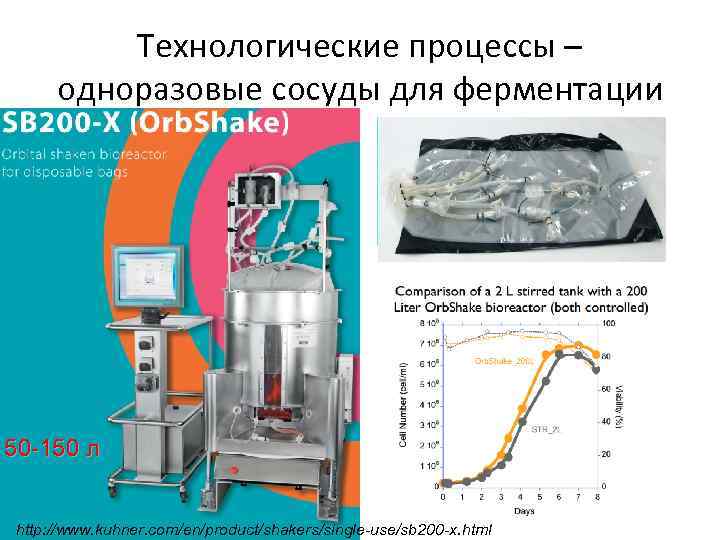
Технологические процессы – одноразовые сосуды для ферментации 50 -150 л http: //www. kuhner. com/en/product/shakers/single-use/sb 200 -x. html

Технологические процессы – выделение продукта E. coli • сбор клеток центрифугированием • разрушение клеток • промывка телец включения • ренатурация CHO • удаление клеток фильтрацией • концентрирование культуральной среды ультрафильтрацией • адсорбция целевого белка на хроматографическом сорбенте

Технологические процессы - очистка Жидкостная хроматография Метод хроматографии Принцип разделения Примеры сорбентов Ионообменная и мультимодальная (IEX @ MMC) Различия в заряде поверхности белков при различных p. H Capto S, Capto Q, Capto MMC, Capto Adhere Гидрофобная (HIC) Различия в размере гидрофобных участков поверхности белков Butyl sepharose, Phenyl sepharose Обращеннофазовая (RPC) Различия в общей гидрофобности белков C 18, С 4, SOURCE RPC Гель-фильтрационная (SEC) Различия в размерах белков Superdex, Superose, Sephacryl Аффинная Специфическое взаимодействие белков и их лигандов Ni-NTA Agarose, Protein A sepharose, Blue sepharose, Lysine sepharose

Технологические процессы - Ультрафильтрация http: //www. spectrumlabs. com/filtration/KR 2 System. html

Технологические процессы – получение лекарственных форм • Стерилизация растворов биофармацевтических лекарственных средств – только фильтрованием • Высушивание только лиофилизацией

Управляемость производственного процесса Контроль исходных веществ и материалов Внутрипроизводственный контроль Контроль качества готового продукта Контроль архивных образцов (стабильность при хранении) • Обеспечение качества • Внесение изменений в процесс производства • •
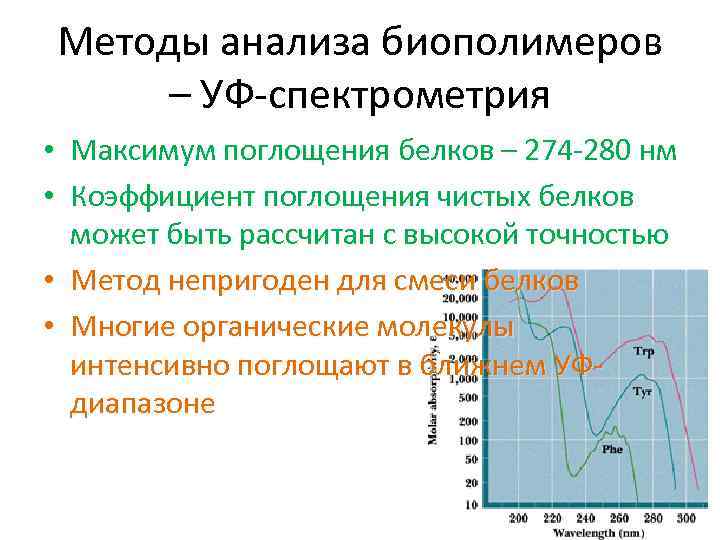
Методы анализа биополимеров – УФ-спектрометрия • Максимум поглощения белков – 274 -280 нм • Коэффициент поглощения чистых белков может быть рассчитан с высокой точностью • Метод непригоден для смеси белков • Многие органические молекулы интенсивно поглощают в ближнем УФдиапазоне
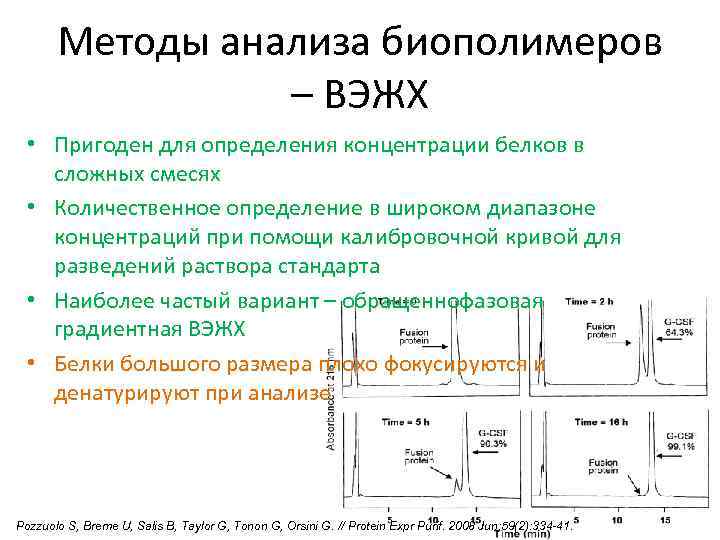
Методы анализа биополимеров – ВЭЖХ • Пригоден для определения концентрации белков в сложных смесях • Количественное определение в широком диапазоне концентраций при помощи калибровочной кривой для разведений раствора стандарта • Наиболее частый вариант – обращеннофазовая градиентная ВЭЖХ • Белки большого размера плохо фокусируются и денатурируют при анализе Pozzuolo S, Breme U, Salis B, Taylor G, Tonon G, Orsini G. // Protein Expr Purif. 2008 Jun; 59(2): 334 -41.
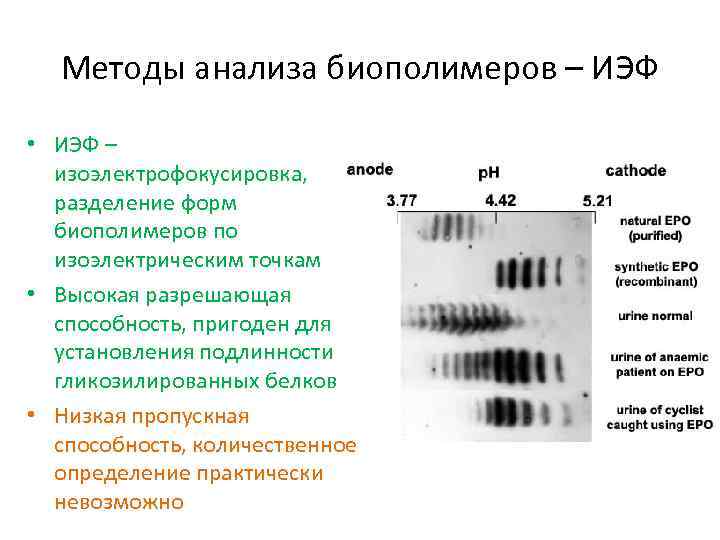
Методы анализа биополимеров – ИЭФ • ИЭФ – изоэлектрофокусировка, разделение форм биополимеров по изоэлектрическим точкам • Высокая разрешающая способность, пригоден для установления подлинности гликозилированных белков • Низкая пропускная способность, количественное определение практически невозможно

Методы анализа биополимеров – капиллярный электрофорез • Разделение биополимеров в электрическом поле внутри заполненных раствором капилляров по удельному заряду молекул • Исключительно высокая разрешающая способность • Низкая чувствительность, вариации коэффициента включения флюорофора в различные формы анализируемого биополимера
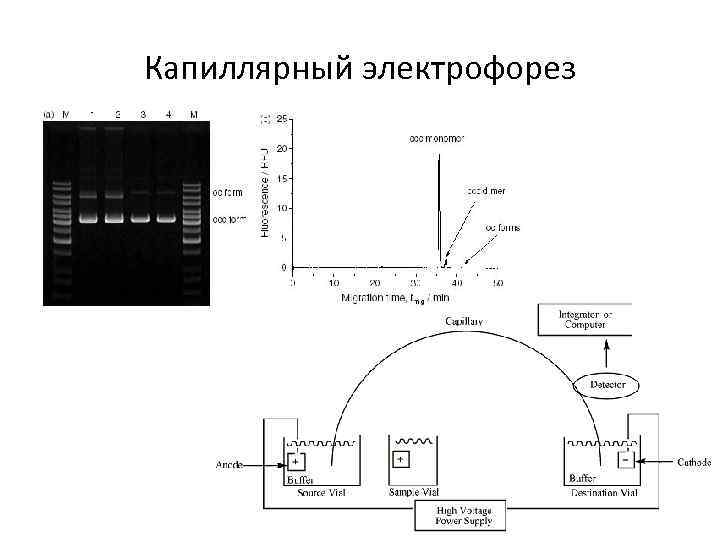
Капиллярный электрофорез

Методы анализа биополимеров – Иммуноферментный анализ • Детекция белков в сложных смесях по связыванию с двумя различными антителами. Enzyme Linked Immuno. Sorbent Assay - ELISA • Исключительно высокая селективность • Высокая пропускная способность • Низкая прецизионность, калибровочная кривая нелинейна
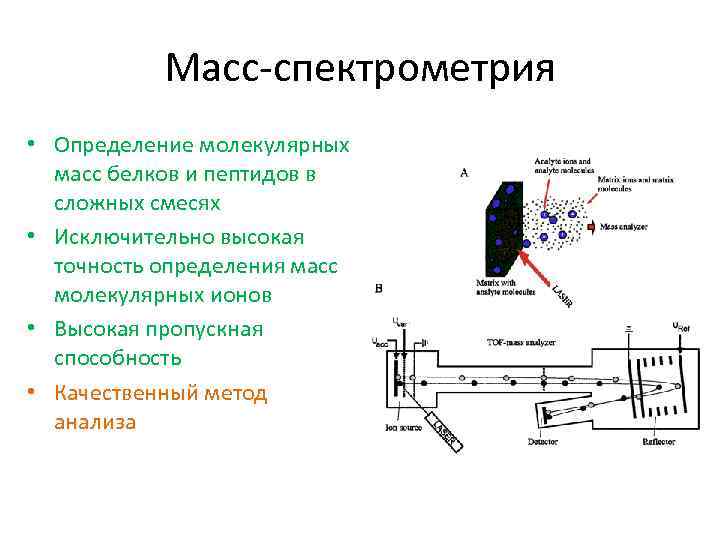
Масс-спектрометрия • Определение молекулярных масс белков и пептидов в сложных смесях • Исключительно высокая точность определения масс молекулярных ионов • Высокая пропускная способность • Качественный метод анализа
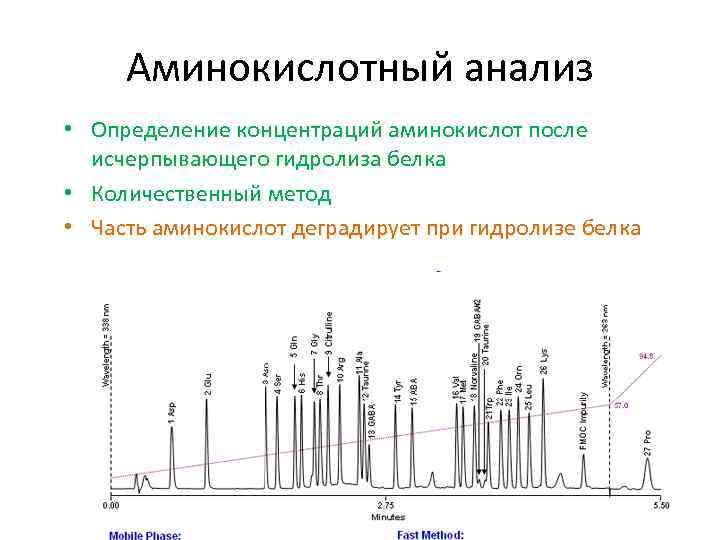
Аминокислотный анализ • Определение концентраций аминокислот после исчерпывающего гидролиза белка • Количественный метод • Часть аминокислот деградирует при гидролизе белка
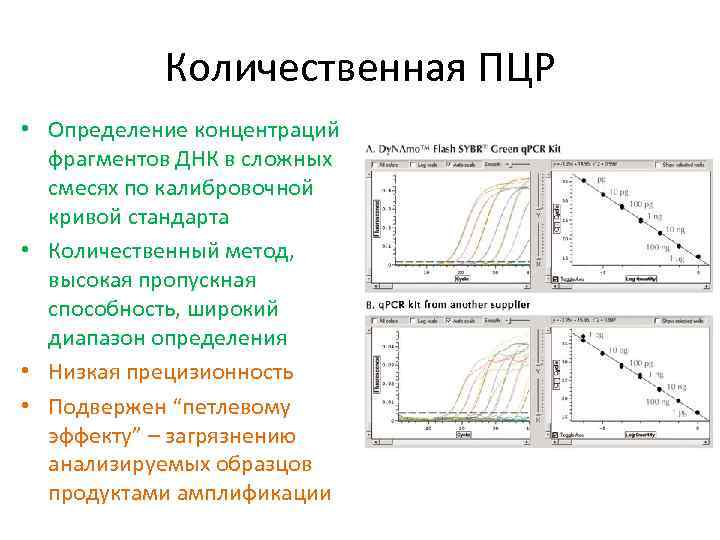
Количественная ПЦР • Определение концентраций фрагментов ДНК в сложных смесях по калибровочной кривой стандарта • Количественный метод, высокая пропускная способность, широкий диапазон определения • Низкая прецизионность • Подвержен “петлевому эффекту” – загрязнению анализируемых образцов продуктами амплификации
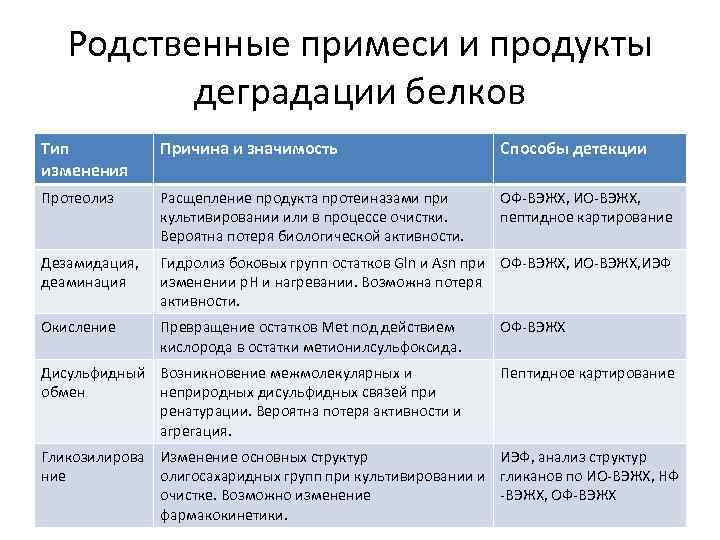
Родственные примеси и продукты деградации белков Тип изменения Причина и значимость Способы детекции Протеолиз Расщепление продукта протеиназами при культивировании или в процессе очистки. Вероятна потеря биологической активности. ОФ-ВЭЖХ, ИО-ВЭЖХ, пептидное картирование Дезамидация, деаминация Гидролиз боковых групп остатков Gln и Asn при ОФ-ВЭЖХ, ИО-ВЭЖХ, ИЭФ изменении p. H и нагревании. Возможна потеря активности. Окисление Превращение остатков Met под действием кислорода в остатки метионилсульфоксида. Дисульфидный Возникновение межмолекулярных и обмен неприродных дисульфидных связей при ренатурации. Вероятна потеря активности и агрегация. ОФ-ВЭЖХ Пептидное картирование Гликозилирова Изменение основных структур ИЭФ, анализ структур ние олигосахаридных групп при культивировании и гликанов по ИО-ВЭЖХ, НФ очистке. Возможно изменение -ВЭЖХ, ОФ-ВЭЖХ фармакокинетики.

Посторонние примеси в субстанциях биополимеров Тип примеси Влияние на безопасность конечного продукта Способы детекции Белки штамма -продуцента Иммунная и аллергическая реакция, возможно появление нейтрализующих антител к продукту. ИФА ДНК штаммапродуцента Потенциальный риск трансформации клеток пациента чужеродной ДНК. Количественная ПЦР, гибридизация по Саузерну Эндотоксины Лихорадка при введении, возможно ЛАЛ-тест, появление нейтрализующих антител к проверка на продукту. животных Типичный допустимый уровень 20 нг/мг 10 пг/доза 5 ЭЕ/мл

Следующее занятие 4 Цитокины – интерфероны, интерлейкины, фактор некроза опухолей • • • Молекулярная биология цитокинов – взаимодействие с рецепторами, киназные каскады, транскрипционные факторы. Семейство интерферонов – рецепторы интерферонов, путь передачи сигнала JAK-STAT, врожденный и адаптивный имунный ответы на вирусную инфекцию. Фармацевтические субстанции интерферонов, методы получения, области применения, токсическое действие, конъюгаты Семейство интерлейкинов – принципы межклеточного взаимодействия, про- и анти- воспалительные факторы, факторы дифференцировки Фармацевтически значимые интерлейкины – ИЛ-2, антагонист рецептора ИЛ-1, ИЛ-11 Фактор некроза опухолей – иммунный ответ и острое воспаление, цитокины семейства ФНО, рецепторы ФНО, терапевтическое использование ФНО и растворимых рецепторов ФНО.
FFM_2013_lec_3.ppt