FFM_2013_lec_1.ppt
- Количество слайдов: 40

Биофармацевтика Иван И. Воробьев, к. х. н. зав. лаб. биоинженерии клеток млекопитающих Центра «Биоинженерия» РАН, н. с. лаборатории биокатализа Института биоорганической химии РАН ptichman@gmail. com МГУ, ФФМ 19. 03. 13

Учебная литература • Глик Б. , Пастернак Дж. Молекулярная биотехнология. Принципы и применение. — Москва: Мир, 2002. • Волова Т. Г. Биотехнология. Новосибирск: Изд-во Сибирского отделения Российской Академии наук, 1999. • Walsh G. Biopharmaceuticals: Biochemistry and Biotechnology. Wiley-Blackwell; 2 edition, 2003

Структура курса “Биофармацевтика” • • • Лекция 1. Введение. Лекарственные • средства, биологические продукты и биофармацевтические лекарственные средства. • Лекция 2. Фармацевтическая разработка биотехнологических субстанций и лекарственных форм. • Лекция 3. Организация биофармацевтического производства. • Лекция 4. Цитокины – интерфероны, интерлейкины, фактор некроза • опухолей Лекция 5. Гемопоэтические факторы роста – Г-КСФ, ГМ-КСФ, эритропоэтины, тромбопоэтин Лекция 6. Факторы роста – ЭФР, фактор роста тромбоцитов, ФРФ, ИФР, ТРФ, нейротропные ростовые факторы Лекция 7. Полипептидные гормоны. Инсулин, глюкагон, соматотропин, гонадотропины Лекция 8. Белки системы гемостаза и терапевтические ферменты. Лекция 9. Антитела и рекомбинантные вакцины. Лекция 10. Перспективные направления в биофармацевтике.
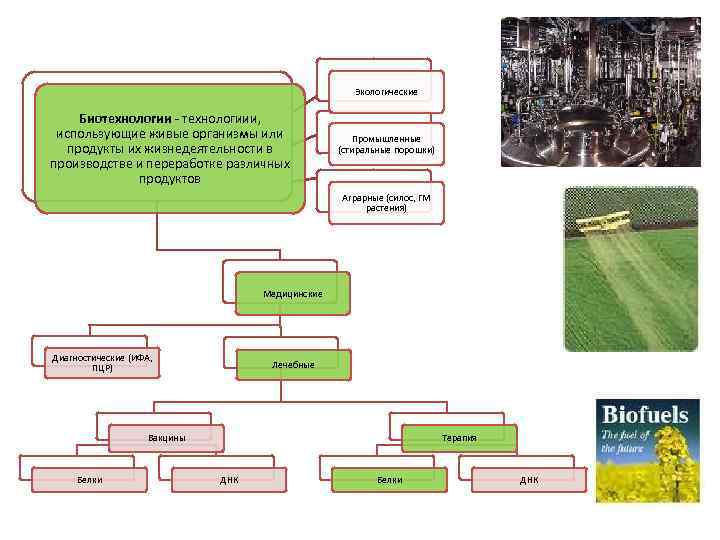
Экологические Биотехнологии - технологиии, использующие живые организмы или продукты их жизнедеятельности в производстве и переработке различных продуктов Промышленные (стиральные порошки) Аграрные (силос, ГМ растения) Медицинские Диагностические (ИФА, ПЦР) Лечебные Вакцины Белки Терапия ДНК Белки ДНК

Использование рекомбинантных белков • Научные исследования и диагностика заболеваний – внесение мутаций, гомогенные ферменты, структурные исследования, слитые белки, антигены и т. д. • В качестве лекарственных средств – биофармацевтическое применение • В пищевой промышленности, сельском хозяйстве, производстве стиральных порошков и т. д. – биотехнологическое применение
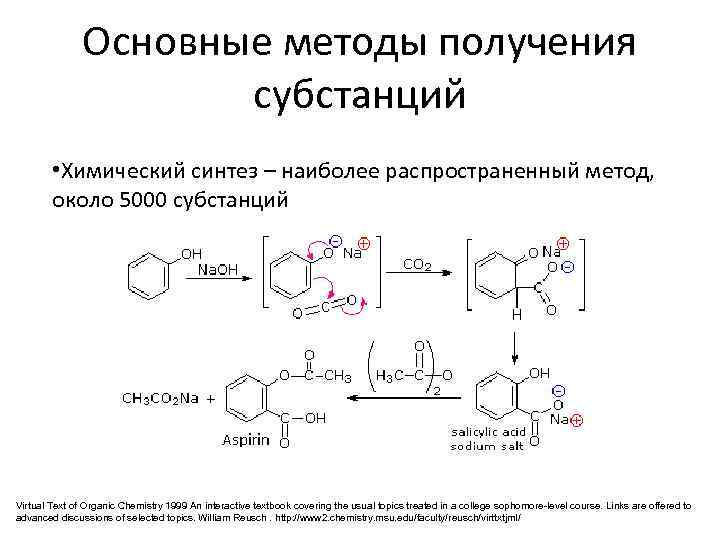
Основные методы получения субстанций • Химический синтез – наиболее распространенный метод, около 5000 субстанций Virtual Text of Organic Chemistry 1999 An interactive textbook covering the usual topics treated in a college sophomore-level course. Links are offered to advanced discussions of selected topics. William Reusch. http: //www 2. chemistry. msu. edu/faculty/reusch/virttxtjml/
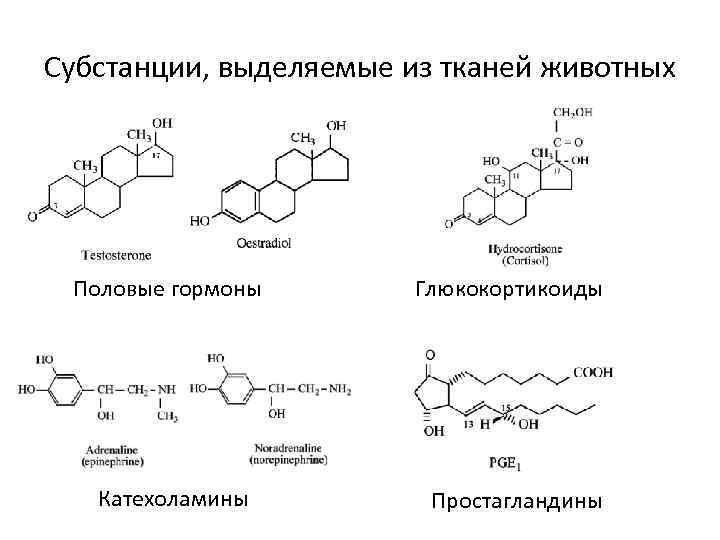
Субстанции, выделяемые из тканей животных Половые гормоны Катехоламины Глюкокортикоиды Простагландины
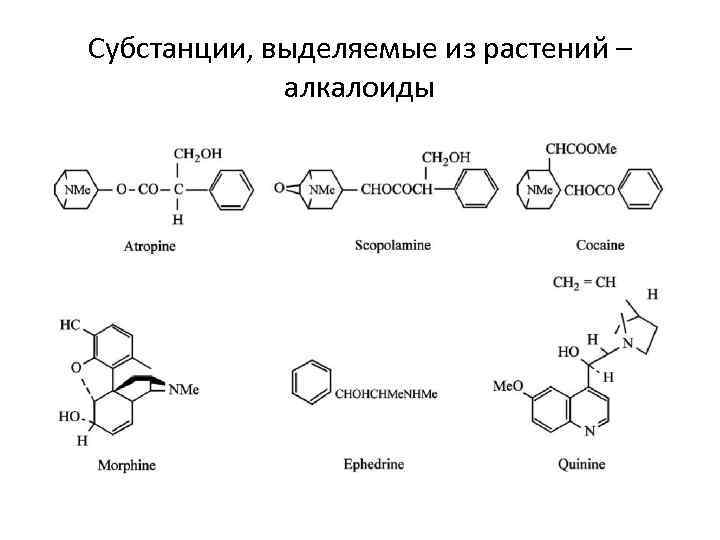
Субстанции, выделяемые из растений – алкалоиды
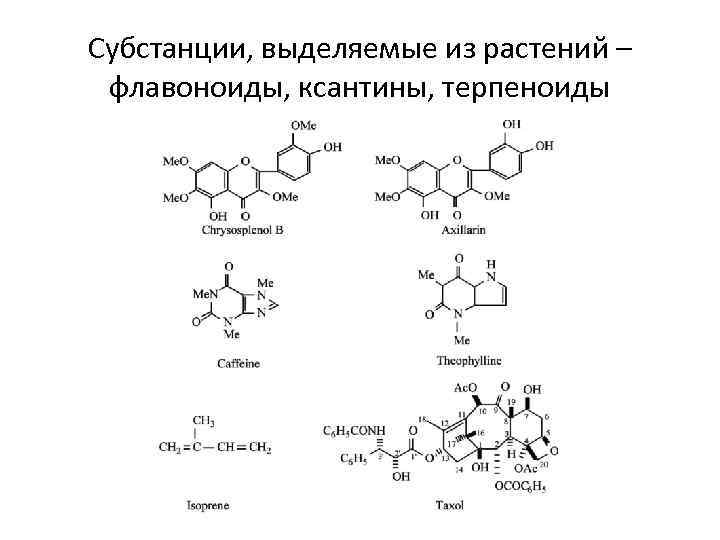
Субстанции, выделяемые из растений – флавоноиды, ксантины, терпеноиды
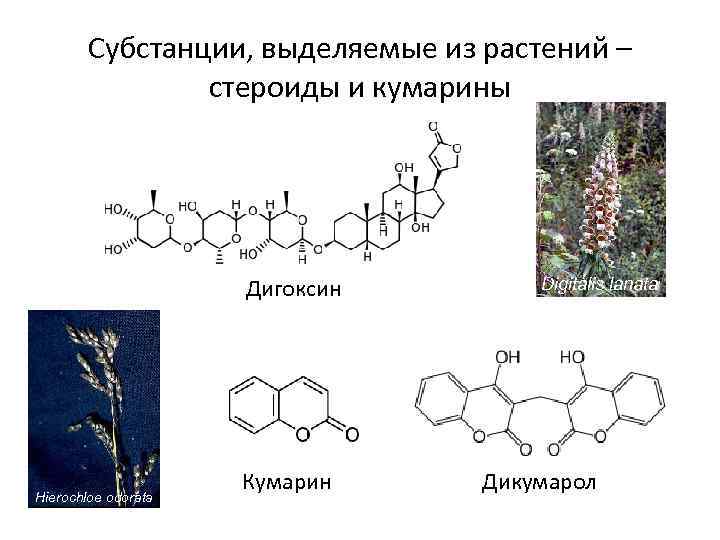
Субстанции, выделяемые из растений – стероиды и кумарины Дигоксин Hierochloe odorata Кумарин Digitalis lanata Дикумарол
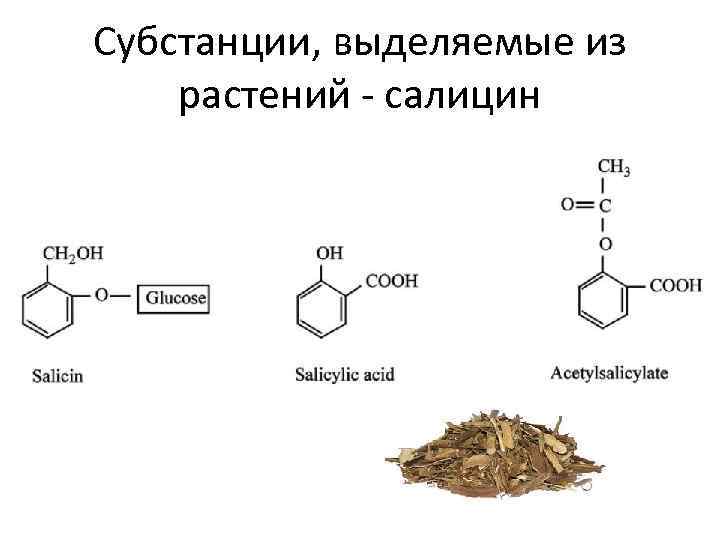
Субстанции, выделяемые из растений - салицин
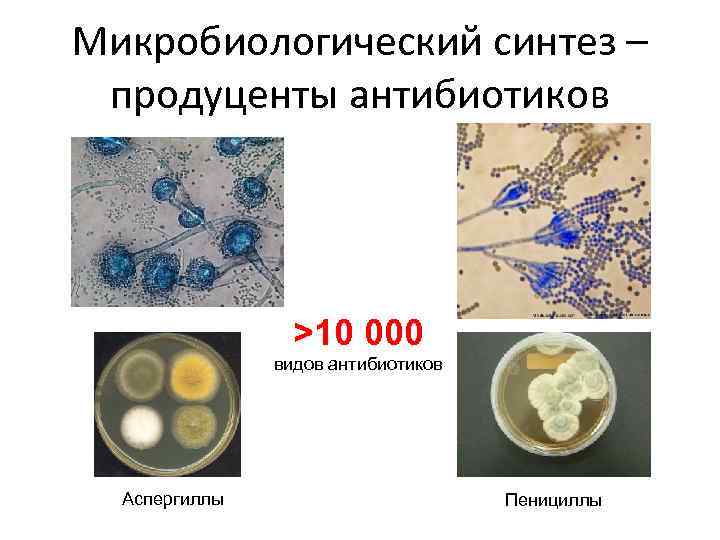
Микробиологический синтез – продуценты антибиотиков >10 000 видов антибиотиков Аспергиллы Пенициллы
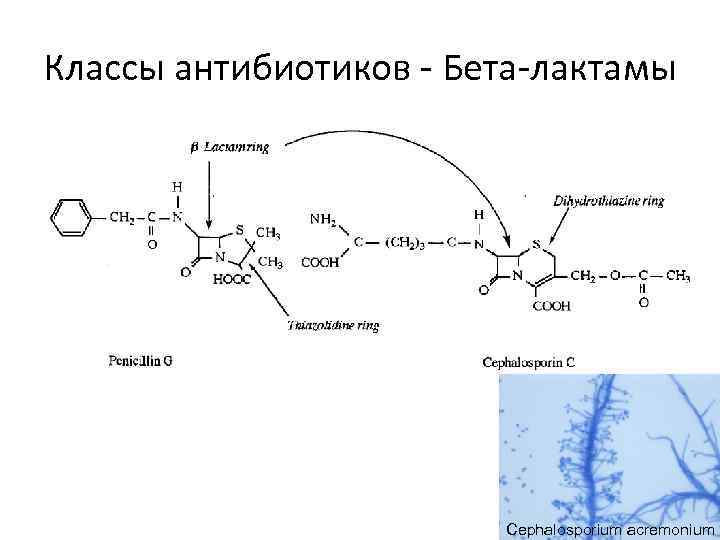
Классы антибиотиков - Бета-лактамы Cephalosporium acremonium

Классы антибиотиков - Тетрациклины

Классы антибиотиков - Аминогликозиды Стрептомицин Streptomyces griseus
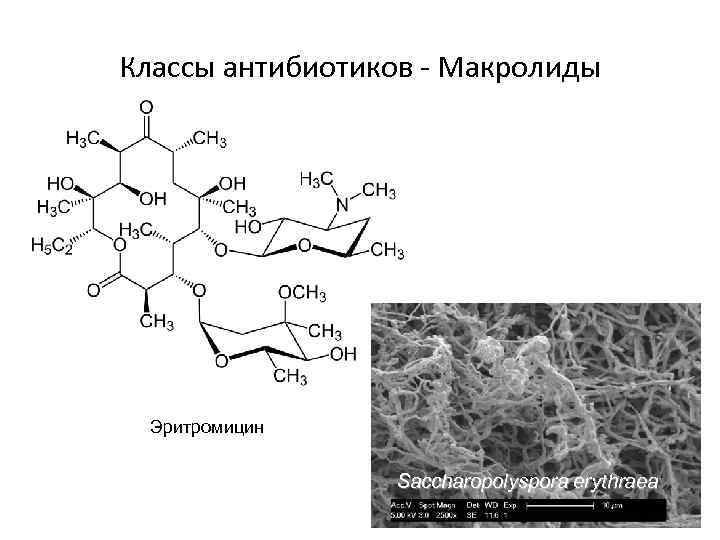
Классы антибиотиков - Макролиды Эритромицин Saccharopolyspora erythraea

Классы антибиотиков - ансамицины
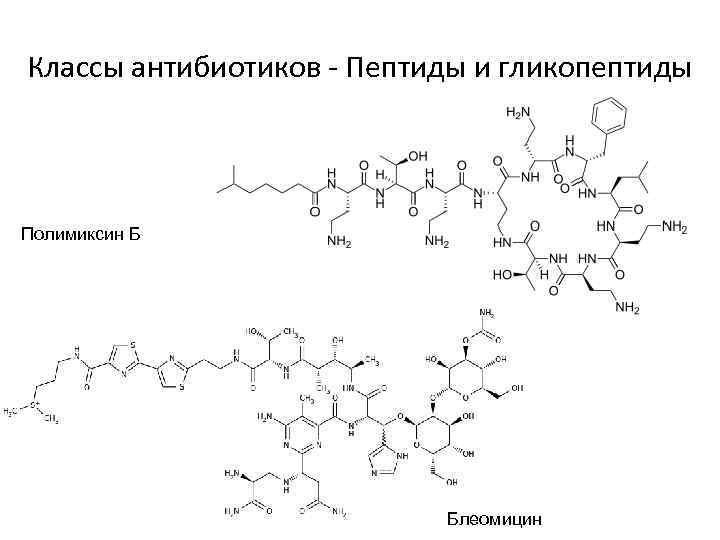
Классы антибиотиков - Пептиды и гликопептиды Полимиксин Б Блеомицин

Классы антибиотиков - прочие Streptomyces venezuelae хлорамфеникол

Рекомбинантные белки для лечения заболеваний: особые требования • Высокая степень очистки • Точная копия природного белка или научные доказательства безопасности мутаций для пациентов • Проверенный, стабильный и безопасный продуцент • Как можно более полное удаление ВСЕХ биополимеров и пирогенов продуцента (ДНК <10 пг/мг) • Раствор или порошок, в котором белок полностью сохраняет свои свойства не менее 1 года • Демонстрация стабильности, управляемости и эффективности процесса получения продукта – GMP (Good Manufacturing Practice)

Общий метод получения рекомбинантного белка 1. Молекулярное клонирование гена или его фрагмента 2. Трансформация клеток, отбор клонов 3. Выращивание культуры или организма 4. Выделение и очистка белка


Экспрессионный вектор • Точка инициации репликации - ORI • Селекционные маркеры • Промотор целевого гена • Терминатор транскрипции • Полилинкер - MCS

Половина биотерапевтических белков производится в клетках млекопитающих К 2006 году из 23 мировых блокбастеров (препаратов с продажами >1 млрд USD) - 8 производилось в бактериальной или дрожжевой системе, а 15 - в клетках млекопитающих (из них 8 являлись моноклональными антителами). На 2010 г – 31 блокбастер, 17 из них - в клетках млекопитающих. Ferrer-Miralles et al. Microbial Cell Factories 2009 8: 17 Expresssion systems and transformed hosts used in manufacturing the recombinant proteins on the United States and European markets Microbes 79 Bacteria (prokaryotes) 58 Escherichia coli (E. coli) 56 Streptococci 2 Yeasts (eukaryotes) 21 Saccharomyces cerevisiae 19 Pichia pastoris 2 Plants 0 Insect Cells, Baculovirus Vectors 3 Mammalian Cells 74 Mammalian cells, nonprimate 65 hamster, Chinese ovary (CHO) 50 murine myeloma cells 11 murine cells other 1 Mammalian cells, primate 9 monkey cells, diploid, kidney, or fetal lung 4 Human cells 5 human cells, transformed with Epstein-Barr virus 1 human cells, gene activation by TKT 2 2 human kidney cells, embryonic 1 human cells, unspecified 1 Avian Systems 0 Transgenic Mammals 3 Goats 1 Rabbits 1 Mice, Xeno. Mouse (used in development only) 1 Viruses 7 Recombinant viruses as products (live vaccines) 6 Yellow fever virus vector 1 Ronald A. Rader. "Expression Systems for Process and Product Development: A Perspective on Opportunities for Innovator and Follow-on Product Developers, " Bio. Process International, vol. 6, issue 6, suppl. 4, Success Stories in Protein Expression (lead article), p. 4 -9, June 2008.

Бактерия Esherichia coli Преимущества • Быстрый рост (6 -12 часов от посева до окончания индукции) • Относительно высокий выход целевого белка (1002000 мг/л) • Низкая цена ростовой среды (натуральные простые компоненты) • Низкая стоимость ферментации • Возможность получать микрокристаллы целевого белка (тельца включения) Недостатки • Затруднен биосинтез крупных полипептидов (>50 к. Да) • Нет системы гликозилирования • Ограниченные возможности секреции белков • Многие гетерологичные белки токсичны для клеток • Затруднено образование дисульфидных связей • Многие гетерологичные белки образуют только тельца включения

E. coli – примеры использования Белки • • • • • • Bactericidal/permeability-increasing Protein, r. DNA Carboxypeptidase, r. DNA G-CSF, r. DNA/Amgen GM-CSF, r. DNA/Schering-Plough Hyaluronidase, r. DNA Insulin-like Growth Factor-1, r. DNA/Tercica Interferon alfa-2 a, r. DNA Interferon alfa-2 b, r. DNA Interferon alfacon-1, r. DNA Interferon betaser, r. DNA/Berlex Interferon gamma, r. DNA Interleukin-1 ra, r. DNA Interleukin-11, r. DNA Interleukin-2, r. DNA/Chiron Keratinocyte growth factor, r. DNA Somatropin, r. DNA/ Somatropin antagonist, r. DNA, PEGT 4 Endonuclease, r. DNA, Liposomal TNF, r. DNA t. PA, r. DNA/PDL Urokinase Plasminogen Activator, r. DNA Слитые белки • • Interleukin-13–Pseudomonas toxin, r. DNA Interleukin-2/diphtheria toxin, r. DNA Вакцины • • • Cholera Vaccine (r. DNA)/SBL Staphylococcus vaccine (r. DNA) Anthrax Vaccine, r. DNA/Vax. Gen Lyme Vaccine, r. DNA/Aventis Pertussis Toxoid, r. DNA Пептиды • • Calcitonin, r. DNA Glucagon, r. DNA/Lilly Insulin glargine, r. DNA Natriuretic peptide, r. DNA Parathyroid hormone (1 -34), r. DNA Parathyroid hormone (1 -84), r. DNA Антитела и фрагменты антител • • Complement C 5 Mab, r. DNA Heat shock protein Mab, r. DNA TNF Mab Fab', r. DNA, PEGVEGF Mab Fab, r. DNA

E. сoli – варианты систем экспрессии Системы экспрессии в E. coli Цитоплазматическая экспрессия Нерастворимый белок (тельца включения Растворимый белок Секреция в периплазму Растворимый белок
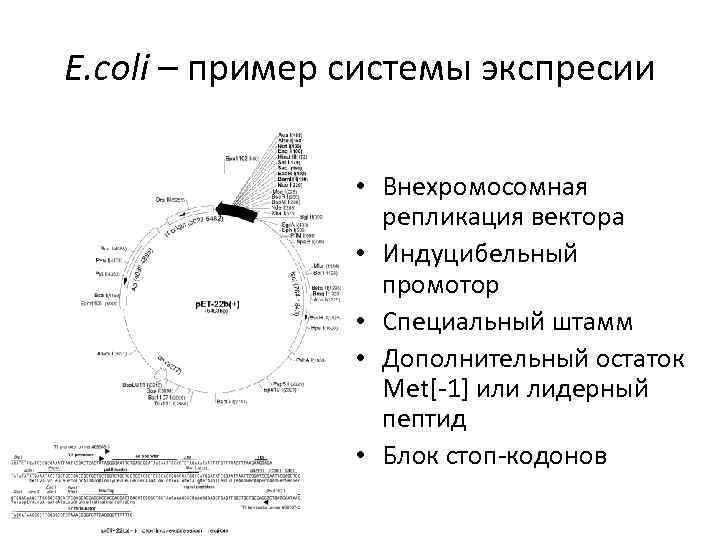
E. coli – пример системы экспресии • Внехромосомная репликация вектора • Индуцибельный промотор • Специальный штамм • Дополнительный остаток Met[-1] или лидерный пептид • Блок стоп-кодонов

Дрожжи Pichia pastoris Преимущества • • Относительно быстрый рост (3 -5 • дней от посева до окончания индукции) • Высокий выход целевого белка (до • 40 г/л) Очень низкая цена ростовой среды (глицерин, метанол, аммиак) Умеренная стоимость ферментации Возможна экспрессия крупных полипептидов (>50 к. Да) Возможно гликозилирование Секреция белка в ростовую среду, низкий уровень секреции протеаз Недостатки N-гликозилирование дает иммуногенные олигосахариды Не все белки эффективно секретируются Патентные ограничения на промышленное использование

P. pastoris – получение продуцента

P. pastoris – схема ферментации

P. pastoris – примеры использования • Alfimeprase - Accfib; 3203 -fibrolase (3 -serine) (Agkistrodon contortrix recombinant) • DX-88; ecallantide; kallikrein inhibitor protein, recombinant

Линия клеток CHO Chinese Hamster Ovary Преимущества • Пригодна для белков любого размера • Любые пост-трансляционные модификации • Не содержит трансмиссивных вирусов • Существуют сублинии DG 44 и DUX -B 11, дефектные по гену DHFR (легкая амплификация кассет) Недостатки • Большое время создания продуцента (от 4 -х месяцев до 1 года) • Медленный рост (промышленное культивирование до 200 дней) • Требует соблюдения полной стерильности и защиты культуры от заражения вирусами • Некоторые ферментные системы пост-трансляционных модификаций имеют ограниченные возможности и требуют оверэкспрессии генов • Ограниченный пролиферативный потенциал (до 25 пассажей) • Дорогая культуральная среда

CHO – вариант системы экспресии • Внехромосомная репликация вектора • Индуцибельный промотор • Специальный штамм • Дополнительный остаток Met[-1] или лидерный пептид • Блок стоп-кодонов

Methotrexate (MTX) Selection Gene of interest DHFR Transfect dfhr- cells Grow in Nucleoside Free medium Culture a Colony of cells Grow in 0. 05 u. M Mtx Culture a Colony of cells

Methotrexate (MTX) Selection Grow in 0. 25 u. M Mtx Culture a Colony of cells Grow in 5. 0 u. M Mtx Culture a Colony of cells Foreign gene expressed in high level in CHO cells

CHO – примеры использования Белки гемостаза Арилсульфатаза B ДНКаза I Глюкоцереброзидаза b Галактозидаза Идуронидаза трансгенные животные клетки млекопитающих CHO гибридомы клетки насекомых дрожжи бактерии число зарегистрированных препаратов Ферменты FIX FVIII BDD ТPA, TNK- ТPA FII (Тромбин) Гормоны и цитокины: ИФН b 1 а; G-CSF; Эритропоэтины BMP-2, BMP-7; FSH и его аналоги; ЛГ; b. ХГЧ; ТТГ; IGF 1/IGFBP-3 Антитела: a. CD 11 a; a. CD 20; a. CD 52; a. EGF ; a. HER 2; a. VEGF; Ig. E; TNFR-Ig. G Fc; CTLA 4 -Ig; LFA-3 -Ig. G 1

Доля России в мировом производстве биотехнологической продукции Объем производства (млрд. $) Россия (млрд. $) 1980 30 1, 5 1990 95 3, 2 2002 363 0, 8 2012 Свыше (прогноз) 1000 5 мировой уровень -9 - Россия

Биофармацевтические компании • Genentech – 5000 сотрудников. Более 15 продуктов, включая инсулин человека, соматропин, ДНКаза I, моноклональные антитела, тканевой активатор плазминогена, фактор VIII Герберт Бойер • Amgen (Applied Molecular Genetics) – 9000 сотрудников. Эритропоэтин, Г-КСФ, антагонист рецептора ИЛ-1, РФНОFc • Biogen – Швейцария, 2000 сотрудников. Интерферон-бета, интерферон-альфа, HBs. Ag • Genetics Institute – фактор VIII, фактор IX, ИЛ-11, BMP-2

Иван И. Воробьев, лаборатория биоинженерии клеток млекопитающих Центра «Биоинженерия» РАН, лаборатория биокатализа Института биоорганической химии РАН, ptichman@gmail. com
FFM_2013_lec_1.ppt