4 Бинарные соединения.ppt
- Количество слайдов: 21

Бинарные соединения

Номенклатура • Идо-соединения – Cu. O (оксид меди (II)), Pb. S (сульфид свинца) • Cu 3 Au (тримедьзолото) 2

Особенности • Состав и связанные с ним проблемы постоянства и переменности состава • Разность электроотрицательностей взаимодействующих атомов и все эффекты, связанные с поляризацией связи Реализуются 3 варианта взаимодействий Me + Me Me + не. Me соединения с преимущ-но металлической связью соединения с преимущ. ионной связью соединения с преимущ. ковалентными связями (полярными) Координационные решетки 3 Молекулярные и координационные соединения

Важнейшие структурные типы, характерные для бинарных соединений

Состав AB • Сфалерит – Кубическая сингония – к. ч. = 4 5

Состав AB • Вюрцит – Гексагональная сингония – к. ч. = 4 6
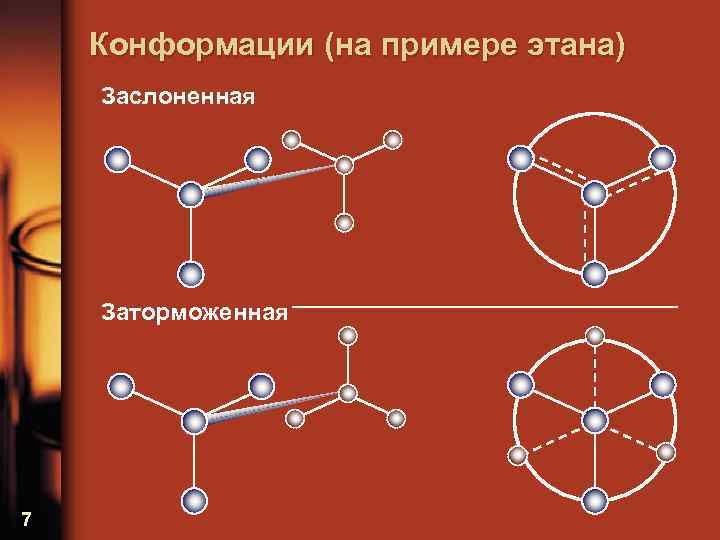
Конформации (на примере этана) Заслоненная Заторможенная 7

Состав AB • Тип Na. Cl – ГЦК упаковка анионов, в которой катионы занимают октаэдрические пустоты (и наоборот) – к. ч. = 6 8
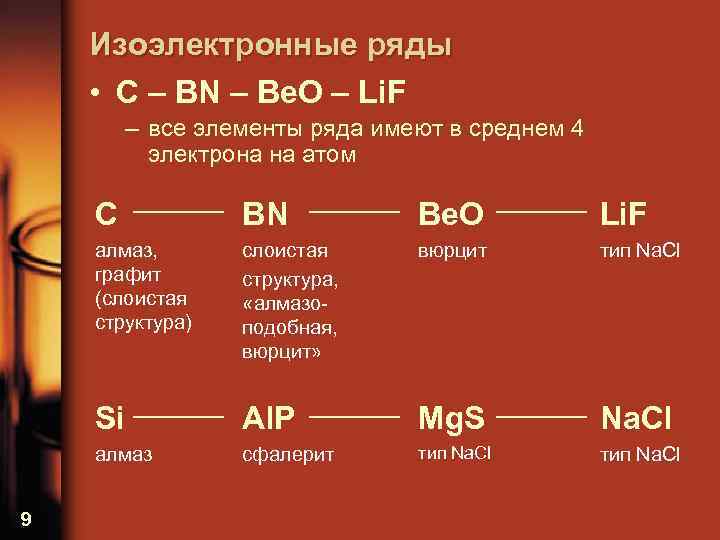
Изоэлектронные ряды • C – BN – Be. O – Li. F – все элементы ряда имеют в среднем 4 электрона на атом C Be. O Li. F алмаз, графит (слоистая структура) слоистая структура, «алмазоподобная, вюрцит» вюрцит тип Na. Cl Si Al. P Mg. S Na. Cl алмаз 9 BN сфалерит тип Na. Cl

Изоэлектронные ряды • В больших периодах Ga. As Zn. Se Cu. Br сфалерит Ge алмаз (Sc. As) структура неизвестна 10 Ca. Se KBr структура Na. Cl

Вертикальное изоэлектронное замещение • по компоненту B Al. P Al. As Al. Sb Zn. Se Zn. Te сфалерит вюрцит сфалерит Pb. Se Pb. Te структура Na. Cl • по компоненту A Al. P Ga. P In. P 11 При вертикальном замещении анионообразователя связи в соединениях становятся менее полярными

Состав AB 2 • Структурный тип Si. O 2 – max к. ч. = 4 – преимущественно ковалентная структура 12
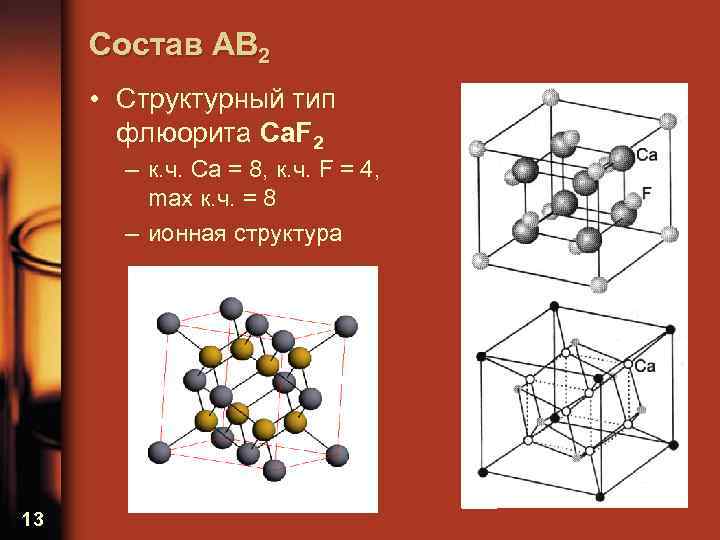
Состав AB 2 • Структурный тип флюорита Ca. F 2 – к. ч. Ca = 8, к. ч. F = 4, max к. ч. = 8 – ионная структура 13
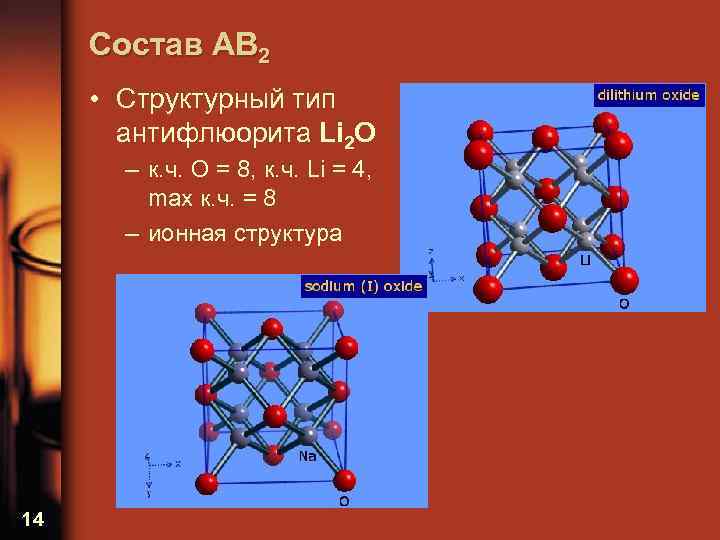
Состав AB 2 • Структурный тип антифлюорита Li 2 O – к. ч. O = 8, к. ч. Li = 4, max к. ч. = 8 – ионная структура 14

Состав AB 2 • Структурный тип рутила Ti. O 2 – к. ч. Ti = 6, к. ч. O = 3, max к. ч. = 6 – Структура более ионная, чем Si. O 2, но менее ионная, чем Ca. F 2 15

Примеры • Be. F 2 изоморфен Si. O 2 • Al. PO 4 изоморфен Si. O 2 • Al. O 2 • PO 2 изоморфен Si. O 2 • Si. O 2 Al – Si – P 16

Правило октета • В таком виде применимо для соединений, содержащих только связи K – A, т. е. подчиняющихся правилу формальной валентности • Для анионоизбыточных фаз, содержащих связи А – А (правило Музера-Пирсона) 17

Обобщенное правило октета (правило Музера-Пирсона) • Cd 3 P 2 • Cd. P 2 (2 + 5· 2)/2 + ba = 8 ba = 2 • Cd. P 4 18 (2· 3 + 5· 2)/2 + ba = 8 ba = 0 (2 + 5· 4)/4 + ba = 8 ba = 2, 5 = 5/2

Иллюстрация структурной неэквивалентности атомов • пропан C 3 H 8 (3· 4 + 1· 8)/3 + ba = 8 ba = 3/4 H H–С–С–С–H H • Ge. As 2 • Ge. As 19 (4 + 5· 2)/2 + ba = 8 ba = 1 (4 + 5)/1 + ba = 8 ba = – 1 (есть связь К – К)

Природа химической связи в бинарных соединениях

• Оба компонента расположены слева от границы Цинтля – Доминирует металлическая связь (исключение – некоторые богатые бором бориды), плотноупакованные структуры • Оба компонента расположены справа от границы Цинтля – Реализуется преимущественно ковалентная связь, неплотноупакованные структуры • Компоненты расположены по разные стороны от границы Цинтля – Наблюдается ионно-ковалентные взаимодействия (исключение – фазы внедрения AB, AB 2 (иногда AB 3) – Ti. B, Ti. C, Ti. N, VB, VN, VC, Ti. H 2, VH 2, AB 1–x, AB 2–x, AB 3–x 21
4 Бинарные соединения.ppt