Bilki_pravleni.ppt
- Количество слайдов: 127

Білки

План лекції 1. Біологічне значення та класифікація білків. 2. Функції білків. 3. Амінокислоти. Класифікація та будова. 4. Фізико-хімічні властивості амінокислот. 5. Рівні структурної організації білкових молекул.

Білки – це нерегулярні біополімери, мономерами яких є α-амінокислоти
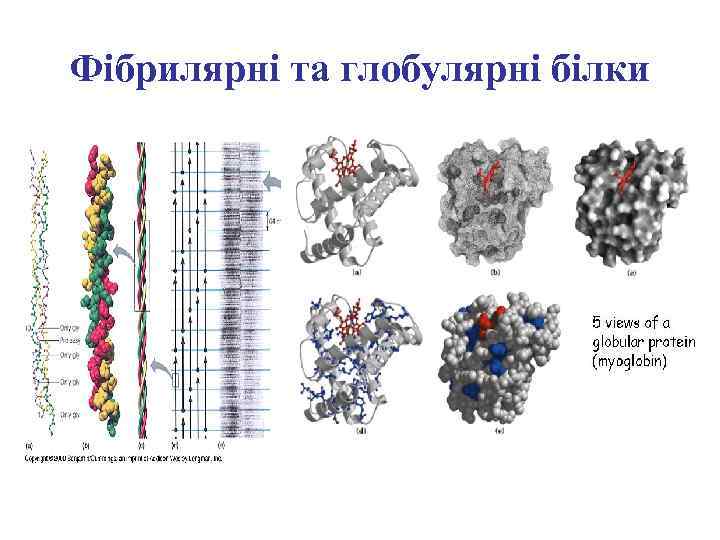
Фібрилярні та глобулярні білки

Прості і складні білки • Простими називаються такі білки, які у результаті гідролізу дають суміш лише амінокислот • Складними називаються такі білки, які після гідролізу дають суміш амінокислот та небілковий компонент: • Вуглеводи – глікопротеїни; • Ліпіди – ліпопротеїни; • Нуклеотиди – нуклеопротеїни; • Пігмент – хромопротеїни; • Метал – металопротеїни.

План лекції 1. Біологічне значення та класифікація білків. 2. Функції білків. 3. Амінокислоти. Класифікація та будова. 4. Фізико-хімічні властивості амінокислот. 5. Рівні структурної організації білкових молекул.

Функції білків 1. 2. 3. 4. 5. 6. 7. Каталітична. Структурна. Рухова. Транспортна. Регуляторна. Захисна. Енергетична.
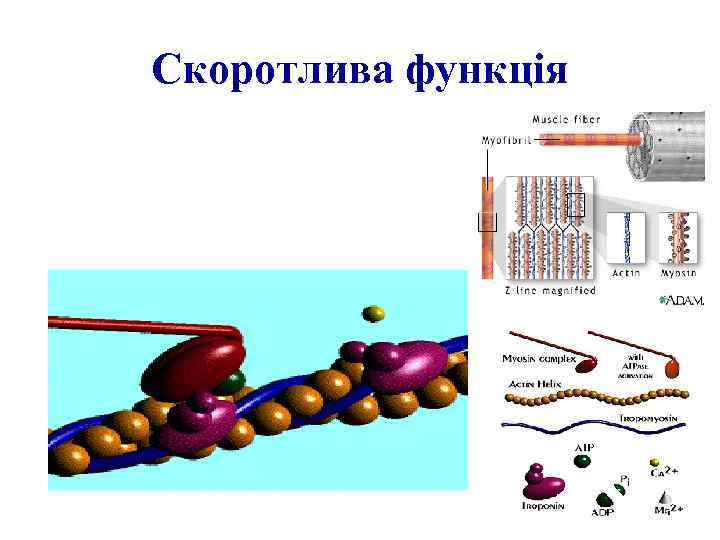
Скоротлива функція

План лекції 1. Біологічне значення та класифікація білків. 2. Функції білків. 3. Амінокислоти. Класифікація та будова. 4. Фізико-хімічні властивості амінокислот. 5. Рівні структурної організації білкових молекул.
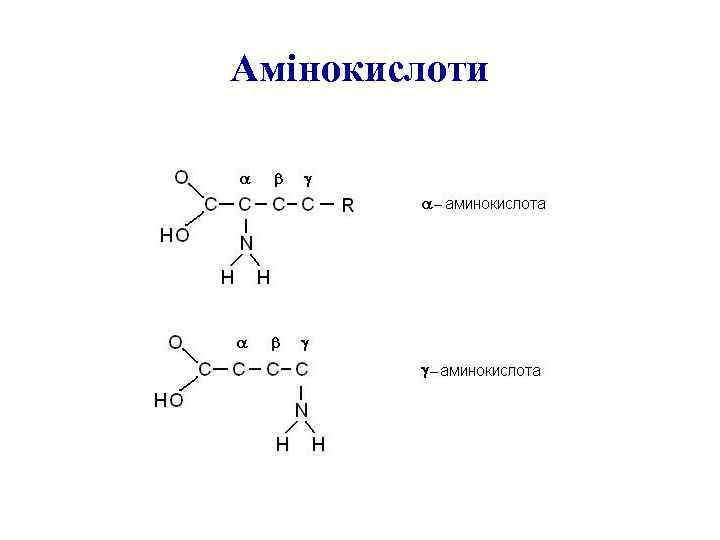
Амінокислоти

Замінимі та незамінимі амінокислоти Амінокислоти можуть бути : незамінні – ті, що не синтезуються у нашому організмі (валін, лейцин, фенілаланін, ізолейцин, метіонін, триптофан, треонін, лізин); частково замінні ( аргінін, гістидин); замінні (аланін, аспарагінова кислота, гліцин, серин, глутамінова кислота, пролін, тирозин, цистеїн)
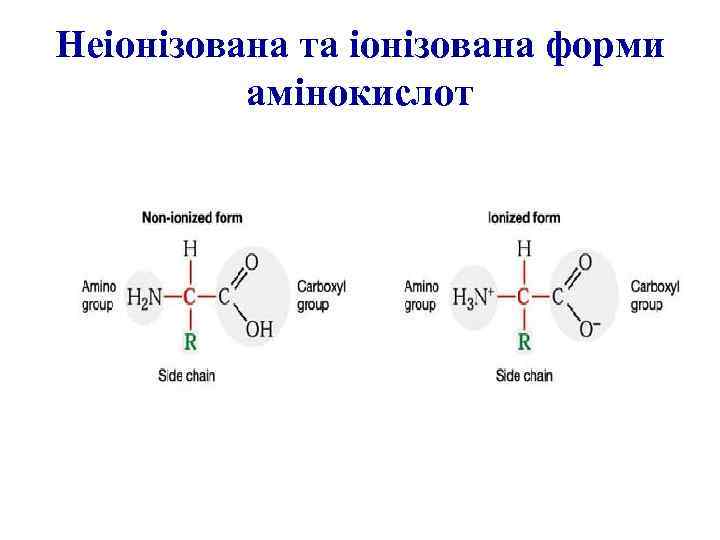
Неіонізована та іонізована форми амінокислот
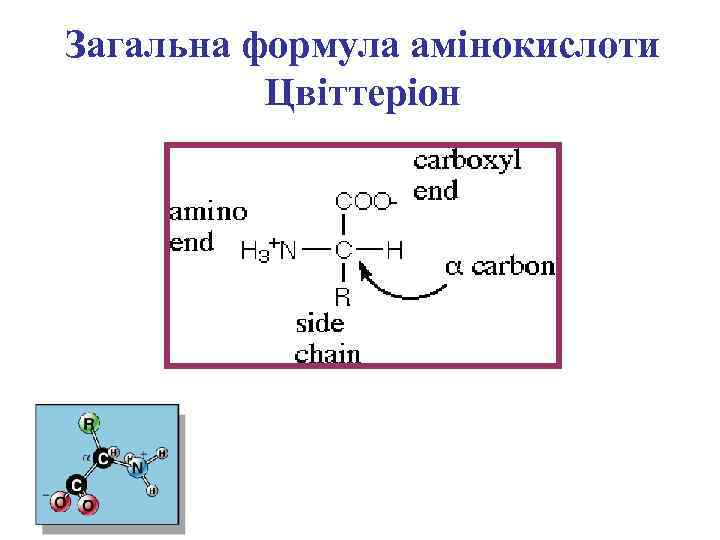
Загальна формула амінокислоти Цвіттеріон
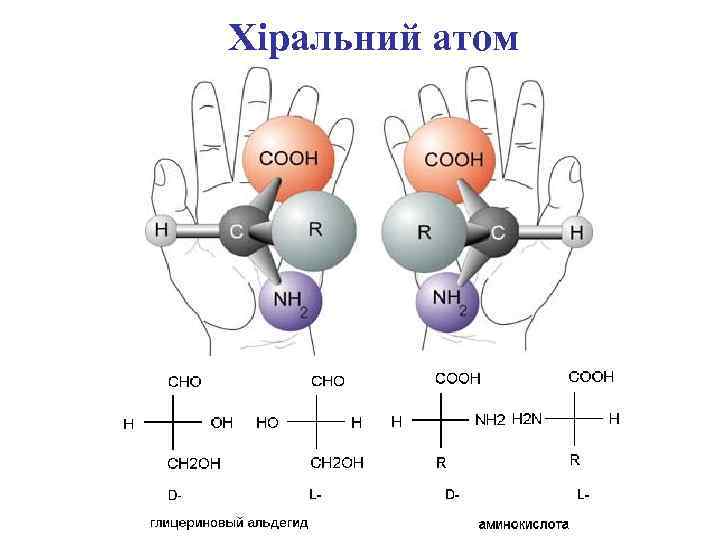
Хіральний атом
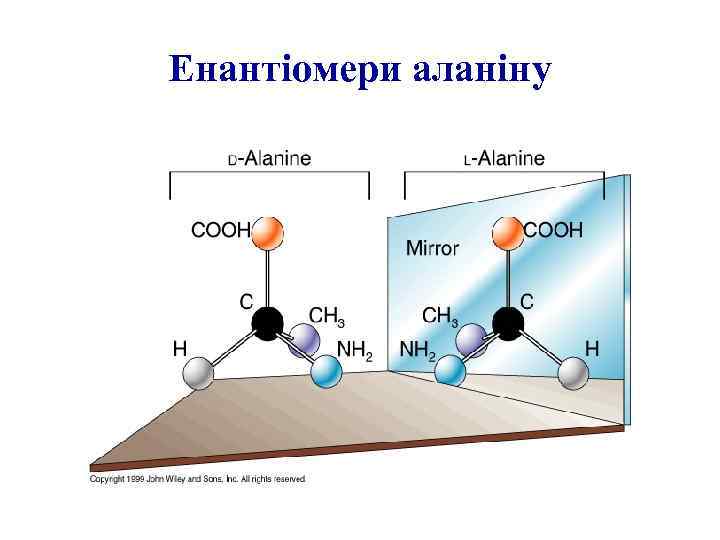
Енантіомери аланіну
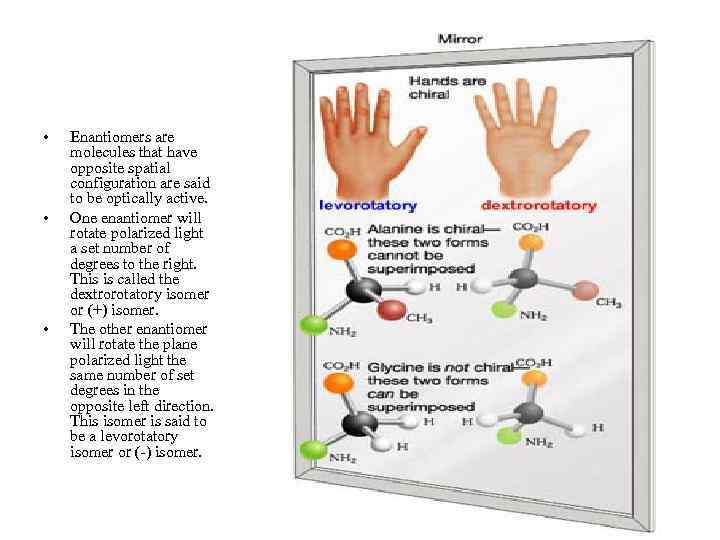
• • • Enantiomers are molecules that have opposite spatial configuration are said to be optically active. One enantiomer will rotate polarized light a set number of degrees to the right. This is called the dextrorotatory isomer or (+) isomer. The other enantiomer will rotate the plane polarized light the same number of set degrees in the opposite left direction. This isomer is said to be a levorotatory isomer or (-) isomer.




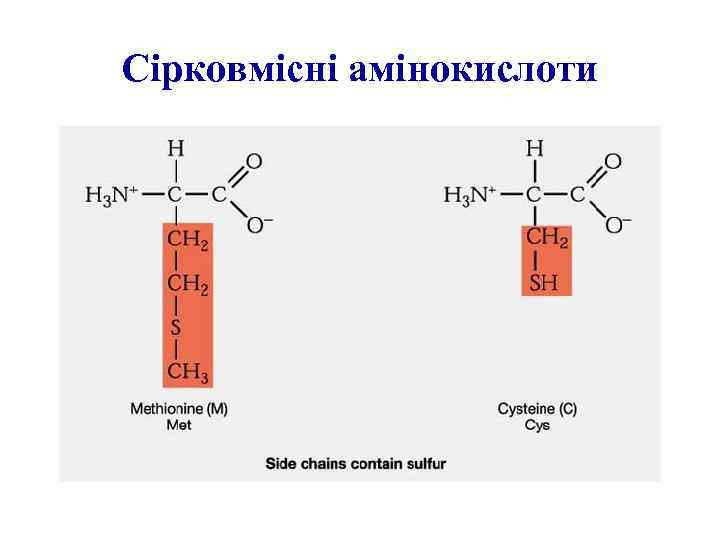
Сірковмісні амінокислоти

План лекції 1. Біологічне значення та класифікація білків. 2. Функції білків. 3. Амінокислоти. Класифікація та будова. 4. Фізико-хімічні властивості амінокислот. 5. Рівні структурної організації білкових молекул.

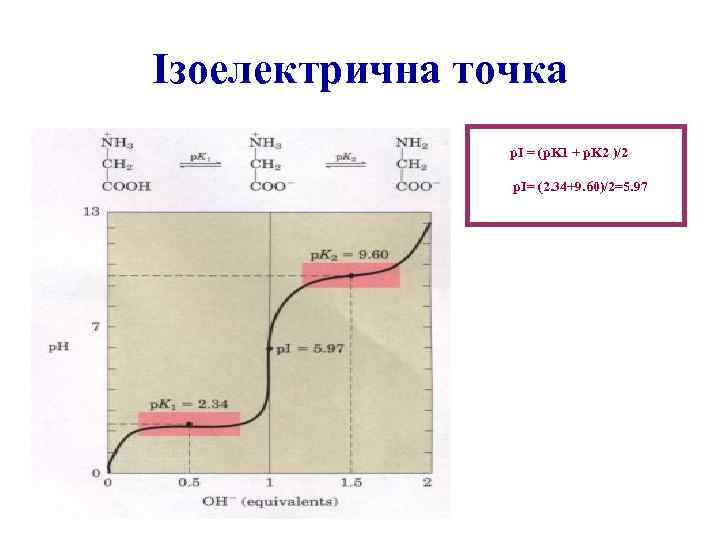
Ізоелектрична точка p. I = (p. K 1 + p. K 2 )/2 p. I= (2. 34+9. 60)/2=5. 97

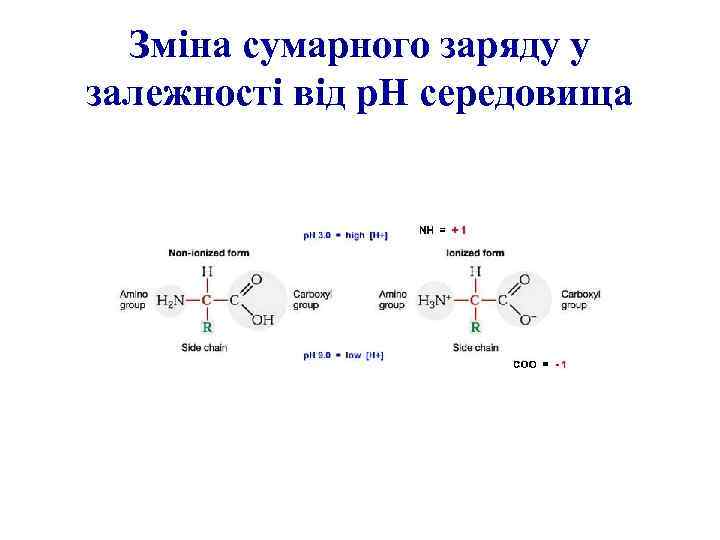
Зміна сумарного заряду у залежності від р. Н середовища

План лекції 1. Біологічне значення та класифікація білків. 2. Функції білків. 3. Амінокислоти. Класифікація та будова. 4. Фізико-хімічні властивості амінокислот. 5. Рівні структурної організації білкових молекул.
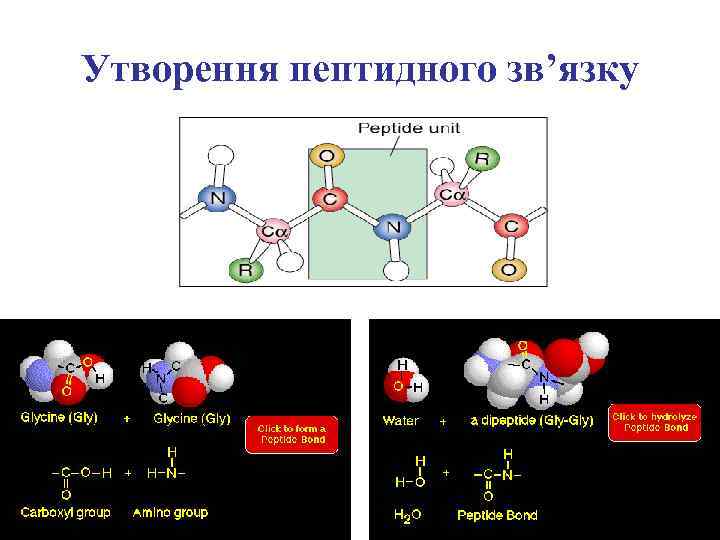
Утворення пептидного зв’язку
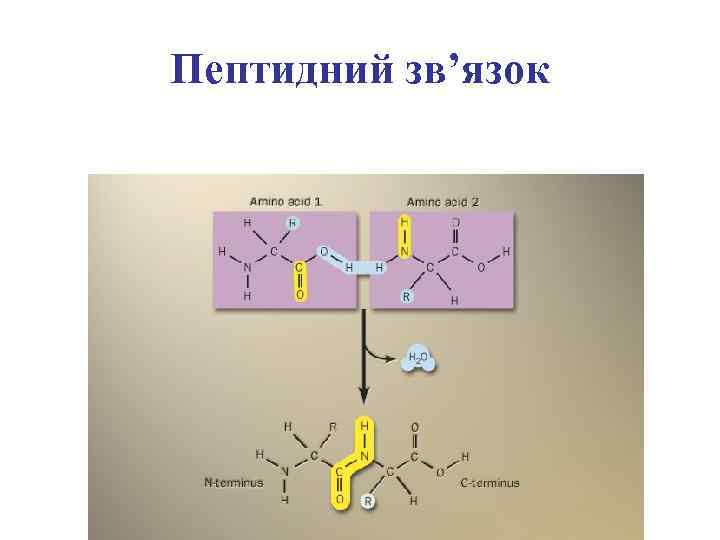
Пептидний зв’язок
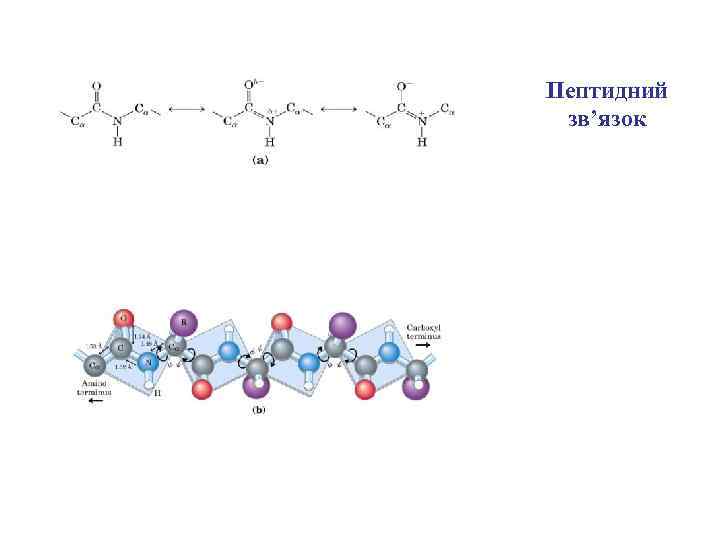
Пептидний зв’язок
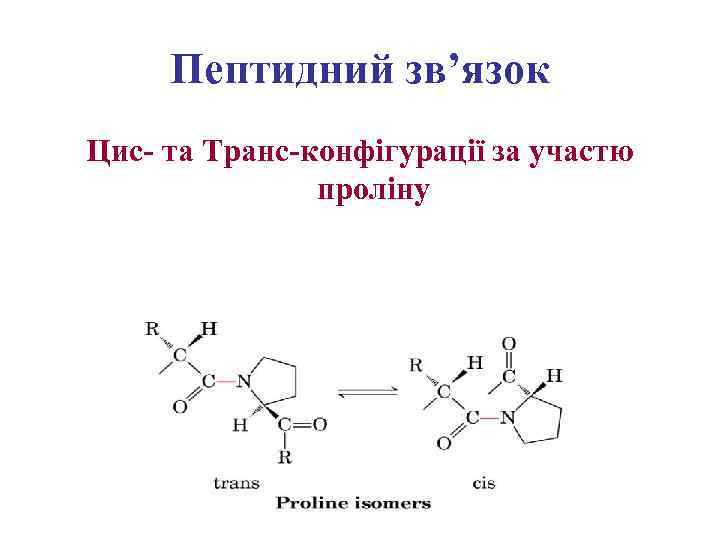
Пептидний зв’язок Цис- та Транс-конфігурації за участю проліну
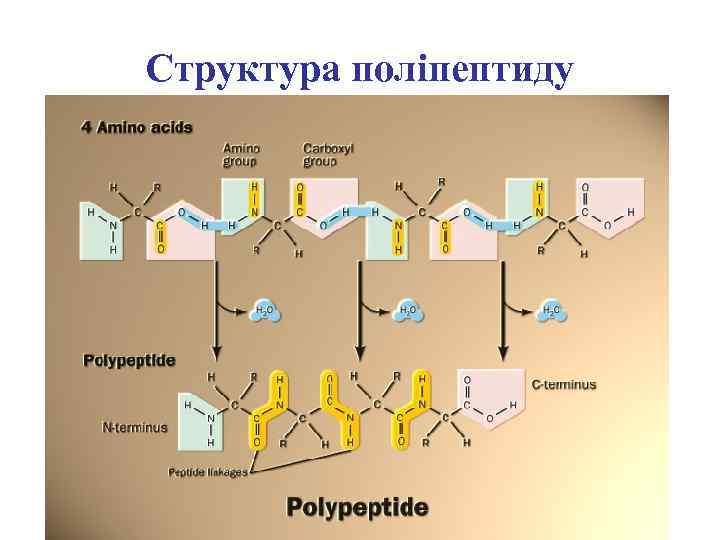
Структура поліпептиду

Систематична назва
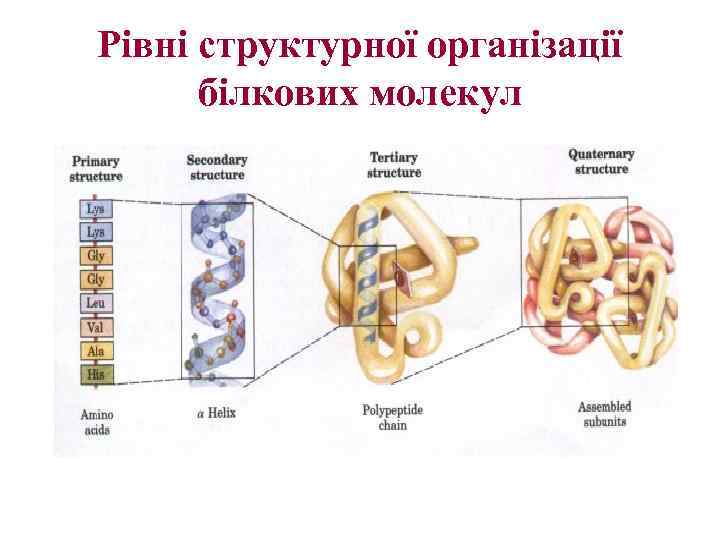
Рівні структурної організації білкових молекул
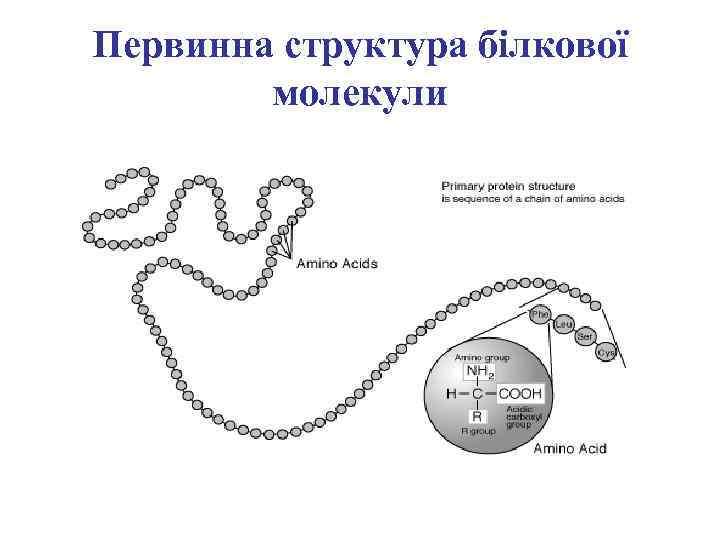
Первинна структура білкової молекули
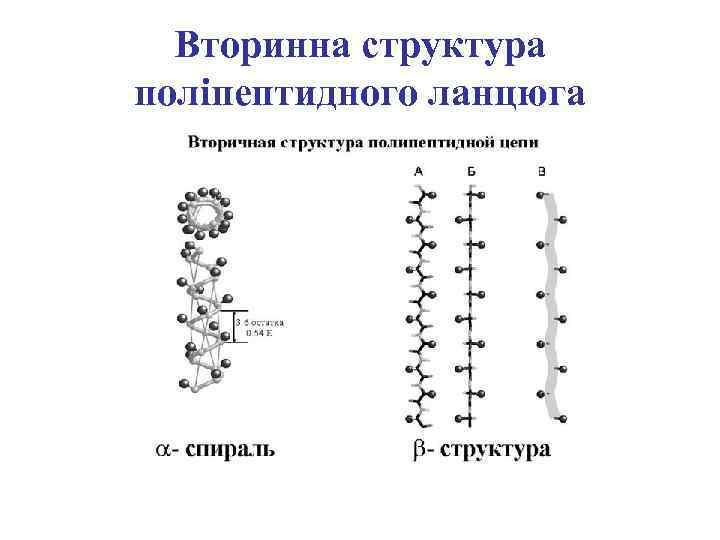
Вторинна структура поліпептидного ланцюга
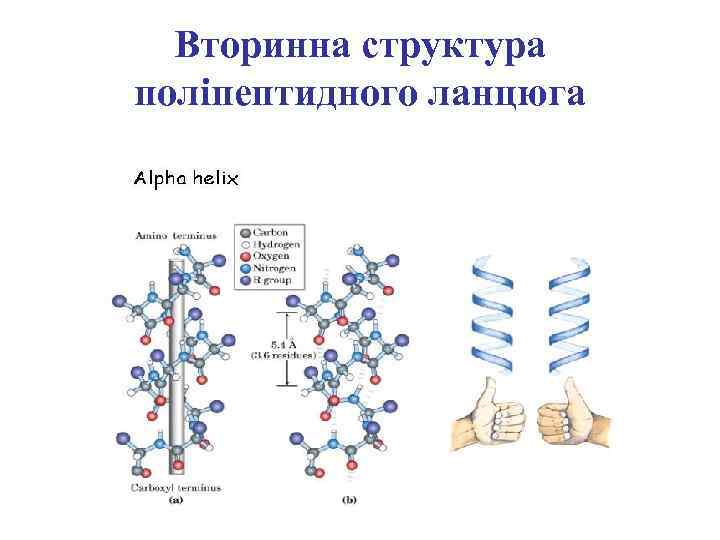
Вторинна структура поліпептидного ланцюга
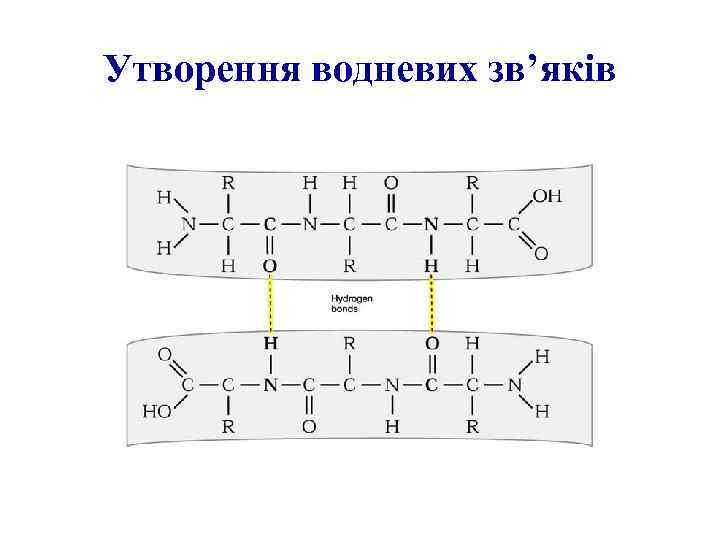
Утворення водневих зв’яків
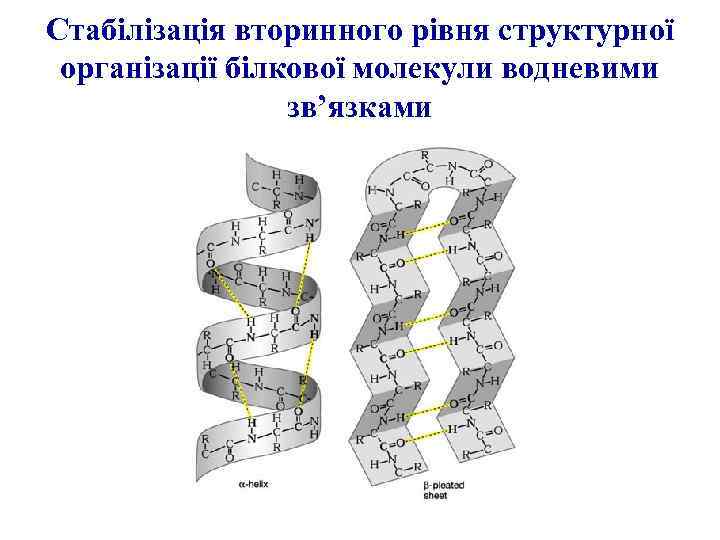
Стабілізація вторинного рівня структурної організації білкової молекули водневими зв’язками
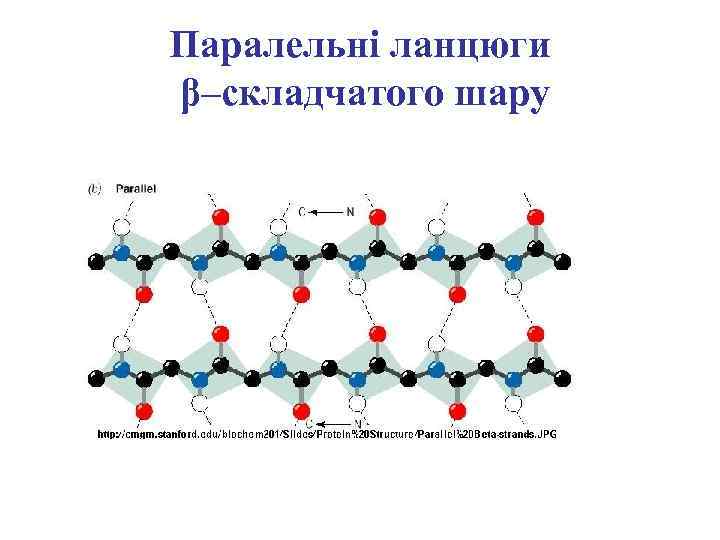
Паралельні ланцюги β–складчатого шару
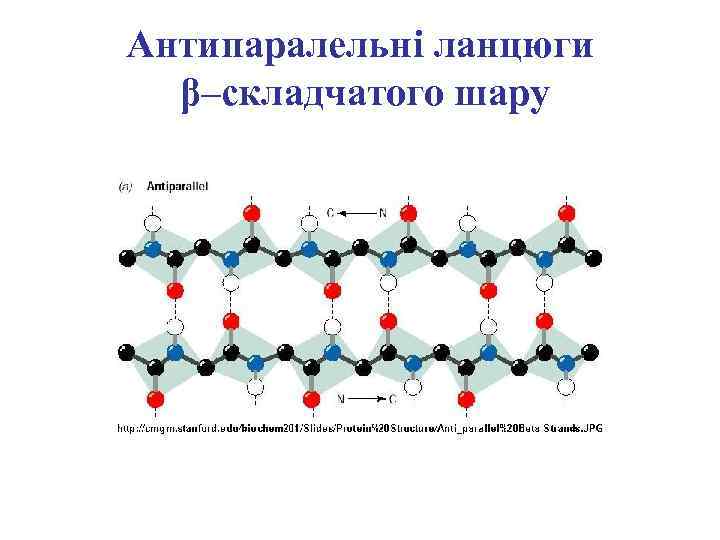
Антипаралельні ланцюги β–складчатого шару
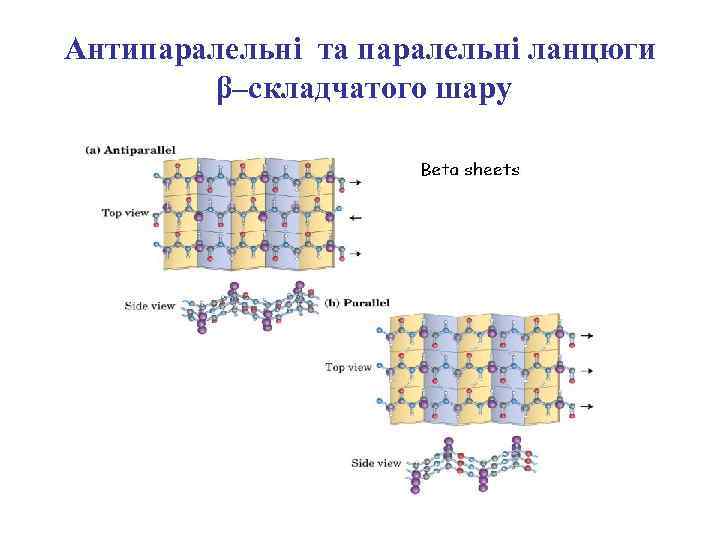
Антипаралельні та паралельні ланцюги β–складчатого шару
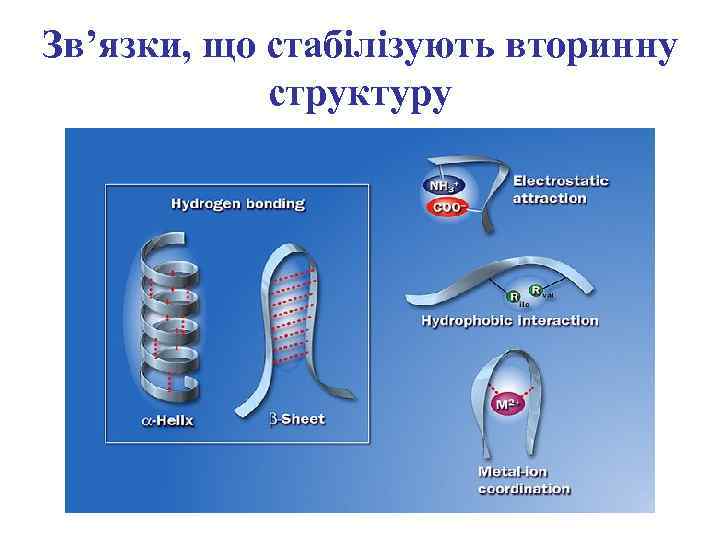
Зв’язки, що стабілізують вторинну структуру
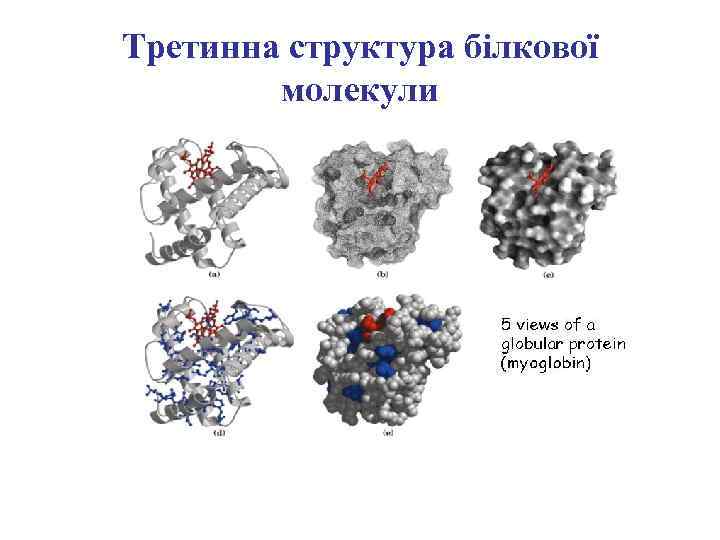
Третинна структура білкової молекули
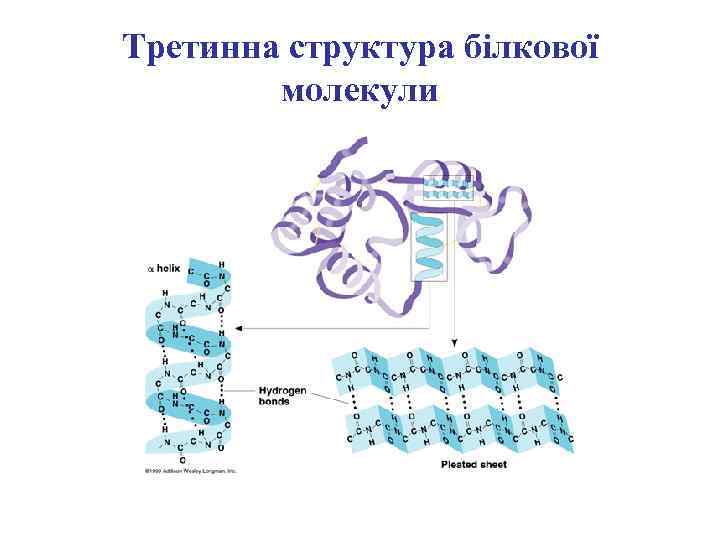
Третинна структура білкової молекули

Дисульфідні зв’язки стабілізують третинну структуру
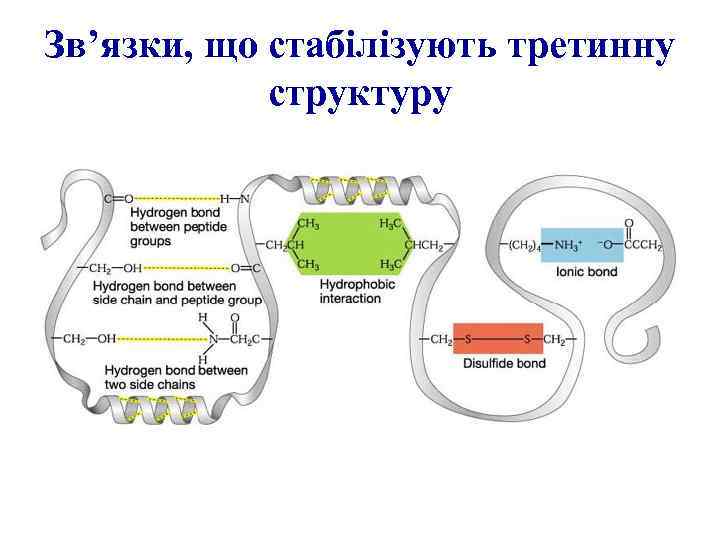
Зв’язки, що стабілізують третинну структуру

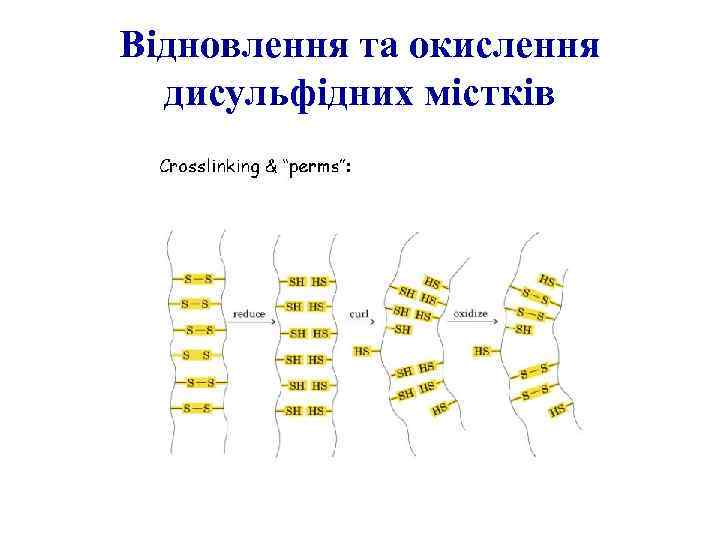
Відновлення та окислення дисульфідних містків
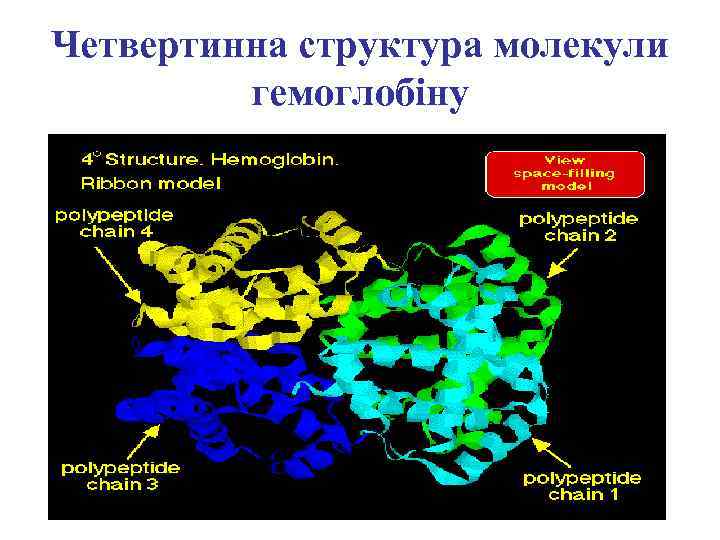
Четвертинна структура молекули гемоглобіну

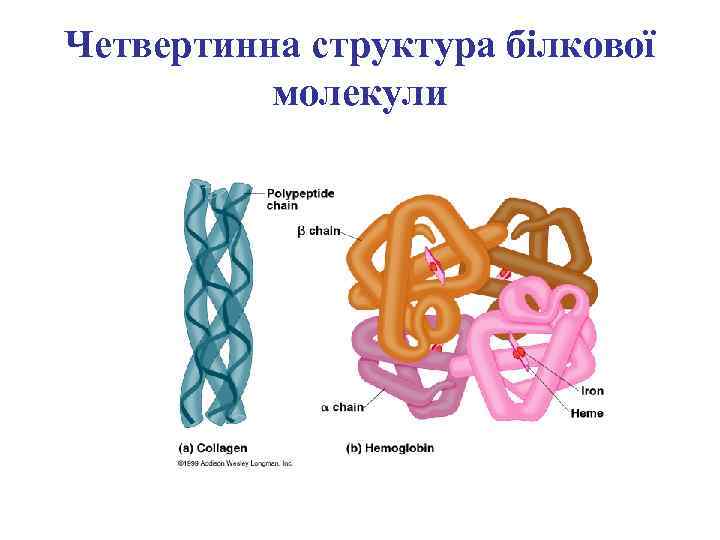
Четвертинна структура білкової молекули
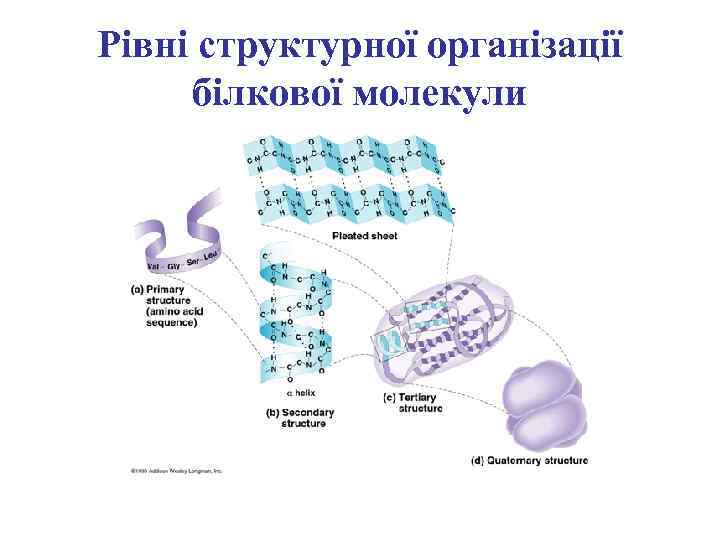
Рівні структурної організації білкової молекули











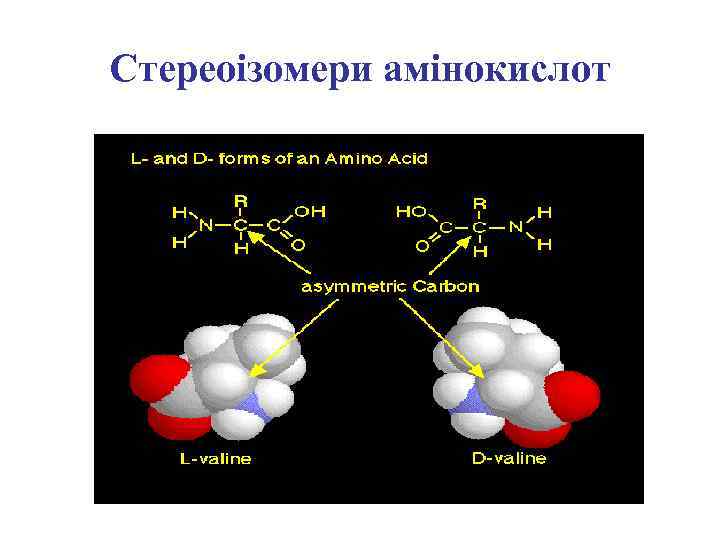
Стереоізомери амінокислот
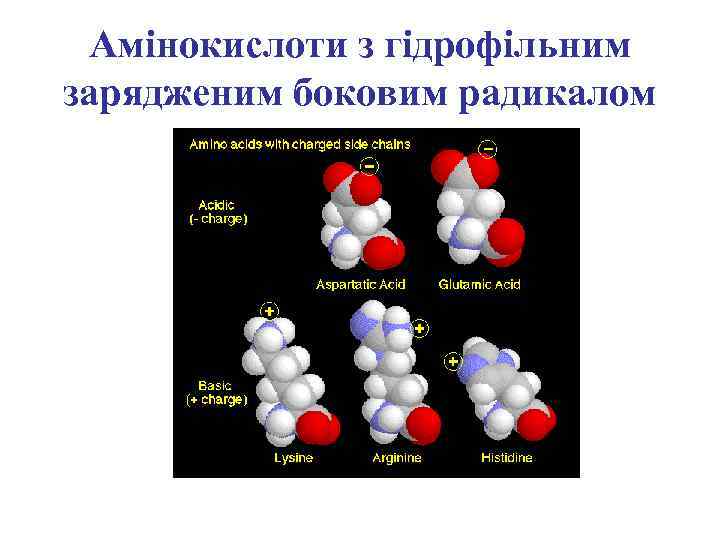
Амінокислоти з гідрофільним зарядженим боковим радикалом

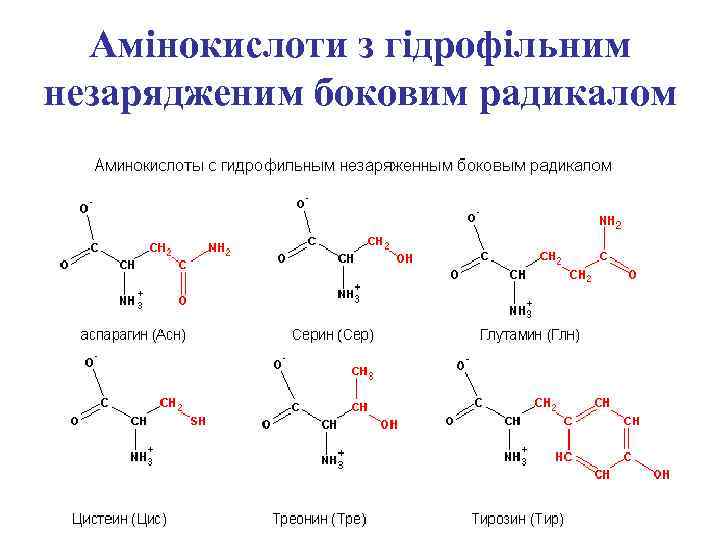
Амінокислоти з гідрофільним незарядженим боковим радикалом
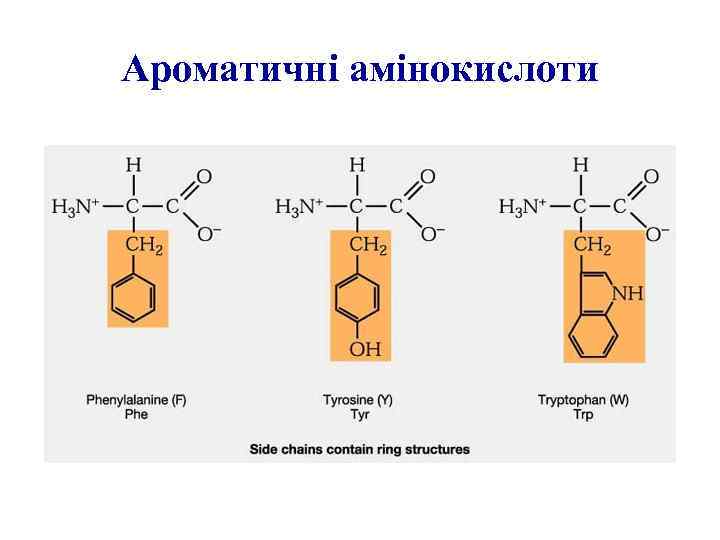
Ароматичні амінокислоти
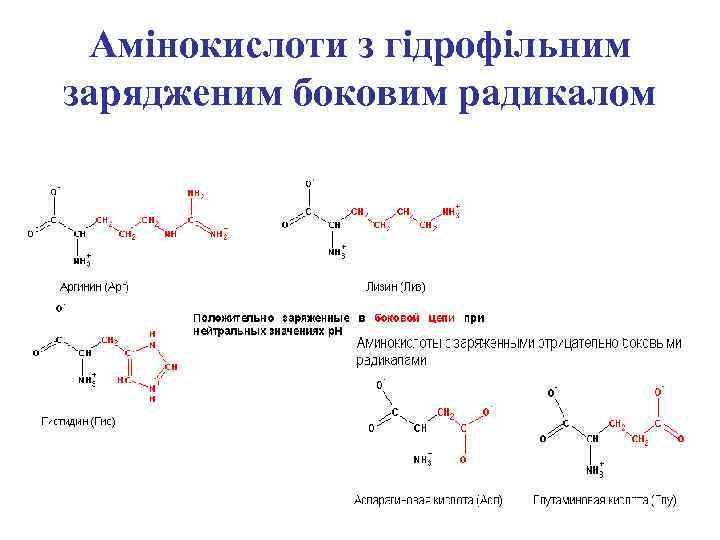
Амінокислоти з гідрофільним зарядженим боковим радикалом

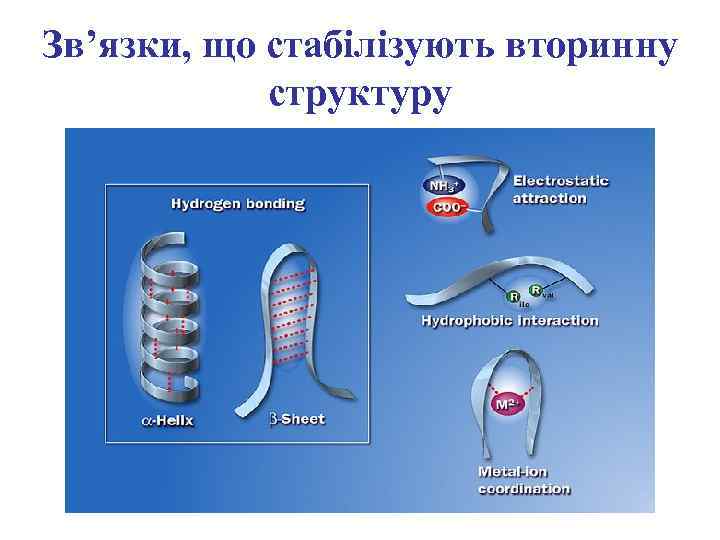
Зв’язки, що стабілізують вторинну структуру
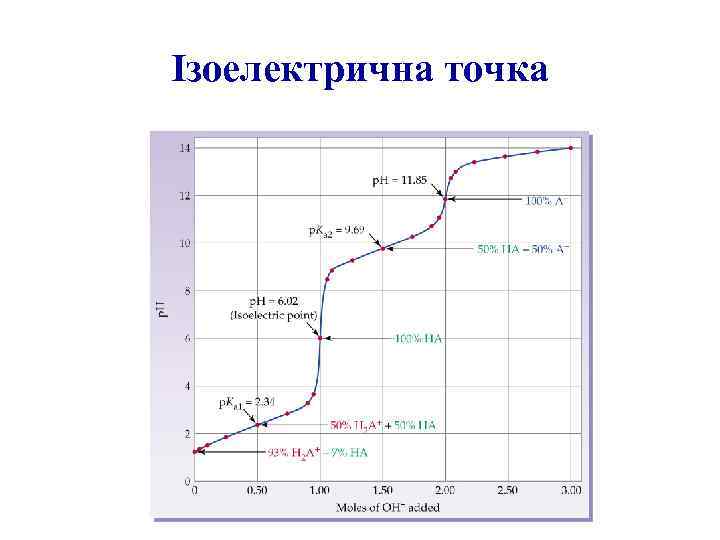
Ізоелектрична точка






















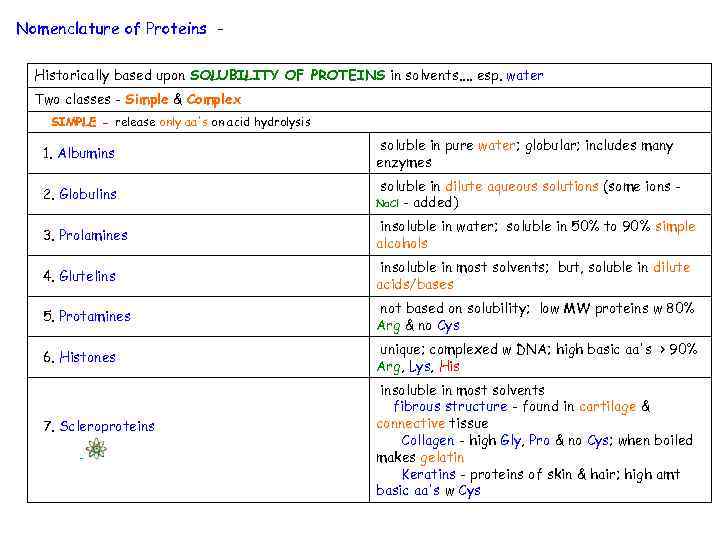
Nomenclature of Proteins - Historically based upon SOLUBILITY OF PROTEINS in solvents. . esp. water Two classes - Simple & Complex SIMPLE - release only aa's on acid hydrolysis 1. Albumins soluble in pure water; globular; includes many enzymes 2. Globulins soluble in dilute aqueous solutions (some ions Na. Cl - added) 3. Prolamines insoluble in water; soluble in 50% to 90% simple alcohols 4. Glutelins insoluble in most solvents; but, soluble in dilute acids/bases 5. Protamines not based on solubility; low MW proteins w 80% Arg & no Cys 6. Histones unique; complexed w DNA; high basic aa's > 90% Arg, Lys, His 7. Scleroproteins insoluble in most solvents fibrous structure - found in cartilage & connective tissue Collagen - high Gly, Pro & no Cys; when boiled makes gelatin Keratins - proteins of skin & hair; high amt basic aa's w Cys

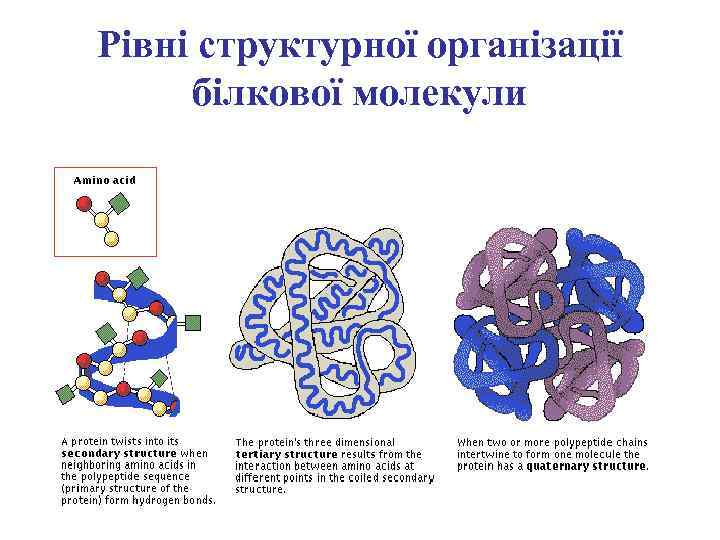
Рівні структурної організації білкової молекули








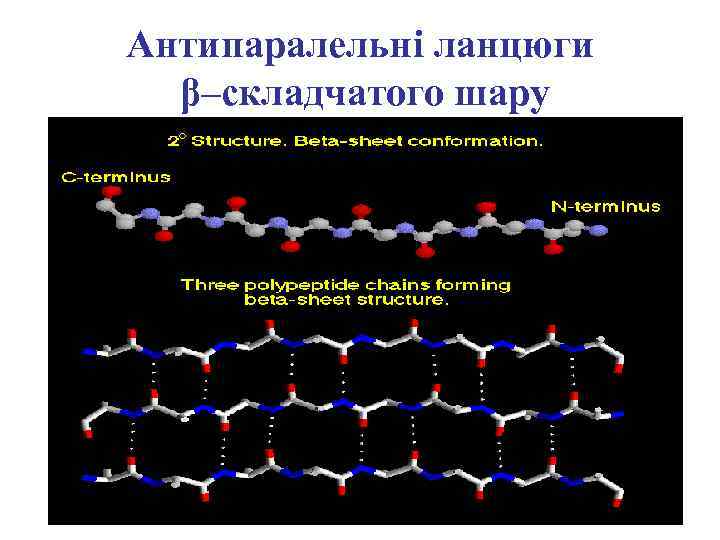
Антипаралельні ланцюги β–складчатого шару


Четвертинна структура білкової молекули



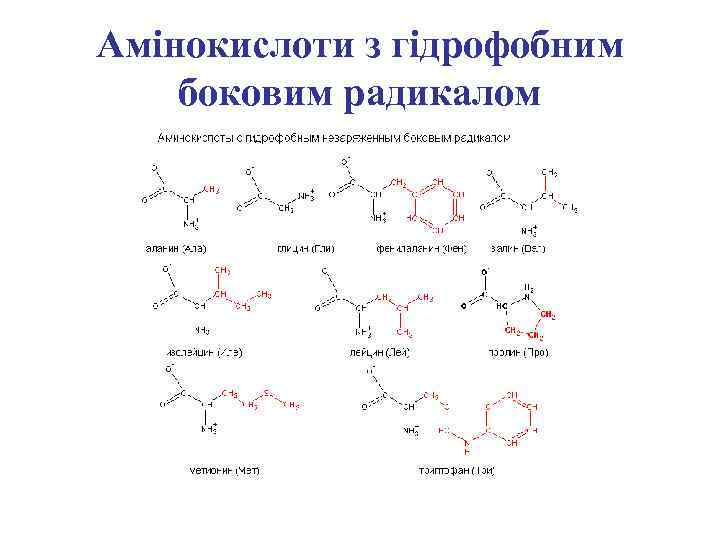
Амінокислоти з гідрофобним боковим радикалом














Bilki_pravleni.ppt