Лекция 3 Комплексы+эдс.pptx
- Количество слайдов: 30
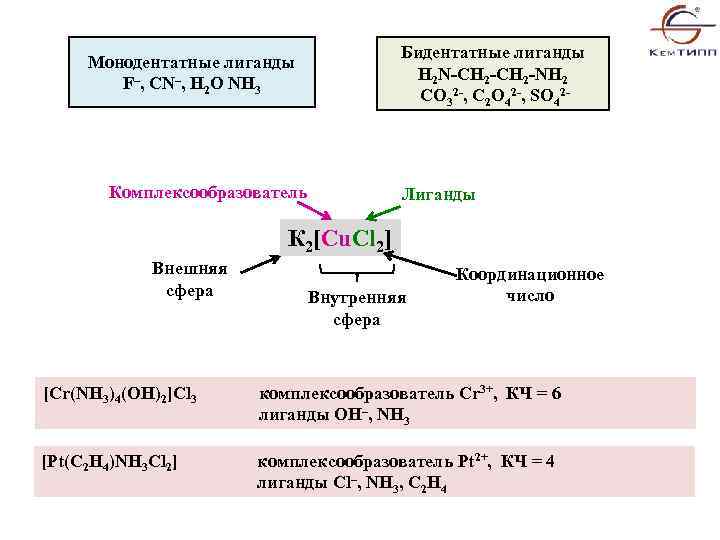
Бидентатные лиганды H 2 N-CH 2 -NH 2 222 СО 3 , С 2 O 4 , SO 4 Монодентатные лиганды F–, CN–, H 2 O NH 3 Комплексообразователь Лиганды К 2[Cu. Cl 2] Внешняя сфера Внутренняя cфера Координационное число [Cr(NH 3)4(OH)2]Cl 3 комплексообразователь Cr 3+, КЧ = 6 лиганды OH–, NH 3 [Pt(C 2 H 4)NH 3 Cl 2] комплексообразователь Pt 2+, КЧ = 4 лиганды Cl–, NH 3, C 2 H 4

Окислительно-восстановительные потенциалы Pt | Fe 3+, Fe 2+ Fe 3+ + ē ⇆ Fe 2+ Между платиновой пластинкой и раствором возникает потенциал, который называют окислительно-восстановительным потенциалом (ОВП) Pt | Fe 3+, Fe 2+ ‖ H+ | H 2, Pt Если активности окисленной (Fe 3+) и восстановленной Fe 2+ форм равны единице, то величина ОВП называется стандартным окислительно-восстановительным потенциалом ( ) при T=298 K табулированы ОВП в реальных условиях (отличающихся от стандартных) может быть рассчитан по уравнению Нернста В предельно разбавленных растворах (а ≈ С) и t=25ºC

Номенклатура комплексных соединений Первым в именительном падеже называют анионы, а затем в родительном падеже – катионы В названии внутренней координационной сферы в русской химической литературе принято перечислять сначала лиганды – анионные, нейтральные и катионные, затем комплексообразователь с указанием его степени окисления. Число лигандов обозначают греческими числительными: ди-, тетра-, гекса-, пента и т. д. – Отрицательные лиганды называют добавляя к их латинскому названию окончания – о. F– – фторо, СN– – циано и т. д. – Нейтральные лиганды называют, как и соответствующие молекулы. (исключение Н 2 О – аква, NH 3 – аммин, СО – карбонил, NO – нитрозил). – Положительные лиганды называют добавляя к их названию окончание – ий (N 2 H 5+ – гидрозиний). – Комплексообразователь. Если входит в состав комплексного катиона – русское название в родительном падеже и в скобках римскими цифрами степень его окисления. Если входит в состав комплексного аниона – латинское название с окончанием – ат. Если координационная сфера имеет нулевой заряд, комплексообразователь называют по-русски в именительном падеже.
![Примеры Формулы комплексных соединений читают справа налево Катионные комплексы [Cu(NH 3)4]Cl 2 – хлорид Примеры Формулы комплексных соединений читают справа налево Катионные комплексы [Cu(NH 3)4]Cl 2 – хлорид](https://present5.com/presentation/-76660488_365635579/image-4.jpg)
Примеры Формулы комплексных соединений читают справа налево Катионные комплексы [Cu(NH 3)4]Cl 2 – хлорид тетраамминмеди(II) [Pt(H 2 О)(NH 3)2 OH]NO 3 – нитрат гидроксодиамминакваплатины (II) Анионные комплексы NH 4[Cr(NH 3)2(CN)4] – тетрацианодиамминхромат(III) аммония K 3[Fe(SCN)6] - гексатиоцианато феррат(III) калия Нейтральные комплексы [Pt(NH 3)Br 2] – дибромодиамминплатина [Pt. H 2 O(C 6 H 5 N)2(OH)3] – тригидроксодипиридинакваплатина [Pd(NH 3)4][Pd. Cl 6]

Электрохимические процессы – процессы, протекающие в ионных системах (растворах, расплавах, твёрдых электролитах), а также на границе двух фаз с участием заряженных частиц (ионов и электронов) Окислительно-восстановительные реакции (ОВР) Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих частиц, называют окислительно-восстановительными Степень окисления – условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов. Многие элементы имеют несколько значений степени окисления: -1 (HCl), +1 (HCl. O), +3 (HCl. O 2), +5 (HCl. O 3), +7 (HCl. O 4) В ходе ОВР атомы окислителя, принимая электроны, уменьшают свою степень окисления, т. е. восстанавливаются Атомы восстановителя отдают электроны, увеличивают свою степень окисления, т. е. окисляются
![Аквакомплексы [Cr(H 2 O)6]Cl 3 [Co(H 2 O)6]Cl 3 Кристаллогидраты Cu. SO 4 ∙ Аквакомплексы [Cr(H 2 O)6]Cl 3 [Co(H 2 O)6]Cl 3 Кристаллогидраты Cu. SO 4 ∙](https://present5.com/presentation/-76660488_365635579/image-6.jpg)
Аквакомплексы [Cr(H 2 O)6]Cl 3 [Co(H 2 O)6]Cl 3 Кристаллогидраты Cu. SO 4 ∙ 5 H 2 O, Na 2 CO 3 ∙ 10 H 2 O Амминокомплексы [Ag(NH 3)2]Cl [Cu(NH 3)2]NO 3 [Co(CO)6] [Fe(CO)5] Карбонилы [Ti(CO)7] [(CO)5 – Mn – (CO)5] – многоядерное соединение в котором хим. связи между атомами переходных металлов ( КЛАСТЕРЫ ) Гидроксокомплексы Na 3[Co(OH)6] K 2[Zn(OH)4] Ацидокомплексы K 2[Pt. Cl 6] K 3[Fe(CN)6] Комплексы смешанного типа [Co(NH 3)4 Cl 2]Cl [Pt(H 2 O)(NH 3)4]Cl 4
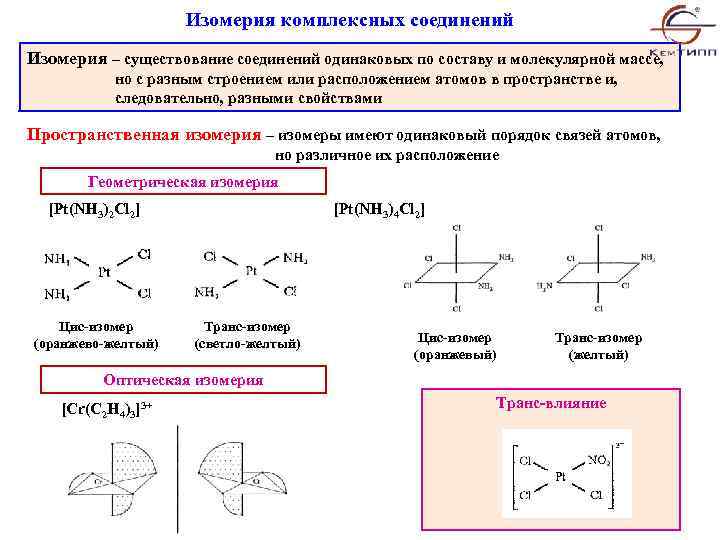
Изомерия комплексных соединений Изомерия – существование соединений одинаковых по составу и молекулярной массе, но с разным строением или расположением атомов в пространстве и, следовательно, разными свойствами Пространственная изомерия – изомеры имеют одинаковый порядок связей атомов, но различное их расположение Геометрическая изомерия [Pt(NH 3)2 Cl 2] Цис-изомер (оранжево-желтый) [Pt(NH 3)4 Cl 2] Транс-изомер (светло-желтый) Цис-изомер (оранжевый) Транс-изомер (желтый) Оптическая изомерия [Cr(C 2 H 4)3]3+ Транс-влияние
![Равновесие в растворах комплексных соединений [Ag(NH 3)2]Cl Первичная диссоциация [Ag(NH 3)2]Cl → [Ag(NH 3)2]+ Равновесие в растворах комплексных соединений [Ag(NH 3)2]Cl Первичная диссоциация [Ag(NH 3)2]Cl → [Ag(NH 3)2]+](https://present5.com/presentation/-76660488_365635579/image-8.jpg)
Равновесие в растворах комплексных соединений [Ag(NH 3)2]Cl Первичная диссоциация [Ag(NH 3)2]Cl → [Ag(NH 3)2]+ + Cl– Вторичная диссоциация [Ag(NH 3)2]+ + Н 2 О [Ag. H 2 ONH 3]+ + NH 3 [Ag. H 2 ONH 3]+ + Н 2 О [Ag(H 2 O)2]+ + NH 3 В упрощенном виде [Ag(NH 3)2]+ [Ag. NH 3]+ + NH 3 [Ag. NH 3]+ Ag+ + NH 3 Общая константа нестойкости

Электродные потенциалы Электрод – система, из двух контактирующих фаз: вещества с электронной проводимостью (металл или полупроводник) и ионного проводника (расплав, раствор электролита, твердый электролит) Me(т) + m. H 2 O ↔ Men+(ж) + m. H 2 O + nē При погружении металлической пластины в раствор соли этого металла Если C(Men+) незначительна, то равновесие сместится влево, и пластина будет заряжаться отрицательно, но в меньшей степени чем в чистой воде. Если C(Men+) будет достаточно большой, то ионы Men+ будут осаждаться на пластине и ее заряд будет положительным Можно подобрать точную C(Men+) так, что пластина заряжаться не будет
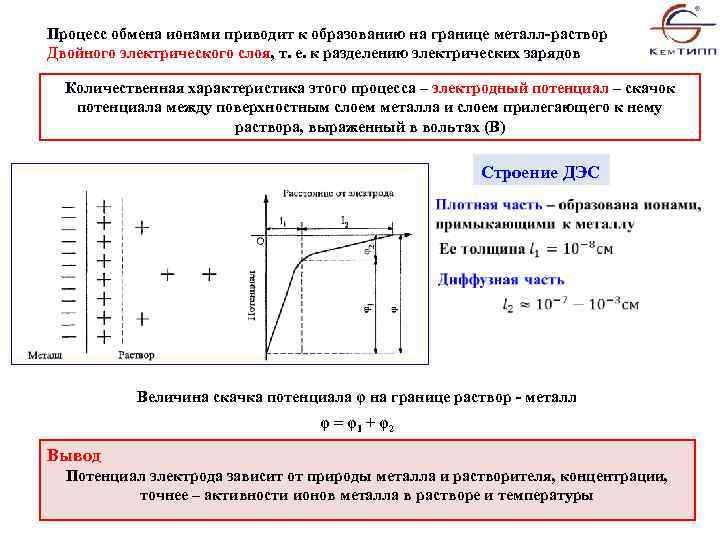
Процесс обмена ионами приводит к образованию на границе металл-раствор Двойного электрического слоя, т. е. к разделению электрических зарядов Количественная характеристика этого процесса – электродный потенциал – скачок потенциала между поверхностным слоем металла и слоем прилегающего к нему раствора, выраженный в вольтах (В) Строение ДЭС Величина скачка потенциала φ на границе раствор - металл φ = φ1 + φ2 Вывод Потенциал электрода зависит от природы металла и растворителя, концентрации, точнее – активности ионов металла в растворе и температуры
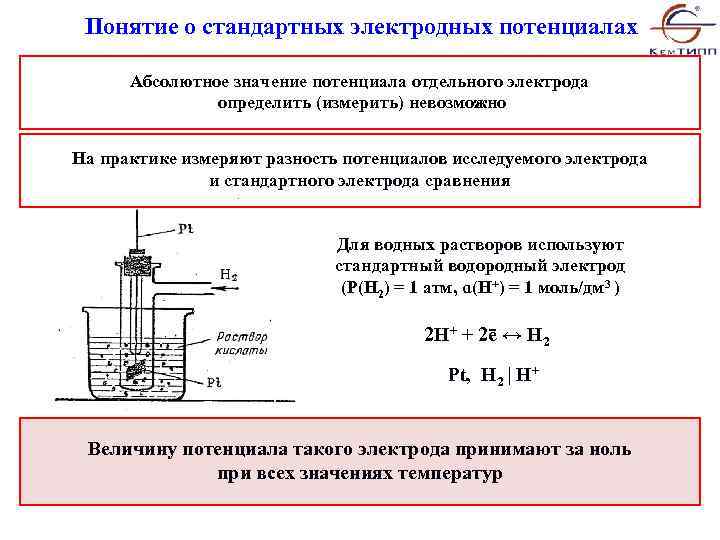
Понятие о стандартных электродных потенциалах Абсолютное значение потенциала отдельного электрода определить (измерить) невозможно На практике измеряют разность потенциалов исследуемого электрода и стандартного электрода сравнения Для водных растворов используют стандартный водородный электрод (P(H 2) = 1 атм, ɑ(H+) = 1 моль/дм 3 ) 2 H+ + 2ē ↔ H 2 Pt, H 2 | H+ Величину потенциала такого электрода принимают за ноль при всех значениях температур

Относительный электродный потенциал равен ЭДС (E) цепи, составленной из исследуемого электрода и стандартного водородного электрода, соединенных электролитическим мостиком (-)Zn|Zn. SO 4||H 2 SO 4|H 2, Pt(+) Zn + 2 H+ = Zn 2+ + H 2 Ряд стандартных электродных потенциалов Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Ag, Pd, Pt, Au Чем левее в ряду напряжений находится металл, тем он химически активнее, тем легче окисляется и труднее восстанавливается из своих ионов Помнить

Электроды сравнения Хлорсеребряный электрод Ag, Ag. Cl | HCl Ag. Cl + ē ⇆ Ag + Cl¯ Уравнение Нернста В условиях отличных от стандартных EMe можно рассчитать по уравнению Нернста R = 8, 314 Дж/моль·K, F = 96485 Кл/моль при T = 298 K Предельно разбавленный раствор
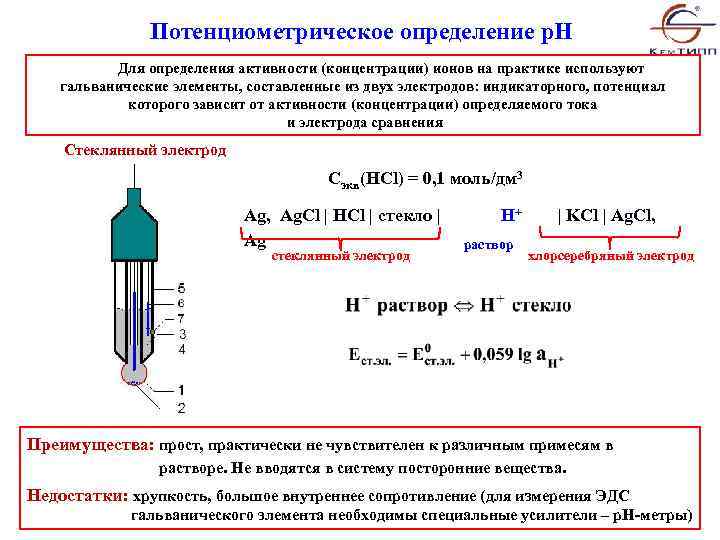
Потенциометрическое определение p. H Для определения активности (концентрации) ионов на практике используют гальванические элементы, составленные из двух электродов: индикаторного, потенциал которого зависит от активности (концентрации) определяемого тока и электрода сравнения Стеклянный электрод Cэкв(HCl) = 0, 1 моль/дм 3 Ag, Ag. Cl | HCl | стекло | Ag стеклянный электрод H+ | KCl | Ag. Cl, раствор хлорсеребряный электрод Преимущества: прост, практически не чувствителен к различным примесям в растворе. Не вводятся в систему посторонние вещества. Недостатки: хрупкость, большое внутреннее сопротивление (для измерения ЭДС гальванического элемента необходимы специальные усилители – p. H-метры)
![Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+ Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+](https://present5.com/presentation/-76660488_365635579/image-15.jpg)
Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+ + 2 H 2 O Ag+ + 2 NH 3 [Ag(NH 3)2]+ ΔG < 0 ΔG 0 = –RTln. К уст –RTln. Kуст = ΔH 0 – TΔS 0
![Разрушение комплексных соединений [Ag(NH 3)2]Cl, K 2 S 2[Ag(NH 3)2]+ + S 2– → Разрушение комплексных соединений [Ag(NH 3)2]Cl, K 2 S 2[Ag(NH 3)2]+ + S 2– →](https://present5.com/presentation/-76660488_365635579/image-16.jpg)
Разрушение комплексных соединений [Ag(NH 3)2]Cl, K 2 S 2[Ag(NH 3)2]+ + S 2– → Ag 2 S↓ + 4 NH 3 Kнест = 5, 7 ∙ 10– 8 Пр = 6. 3 ∙ 10– 50 [Ag(NH 3)2]Cl, KCN [Ag(NH 3)2]+ + 2 CN- [Ag(CN)2]– + 2 NH 3 Kнест = 1, 4 ∙ 10– 20
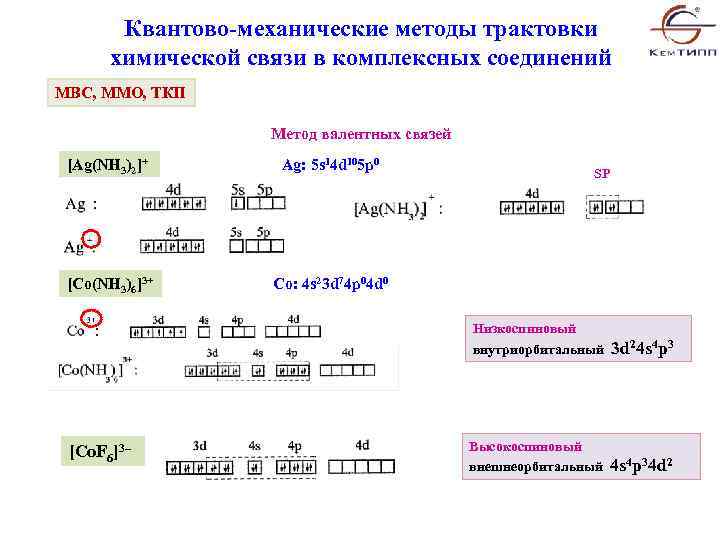
Квантово-механические методы трактовки химической связи в комплексных соединений МВС, ММО, ТКП Метод валентных связей [Ag(NH 3)2]+ Ag: 5 s 14 d 105 p 0 [Co(NH 3)6]3+ Co: 4 s 23 d 74 p 04 d 0 SP Низкоспиновый внутриорбитальный 3 d 24 s 4 p 3 [Co. F 6]3– Высокоспиновый внешнеорбитальный 4 s 4 p 34 d 2

Окислительно-восстановительные потенциалы Pt | Fe 3+, Fe 2+ Fe 3+ + ē ⇆ Fe 2+ Между платиновой пластинкой и раствором возникает потенциал, который называют окислительно-восстановительным потенциалом (ОВП) Pt | Fe 3+, Fe 2+ ‖ H+ | H 2, Pt Если активности окисленной (Fe 3+) и восстановленной Fe 2+ форм равны единице, то величина ОВП называется стандартным окислительно-восстановительным потенциалом ( ) при T=298 K табулированы ОВП в реальных условиях (отличающихся от стандартных) может быть рассчитан по уравнению Нернста В предельно разбавленных растворах (а ≈ С) и t=25ºC

Направление окислительно-восстановительных реакций ОВП является количественной характеристикой, как процесса окисления, так и обратного ему процесса восстановления Чем больше величина ОВП, тем больше окислительная способность системы и тем меньше ее восстановительная способность Пример Возможно ли взаимодействие галогенов с ионами Fe 2+ в стандартных условиях Полуреакция Fe 3+ + ē = Fe 2+ F 2 + 2ē = 2 Fˉ Cl 2 + 2ē = 2 Clˉ Br 2 + 2ē = 2 Brˉ I 2 + 2ē = 2 Iˉ , B 0, 77 2, 87 1, 36 1, 07 0, 54 Если условия нестандартные, необходимо учитывать активности ионов и p. H среды F 2, Cl 2, Br 2 могут быть окислителями Fe 2+ Br 2 + 2 Fe 2+ = 2 Brˉ + 2 Fe 3+ ∆E 0=1, 07 – 0, 77 = 0, 3 B I 2 + 2 Fe 2+≠ 2 Iˉ + 2 Fe 3+ = I 2 + 2 Fe 2+ ∆E 0 = 0, 77 – 0, 54 = 0, 23 B

Химические источники тока Гальванические элементы Аккумуляторы Топливные элементы Гальванический элемент – устройство, в котором энергия химической (окислительно восстановительной) реакции превращается в электрическую Гальванический элемент Якоби-Даниэля Zn | Zn. SO 4 ‖ Cu. SO 4 | Cu Электродные процессы (‒) Анод: Zn - 2ē ⇆ Zn 2+ (окисление) (+) Катод: Cu 2+ + 2ē ⇆ Cu (восстановление) Zn + Cu 2+ ⇆ Zn 2+ + Cu В стандартных условиях ∆E 0 – стандартная электродвижущая сила (ЭДС) гальванического элемента

ЭДС гальванического элемента в реальных условиях ∆E = ECu - EZn В предельно разбавленных растворах, при Т = 298 К , где Если гальванический элемент работает обратимо при постоянных температуре и давлении, то ΔG протекающей в нем реакции связана с его ЭДС ΔG = ‒n. F∆E Для системы находящейся в стандартном состоянии при T=25ºC ΔG 0 = ‒n. F∆E 0 ΔG 0 = ‒RTln. Kр ‒RTln. Kр = ‒n. F∆E 0,

Аккумуляторы Гальванические элементы работают в течение ограниченного промежутка времени, пока исходные материалы не будут израсходованы Аккумуляторы можно использовать многократно. При пропускании постоянного тока от внешнего источника в направлении обратном току в гальваническом элементе происходит регенерация израсходованных реактивов (зарядка аккумулятора) Свинцовый аккумулятор Pb | H 2 SO 4 | Pb. O 2 | Pb Электролит – 30% водный раствор H 2 SO 4 Электродные процессы При разряде аккумулятора реакция протекает слева направо, при зарядке – справа налево

Топливные элементы В топливных элементах энергия окисления (сгорания) топлива непосредственно преобразуется в электроэнергию. Их коэффициент полезного действия приближается к 80% ТЭ способны работать в течение длительного времени, пока к электродам подводятся реагенты, а продукты о/в реакции удаляются Чаще всего в качестве окислителя используют кислород или воздух, а восстановителя (топливо) – водород, гидразин, углеводороды и т. д. Водород – энергетически наиболее выгодный вид топлива Удельная теплота сгорания – 143 к. Дж/г H 2 (бензин 47, 3 к. Дж/г) Водородно-кислородный топливный элемент C(Pt), H 2 | H+ | O 2, (Pt)C Анод: 2 H 2 = 4 H+ + 4ē Катод: O 2 + 4 H+ + 4ē = 2 H 2 O 2 H 2 + O 2 = 2 H 2 O
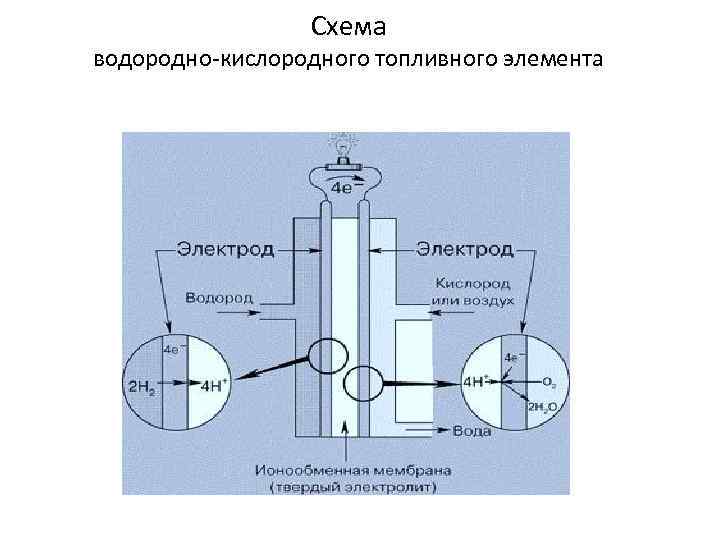
Схема водородно-кислородного топливного элемента

Коррозия металлов Коррозия – процесс самопроизвольного разрушения материалов под воздействием на них внешней среды Выход из строя из-за коррозии различных металлических конструкций, сложной аппаратуры, машин и приборов является причиной не только огромного материального ущерба, но и катастроф. Потери металлов и их сплавов ежегодно составляет ≈ 30 % от получаемого количества черных металлов (10 % теряется безвозвратно) В развитых странах стоимость прямых и косвенных потерь, связанных с коррозией, составляет 3 - 10 % валового национального дохода Получение металла Men+ + nē = Me , ΔG ˃ 0 (восстановление) Коррозия металлов Me ‒ nē = Men+ , ΔG ˂ 0 (окисление) Первопричина коррозия – термодинамическая неустойчивость металлов По площади повреждения коррозия подразделяется Сплошная (охватывает всю поверхность) Местная (пятнистая и питтинговая)

По механизму протекания различают Химическую, биохимическую и электрохимическую коррозию Химическая коррозия (грызть, лат. ) Биохимическая коррозия Связана с воздействием на материал микроорганизмов. Металл может разрушаться из-за того, что он служит питательной средой, или действия на металл продуктов жизнедеятельности этих организмов. В чистом виде встречается редко Пример В топливных системах реактивных самолетов найдено более 100 видов микроорганизмов, которые выделяют органические кислоты и другие метаболические продукты, вызывающие коррозию

Электрохимическая коррозия Самопроизвольный процесс разрушения металлов в присутствии электролитов в результате возникновения гальванических микроэлементов Самый распространенный вид коррозии Причины возникновения гальванических микроэлементов Неоднородность металлической фазы Неоднородность среды Неоднородность физических условий Пример Коррозия железа, содержащего в качестве примеси медь Кислая среда (‒) Fe| H+ |Cu+ (+) Анод: Fe = Fe 2+ + 2ē Катод: 2 H+ + 2ē = H 2 Fe + 2 H+ = Fe 2+ + H 2 Нейтральная среда Анод: Fe = Fe 2+ + 2ē Катод: O 2 + 2 H 2 O + 4ē = 4 OHˉ O 2 Fe + O 2 + 2 H 2 O = 2 Fe(OH)2↓ 4 Fe(OH)2 + O 2 + 2 H 2 O = 4 Fe(OH)3↓, Fe(OH)3 = Fe + H 2 O OH Бурая ржавчина

Методы защиты от коррозии Электрохимические методы защиты Создание гальванического элемента, в котором роль катода выполняет защищенный металл (конструкция или деталь из металла) 1 Конструкции, находящиеся в почве (трубопроводы, сваи, резервуары) подключают к отрицательному полюсу внешнего источника постоянного тока, а положительный полюс заземляют 2 Конструкцию присоединяют к электроду, изготовленному из более активного металла (Zn, Mg). При появлении влаги конструкция будет выполнять функцию катода, а металл – функцию анода (протекторная защита) Покрытие металлами анодное покрытие катодное покрытие

Изоляция металлов от агрессивной среды Создание на поверхности металла защитной пленки – покрытия. Используют неорганические и органические вещества: пленки высокополимерных веществ, лаки, олифы, композиции из высокополимерных и неорганических веществ Химические покрытия Искусственно создаваемые поверхностные пленки различного состава (оксидные, фосфатные, нитридные) Изменение коррозийной среды Осуществляется путем добавления в неё веществ, называемых ингибиторами (замедлителями) коррозии. Ингибиторы адсорбируются на поверхности металла, образуя тонкие пленки, которые выводят из строя гальванические микроэлементы. Ингибиторы – фосфаты, альдегиды, гетероциклические соединения и т. д. Антикоррозийное легирование В состав металлического сплава вводят компоненты, повышающие его устойчивость. Применяют – хром, никель, вольфрам, алюминий, кремний и т. д.

Изоляция металлов от агрессивной среды Создание на поверхности металла защитной пленки – покрытия. Используют неорганические и органические вещества: пленки высокополимерных веществ, лаки, олифы, композиции из высокополимерных и неорганических веществ Химические покрытия Искусственно создаваемые поверхностные пленки различного состава (оксидные, фосфатные, нитридные) Изменение коррозийной среды Осуществляется путем добавления в неё веществ, называемых ингибиторами (замедлителями) коррозии. Ингибиторы адсорбируются на поверхности металла, образуя тонкие пленки, которые выводят из строя гальванические микроэлементы. Ингибиторы – фосфаты, альдегиды, гетероциклические соединения и т. д. Антикоррозийное легирование В состав металлического сплава вводят компоненты, повышающие его устойчивость. Применяют – хром, никель, вольфрам, алюминий, кремний и т. д.
Лекция 3 Комплексы+эдс.pptx