металлы-2.ppt
- Количество слайдов: 11

Бериллий, магний и щелочноземельные металлы

Щелочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция и вниз по группе. Оксиды этих элементов ( «земли» - по старинной терминологии) взаимодействуют с водой, образуя щелочи.
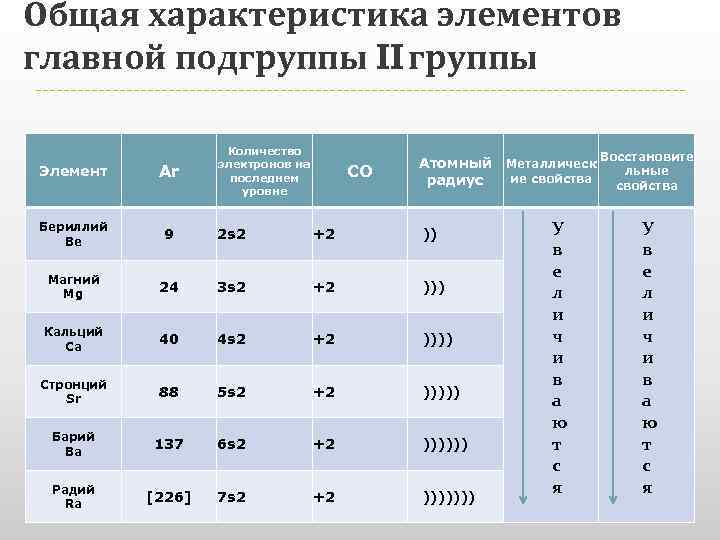
Общая характеристика элементов главной подгруппы II группы Количество электронов на последнем уровне СО Атомный Металлическ Восстановите льные ие свойства радиус свойства Элемент Ar Бериллий Be 9 2 s 2 +2 )) Магний Mg 24 3 s 2 +2 ))) Кальций Ca 40 4 s 2 +2 )))) Стронций Sr 88 5 s 2 +2 ))))) Барий Ba 137 6 s 2 +2 )))))) Радий Ra [226] 7 s 2 +2 ))))))) У в е л и ч и в а ю т с я

Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют со +2 Атомы элементов являются сильными восстановителями, т. к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами. С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.

Ве - амфотерный металл, Mg – металл, Сa, Sr, Ba - щёлочноземельные металлы Ra –радиоактивный элемент

Физические свойства Бериллий, магний, кальций, барий и радий - металлы серебристо-белого цвета. Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом на воздухе элементы достаточно устойчивы, но покрываются оксидной пленкой, Бериллий (Ве) очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу Бериллий магний кальций
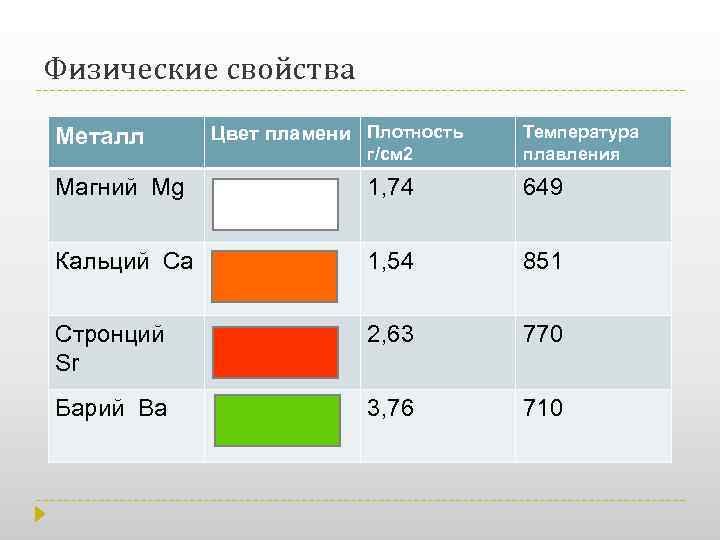
Физические свойства г/см 2 Температура плавления Магний Mg 1, 74 649 Кальций Са 1, 54 851 Стронций Sr 2, 63 770 Барий Ва 3, 76 710 Металл Цвет пламени Плотность

Химические свойства Щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки. 1. С кислородом 2 M+O 2=2 MO (оксид) 2. С галогенами M+Cl 2=MCl 2 (хлорид) 3. С серой M+S=MS (сульфид) 4. С азотом 3 M+N 2=M 3 N 2 (нитрид) 5. С водородом M+H 2=MH 2 (гидрид) 6. С водой M+2 H 2 O=M(OH)2+H 2

Получение щелочноземельных металлов Электролизом расплавов их хлоридов или термическим восстановлением их соединений: Be. F 2 + Mg = Be + Mg. F 2 Mg. O + C = Mg + CO 3 Ca. O + 2 Al = 2 Ca + Al 2 O 3 3 Ba. O + 2 Al = 3 Ba + Al 2 O 3

Приминение

металлы-2.ppt