
БЕЛОКТАР
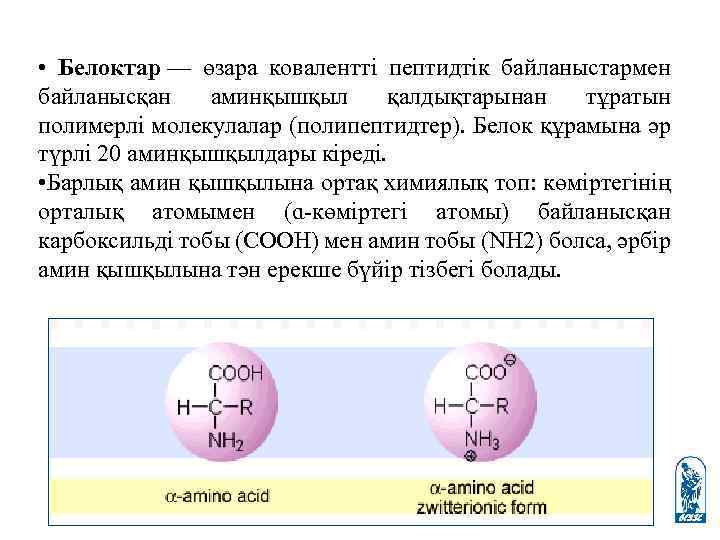
• Белоктар — өзара ковалентті пептидтік байланыстармен байланысқан аминқышқыл қалдықтарынан тұратын полимерлі молекулалар (полипептидтер). Белок құрамына әр түрлі 20 аминқышқылдары кіреді. • Барлық амин қышқылына ортақ химиялық топ: көміртегінің орталық атомымен (ɑ-көміртегі атомы) байланысқан карбоксильді тобы (СООН) мен амин тобы (NH 2) болса, әрбір амин қышқылына тән ерекше бүйір тізбегі болады.
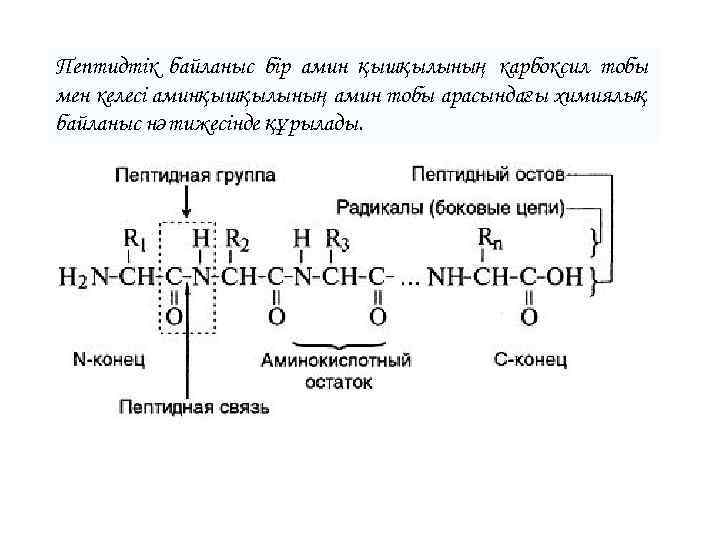
Пептидтік байланыс бір амин қышқылының карбоксил тобы мен келесі аминқышқылының амин тобы арасындағы химиялық байланыс нәтижесінде құрылады.

Белок құрамына кіретін 20 аминқышқылдарын химиялық құрылысы және бүйір радикалдарының қасиетіне байланысты жіктейді. ПОЛЯРЛЫ ЕМЕС ТОП (гидрофобты) 10 аминқышқылынан тұрады. -R-тобы алифатты көмірсу (5 аминқышқылы) – аланин, валин, лейцин, изолецин, пролин. -Ароматты сақиналы (2 аминқышқылы) - фенилаланин, триптофан -Құрамында S бар (2 аминқышқылы) – метионин, цистеин жатады. Аталған барлық а. қ. суда ерігіштігі өте төмен, олардың Rтобы сумен байланыспайды.
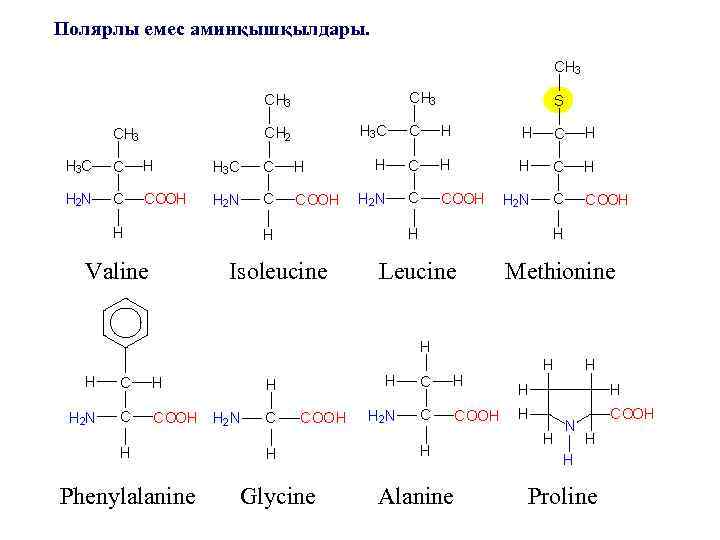
Полярлы емес аминқышқылдары. Valine Phenylalanine Isoleucine Leucine Methionine Glycine Alanine Proline

Полярлы топ (10 амин қышқылы) -Зарядталмаған (5 аминқышқылы) – серин, треонин, тирозин, аспарагин және глутамин – р. Н-тің физиологиялық мәнінде электрлі нейтралды. Олардың бүйір тобы су молекуласымен сутегі байланысын түзе алады. -Оң зарядты (3 аминқышқылы) – лизин, аргинин, гистидин. -Теріс зарядты (2 аминқышқылы) – аспарагин қышқылы, глутамин қышқылы.
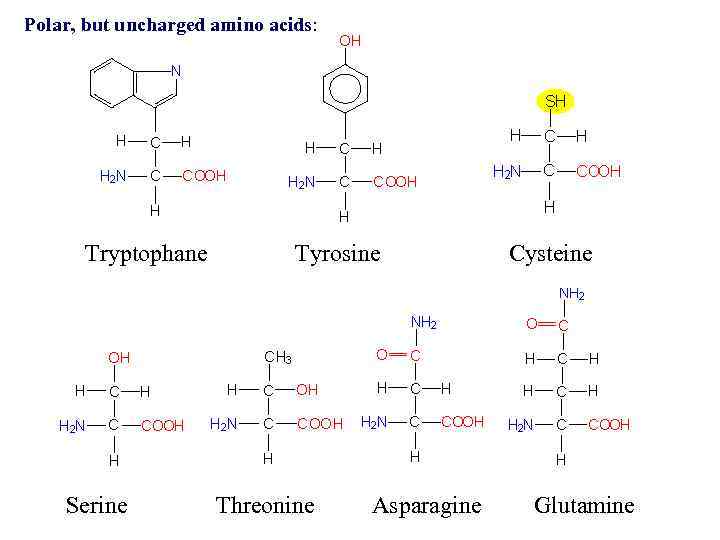
Polar, but uncharged amino acids: Tryptophane Serine Tyrosine Threonine Asparagine Cysteine Glutamine
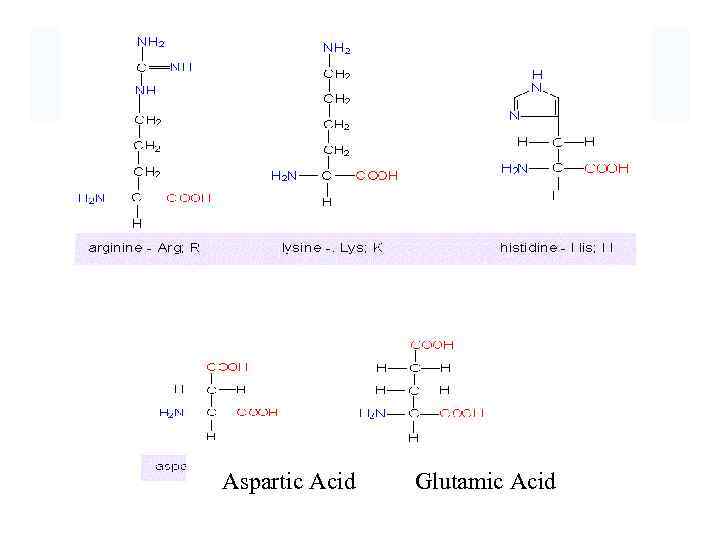
Aspartic Acid Glutamic Acid

Amino Acids Name Abbr. Linear structure formula =========================== Alanine Arginine Asparagine ala a arg r HN=C(NH 2)-NH-(CH 2)3 -CH(NH 2)-COOH asn n Aspartic acid asp d Cysteine Glutamine cys c gln q Glutamic acid glu e Glycine Histidine CH 3 -CH(NH 2)-COOH gly g his h H 2 N-CO-CH 2 -CH(NH 2)-COOH HOOC-CH 2 -CH(NH 2)-COOH HS-CH 2 -CH(NH 2)-COOH H 2 N-CO-(CH 2)2 -CH(NH 2)-COOH HOOC-(CH 2)2 -CH(NH 2)-COOH NH 2 -COOH NH-CH=N-CH=C-CH 2 -CH(NH 2)-COOH |_____|

Isoleucine ile i CH 3 -CH 2 -CH(CH 3)-CH(NH 2)-COOH Leucine leu l (CH 3)2 -CH-CH 2 -CH(NH 2)-COOH Lysine lys k H 2 N-(CH 2)4 -CH(NH 2)-COOH Methionine met m Phenylalanine phe f CH 3 -S-(CH 2)2 -CH(NH 2)-COOH Ph-CH 2 -CH(NH 2)-COOH Proline pro p NH-(CH 2)3 -CH-COOH |_____| Serine ser s HO-CH 2 -CH(NH 2)-COOH Threonine thr t Tryptophan trp w Tyrosine Valine tyr y val v CH 3 -CH(OH)-CH(NH 2)-COOH Ph-NH-CH=C-CH 2 -CH(NH 2)-COOH |_______| HO-p-Ph-CH 2 -CH(NH 2)-COOH (CH 3)2 -CH-CH(NH 2)-COOH
Белоктар қасиеттері Белок мөлшері аминқышқылдарының санына қарай және молекулалық массасына қарай дальтон бірлігі негізінде өлшенеді. Орташа шамамен ашытқы саңырауқұлақтарының құрамы - 466 аминқышқылынан тұрса, массасы -53 к. Да, ең үлкен белок – титин. Ол бұлшық ет сарокмерлерінде кездесетін белок. Молекулалық массасы -3000 -3700 к. Да өзгеріп отырады, ұзындығы 38 138 амин қышқылдарынан тұрады.

Белоктардың қасиеттері 1. Белоктар амфотерлік қасиетке ие, яғни олар амин қышқылының радикалдары бойынша анықталатын негіздік те қышқлыдық та қасиетке ие. 2. Сонымен бірге ерігіш және ерімейтін белоктар болады, олар механикалық қызмет атқарады (фиброин, кератин, коллаген). 3. Ерекше химиялық активті (ферменттер) және активті емес белоктар болады. 4. Қоршаған ортаның әртүрлі факторларына төзімді және төзімсіз белоктар болады (температураның өзгеруі, ортаның тқздық құрамы, р. Н, радиация). Аталған факторлар белок молекуласының структуралық құрылымын бұзады. Денатурация.
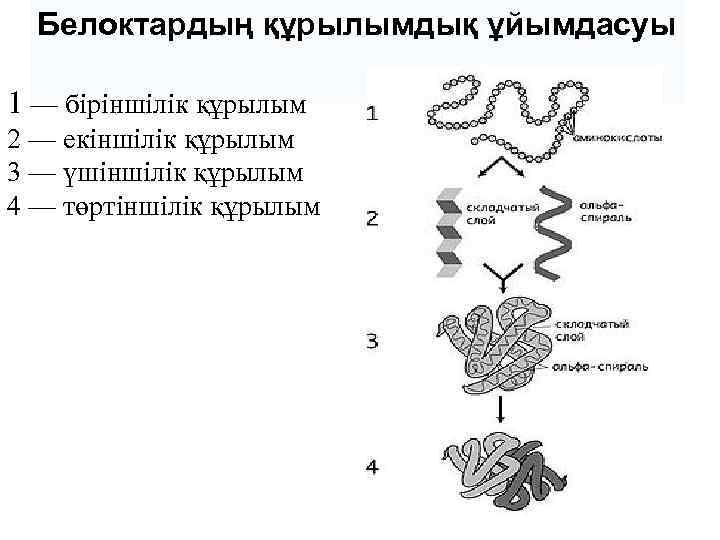
Белоктардың құрылымдық ұйымдасуы 1 — біріншілік құрылым 2 — екіншілік құрылым 3 — үшіншілік құрылым 4 — төртіншілік құрылым
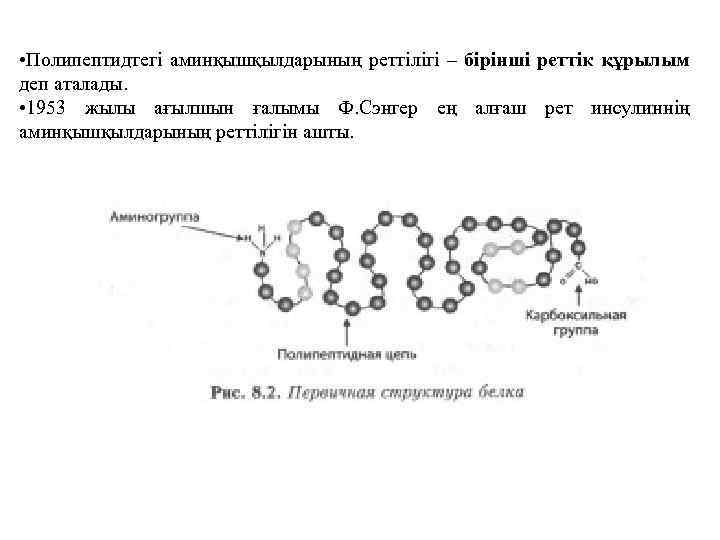
• Полипептидтегі аминқышқылдарының реттілігі – бірінші реттік құрылым деп аталады. • 1953 жылы ағылшын ғалымы Ф. Сэнгер ең алғаш рет инсулиннің аминқышқылдарының реттілігін ашты.

• Полипептидті тізбектер өздігінен нақты екіншілік құрылымды құрайды. • Екіншілік құрылымдағы маңызды типтердің бірі- α спираль. • Полипептид негізінен бүйір R-топтары сыртқа бағытталған оң жақты спиральдануды құрайды. • α спиральдің әрбір тізбегіне 3, 6 аминқышқылынан келеді. Осы құрылым NH- тобындағы бір аминқышқылының сутегі атомымен және төртінші аминқышқыл тізбегінің СО- тобы арасында сутектік байланыстың пайда болуымен тұрақты. • А. қ. Бүйір топтары спиральдің сырт жағында орналасқан. • α спиральді участкелер орташа есеппен 10 -20 аминқышқылынан тұрады.
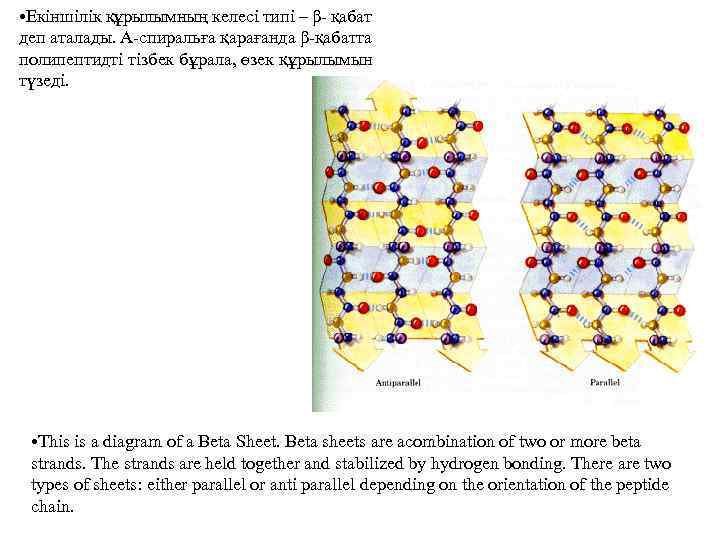
• Екіншілік құрылымның келесі типі – β- қабат деп аталады. Α-спиральға қарағанда β-қабатта полипептидті тізбек бұрала, өзек құрылымын түзеді. • This is a diagram of a Beta Sheet. Beta sheets are acombination of two or more beta strands. The strands are held together and stabilized by hydrogen bonding. There are two types of sheets: either parallel or anti parallel depending on the orientation of the peptide chain.
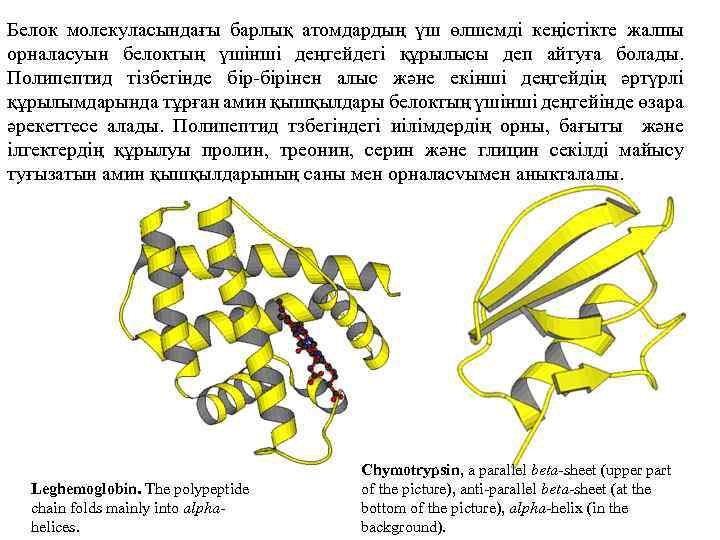
Белок молекуласындағы барлық атомдардың үш өлшемді кеңістікте жалпы орналасуын белоктың үшінші деңгейдегі құрылысы деп айтуға болады. Полипептид тізбегінде бір-бірінен алыс және екінші деңгейдің әртүрлі құрылымдарында тұрған амин қышқылдары белоктың үшінші деңгейінде өзара әрекеттесе алады. Полипептид тзбегіндегі иілімдердің орны, бағыты және ілгектердің құрылуы пролин, треонин, серин және глицин секілді майысу туғызатын амин қышқылдарының саны мен орналасуымен анықталады. Leghemoglobin. The polypeptide chain folds mainly into alphahelices. Chymotrypsin, a parallel beta-sheet (upper part of the picture), anti-parallel beta-sheet (at the bottom of the picture), alpha-helix (in the background).

Төртіншілік құрылым- олигомерлер, екі немесе оданда көп бірдей немесе әртүрлі полипептид тізбектерінен тұрады. Олигомерлі белоктар белгілі бір төртіншілік құрылыммен сипатталады. Белоктардың төртіншілік құрылымы олигомерлі құрылымда жекеленген шиыршықталған полипептидті тізбектер өзара әсерлесуі арқылы анықталады. Myoglobin has tertiary structure (because it is composed of one chain). Quaternary protein structure is a protein consisting of more than one amino acid chain. Hemoglobin has quaternary structure (2 alpha units, 2 Beta units)

Белоктар қызметі • 1. Белоктардың басты қызметі - катализаторлық. Барлық тірі организмдерде зат алмасу реакциялары ферменттердің әсер етуімен жүзеге асады. Ал, белгілі ферменттердің барлығы белоктардан құралған. • 2. Көпшілік гормондар белоктар- регуляторлық қызмет атқарады. Мысалы, ұйқы безінің гормоны – инсулин, қалқанша безінің гормоны – тироксин, бүйрек үсті безінің гормондары – адреналин, ми қабатының гормондары – соматотропин, окситоцин, вазопрессин. • 3. Тасымалдаушы қызмет. Заттардың клетка мен органоидтар ішінде қозғалуын белок реттеп отырады. Соңғы кезде клетка мембранасының құрамында түрлі тасымалдаушы белоктардың /АЦБ/ болатыны анықталды. • 4. Қорғаныштық қызмет атқарады. Ол организмнің иммундық /ауруға төтеп беру/ қасиеттерін жүзеге асырады. Қорғанудың бір әдісі – антиденелер /бейтараптаушы денелер/ жасап шығару. • 5. Бұлшықет белоктары /актин, миозин, актомиозин/ олардың жиырылуын және босаңсуын, жалпы, денедегі механикалық қозғалыстардың барлық түрлерін қамтамасыз етеді.

Белоктар фолдингі • 1. Белоктың кеңістік құрылымын түзу процесі – фолдинг деп аталады. • Фолдингті қамтамасыз етуші белоктар – шаперондар деп аталады. • Шаперондар рибосомадан жаңа түзіліп шыққан бір полипептидті тізбектің гидрофобты учаскелерімен байланысып, олардың басқа тізбектің гидрофобты учаскелерімен байланыс жасауын тежейді. • Нәтижесінде нативті белоктар шаперондардың қатысуымен фолдтар құрайды. • Полипептидті тізбектен босаған шаперондар қайтадан фолдинг процесіне қатысады немесе шаперон жүйесін құрып, басқа күрделі фолдтардың түзілуіне қатысады.
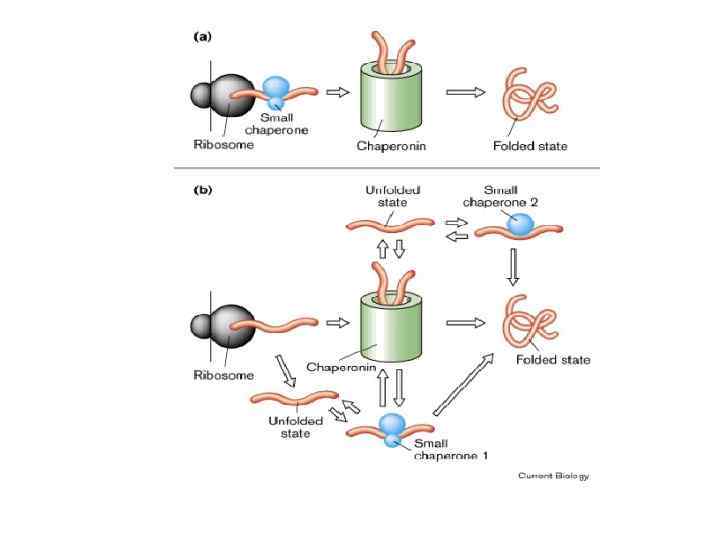

• Қазіргі уақытта үш түрлі шаперондар белгілі: • 1. нуклеоплазминдер (нуклеосомдарды жинақтауға қатысатын ядролық белоктар) • 2. «жылу шокты» белоктар • 3. нативті полипептидті тізбектің шиыршықталуына тікелей қатысатын шаперон- белоктар. • Олар синтезделетін полипептидті тізбектердің дұрыс шиыршықталуына себепші және шиыршықталған тізбектер глобулаларын агрегациядан сақтайды.