белки.ppt
- Количество слайдов: 48

Белки. Химия белков n Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Природные белки состоят из небольшого числа сравнительно простых структурных блоков, представленных мономерными молекулами – аминокислотами, связанными друг с другом в полипептидные цепи.

Природные белки построены из 20 различных аминокислот. Эти аминокислоты могут объединяться в самой разной последовательности, поэтому они могут образовывать громадное количество разнообразных белков. Число изомеров, которое можно получить при всевозможных перестановках указанного числа аминокислот в полипептиде, исчисляется огромными величинами. Так, если из 2 аминокислот возможно образование только двух изомеров, то уже из 4 аминокислот теоретически возможно образование 24 изомеров, а из 20 аминокислот – 2, 4 • 1018 разнообразных белков

ФУНКЦИИ БЕЛКОВ Каталитическая функция. К 1995 г. было идентифицировано более 3400 ферментов. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, является белками. Эта функция белков, определяет скорость химических реакций в биологических системах. Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы мишени.

Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях. Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).

Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов: мукоидов, муцина и т. д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток. Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во многих других клетках организма. Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются производными аминокислот.

Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма. Можно назвать еще некоторые другие жизненно важные функции белков. Это, в частности, экспрессия генетической информации, генерирование и передача нервных импульсов, способность поддерживать онкотическое давление в клетках и крови, буферные свойства, поддерживающие физиологическое значение р. Н внутренней среды, и др.

СОДЕРЖАНИЕ БЕЛКОВ В ОРГАНАХ И ТКАНЯХ Элементный состав белков в пересчете на сухое вещество представлен 50– 54% углерода, 21– 23% кислорода, 6, 5– 7, 3% водорода, 15– 17% азота и до 0, 5% серы. В составе некоторых белков присутствуют в небольших количествах фосфор, железо, марганец, магний, йод и др. Таким образом, помимо углерода, кислорода и водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот, в связи с чем белки принято обозначать как азотсодержащие органические вещества. Содержание азота более или менее постоянно во всех белках (в среднем 16%), поэтому иногда определяют количество белка в биологических объектах по содержанию белкового азота.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ Последовательность операций по выделению белков обычно состоит в следующем: измельчение биологического материала (гомогенизация); извлечение белков, точнее, перевод белков в растворенное состояние (экстракция); выделение исследуемого белка из смеси других белков, т. е. очистка и получение индивидуального белка. Белковые вещества весьма чувствительны к повышению температуры и действию многих химических реагентов (органические растворители, кислоты, щелочи). Поэтому обычные методы органической химии, применяемые для выделения того или иного вещества из смеси (нагревание, перегонка, возгонка, кристаллизация и др. ), в данном случае неприемлемы. Белки в этих условиях подвергаются денатурации, т. е. теряют некоторые существенные природные (нативные) свойства, в частности растворимость, биологическую активность. Разработаны эффективные методы выделения белков в «мягких» условиях, при низкой температуре (не выше 4°С), с применением щадящих нативную структуру химических реагентов.

В соответствии с функциональным принципом различают 12 главных классов белков: каталитически активные белки (ферменты); 2) белки гормоны (хотя есть и стероидные гормоны); 3) белки регуляторы активности генома; 4) защитные белки (антитела, белки свертывающей и антисвертывающей систем крови); 5) токсические белки; 6) транспортные белки; 7) мембранные белки; 8) сократительные белки; 9) рецепторные белки; 10) белки ингибиторы ферментов; 11) белки вирусной оболочки; 12) белки с иными функциями. 1)

Все белки в зависимости от строения делятся на простые — протеины, состоящие только из аминокислот, и сложные — протеиды, молекулы которых, помимо белковой части, имеют и небелковую — простетическую группу. ПРОТЕИНЫ Протеины представляют собой простые белки, состоящие только из белковой части. Они широко распространены в животном и растительном мире. К ним относятся альбумины и глобулины, встречающиеся практически во всех животных и растительных клетках, биологических жидкостях и выполняющие очень важные функции.

Альбумины участвуют в поддержании осмотического давления крови (создают онкотическое давление), транспортируют с кровью различные вещества. Глобулины входят в состав ферментов, составляют основу иммуноглобулинов, выполняющих функции антител. В сыворотке крови между этими белками существует постоянное соотношение — альбуминноглобулиновый коэффициент (А/Г), равный 1, 7 — 2, 3 и имеющий важное диагностическое значение.

Другими представителями протеинов являются протамины и гистоны — белки основного характера, содержащие много лизина и аргинина. Эти белки входят в состав нуклеопротеидов. Другой основной белок — коллаген — образует внеклеточное вещество соединительной ткани и находится в коже, хрящах и других тканях.

ПРОТЕИДЫ Протеиды являются сложными белками, состоящими из белковой и небелковой частей. Название протеида определяется названием его небелковой части (простетической группы). Так, нуклеиновые кислоты являются небелковой частью нуклеопротеидов, фосфорная кислота входит в состав фосфопротеидов, углеводы — гликопротеидов, а липиды — липопротеидов.

Нуклеопротеиды. Имеют важное значение, так как их небелковая часть представлена нуклеиновыми кислотами: дезоксирибонуклеиновой (ДНК) и рибонукленновой (РНК). Нуклеиновые кислоты участвуют в хранении и передаче наследственной информации о синтезе белков, специфичных для данного организма. Белковая часть нуклеопротеидов представлена в основном протаминами и гистонами.

n Хромопротеиды. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями. К хромопротеидам относятся гемоглобин, миоглобин (белок мышц), ряд ферментов (каталаза, пероксидаза, цитохромы), а также хлорофилл, содержащийся в растениях. Г е м о г л о б и н (НЬ) состоит из белка глобина и небелковой части — гема, в составе которого имеется атом двухвалентного железа. Молекула НЬ содержит четыре гема и является белком с четвертичной структурой.

Основная биологическая функция НЬ — транспорт кислорода и углекислого газа в крови. В капиллярах легких при высоком парциальном давлении кислорода, равном примерно 100 мм рт. ст. , НЬ почти полностью насыщается кислородом. Последний присоединяется к железу гема координационными связями. При этом окисления железа не происходит и оно остается двухвалентным. Такое соединение называется оксигемоглобином — НЬО 2. В капиллярах тканей, где парциальное давление кислорода низкое (около 5 мм рт. ст. ), оксигемоглобин распадается (дислоцирует) на НЬ и 02.

Кислород переходит в ткани, а освободившийся гемоглобин соединяется с поступившим из тканей углекислым газом и превращается в карбгемоглобин — НЬСО 2 который переносится с кровью к легким. В легочных капиллярах карбгемоглобин распадается на НЬ и СО 2 Углекислый газ выделяется из организма при выдыхании, а гемоглобин вновь насыщается кислородом. В организме обнаружен в небольшом количестве (около 1%) метгемоглобин — НЬОН, имеющий в своем составе окисленное железо (Ее+З) и не способный транспортировать газы крови. При отравлении угарным газом (СО) в крови образуется комплекс карбоксигемоглобин — НЬСО. Угарный газ прочнее, чем кислород связывается с НЬ, препятствуя тем самым образованию оксигемоглобина и транспорту кислорода. В результате нарушается снабжение тканей кислородом и возникает кислородное голодание.

У взрослого здорового человека молекула гемоглобина состоит из двух а- и двух β-цепей. Такой гемоглобин обозначается как НЬА. Однако состав цепей гемоглобина может меняться в зависимости от целого ряда условий. Так, в ходе развития человека от плода до взрослого организма происходит смена гемоглобинов. У плода присутствует Нb. F (фетальный), который состоит из двух а- и двух гамма-цепей. Он обладает способностью лучше связывать кислород при его относительной недостаточности в период внутриутробного развития. После рождения Нb. F заменяется на НЬА.

М и о г л о б и н — хромопротеид, содержащийся в мышцах. Он состоит только из одной цепи, аналогичной субъединице гемоглобина. Миоглобин является дыхательным пигментом мышечной ткани. Он значительно легче гемоглобина соединяется с кислородом, но труднее его отдает. Миоглобин создает запасы кислорода в мышцах, где его количество может достичь 14% всего кислорода организма. Это имеет важное значение, особенно для работы мышцы сердца. Высокое содержание миоглобина обнаружено у морских млеко питающих (тюленя, моржа), что позволяет им находиться длительное время под водой.

Гликопротеиды. Представляют собой сложные белки, простетическая группа которых образована производными углеводов (аминосахарами, гексуроновыми кислотами). Гликопротеиды входят в состав клеточных мембран, участвуют в транспорте различных веществ, в процессах свертывания крови, иммунитета, являются составными частями слизи и секретов желудочно-кишечного тракта. У арктических рыб гликопротеиды играют роль антифризов веществ, препятствующих образованию кристаллов льда внутри их организма.

Фосфопротеиды. Имеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц), ихтулин (белок икры рыб). Такая локализации фосфопротеидов свидетельствует важном их значении для развивающегося организма. взрослых форм эти белки присутствуют в костной нервной тканях. о У и Липопротеиды - сложные белки, простетическая группа которых образована липидами. Они условно подразделяют на растворимые в воде липопротеиды встречающиеся в крови, и протеолипиды жирорастворимые структурные компоненты клеточных мембран.

Классификация аминокислот Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой. Современная рациональная классификация аминокислот основана на полярности радикалов (R групп), т. е. способности их к взаимодействию с водой при физиологических значениях р. Н (близких к р. Н 7, 0).

Современная рациональная классификация аминокислот основана на полярности радикалов (R групп), т. е. способности их к взаимодействию с водой при физиологических значениях р. Н (близких к р. Н 7, 0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. (табл. 1. 3)
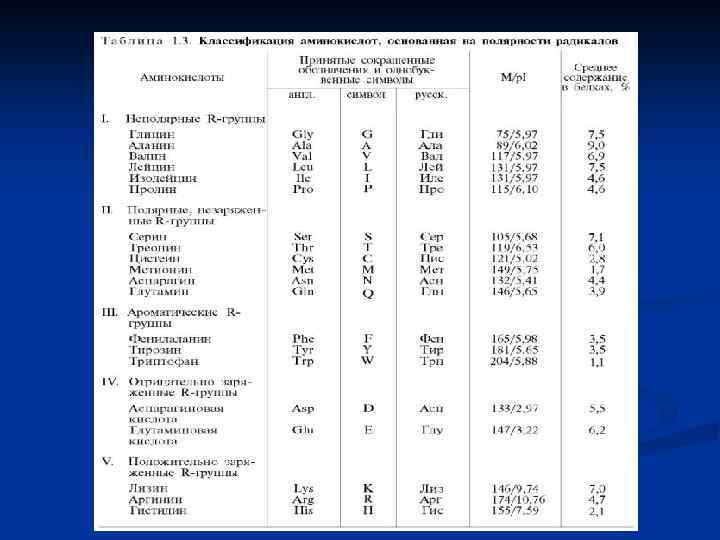

Полярные, незаряженные R-группы

Для обеспечения синтеза белков организм человека нуждается в сбалансированной смеси из 20 аминокислот, входящих в состав большинства белков. Для человека абсолютно незаменимыми являют ся 8 аминокислот: Валин (Вал), лейцин (Лей), изолейцин (Илей), лизин (Лиз), фенилаланин (Фен), триптофан (Три), треонин (Тре), метионин (Мет). К ним следует прибавить гистидин (Гис), и аргинин (Apг), синтез которых идет в организме человека, но объем этого синтеза недостаточен для покрытия потребности в этих аминокислотах.

Все остальные аминокислоты считаются заменимыми, однако заменимость тирозина (Тир) и цистеина (Цис) достаточно условна, поскольку для их синтеза используются незаменимые фенилааланин (Фен) и метионин (Мет) и при недостатке тирозина (Тир) и цистеина (Цис) автоматически увеличивается потребность в незаменимых фенилаланина (Фен) и метионина (Мет).

Все аминокислоты в зависимости от структуры разделены на Ациклические. Моноаминомонокарбоновые аминокислоты имеют в своем составе одну аминную и одну карбоксильную группы, в водном растворе они Нейтральны. Некоторые из них имеют общие структурные особенности, что позволяет рассматривать их вместе. 1. Глицин и аланин. Глицин (гликокол или аминоуксусная кислота) является оптически неактивным из за отсутствия асимметрического углеродного атома. Глицин участвует в образовании нуклеиновых и желчных кислот, гема, необходим для обезвреживания в печени токсических продуктов. Аланин используется в различных процессах обмена углеводов и энергии. Его изомер 3 -аланин является составной частью витамина пантотеновой кислоты, коэнзима А (Ко. А).

2. Серин и треонин. Данные аминокислоты относятся к группе гидроксикислот, как имеющие гидроксильную группу. Серии входит в состав различных ферментов, основного белка молока казеина, обнаружен в составе липопротеидов и других белков. Треонин участвует в биосинтезе белка, являясь незаменимой аминокислотой. З. Цистеин и метионин — аминокислоты, имеющие в составе атом серы. Значение цистеина определяется наличием в его молекуле сульфгидрильной (—$Н) группы, которая придает ему способность легко окисляться и защищать организм от веществ с высокой окислительной способностью (при лучевом поражении, отравлении фосфором), две молекулы цистеина, окисляясь, образуют цистин.

При этом образуется дисульфидная Связь (—$—-$ -). Метионин характеризуется наличием легко подвижной метильной группы ( —СН 3 которая используется для синтеза важных соединений (холина, креатина, тимина, адреналина и др. ). 4. Валин, лейцин и изолейцин. Представляют собой разветвленные аминокислоты, которые активно участвуют в обмене веществ и не синтезируются в организме. n Моноаминодикарбоновые аминокислоты имеют одну аминную и две карбоксильные группы и в водном растворе дают кислую реакцию.

К ним относятся аспарагиновая и глутаминовая кислоты, имеющие большое значение для организма. Они участвуют в биосинтезе белка, образовании важнейших соединений (тормозных медиаторов нервной системы, других аминокислот), энергетическом обмене и т. д. Диаминомонокарбоновые аминокислоты в водном растворе имеют щелочную реакцию за счет наличия в них двух аминных групп. Относящийся к ним лизин необходим для синтеза белков, в том числе гистонов, входящих в состав нуклеопротеидов; обнаружен в структуре некоторых ферментов. Аргинин участвует в синтезе мочевины обезвреживания аммиака), креатина (входит участвует в обмене энергии). (основной путь в состав мышц и

Циклические. Эти аминокислоты имеют в своем составе ароматическое или гетероциклическое ядро и, как правило, не синтезируются в организме и должны поступать с пищей. Они активно участвуют в разнообразных обменных процессах. Так, фенилаланин служит основным источником синтеза тирозина, являющегося предшественником ряда биологически важных веществ: гормонов (тироксина, адреналина), некоторых пигментов и др. Триптофан, помимо участия в синтезе белка, служит источником никотиновой кислоты (витамина РР), биогенных аминов (серотонина, триптамина), ряда пигментов. Гистидин необходим для синтеза белков, является предшественником гистамина, влияющего на кровяное давление и секрецию желудочного сока.

Азотистый баланс. Нормы белка в питании Большая часть азота, поступающего в организм с пищей (95 %) представляет собой азот белков или аминокислот. Состояние белкового обмена в организме может быть оценено по соотношению поступающего в организм азота и азота, выводимого из организма. Это соотношение по лучило название азотистый баланс. n Азотистый баланс может быть положительным. В этом случае в организм поступает больше азота, чем выводится, т. е. наблюдается задержка азота в организме. Положитель ныйазотистый баланс характерен для организма детей и для людей, выздоравливающих после длительной тяжелой болезни. При отрицательном азотистом балансе выведение азота из организма превышает его поступление с пищей. Это свидетельствует о потере азота организмом и является резуль татомусиления распада белков в организме, некомпенсируемым синтезом обновления. Такая ситуация встречается при длительном голодании или тяжелых заболеваниях.

Для здоровых взрослых людей характерно азотистое равновесие, т. е. такое состояние азотистого баланса, при котором поступление азота с пищей эквивалентно его выведе нию из организма. В условиях смешанной пищи минимальная потребность человека в пищевых белках составляет 30 45 г в сутки. Поскольку в обычных условиях человек питается смешанной пищей, не достаточность той или иной незаменимой аминокислоты встречается довольно редко. При обычном смешанном пищевом рационе количество пищи, обеспечивающее организм 1000 ккал энергии, содержит необходимое количество всех незаменимых аминокислот. Состояние азотистого баланса следует оценивать применительно к конкретному человеку, здоровому или больному. Положительный азотистый баланс для здорового ребенка является нормой, положительный азотистый баланс для больного с поражением почек свидетельствует о задержке азотистых шлаков (конечных продуктов азотистого обмена) в организме и развивающейся интоксикации этими шлаками.

Переваривание белков в ЖКТ Расщепление белков в ЖКТ идет при участии ферментов-протеиназ, катализирующих гидролитическое расщепление их пептидных связей. Эти протеиназы могут быть разделе ны на 2 группы: n а) эндопротеиназы, катализирующие разрыв пептидных связей внутри белковых молекул с образованием пептидов. К их числу относятся пепсин, гастриксин, трипсин, химотрипсин, коллагеназа, эластаза. б) экзопротеиназы, катализирующие отщепление концевых аминокислот с N или С-конца полипептида. К ним относятся карбоксипептидаза А и В, лейцинаминопептидаза и аланинаминопептидаза. Отсутствие од нойиз протеиназ, за исключением трипсина, обычно не приводит к существенному нарушению процесса переваривания белков.

n Всасывание аминокислот в кишечнике Всасывание аминокислот идет главным образом в тонком кишечнике и представляет собой активный, т. е. энергозависимый процесс. Существует не менее 5 специфических транспортных систем, каждая из которых обес печивает поступление в стенку кишечника группы близких по структуре аминокислот. а) система для всасывания нейтральных аминокислот с небольшими радикалами (серин (Сер), аланин (Ала), цистеин (Цис) б) система для всасывания нейтральных аминокислот с объемистыми радикалами (лейцин Лей, фенилаланин Фен). в) система для всасывания основных аминокислот (Лиз, Apr) г) система для всасывания кислых аминокислот (глутаминоваая кислота Глу, аспаргиновая кислота Асп) д) система для всасывания пролина

Аминокислоты одной группы конкурируют за участок связывания в своей системе и избыток одной аминокислоты тормозит всасывание других аминокислот той же группы; избыточная конц. Лей уменьшает всасывание изолейцина (Илей). Из кишечника аминокислоты поступают непосредственно в кровь и, разносясь по телу, поглощается клетками различных органов и тканей. В крови в норме содержится 35 -65 мг аминокислот на 100 мл (4 -8 мг аминного азота на 100 мл или 4, 3 -5, 7 ммоль/л). Аминокислоты очень быстро покидают кровяное русло. При внутривенном введении 5 -10 г смеси аминокислот уже через 5 мин более 85 % введенного их количества поглощается клетками.

Аминокислотный пул организма В жидкой среде организма, т. е. в плазме крови, межклеточной жидкости и во внутри клеточной жидкости постоянно имеется определенное количество свободных аминокислот. Они образуют аминокислотный пул организма. Для человека массой 70 кг величина этого пула составляет около 30 г. Этот пул постоянно пополняется за счет 3 процессов: поступления аминокислот из кишечника, распада тканевых белков и синтеза заменимых аминокислот. В то же время аминокислоты постоянно изымаются из пула для использо ванияв различных метаболических процессах. Ежесуточно в аминокислотный пул поступает до 400 г аминокислот в результате рас щепления тканевых белков и около 100 г аминокислот поступает из кишечника. Объем синтеза заменимых аминокислот оценить сложно, поскольку нет соответствующих крите риев. Из аминокислотного пула ежесуточно изымается не менее 400 г аминокислот для ресинтеза тканевых белков и около 100 г аминокислот расщепляется до конечных продуктов.

В сутки в результате глюконеогенеза при безуглеводном ра ционе может быть синтезировано до 100 -120 г глюкозы и основным поставщиком пластического материала для этого синтеза являются аминокислоты. Ежесуточно в организме из сукинил. Ко. А и Гли синтезируется до 300 мг гема. Синтез отдельных гормонов и биогенных аминов измеряется десятками мг, они необходимы организму. За сутки через аминокислотный пул проходит не менее 450 -500 г аминокислот, т. е. пул обменивается за сутки не менее 15 раз, а его постоянство есть отражение динамического равновесия между процессами, обеспечивающими поступление аминокислот в пул и процессами использования аминокислот из пула.

Избыточные аминокислоты подвергаются в организме расщеплению с образованием конечных продуктов, которыми являются углекислый газ, вода и аммиак. В ходе их расщепления выделяется свободная энергия, которая используется для нужд организма. При расщеплении аминокислот образуется аммиак, представляющий собой высокотоксичное соединение, требующее специальных механизмов для его обезвреживания. Окислительный распад большинства аминокислот начинается с отщепления от этих соединений аминогруппы в виде аммиака с образованием углеродного остова или углеродного скелета аминокислот. Это достигается в результате трансаминирования, окислительного дезаминирования или трансдезаминирования аминокислот.

Трансаминирование играет важную роль в оптимизации смеси аминокислот, поступающих из кишечника во внутреннюю среду организма. Чужеродные белки, содержащиеся в пищевом рационе, при расщеплении в кишечнике образуют смесь аминокислот, в которой соотношение отдельных аминокислот может быть весьма далеким от соотношения аминокислот в белках человеческого организма. В организме синтезируется ряд кетокислот, которые в результате трансаминирования могут превращаться в заменимые амино кислоты. За счет этого синтеза и происходит оптимизация смеси аминокислот, в ходе которой при участии трансаминирования происходит перераспределение аминного азота, поступающего из кишечника.

Определение активности 2 трансаминаз: аспартатаминотрансферазы и аланинаминотрансферазы нашло широкое применение в практике биохимических исследований в качестве диагностического теста. ACT и АЛТ внутриклеточные ферменты и в норме их активность в крови минимальна (20 и 15 единиц соответственно). Их активность в клетках различных тканей весьма велика: в миокарде 150 000 и 7 000 единиц, в печени 140 000 и 44 000 единиц соответственно. При поражении тканей ферменты выходят в межклеточную жидкость, а затем в кровь или при гибели клеток, или за счет увеличения проницае мости клеточных мембран. Повышение активности трансаминаз в крови свидетельствует о поражении той или иной ткани. При инфаркте миокарда уровень ACT уже через 3 5 часов повышается до 300 500 единиц. При благоприятном течении заболевания активность фермента через 3 4 дня возвращается к исходному уровню, при затяжном процессе нор мализациипоказателя не происходит. Этот тест, наряду с другими показателями, можно использовать как для постановки диагноза, так и для слежения за развитием патологического процесса.

n Дезаминирование аминокислот представляет собой процесс отщепления от аминокислот аминогруппы с образованием свободного аммиака. Дезаминирование в организме человека может протекать в 2 вариантах: в виде прямого дезаминирования, в ходе которого аммиак образуется при непосредственном отщеплении от той или иной аминокислоты аминогруппы или в виде непрямого дезаминирования, в ходе последнего отщепляемая аминогрупа вначале переносится с той или иной аминокислоты на другое соединение, от которого в дальнейшем отщепляется аммиак. Непрямое дезаминирование известно еще как трансдезаминирование. Прямое дезаминирование на разных уровнях организации живых объектов встречается в 4 вариантах: а) Окислительное дезаминирование б) внутримолекулярное дезаминировани в) гидролитическое дезаминирование г) восстановительное дезаминирование В клетках человеческого организма работают лишь 2 из перечисленных механизма: окислительное и внутримолекулярное дезаминирование.

В организме человека в результате дезаминирования аминокислот, биогенных аминов, а также некоторых других соединений, например, азотистых оснований нуклеотидов, ежесуточно образуется 15 17 г аммиака. Аммиак представляет собой высокотоксичное соединение, его конц. в крови в норме не превышает 1 мг/л, составляя в среднем величину порядка 0, 1 0, 2 мг/л или 30 40 мк. Мл. При повышении конц. аммиака в крови наблюдаются симптомы аммиачного отравления: своеобразный тремор, повышенная раздражительность, нечленораздельная речь, затуманивание зрения, в тяжелых случаях отравления развивается коматозное состояние и может наступить смерть. Основным органом, в котором происходит обезвреживание аммиака, является печень, в ее гепатрцитах до 80 90 % образовавшегося в организме аммиака превращается в мочеви ну малотоксичное соединение, которое с током крови поступает из печени в почки и выводится из организма с мочой. В норме в сутки с мочой выводится 20 35 г мочевины.

Количество мочевины, ежесуточно выводимой из организма, зависит от нескольких факторов. Оно уменьшается при снижении содержания белка в пище. Количество выводимой мочевины будет уменьшаться при патологии почек, сопровождающейся задержкой азотистых шлаков в организме. Выведение мочевины может снижаться при тяжелой патологии печени как следствие нарушения ее синтеза. Регуляция обмена аминокислот Основная масса аминокислот служит пластическим материалом для синтеза белков, в связи с чем активация или торможение белкового синтеза сказываются на различных показателях аминокислотного обмена. n Основными анаболическими гормонами человека являются СТГ и инсулин. Введение СТГ резко увеличивает уровень синтеза белков в клетках различных органов и тканей, соответственно увеличивается и потребление аминокислот на эти цели.

В то же время повышение содержания аминокислот в крови приво дитк увеличению продукции СТГ и ускорению синтеза белков в клетках. Инсулин также ускоряет использование аминокислот в клетках для синтеза белков; инсулин увеличивает поступление аминокислоте клетки, хотя механизм этого эффекта пока не выяснен. Половые гормоны (тестостерон) также обладают анаболическим действием, стимулируя исполь зование аминокислот для синтеза белков. Глюкокортикоиды стимулируют распад белков в клетках периферических тканей и стимулируют выход аминокислот из клеток в кровь. В печени глюкокортикоиды стимулируют использование аминокислот, во первых, для синтеза ферментов, участвующих в глюконеогенезе, во вторых, как субстратов глюконеогенеза.

Белковая недостаточность может развиваться или дефицита белка в пищевом рационе[ в том недостаточном поступлении с пищей одной или незаменимых аминокислот, или в результате усвоения пищевых белков при забо леваниях ЖКТ. вследствие числе при нескольких нарушения От белковой недостаточности по данным ВОЗ страдает в мире 200 млн. человек; ос новнымипричинами ее развития являются или голодание, или питание однообразной растительной пищей с недостаточным содержанием незаменимых аминокислот. Главными симптомами развития этого состояния являются отрицательный азотистый баланс, гипопротеинемия (снижение содержания белков в плазме крови) и развитие отеков. В организме нарушается синтез белков, что приводит к быстрой утомляемости, снижению его резистентности к воздействию неблагоприятных факторов внешней Среды и другим нежелательным явлениям.

В далеко зашедших случаях в организме нарушается синтез ферментов, принимающих участие в обмене аминокислот, нарушаются процессы дезаминирования и трансаминирования аминокислот. При этом в крови пострадавших увеличивается содержание аминокислот, увеличивается их выведение с мочой. В тканях нарушается обмен отдельных аминокислот: так, в тканях накапливается гистамин. образующийся из гистидина; в результате нарушения обмена Три в организме нарушается об разование никотинамида и накапливается ксантуреновая кислота, обладающая токсичным эффектом в отношении бета клеток поджелудочной железы. В тяжелых случаях белковой недостаточности, например, при длительном голодании, нарушается выработка пищеварительных ферментов ЖКТ, в том числе и протеиназ. Особенно тяжело белковую недостаточность переносят дети: у них развивается тяжелое поражение печени, наблюдается остановка роста, исхудание, резко падает сопротивляемость. Белковая недостаточность может развиваться и при тяжелых заболеваниях, поражающих органы пищеварения при витаминной недостаточности.
белки.ppt