Тема_5_Белки_Структура_белковой_молекулы.ppt
- Количество слайдов: 116
БЕЛКИ Структура белковой молекулы

l l Выяснение структурной организации белков – одна из главных проблем современной биохимии Оно имеет важное научно-практическое значение для понимания огромного разнообразия функций белков Белковые молекулы – продукт поликонденсации 20 -ти различных аминокислот, соединенных не хаотично, а в строгом соответствии с кодом белкового синтеза Каким образом соединяются между собой многие десятки и сотни аминокислот в белковой молекуле?

Полипептидная теория строения белка l l 1902 г. , Эмиль Фишер Белки – сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными (R–CO–NH–R ) связями, возникающими при взаимодействии карбоксильных и аминогрупп аминокислот

Экспериментальные доказательства теории l l l В природных белках сравнительно мало свободных групп –СООН и –NH 2 В процессе гидролиза белка образуется стехиометрическое количество титруемых групп – СООН и –NH 2 Под действием протеолитических ферментов белки расщепляются на строго определенные фрагменты (полипептиды) с концевыми аминокислотами, соответствующими избирательности действия ферментов Белки дают биуретовую реакцию Анализ рентгенограмм подтверждает полипептидную структуру белка Существенное подтверждение полипептидной теории строения белка – возможность синтеза химическими методами полипептидов и белков с уже известным строением (инсулина, лизоцима, рибонуклеазы и др. )
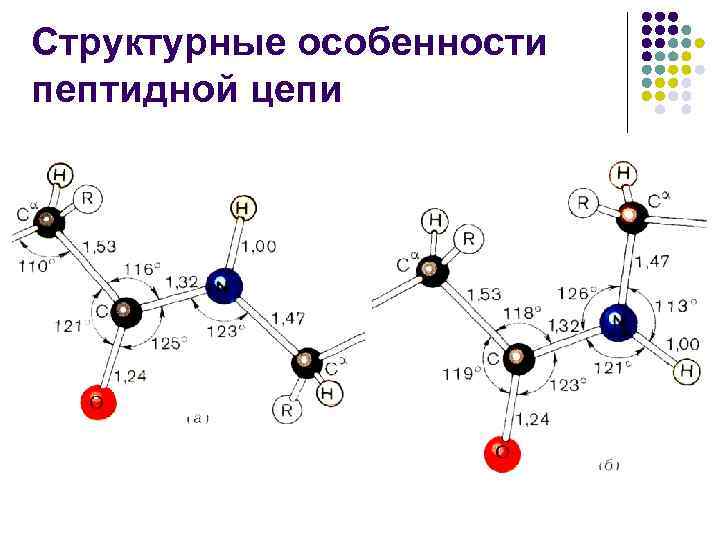
Структурные особенности пептидной цепи
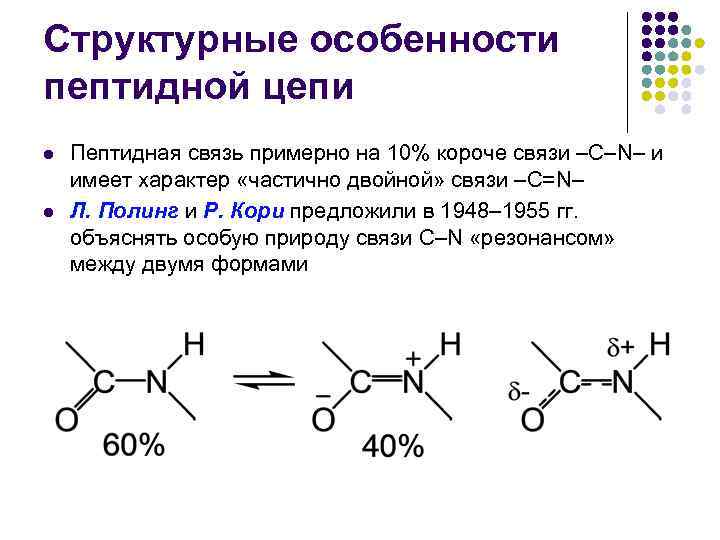
Структурные особенности пептидной цепи l l Пептидная связь примерно на 10% короче связи –С–N– и имеет характер «частично двойной» связи –С=N– Л. Полинг и Р. Кори предложили в 1948– 1955 гг. объяснять особую природу связи С–N «резонансом» между двумя формами

Структурные особенности пептидной цепи l l l Другими словами, в белках и пептидах связь С–N является частично кратной из-за взаимодействия неподеленной пары электронов атома азота с электронной системой карбонильной группы, что приводит к затрудненному вращению вокруг связи С–N Обычно пептидная связь имеет транс-конфигурацию, что выгоднее цис-конфигурации на 2, 6 ккал/моль (10, 878 к. Дж/моль), т. к. сближение -углеродных атомов в цисконфигурации вызывает пространственные затруднения Эта разница в значительной мере снимается, если азот пептидной связи принадлежит про
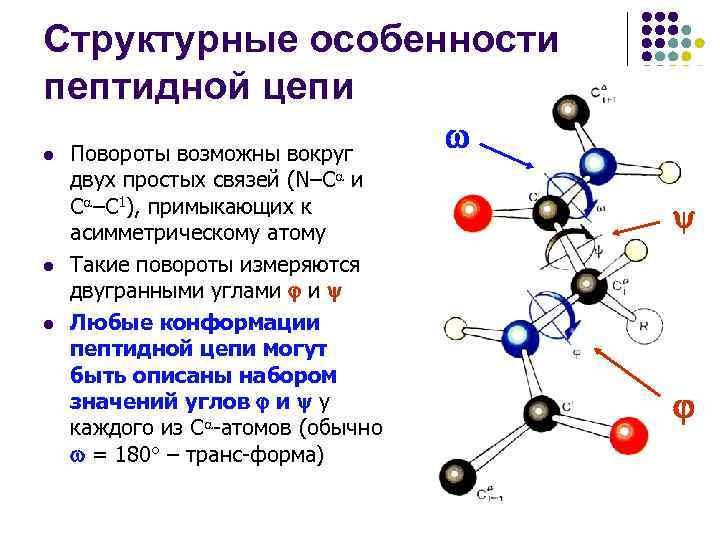
Структурные особенности пептидной цепи l l l Повороты возможны вокруг двух простых связей (N–С и С –C 1), примыкающих к асимметрическому атому Такие повороты измеряются двугранными углами и Любые конформации пептидной цепи могут быть описаны набором значений углов и у каждого из С -атомов (обычно = 180 – транс-форма)
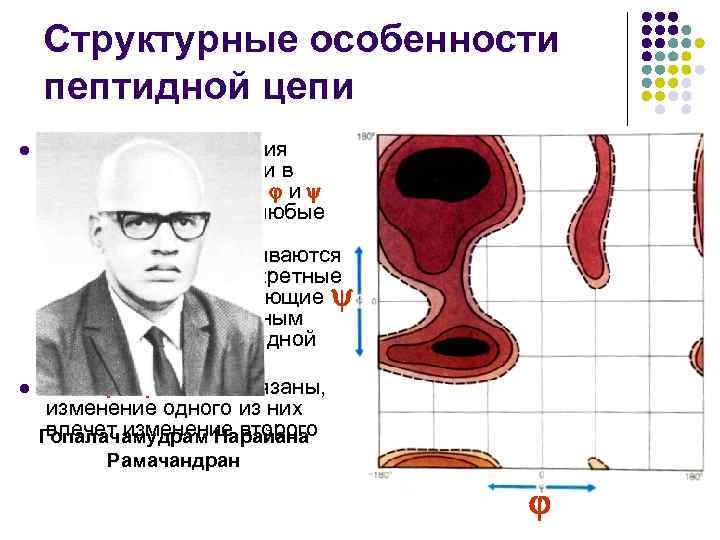
Структурные особенности пептидной цепи l l В силу взаимодействия между заместителями в пептидной цепи углы и не могут принимать любые значения – для них разрешенными оказываются лишь некоторые дискретные области, соответствующие энергетически выгодным конформациям пептидной цепи Углы и взаимосвязаны, изменение одного из них влечет изменение второго Гопалачамудрам Нарайана Рамачандран

Уровни организации белковой молекулы

l К. У. Линдерстрем-Ланг предложил различать 4 уровня организации белковых молекул – первичную, вторичную, третичную и четвертичную структуры. Хотя эти категории в известной степени устарели, ими пока продолжают пользоваться

Первичная структура белка

Первичная структура белка l l l последовательность аминокислотных остатков в полипептидной цепи кодируется структурным геном данного белка и содержит в себе все необходимое для самоорганизации его пространственной структуры Все белки различаются по своей первичной структуре Потенциально возможное число таких структур неограниченно Однако в живой природе все эти возможности не реализуются: общее число различных типов белков у всех видов живых организмов составляет величину порядка 1010– 1012

l l l Познание биологической функции и, в частности, молекулярного механизма физиологического действия белка невозможно без детального знания его строения Установление первичной структуры белка – основа для определения вторичной и третичной структур, выяснения расположения функциональных групп в его активном центре, путь к познанию механизма его функционирования. Исследование первичной структуры «мутагенных» белков позволяет на молекулярном уровне выяснить характер наследственных болезней Данные по первичной структуре используются как один из показателей при установлении и проверке таксономических взаимоотношений между различными видами живых организмов и построении схемы биологической эволюции

Методы определения первичной структуры l l Подготовка белка к анализу первичной структуры призвана свести к минимуму влияние других, более высоких уровней его организации Иными словами, объектом анализа должна быть неупорядоченная белковая цепь без каких-либо поперечных ковалентных связей (например, дисульфидных) так, чтобы все ее звенья, все пептидные связи были в равной мере доступны действию как химических реагентов, так и ферментов
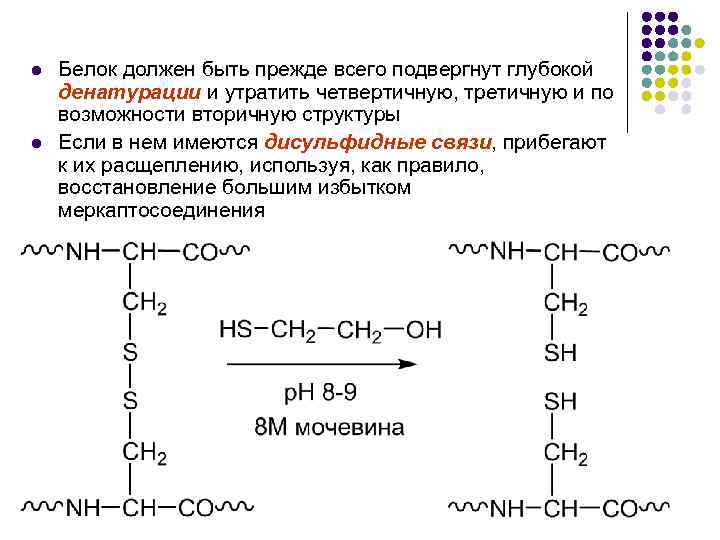
l l Белок должен быть прежде всего подвергнут глубокой денатурации и утратить четвертичную, третичную и по возможности вторичную структуры Если в нем имеются дисульфидные связи, прибегают к их расщеплению, используя, как правило, восстановление большим избытком меркаптосоединения

l Во избежание замыкания дисульфидных связей вновь сульфгидрильные группы блокируют избытком иодуксусной кислоты: R–SН + I–СН 2–СООН R–S–СН 2–СООН + НI

Затем проводят селективный гидролиз денатурированного белка для получения системы перекрывающихся пептидов. Гидролиз проводят ферментами: l l l трипсином (связи, образованные карбоксильными группами арг или лиз), химотрипсином (связи, образованные группами –СООН ароматических аминокислот) и др. ; химическими реагентами: бромцианом Br –С N (связи, образованные группами –СООН мет) и др.

l l l Следующий этап – фракционирование полученных пептидов – осуществляется методами хроматографии Наконец, последний этап – определение первичной структуры l начинается с определения его молекулярной массы, аминокислотного состава, N- и Сконцевых аминокислотных остатков После того, как структура всех фрагментов установлена, белок подвергают расщеплению при помощи другого агента и получают второй, отличный от первого набор пептидных фрагментов, которые разделяют и анализируют для выяснения порядка расположения аминокислот в белке

Первичная структура белка Определение N-концевых аминокислот

Метод Ф. Сенджера l В 1945 г. английский биохимик Ф. Сенджер предложил один из первых методов определения N-концевых аминокислот
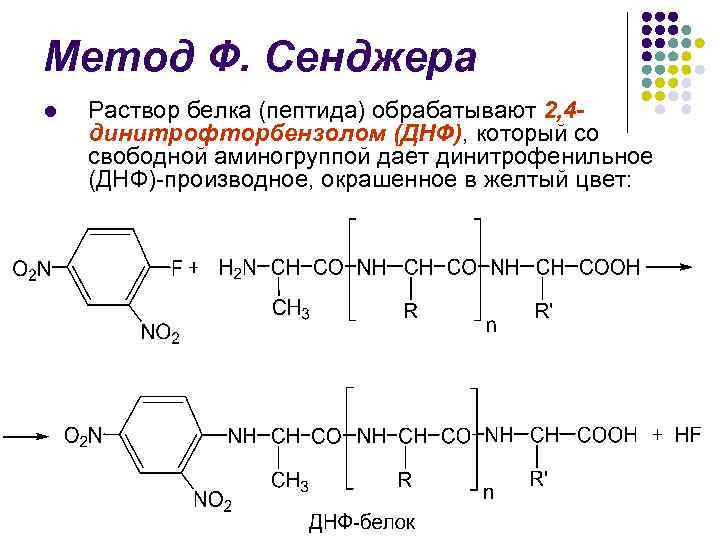
Метод Ф. Сенджера l Раствор белка (пептида) обрабатывают 2, 4 динитрофторбензолом (ДНФ), который со свободной аминогруппой дает динитрофенильное (ДНФ)-производное, окрашенное в желтый цвет:

Метод Ф. Сенджера l l Последующий кислотный гидролиз (5, 7 н. НСl) приводит к разрыву пептидных связей и образованию ДНФ-производного Nконцевой аминокислоты Последнее экстрагируется эфиром и идентифицируется методом ТСХ в присутствии стандартов

Дансильный метод l Разработан в 1963 г. английскими биохимиками В. Греем и Б. Хартли l Также основан на введении в аминогруппы белка «метки» , не удаляющейся при последующем гидролизе Брайен Хартли

Дансильный метод l Первая стадия – реакция дансилхлорида (1 -диметиламинонафталин-5 -сульфохлорида) с непротонированной -аминогруппой пептида (или белка) с образованием дансилпептида (ДНС-пептида)
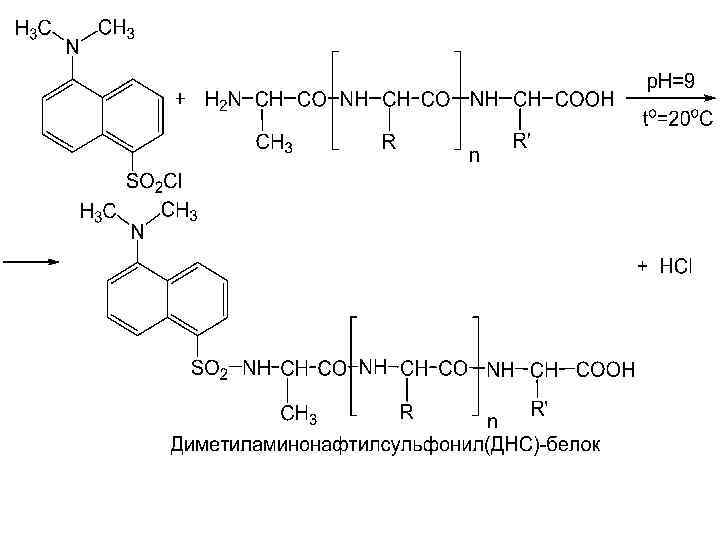

Дансильный метод l Полученный ДНС-белок подвергается гидролизу в присутствии 5, 7 н. НСl, при 105 С в течение 12– 16 ч, отщепившуюся ДНС-аминокислоту идентифицируют по флуоресценции в УФ-лучах

Первичная структура белка Определение С-концевых аминокислот

Метод С. Акабори l Метод гидразинолиза, предложенный японским биохимиком С. Акабори
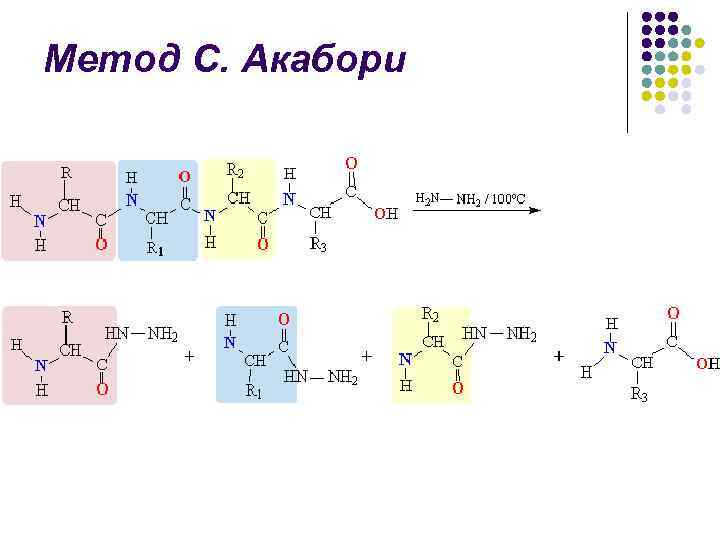
Метод С. Акабори l l При нагревании пептида (или белка) с безводным гидразином при 100– 120 С пептидные связи гидролизуются с образованием гидразидов аминокислот С-концевая аминокислота остается в виде свободной аминокислоты и может быть выделена из смеси и идентифицирована:

Первичная структура белка Определение аминокислотной последовательности

Метод П. Эдмана l Метод деградации полипептидной цепи с помощью фенилизотиоционата (ФИТЦ) разработан шведским химиком П. В. Эдманом в 1950– 56 гг. l Метод Эдмана позволяет последовательно отщеплять N-концевые аминокислотные остатки в виде фенилтиогидантоинов (ФТГ) l Каждый цикл деградации включает 3 стадии
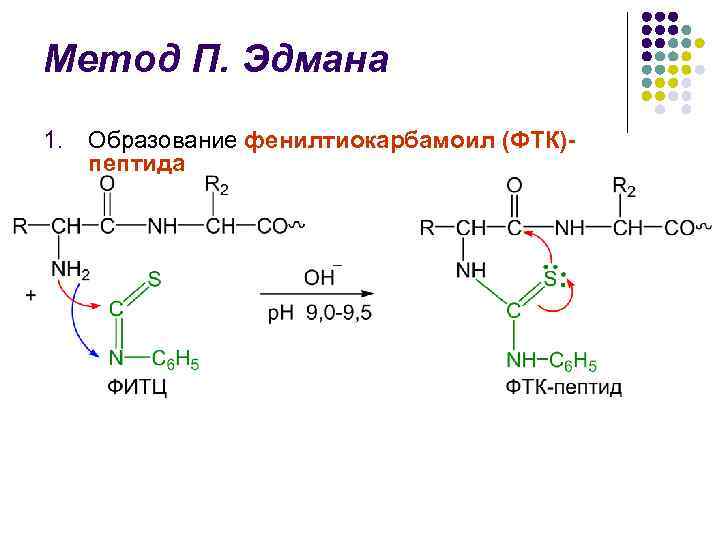
Метод П. Эдмана 1. Образование фенилтиокарбамоил (ФТК)пептида
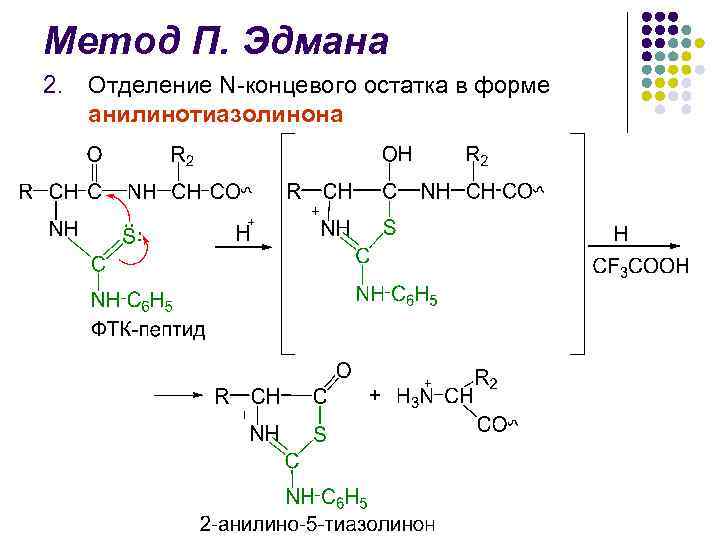
Метод П. Эдмана 2. Отделение N-концевого остатка в форме анилинотиазолинона
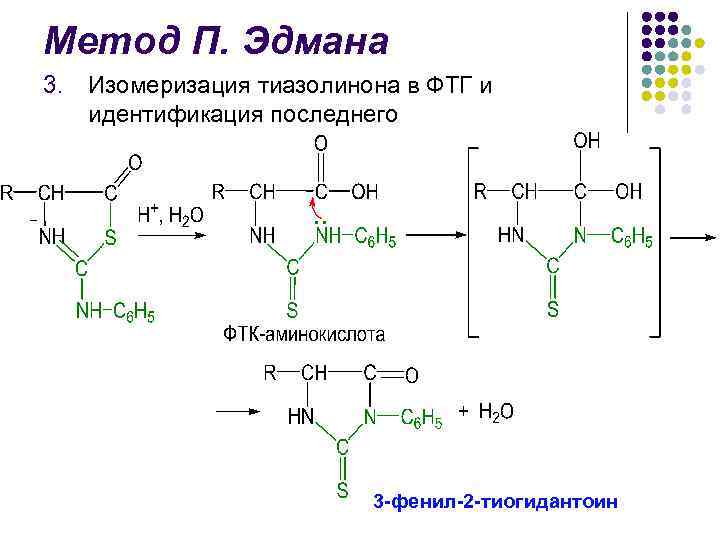
Метод П. Эдмана 3. Изомеризация тиазолинона в ФТГ и идентификация последнего 3 -фенил-2 -тиогидантоин
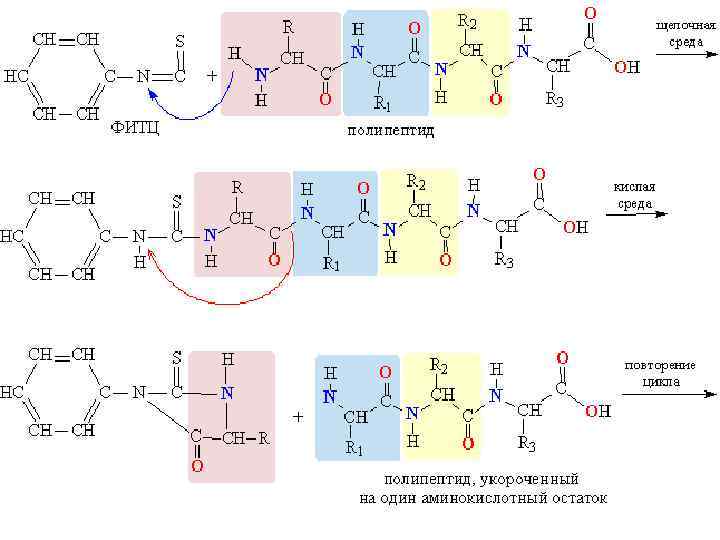

Метод П. Эдмана l l l Идентификация отщепленных ФТГ является определяющей в методе Эдмана В течение длительного времени использовали хроматографию на бумаге, затем микротонкослойную хроматографию на силикагеле и полиамиде, жидкостную и газо-жидкостную хроматографии Крупным достижением в области структурных исследований белков явилось создание в 1967 г. П. Эдманом и Дж. Бэггом секвенатора (от англ. sequence – последовательность) – прибора, который с высокой эффективностью осуществляет последовательное автоматическое отщепление N-концевых аминокислотных остатков по методу Эдмана

l Для определения структуры пептидов и белков можно применять: l l ферменты, катализирующие отщепление N- и С-концевых аминокислотных остатков – аминои карбоксипептидазы физико-химические методы, в частности, масс-спектрометрию

Анализ данных по первичной структуре позволяет сделать следующие общие выводы l l Стабильность первичной структуры обеспечивается в основном пептидными связями; возможно участие и небольшого числа дисульфидных связей В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот В полипептидах были открыты все мыслимые дипептиды В полипептидах относительно редки повторяющиеся последовательности

Анализ данных по первичной структуре позволяет сделать следующие общие выводы l l Каждый индивидуальный гомогенный белок характеризуется уникальной первичной структурой; часто замены аминокислот приводят не только к структурным перестройкам, но и к изменениям физикохимических свойств и биологических функций В некоторых белках (особенно ферментах), обладающих близкими свойствами, встречаются идентичные пептидные структуры (последовательности аминокислот), в особенности в областях их активных центров. Этот принцип структурного подобия наиболее типичен для ряда протеолитических ферментов – трипсина, химотрипсина и др.

Невалентные взаимодействия в пептидной цепи
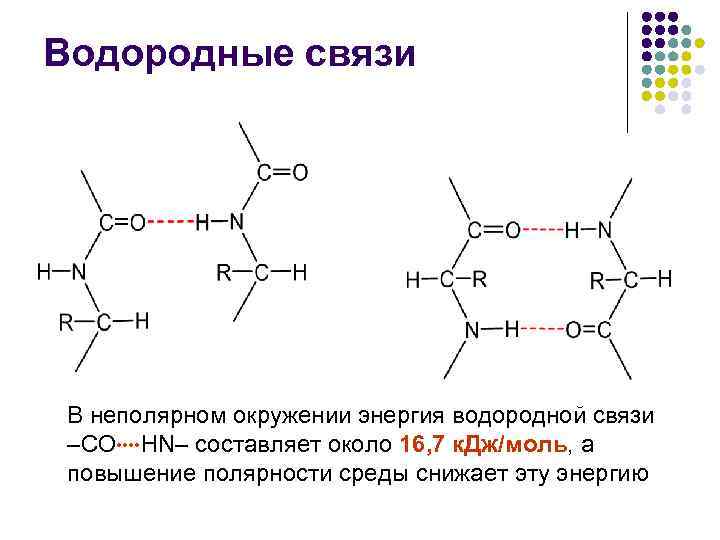
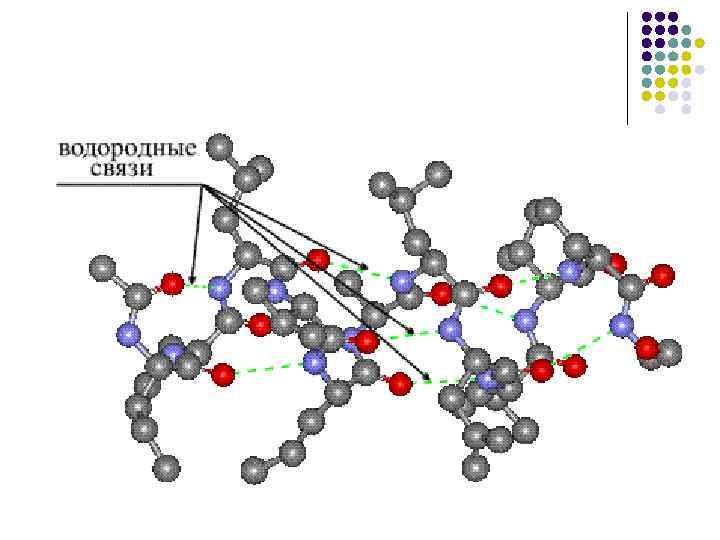
Водородные связи В неполярном окружении энергия водородной связи –СО НN– составляет около 16, 7 к. Дж/моль, а повышение полярности среды снижает эту энергию
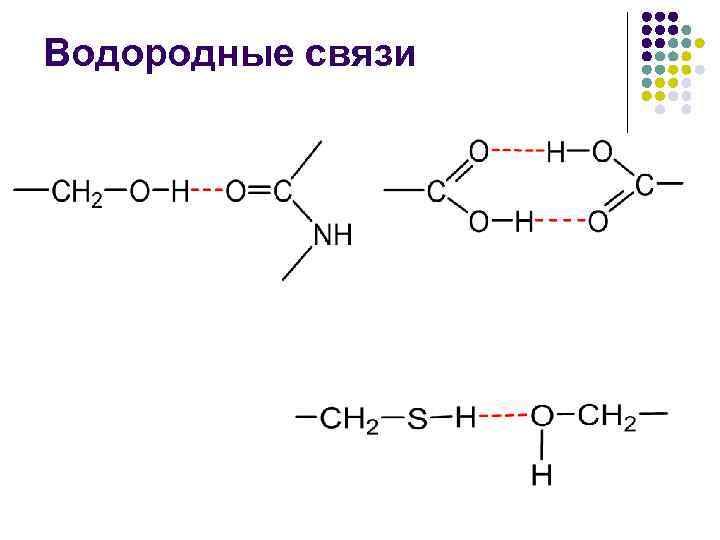
Водородные связи

Гидрофобные взаимодействия l l Имеют энтропийную природу Связаны с тем, что неполярные заместители выталкиваются из воды и стремятся ограничить свой контакт с ней Напротив, вода стремится восстановить свое структурированное состояние и как бы принудительно группирует заместители в кластеры, обладающие минимумом энергии Вступают в основном неполярные боковые группы аминокислотных остатков


Ван-дер-ваальсовы взаимодействия l l Складываются из дисперсионных сил притяжения атомов и сил взаимного отталкивания их электронных оболочек Энергетический вклад каждого контакта невелик (<0, 42 к. Дж/моль), но ввиду их большого числа ван-дер-ваальсовы взаимодействия дают основной вклад в суммарную энергию внутримолекулярных невалентных взаимодействий
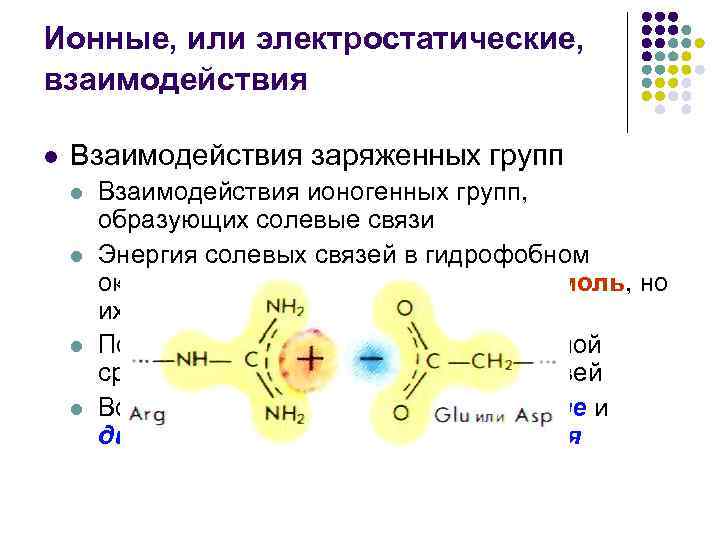
Ионные, или электростатические, взаимодействия l Взаимодействия заряженных групп l l Взаимодействия ионогенных групп, образующих солевые связи Энергия солевых связей в гидрофобном окружении может достигать 41, 9 к. Дж/моль, но их число сравнительно невелико Повышение диэлектрической постоянной среды понижает энергию солевых связей Во многом аналогичны ион-дипольные и диполь-дипольные взаимодействия
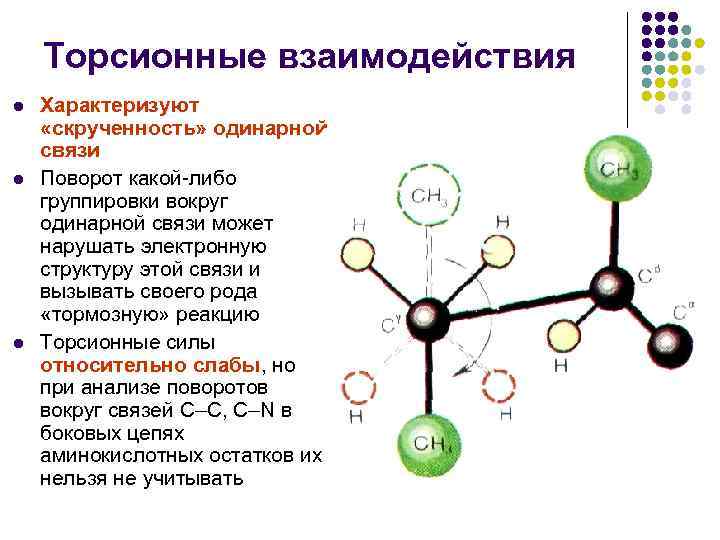
Торсионные взаимодействия l l l Характеризуют «скрученность» одинарной связи Поворот какой-либо группировки вокруг одинарной связи может нарушать электронную структуру этой связи и вызывать своего рода «тормозную» реакцию Торсионные силы относительно слабы, но при анализе поворотов вокруг связей С–С, С–N в боковых цепях аминокислотных остатков их нельзя не учитывать

Вторичная структура белков

Вторичная структура белка… l l пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокислот Образуется за счет водородных связей между пептидными группами как одной цепи, так и разных цепей

Вторичная структура белка l l l Любой участок молекулы белка имеет вторичную структуру Иногда рассматривают как вторичную структуру только периодические ее элементы: -спираль и -структуру Однако в белках встречаются участки, которые уложены вполне определенным способом, хотя их пространственная структура не содержит какого-либо периодически повторяющегося, регулярного мотива. Тем не менее к ним вполне приложимо понятие вторичной структуры Различают 2 вида вторичных структур: регулярные и нерегулярные Понятие вторичной структуры относится не ко всей белковой молекуле в целом, а к отдельным более или менее протяженным участкам ее полипептидной цепи

Вторичная структура белка l Взаимодействия, которым принадлежит важнейшая роль в формировании вторичной структуры, определяются: l l l особенностями пептидной связи стерическими ограничениями ( - и -углы) Основную роль играют водородные связи между периодически повторяющимися в цепи пептидными группировками

Стабилизация вторичной структуры за счет водородной связи l l Влияние окружающей белок воды Вода способна эффективно конкурировать за образование водородных связей: Влияние воды снижается при формировании компактной пространственной структуры белка, росте содержания пептидных связей, повышении вероятности их взаимодействия Таким образом, стабильность вторичной структуры зависит от ее включения в компактную третичную структуру

Вторичная структура белков -Спираль

-Спираль l В 50 -х годах ХХ в. Л. Полинг и Р. Кори, основываясь на данных о структуре кристаллов аминокислот и простых пептидов, рассмотрели возможные периодические конформации полипептидной цепи и пришли к выводу, что наиболее вероятна структура, названная ими -спиралью

-Спираль В основу ее выбора были положены следующие критерии: 1. Образование плотноупакованной компактной структуры без пустот и перекрывания атомов 2. Максимальная насыщенность структуры водородными связями с тем условием, чтобы их геометрия была близка к линейной 3. Соблюдение межатомных расстояний и углов, свойственных аминокислотам и простым пептидам l

-Спираль l С соблюдением этих условий можно построить как правую, так и левую спирали, однако правая -спираль оказывается энергетически несколько выгоднее левой, если пептидная цепь образована L-аминокислотами

-Спираль l l Спиральная структура возникает, когда во всех звеньях полипептидной цепи углы поворота вокруг простых связей ( и ) имеют одинаковую величину и знак (близки к 60 ), что и приводит к постепенному закручиванию цепи При этом радикалы аминокислотных остатков оказываются на периферии образованного спиралью цилиндра и могут, в зависимости от характера их, обеспечивать гидрофобную или гидрофильную природу цилиндрической поверхности
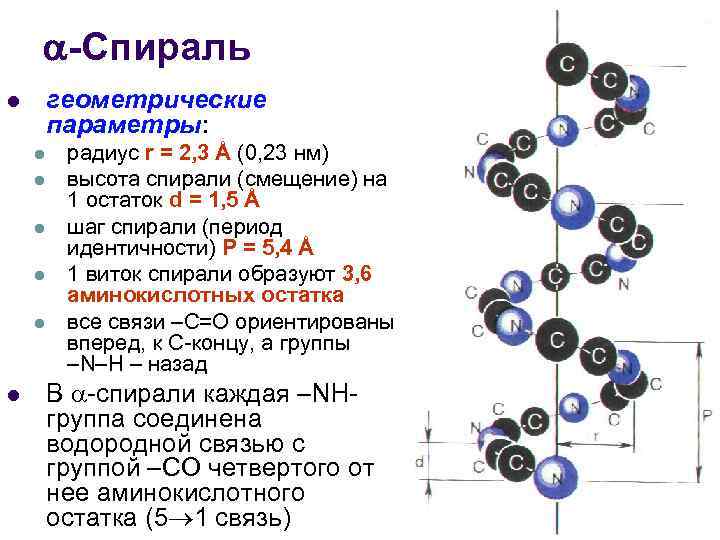
-Спираль геометрические параметры: l l l l радиус r = 2, 3 Å (0, 23 нм) высота спирали (смещение) на 1 остаток d = 1, 5 Å шаг спирали (период идентичности) Р = 5, 4 Å 1 виток спирали образуют 3, 6 аминокислотных остатка все связи –С=О ориентированы вперед, к С-концу, а группы –N–Н – назад В -спирали каждая –NНгруппа соединена водородной связью с группой –СО четвертого от нее аминокислотного остатка (5 1 связь)

-Спираль l l Длина -спиральных участков в глобулярных белках относительно невелика (5– 15 аминокислотных остатков, 3 – 4 витка спирали), в фибриллярных белках – гораздо протяженнее Иногда наблюдаются изломы -спирали, обычно в местах включения остатков про, прерывающих системы водородных связей. При этом ось спирали отклоняется на 20– 30

Вторичная структура белков -Структура

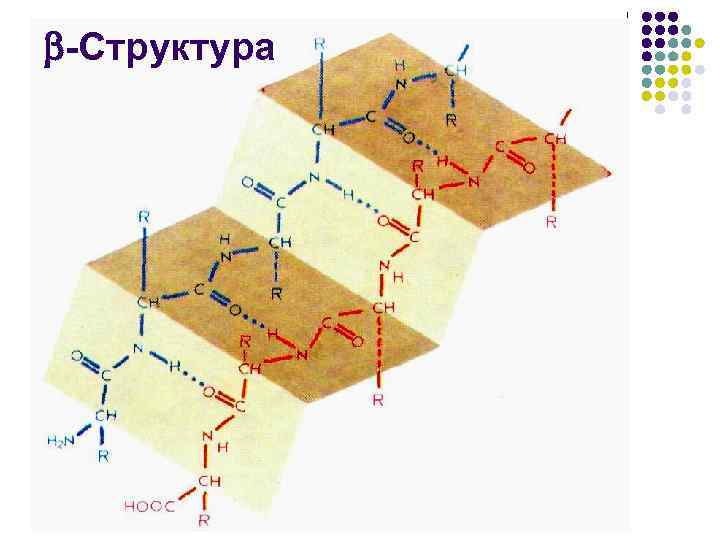
-Структура l l Предложена У. Т. Астбери в 1941 г. на основании рентгеноструктурных исследований -кератина Через 10 лет Л. Полинг и Р. Кори установили, что структура, или «складчатый лист» , – это стабилизированный межцепочечными водородными связями ассоциат вытянутых, зигзагообразных пептидных цепей
-Структура
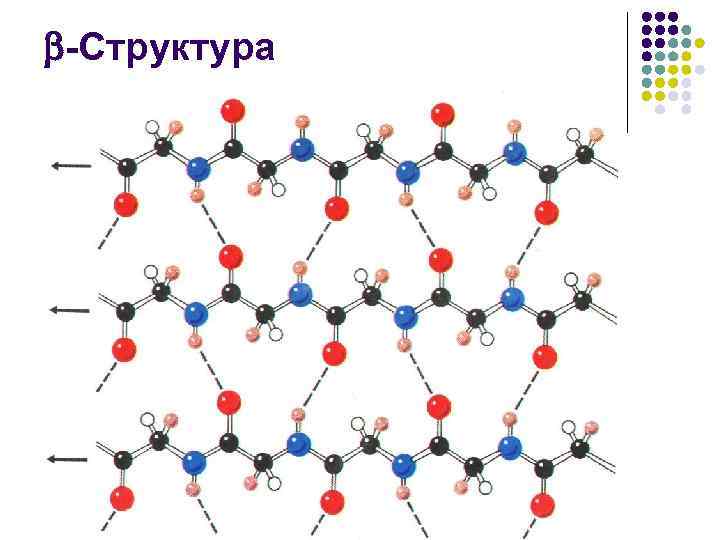
-Структура l l параллельная -структура = 180
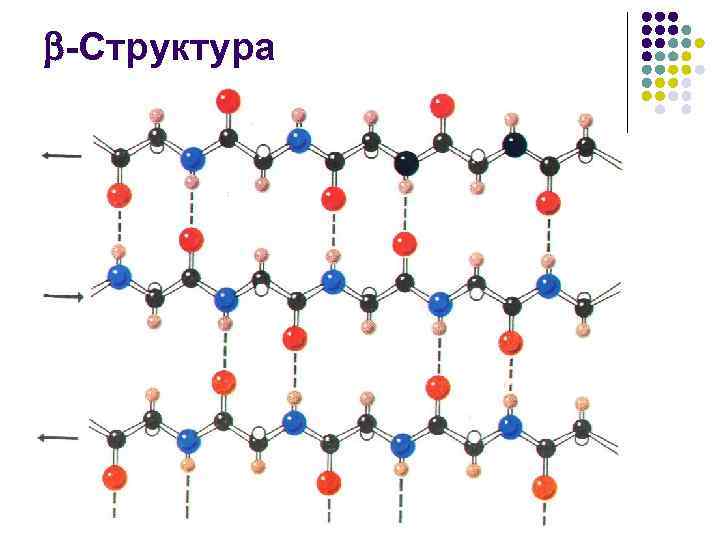
-Структура l l антипараллельная -структура – 140 , +135
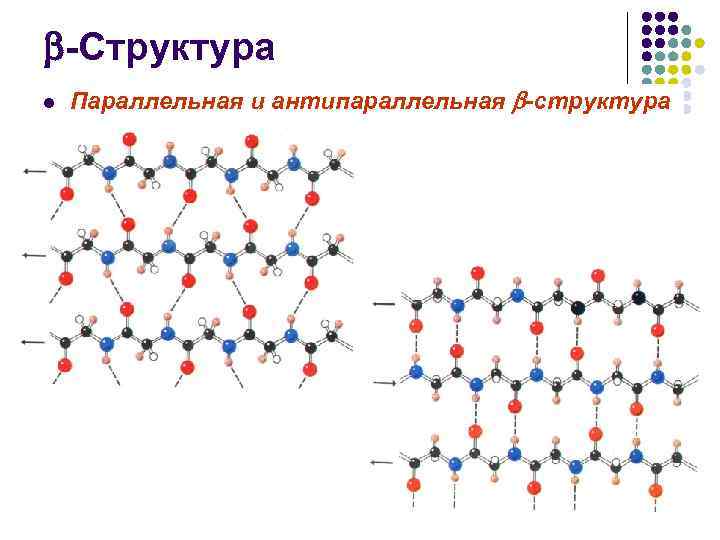
-Структура l Параллельная и антипараллельная -структура

-Структура l l Число аминокислотных остатков в отрезке пептидной цепи, образующем -структуру, обычно от 3 до 8 Протяженная -структура, так называемый -слой, или -складчатый лист чаще всего состоит из 2– 6 цепей, иногда до 10

-Структура l l l Боковые группы аминокислотных остатков при образовании структуры оказываются по разные стороны ее поверхности Сама же поверхность имеет складчатую форму, причем складки заданы -углеродными атомами Отходящие от них боковые группы образуют гребни Это позволяет формировать довольно протяженные поверхности, насыщенные однотипными (например, гидрофобными) боковыми радикалами Гидрофобные поверхности -складчатого слоя, взаимодействуя между собой или с гидрофобными гребнями -спиралей, участвуют в построении внутримолекулярных гидрофобных ядер, стабилизирующих пространственную структуру белка

Вторичная структура белков -Изгиб

-Изгиб l l Как -спираль, так и -структура обычно представлены в глобулярных белках сравнительно короткими отрезками, поэтому значительная часть вторичной структуры белка приходится на разного рода петли, позволяющие изменить направление пептидной цепи Наиболее экономный структурный элемент, позволяющий повернуть полипептид на 180 , используя всего 3 пептидные группировки, – -изгиб Стабилизируется одной водородной связью Практически всегда оказывается на поверхности белковой глобулы, поэтому нередко играет существенную роль в ее взаимодействии с другими молекулами
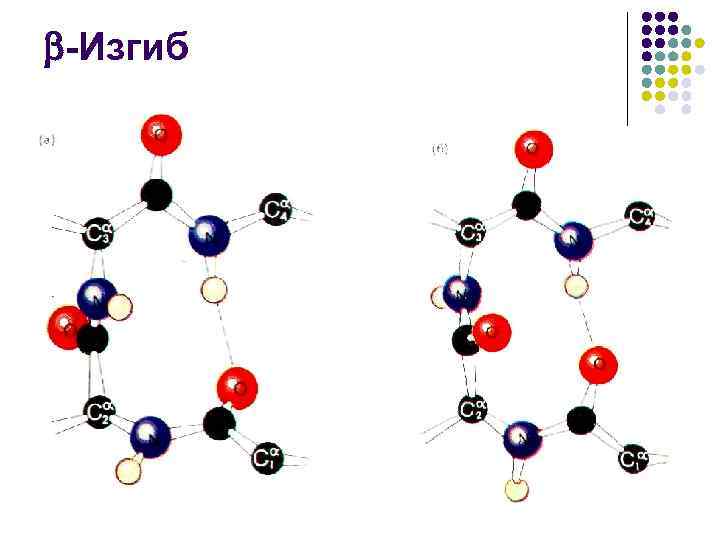
-Изгиб

Вторичная структура белков Зависимость от аминокислотной последовательности

l По результатам рентгеноструктурного анализа обнаружено, что способ укладки молекулы белка определяется его аминокислотной последовательностью l l l образованию -спирали способствуют ала, лей, глу образованию -структуры – мет, вал, иле изгибу цепи – гли, про, асн Если из 6 сгруппированных остатков аминокислот 4 способствуют образованию спирали, то данная группа – центр спирализации Если 3 остатка из 5 сгруппированных способствуют образованию -структуры, то данная группировка – затравка для -слоя

Сверхвторичная (надвторичная) структура белков

Сверхвторичная (надвторичная) структура белков l l Этот уровень организации белковой молекулы связан с наличием ансамблей взаимодействующих между собой вторичных структур Пространственное строение таких ансамблей и называют сверхвторичной структурой белковой молекулы, которая энергетически наиболее предпочтительна

Сверхвторичная (надвторичная) структура белков Типы сверхвторичных структур

Суперспирализованная -спираль l l Образуется при скручивании нескольких -спиралей в протофибриллы ( -кератин), которые объединяются в микрофибриллы -Спирали удерживаются силами Ван-дер-Ваальса

l две антипараллельно упакованные -спирали
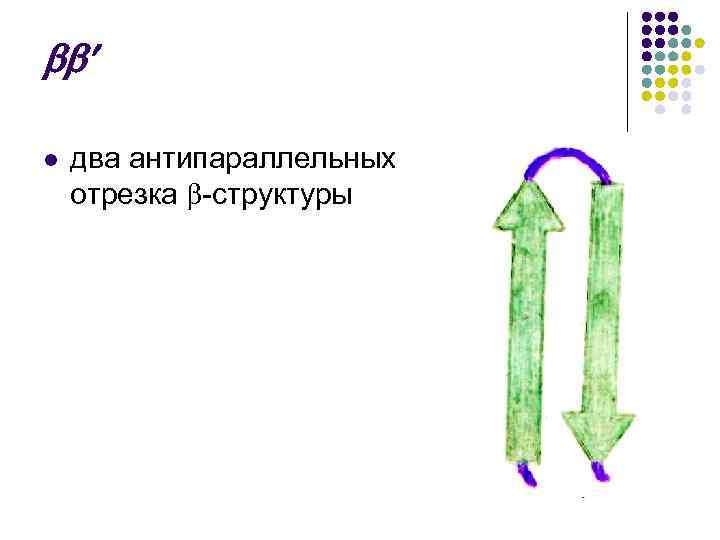
l два антипараллельных отрезка -структуры

х l звено, состоящее из двух параллельных -слоев с сочленением между ними в виде: l неупорядоченного клубка – с
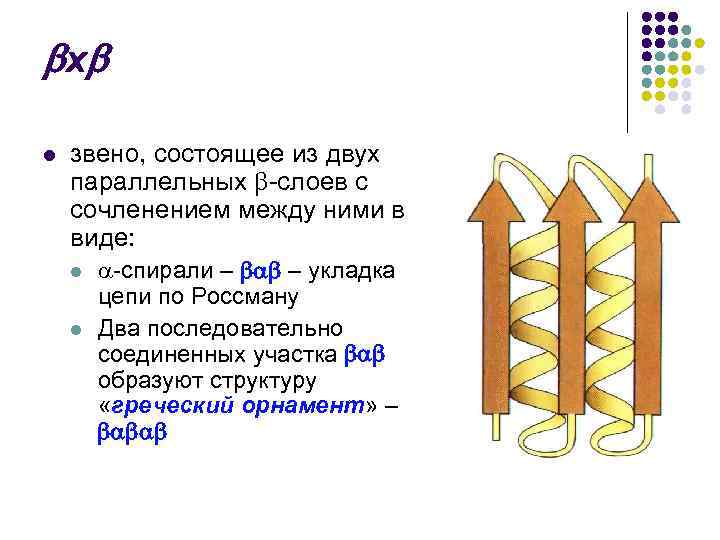
х l звено, состоящее из двух параллельных -слоев с сочленением между ними в виде: l l -спирали – – укладка цепи по Россману Два последовательно соединенных участка образуют структуру «греческий орнамент» –
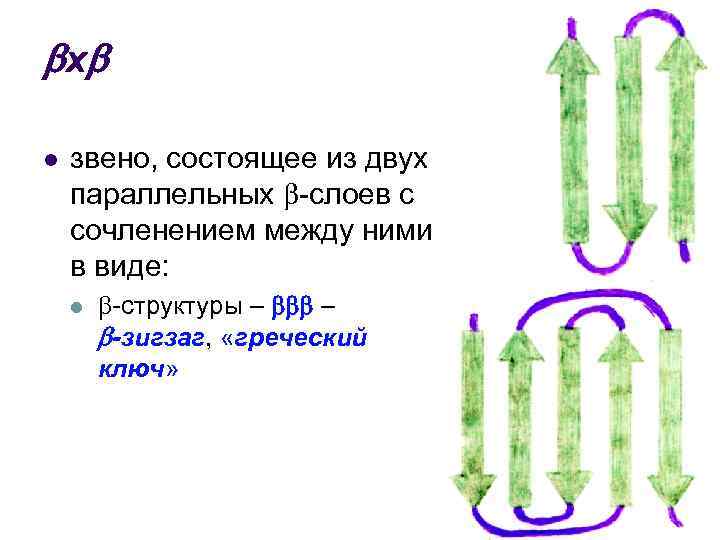
х l звено, состоящее из двух параллельных -слоев с сочленением между ними в виде: l -структуры – – -зигзаг, «греческий ключ»
Домены

Домены l l Многие белки содержат относительно слабо взаимодействующие между собой участки – домены Домены (от фр. domaine – владение) – структурно и функционально обособленные области (субобласти) молекулы, соединенные друг с другом короткими участками полипептидной цепи, которые называются шарнирными участками Функциональные домены могут состоять из одного или нескольких структурных доменов У ряда ферментов в углублениях между доменами располагается активный центр

Домены Классификация структурных доменов и белков по организации пространственной структуры полипептидной цепи
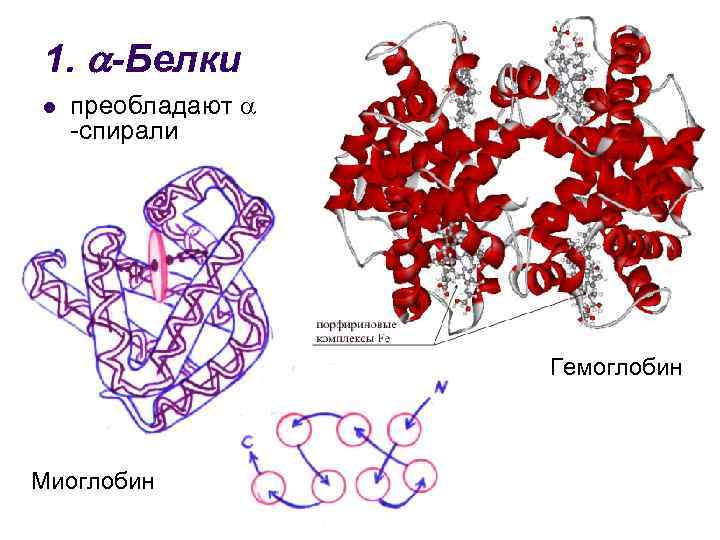
1. -Белки l преобладают -спирали Гемоглобин Миоглобин
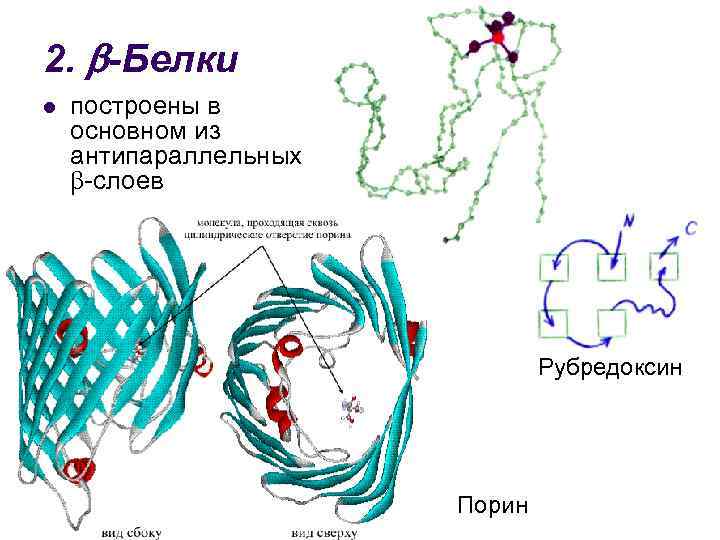
2. -Белки l построены в основном из антипараллельных -слоев Рубредоксин Порин
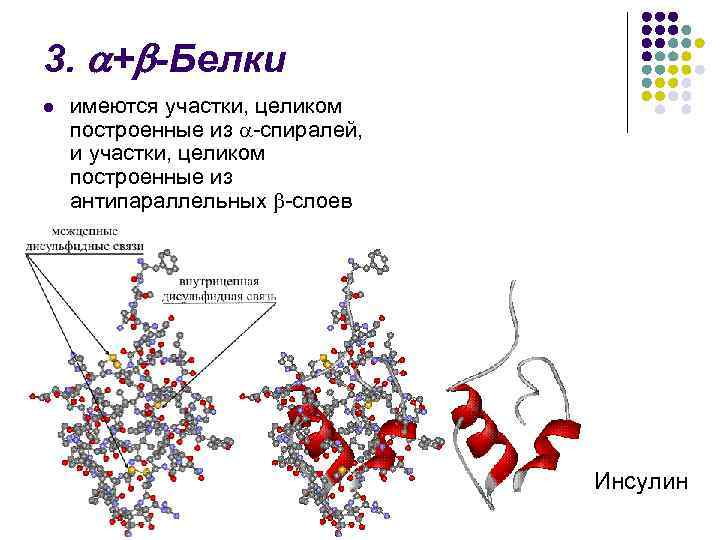
3. + -Белки l имеются участки, целиком построенные из -спиралей, и участки, целиком построенные из антипараллельных -слоев Инсулин
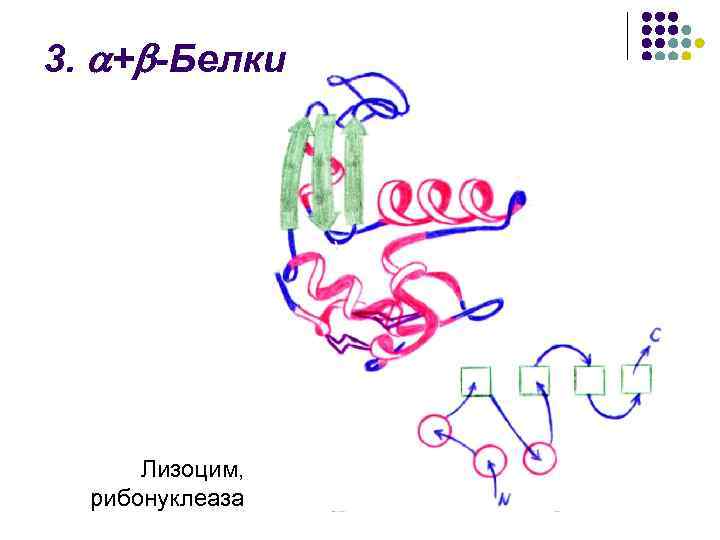
3. + -Белки Лизоцим, рибонуклеаза

4. / -Белки l l -Спирали и -структуры чередуются по ходу цепи Большинство -структур (параллельные) оказываются локализованными в центральной части молекулы, где эти структуры изгибаются в виде пропеллера ( «твист» структуры), образуя жесткую «основу» , с которой связаны остальные участки молекулы
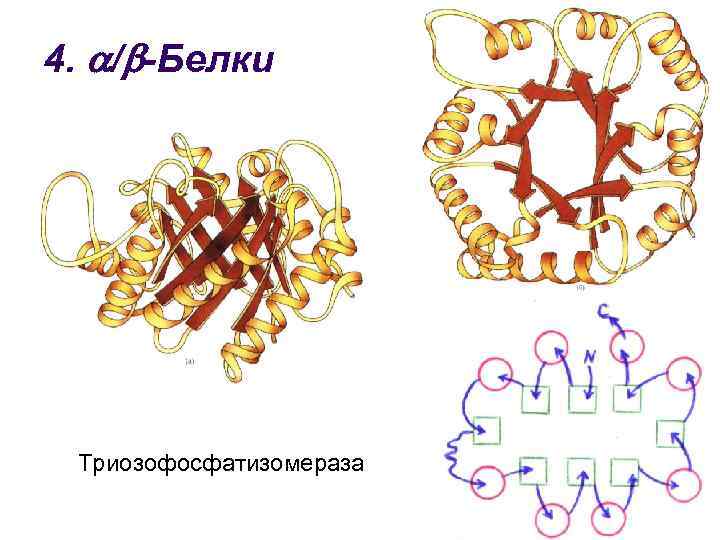
4. / -Белки Триозофосфатизомераза

5. Домены и белки без выраженной вторичной структуры

Домены l l l Средний размер домена обычно – 100– 150 остатков, что отвечает глобуле с поперечником около 2, 5 нм Вместе с тем встречаются и значительно большие домены Вероятнее всего, формирование пространственной структуры белка вначале происходит внутри будущих доменов, а взаимная укладка доменов, т. е. образование третичной структуры, происходит на заключительных этапах формирования глобулы

Третичная структура белка

Третичная структура белка… l l l характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью Имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной
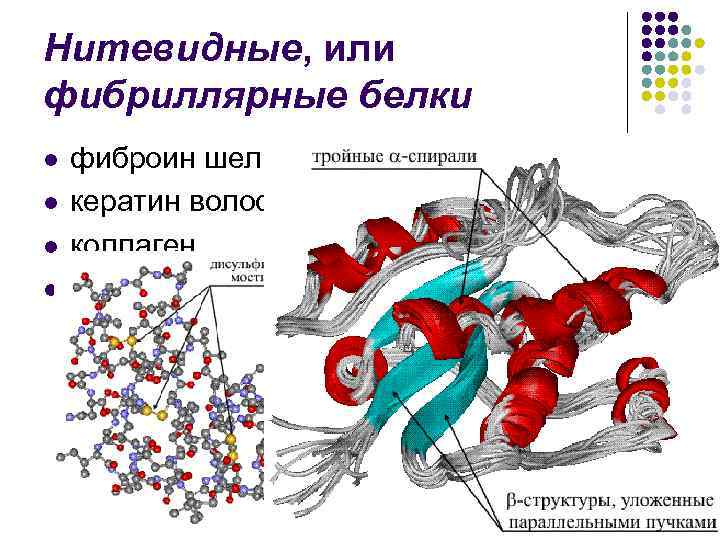
Нитевидные, или фибриллярные белки l l фиброин шелка кератин волос, рогов, копыт коллаген и др.

Шаровидные, или глобулярные белки

Третичная структура белка l l основа функциональности белка, которая требует точной пространственной организации больших ансамблей, построенных из множества аминокислотных остатков Такие ансамбли (домены) формируют: l l активные центры ферментов зоны связывания других биологических молекул эффекторные центры белков и т. д. , поэтому нарушение третичной структуры белка (денатурация) неизменно приводит к утрате им способности функционировать

Третичная структура белка l l l Стабильность третичной структуры зависит от системы нековалентных взаимодействий внутри белковой глобулы (? ) Некоторые белки дополнительно стабилизируются ковалентными – дисульфидными – связями Gцепь = RТln. К = Нцепь – Т Sцепь Нцепь < 0 –Т Sцепь > 0 ( S < 0) При компенсации К = 1 (? ) Чтобы равновесие сдвинулось в сторону образования компактной структуры, необходимо существенное превышение Нцепь над –Т Sцепь

Третичная структура белка l Соотношение Нцепь и –Т Sцепь зависит от: l l числа нековалентных связей, устанавливающихся при свертывании молекулы белка в глобулу, а значит, от длины полипептидной цепи от температуры. С ростом Т |Т S| рано или поздно превысит | Н| и пространственная структура утратит стабильность – тепловая денатурация белка

Третичная структура белка l l При свертывании глобулы убывает энтропия пептидной цепи, но одновременно происходит возрастание энтропии растворителя – воды Это играет решающую роль в стабилизации третичной структуры

Третичная структура белка l l Вода – необычный, в высокой мере структурированный растворитель (? ) Полярные группы белка легко включаются в льдоподобные структуры воды, устанавливая с ней водородные связи Неполярные группы занимают своеобразные полости, образованные молекулами воды, связанными водородными связями Все это выключает из хаотического движения значительное число молекул воды, т. е. происходит упорядочение, уменьшение энтропии воды

Третичная структура белка l l l Но так как неполярные группы белка не могут «отслаиваться» от молекулы, происходит свертывание глобулы, при котором значительная часть (не менее ½) гидрофобных групп оказывается скрытой от контакта с водой Это влечет установление гидрофобных контактов, ван-дер-ваальсовых сил Происходит понижение энтропии белка Следствием образования глобулы является разрушение значительной части водородных связей и гидрофобных взаимодействий боковых групп с молекулами воды Возрастает хаотичность движения последних, и энтропия воды растет

Четвертичная структура белка

Четвертичная структура белка… l l l Четвертичную структуру имеют олигомерные белки, молекулы которых состоят из двух и более полипептидных цепей, связанных нековалентно Четвертичная структура – размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка Взаимодействие между субъединицами достаточно сильно, так что их ансамбль (ансамбль глобул) выступает как единая молекула, в то же время каждая из объединившихся глобул сохраняет значительную автономность
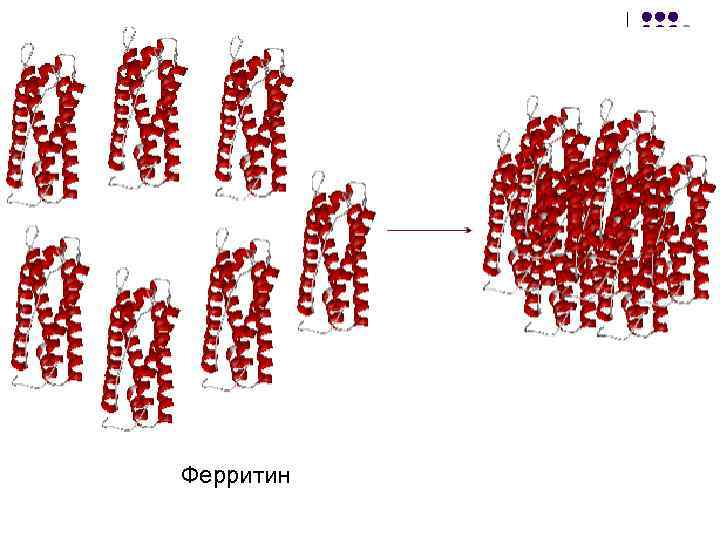
Ферритин

Четвертичная структура белка l l Субъединицы, образующие четвертичную структуру белка, могут быть совершенно различными по строению и функциям – гетеромерные белки Это позволяет объединить в одной структуре несколько взаимосвязанных функций, создать полифункциональную молекулу l l Пример. Протеинкиназа: С-субъединица отвечает за ферментативную активность, а R-субъединица – регуляторная В гомомерных белках субъединицы одинаковы

Четвертичная структура белка l Межсубъединичные контакты – весьма развитая система нековалентных взаимодействий l l Контакты между гидрофобными группами и целыми гидрофобными участками на поверхности субъединиц (контактные площадки, или зоны), приводящие к возрастанию энтропии системы и сдвигу равновесия в сторону олигомера водородные связи электростатические взаимодействия между боковыми группами Четвертичная структура менее прочная, чем третичная, т. к. меньше вклад гидрофобных контактов

Четвертичная структура белка Функциональное значение

Функции четвертичной структуры 1. Объединение нескольких взаимосвязанных функций в единой структуре 2. Архитектурная функция 1. Формирование пространственных образований весьма сложной конфигурации, обеспечивающих специфические функциональные возможности белка (ферритин) 2. Суммарное проведение последовательных реакций ферментами 3. Формирование функциональных центров (активных центров ферментов)

Функции четвертичной структуры 3. Обеспечение множественных взаимодействий белка с протяженными структурами l ДНК-связывающие белки – димеры (? ) 4. Регуляторная функция. Передача эффекта (нарушение третичной структуры при взаимодействии с субстратом) передается от одной субъединицы к другой, что приводит к перестройке всей четвертичной структуры
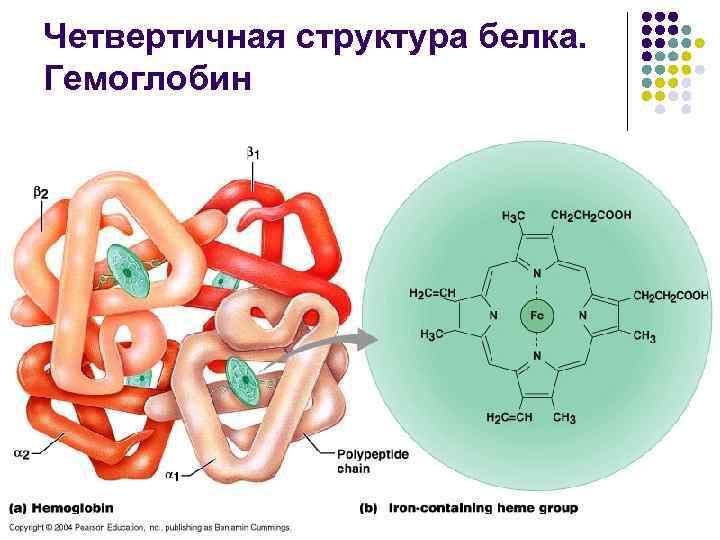
Четвертичная структура белка. Гемоглобин
Вывод

1. Каждый индивидуальный белок характеризуется уникальной структурой, обеспечивающей уникальность его функций 2. Поэтому выяснение структуры разнообразных белков может служить ключом к познанию природы живых систем и, соответственно, сущности жизни

Литература l l l l Березов Т. Т. , Коровкин Б. Ф. Биологическая химия. – М. : Медицина, 1983 Мецлер Д. Биохимия. Химические реакции в живой клетке. В 3 -х т. – Т. т. 1, 2. – М. : Мир, 1980 Овчинников Ю. А. Биоорганическая химия. – М. : Просвещение, 1987 Основы биохимии / Под ред. А. А. Анисимова. – М. : Высшая школа, 1986 Рис Э. , Стренберг М. От клеток к атомам. Иллюстрированное введение в молекулярную биологию. – М. : Мир, 1988 Степанов В. М. Молекулярная биология. Структура и функции белков. – М. : Высшая школа, 1996 Филиппович Ю. Б. Основы биохимии. – М. : Высшая школа, 1993
Тема_5_Белки_Структура_белковой_молекулы.ppt