Белки.ppt
- Количество слайдов: 65

БЕЛКИ Строение и функции
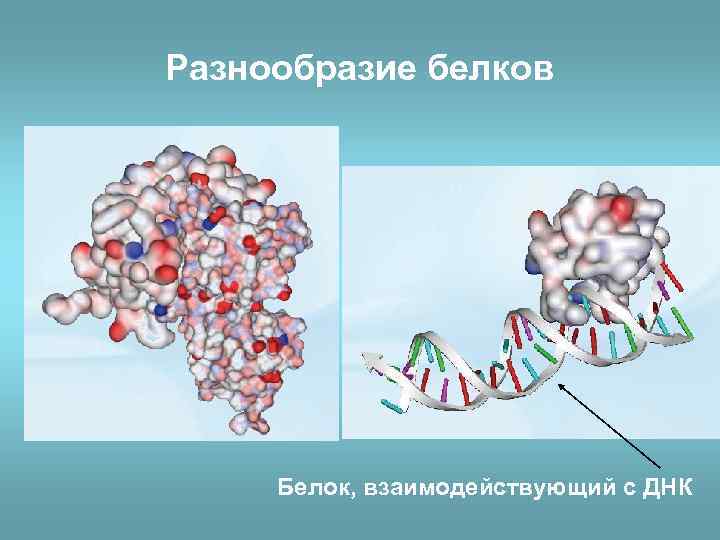
Разнообразие белков Белок, взаимодействующий с ДНК
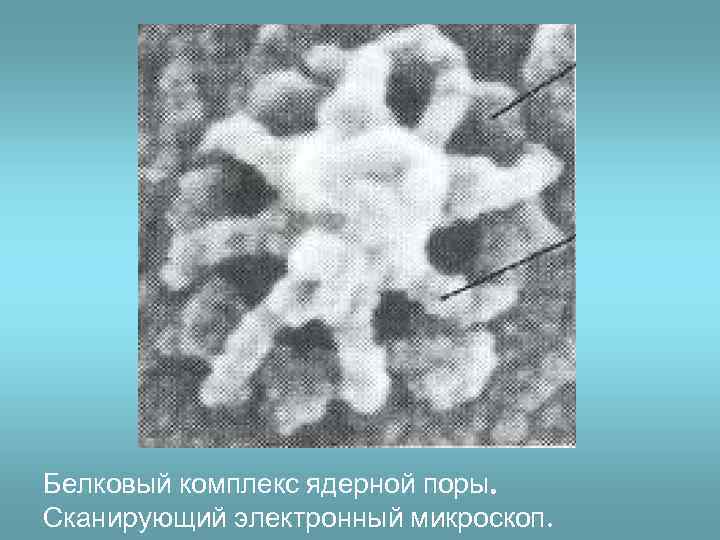
Белковый комплекс ядерной поры. Сканирующий электронный микроскоп.
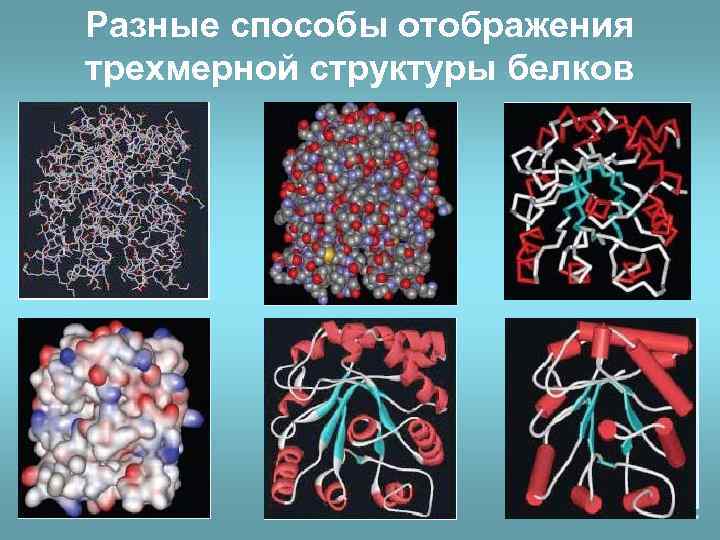
Разные способы отображения трехмерной структуры белков
Белок бабочки

Аденилатциклаза I мышцы человека
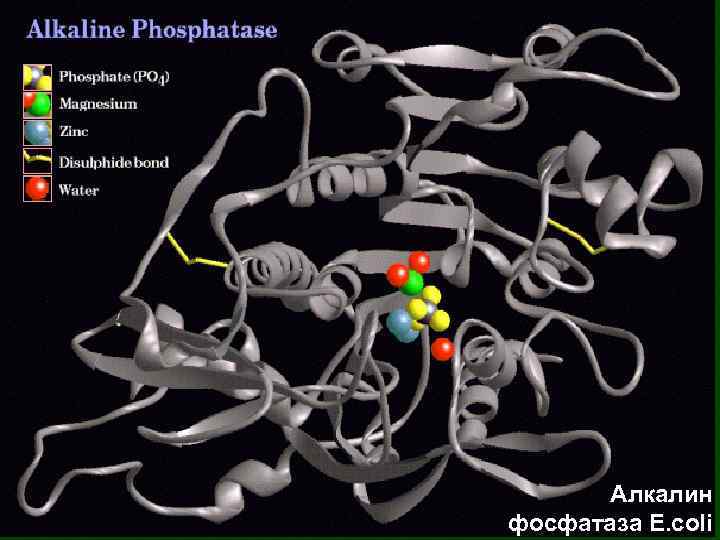
Алкалин фосфатаза E. coli
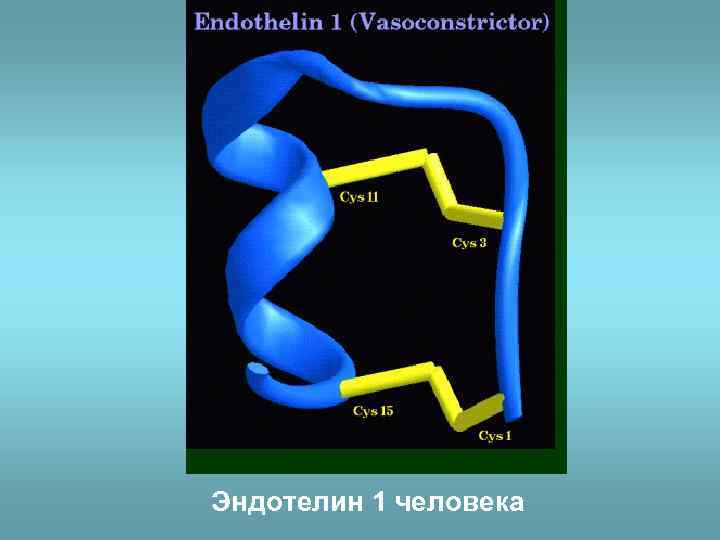
Эндотелин 1 человека
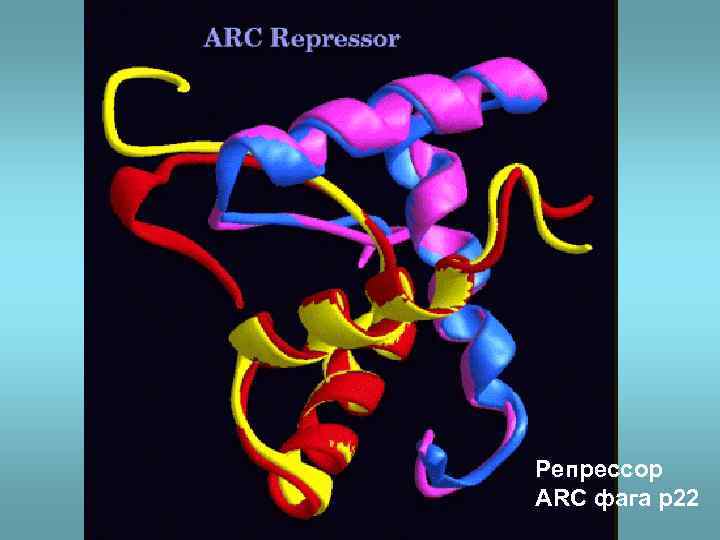
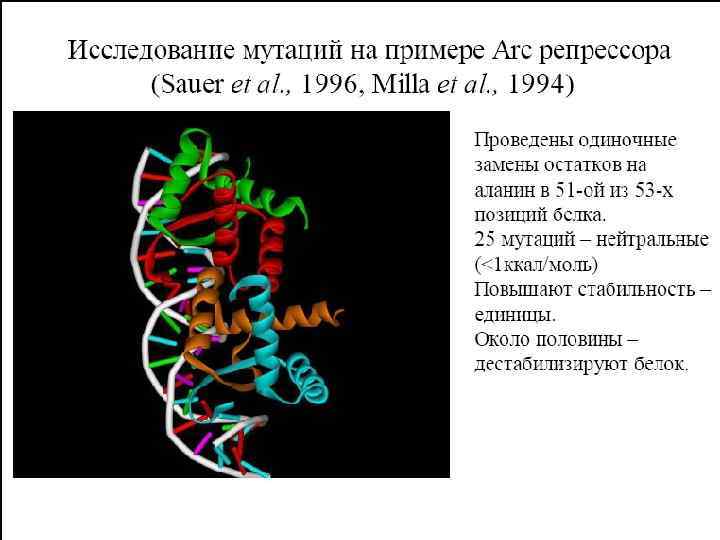
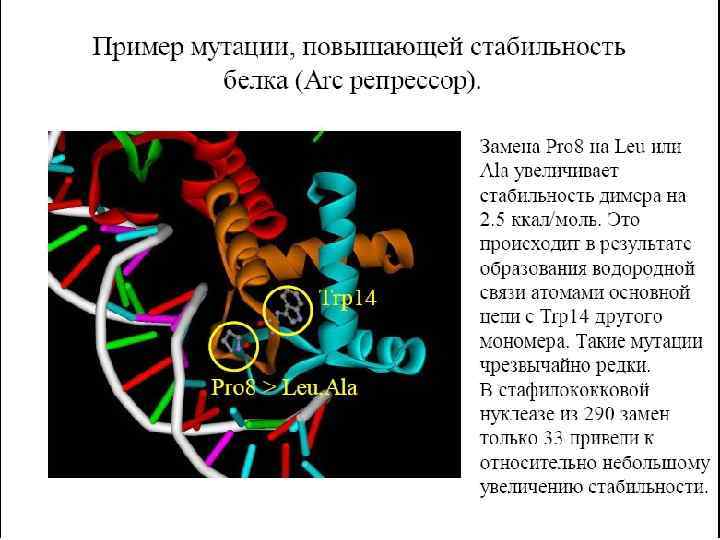
Репрессор ARC фага p 22
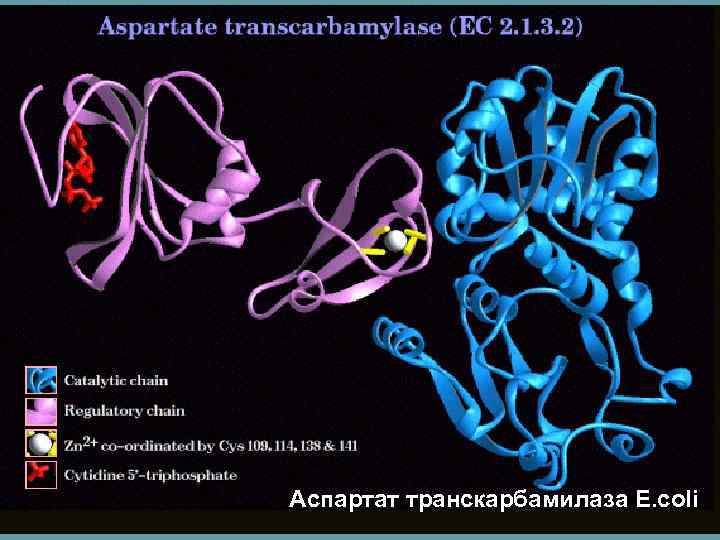
Аспартат транскарбамилаза E. coli
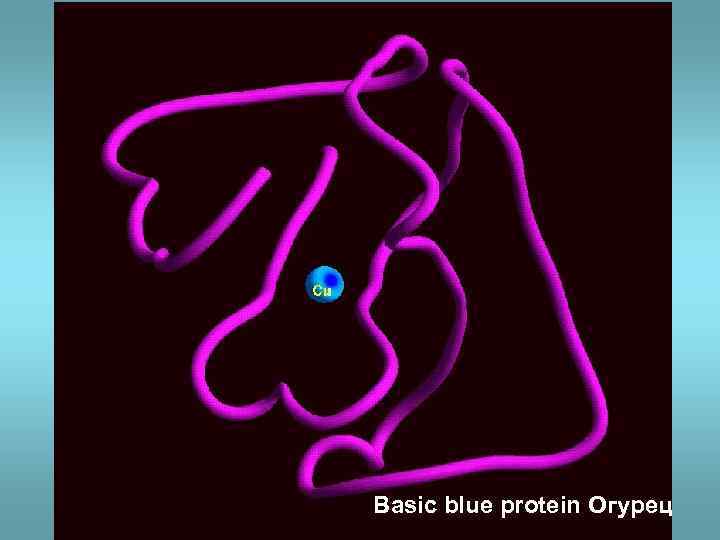
Basic blue protein Огурец
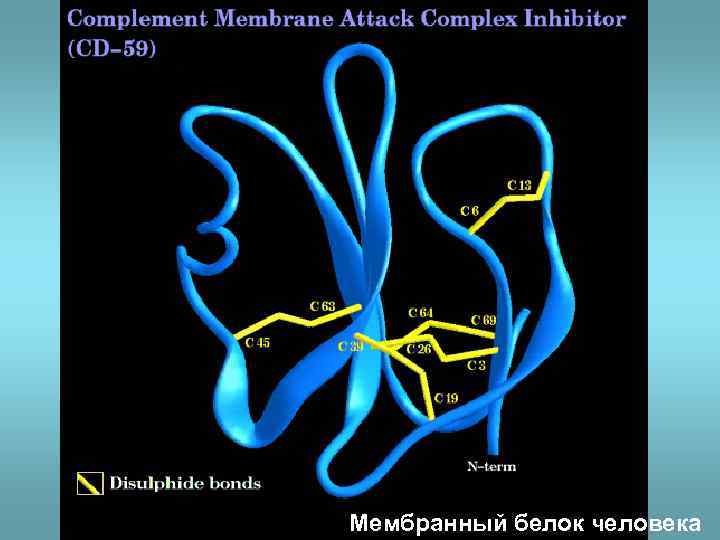
Мембранный белок человека
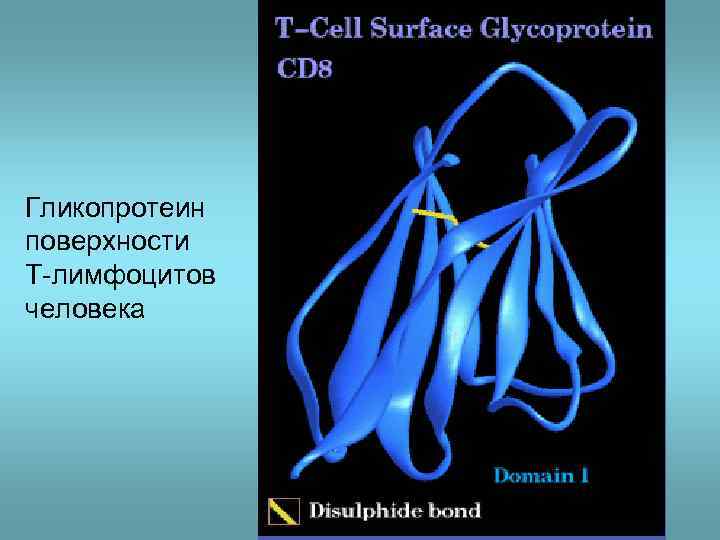
Гликопротеин поверхности T-лимфоцитов человека
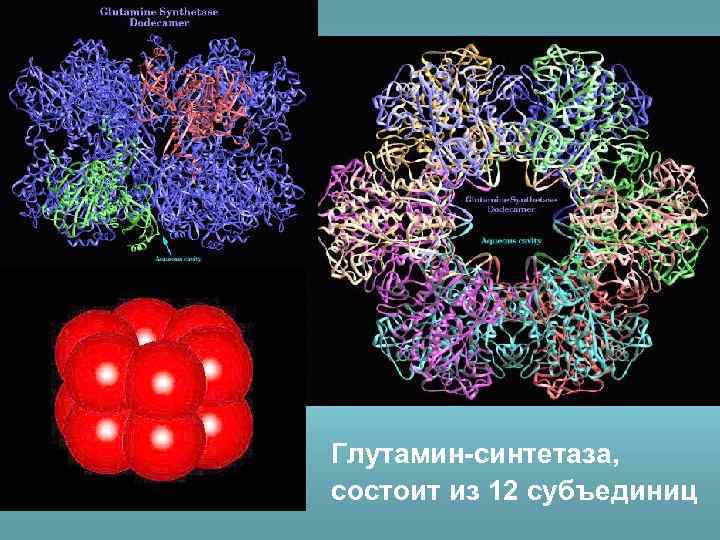
Глутамин-синтетаза, состоит из 12 субъединиц
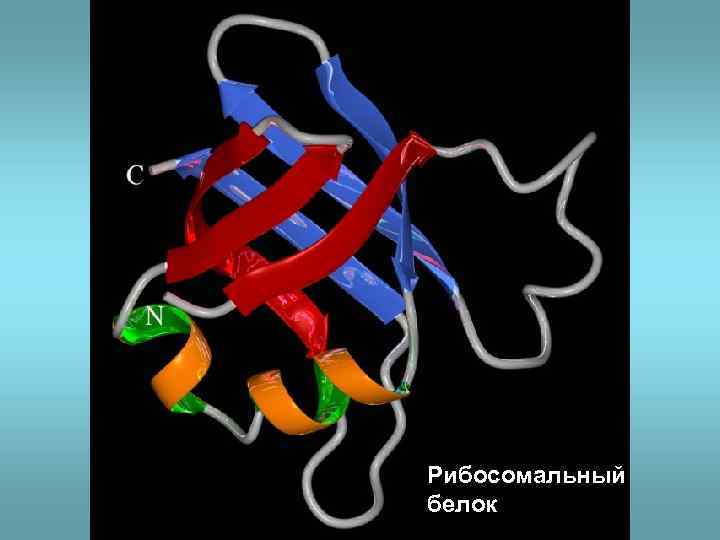
Рибосомальный белок
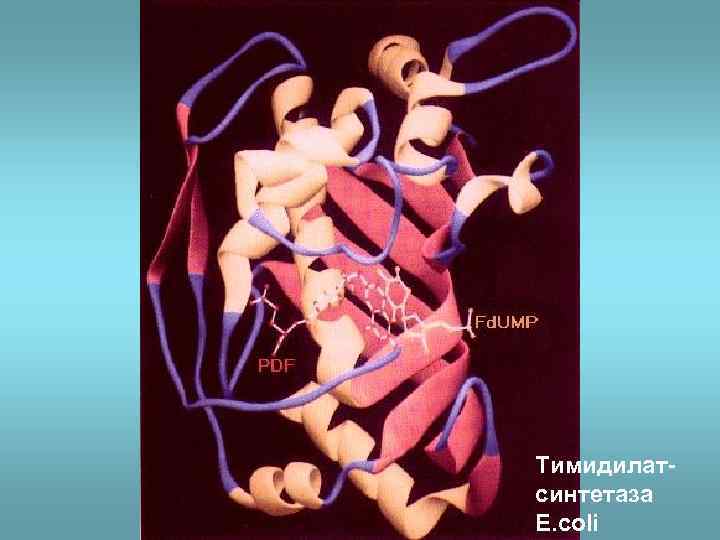
Тимидилатсинтетаза E. coli
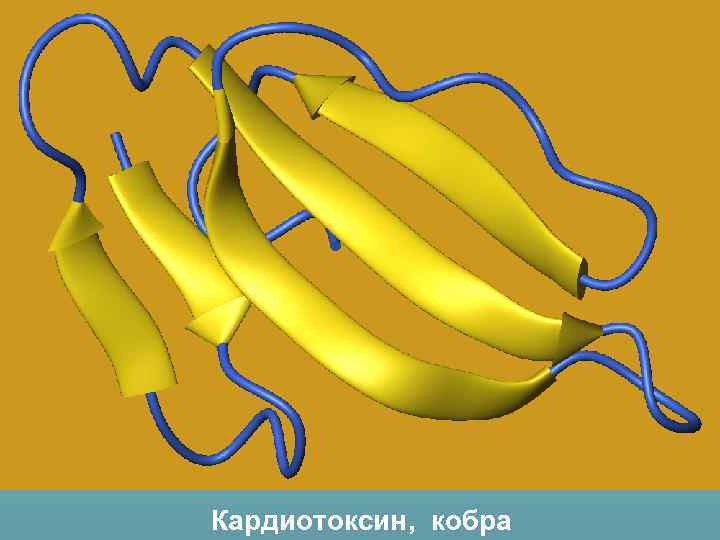
Кардиотоксин, кобра
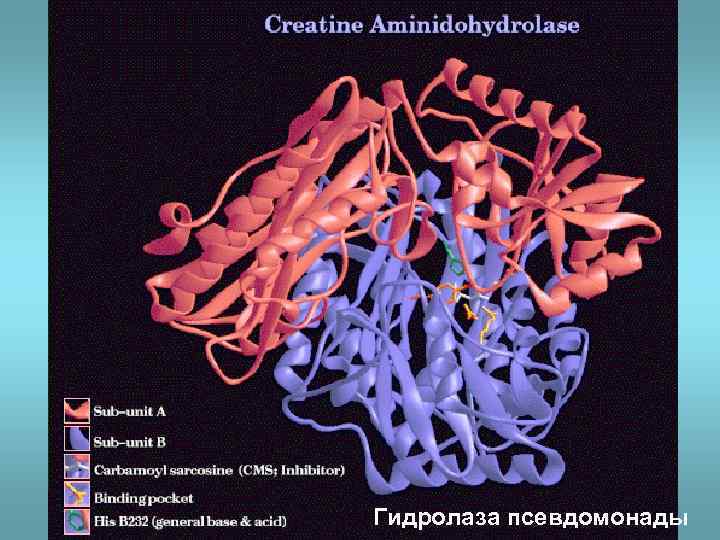
Гидролаза псевдомонады

Выводы • Белки – макромолекулы. • Они разнообразны по размеру, форме и химическим группам на поверхности. • Форма и атомы в составе белка – не случайны, от них зависит его функция. • Каждый организм синтезирует строго определенные белки – характерные для его биологического вида. • Как он это делает? И откуда знает, как синтезировать такие сложные молекулы?

• Белки – нерегулярные полимеры • Мономерами являются аминокислоты - 20 • I структура белка – последовательность аминокислот в полипептидной цепочке, записанная от N к C концу. • II структура – α-спираль или β-слой. Эти элементы одинаковы у всех белков. • III структура – уникальная пространственная форма данного белка • IV структура – объединение нескольких цепочек (субъединиц) в один белок.
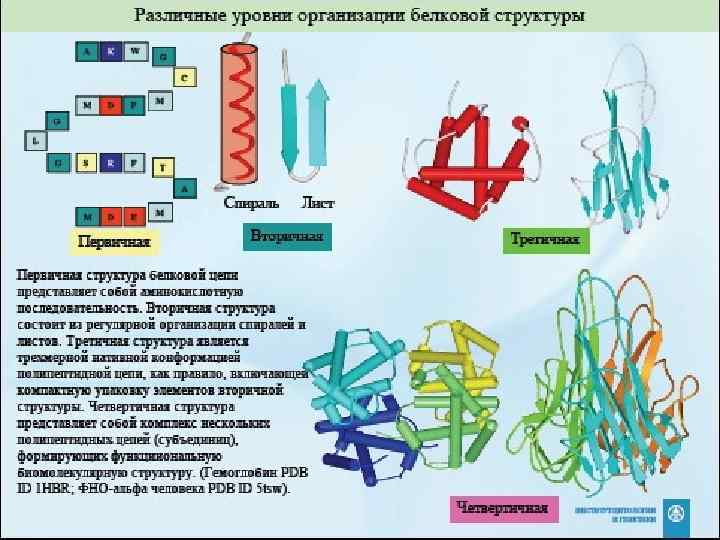

Первичная структура белков • Теоретически возможное многообразие – 20 n, где n – количество аминокислот в полипептидной цепочке.
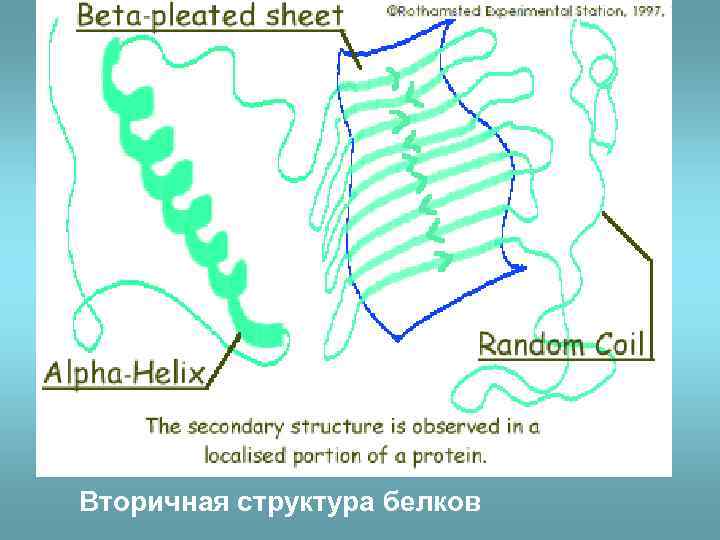
Вторичная структура белков
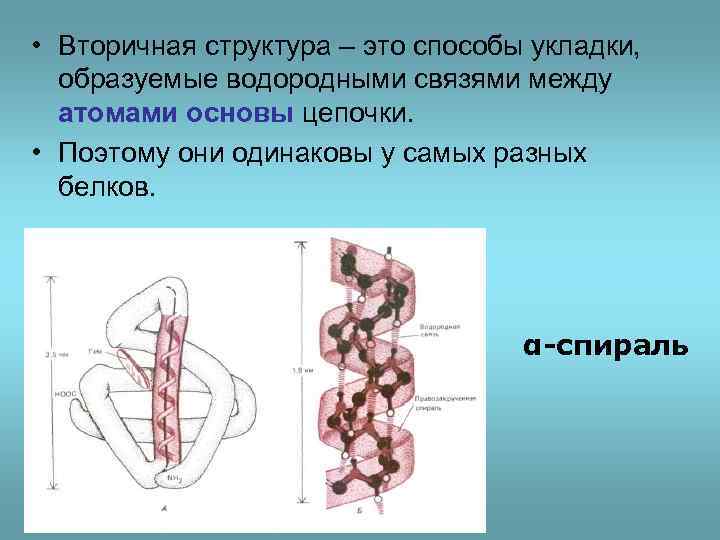
• Вторичная структура – это способы укладки, образуемые водородными связями между атомами основы цепочки. • Поэтому они одинаковы у самых разных белков. α-спираль
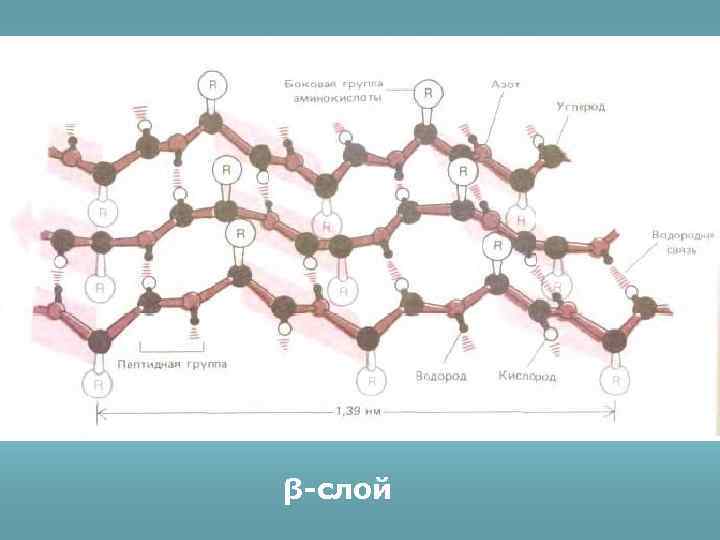
β-слой
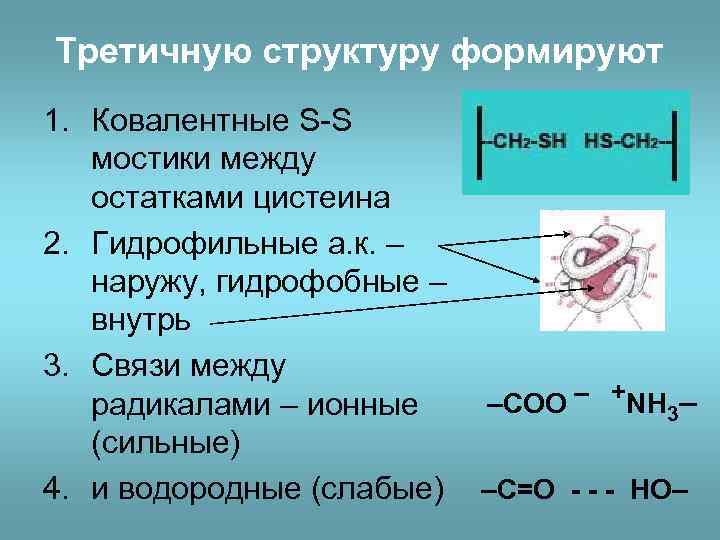
Третичную структуру формируют 1. Ковалентные S-S мостики между остатками цистеина 2. Гидрофильные а. к. – наружу, гидрофобные – внутрь 3. Связи между радикалами – ионные (сильные) 4. и водородные (слабые) –COO – +NH 3– –C=O - - - HO–
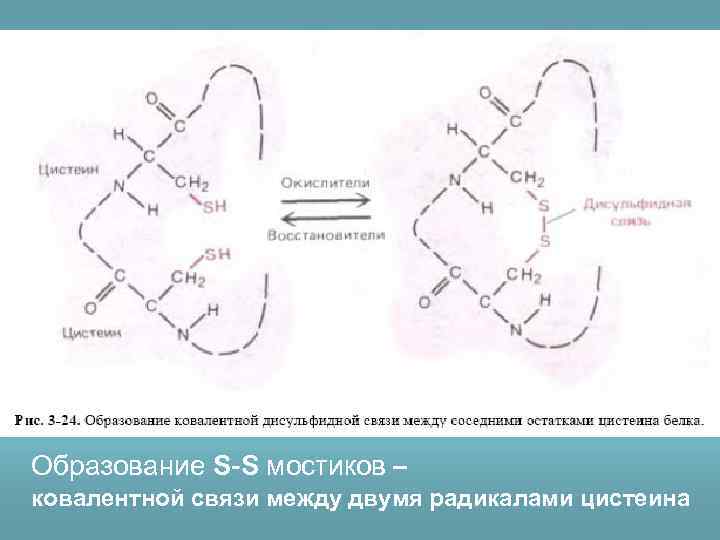
Образование S-S мостиков – ковалентной связи между двумя радикалами цистеина
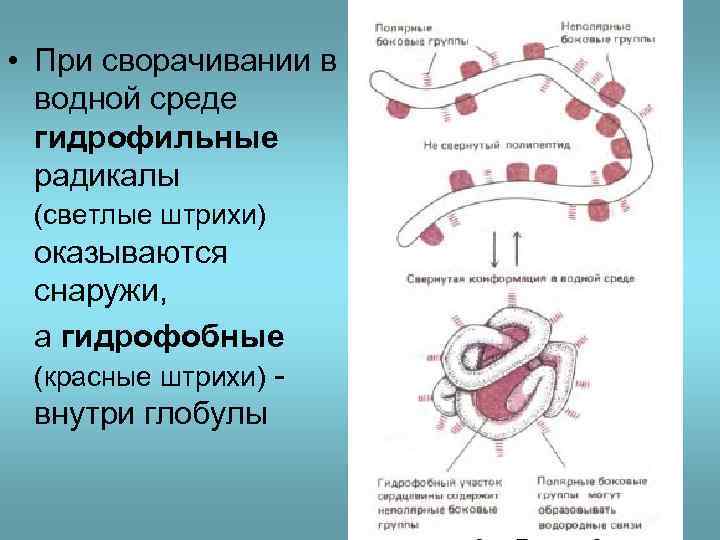
• При сворачивании в водной среде гидрофильные радикалы (светлые штрихи) оказываются снаружи, а гидрофобные (красные штрихи) внутри глобулы

Обратимая денатурация белка

ФУНКЦИИ БЕЛКОВ

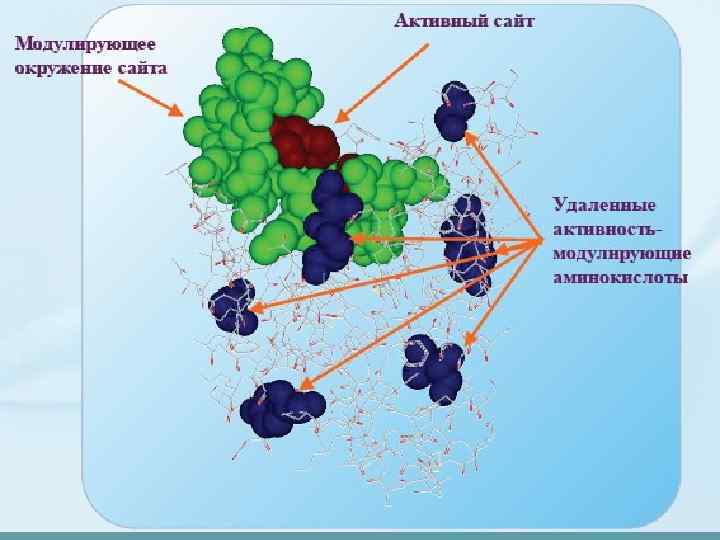
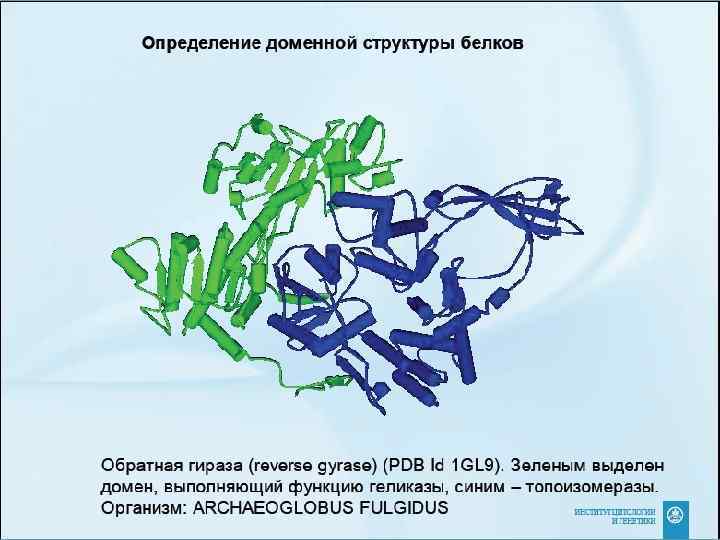
Структура белков определяет их функции • Участок белка, непосредственно выполняющий какую-либо функцию, называется активным центром. Обычно его формируют 3 -5 аминокислот, находящихся не рядом в первичной последовательности. • Многие белки имеют несколько функций – и в молекуле можно выделить участки – домены, каждый из которых отвечает за одну функцию и содержит ее активный центр.
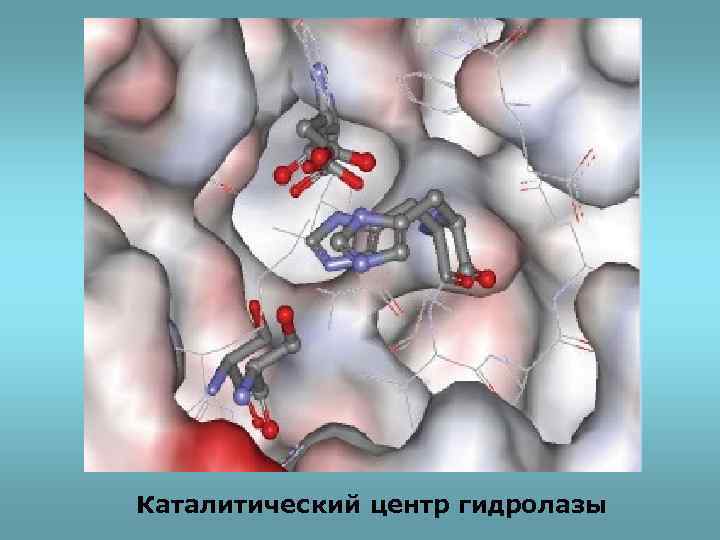
Каталитический центр гидролазы
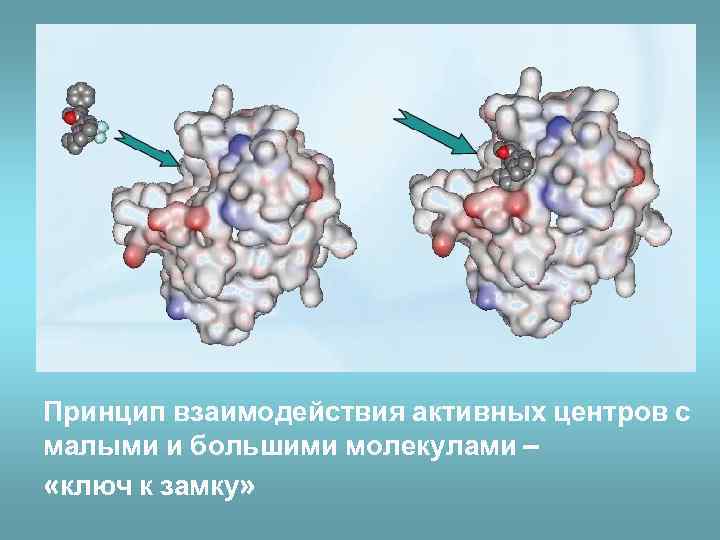
Принцип взаимодействия активных центров с малыми и большими молекулами – «ключ к замку»

Рецептор и лиганд

• Кофакторы – молекулы небелковой природы, присутствующие в активном центре многих белков. Это могут быть ионы тяжелых металлов и другие микроэлементы, например кобальт, бром, медь, цинк, йод. • Органические кофакторы называют коферменты – например, НАДФ, ФАД, необходимые для ферментов фотосинтеза и дыхания. Большинство коферментов – производные витаминов, поэтому витамины и нужны в небольшом количестве. • Если кофактор соединен с ферментом ковалентной связью – он называется простетической группой. Например, гем в молекуле гемоглобина.
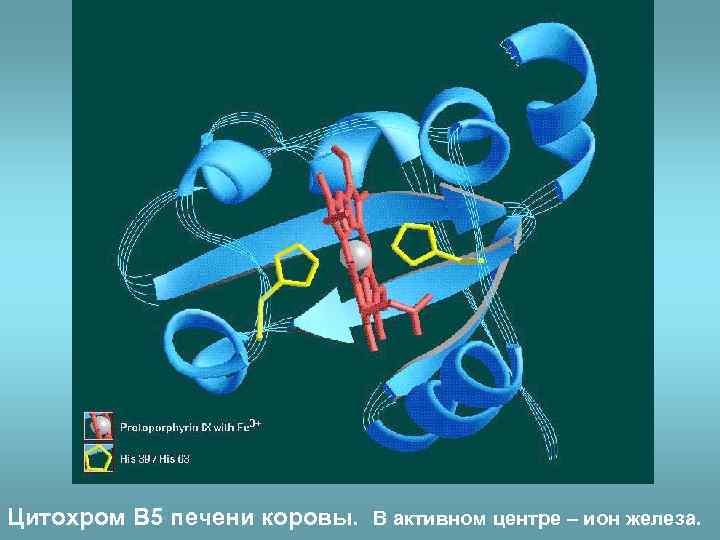
Цитохром B 5 печени коровы. В активном центре – ион железа.
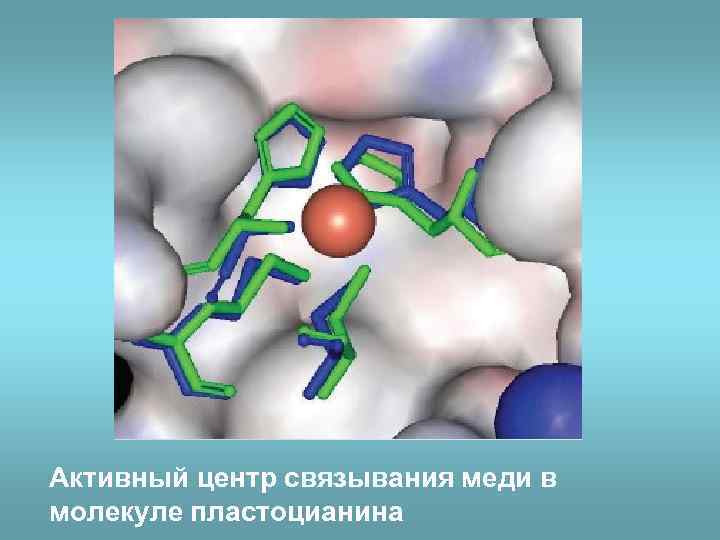
Активный центр связывания меди в молекуле пластоцианина
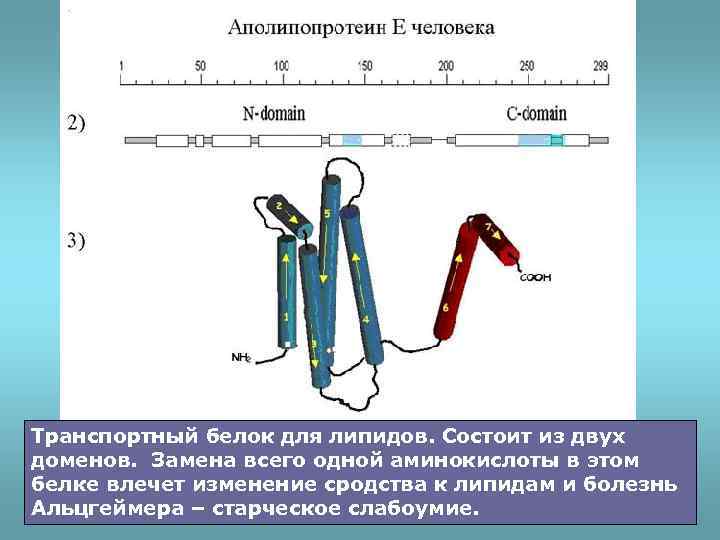
Транспортный белок для липидов. Состоит из двух доменов. Замена всего одной аминокислоты в этом белке влечет изменение сродства к липидам и болезнь Альцгеймера – старческое слабоумие.
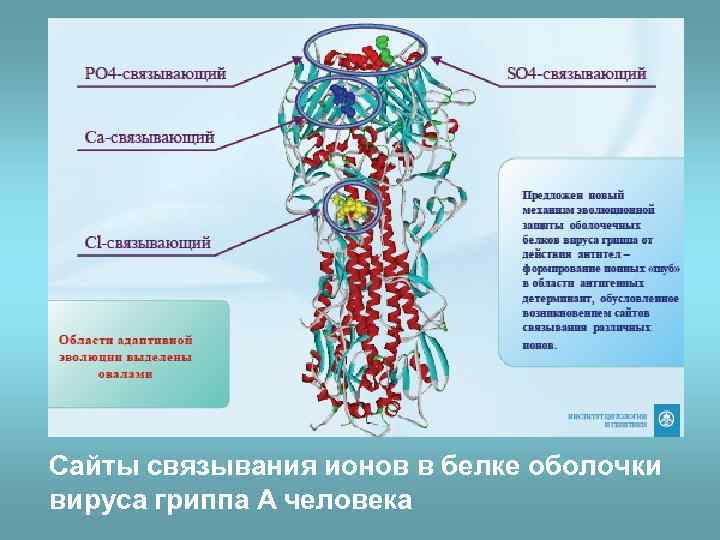
Сайты связывания ионов в белке оболочки вируса гриппа А человека
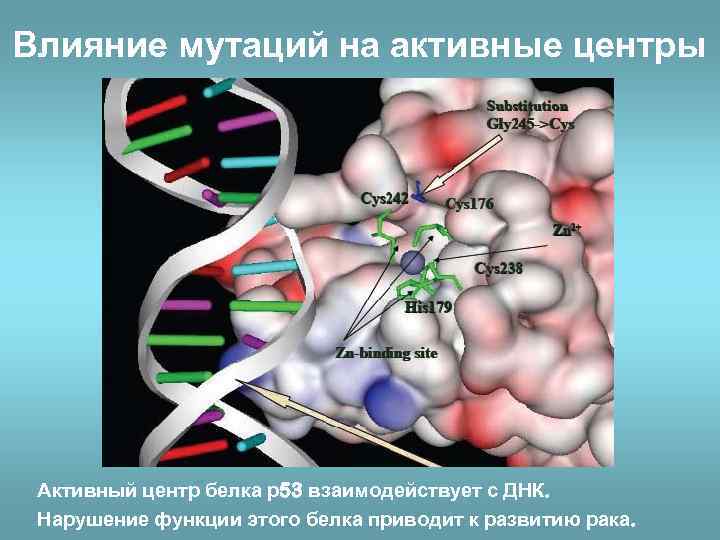
Влияние мутаций на активные центры Активный центр белка р53 взаимодействует с ДНК. Нарушение функции этого белка приводит к развитию рака.
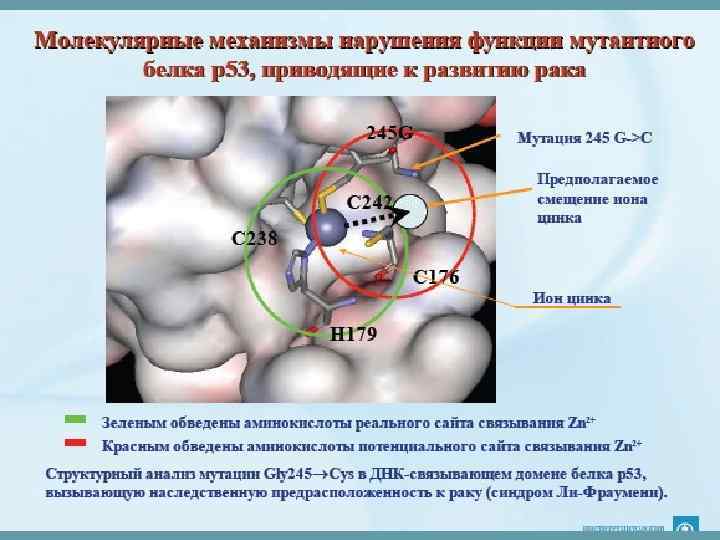
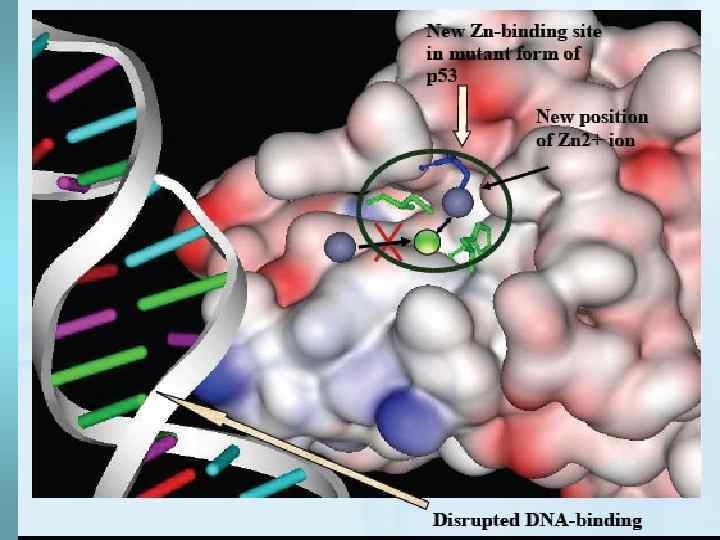

Аллостерические конформации • Это две или более устойчивых конформации, которые принимает белок, связываясь с разными молекулами. • Это свойство белков лежит в основе 1. перехода ферментов из активной формы в неактивную 2. работы мембранных и цитоплазматических белков-рецепторов
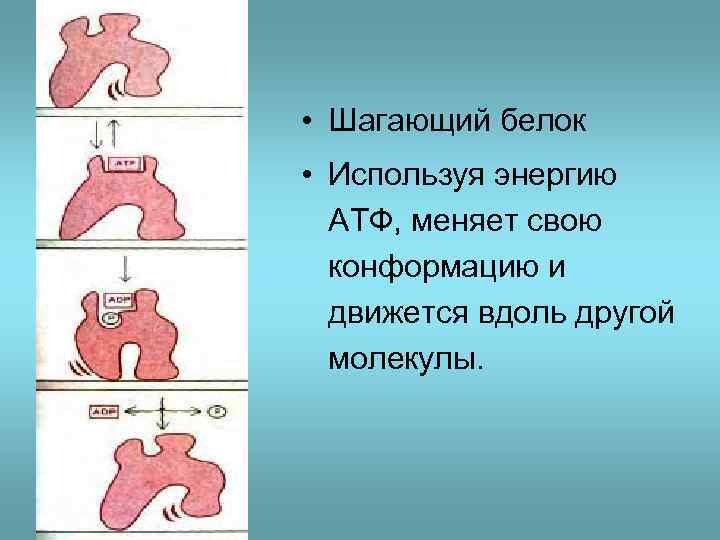
• Шагающий белок • Используя энергию АТФ, меняет свою конформацию и движется вдоль другой молекулы.

Примеры белков с разными функциями
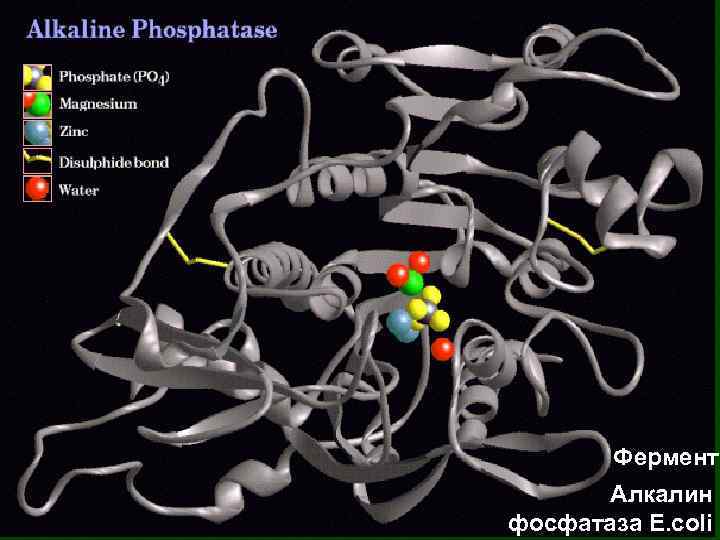
Фермент Алкалин фосфатаза E. coli
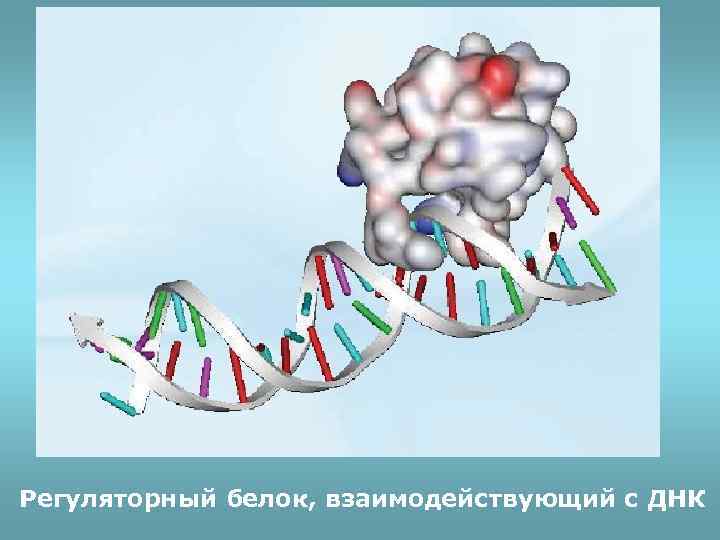
Регуляторный белок, взаимодействующий с ДНК
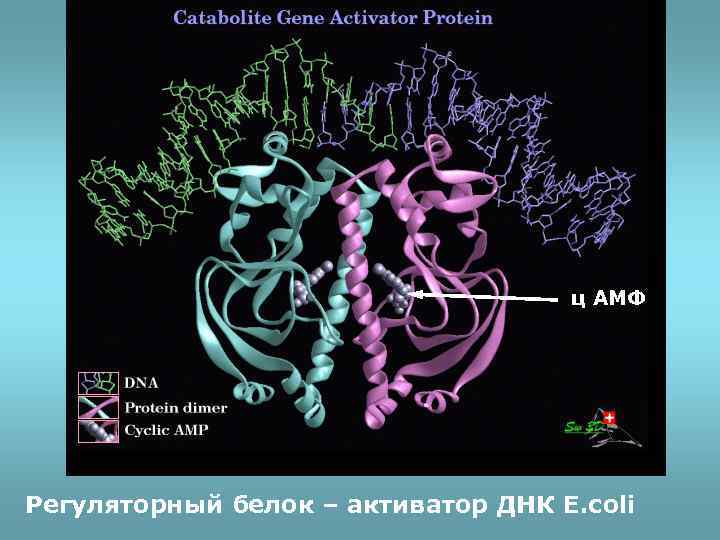
ц АМФ Регуляторный белок – активатор ДНК E. coli
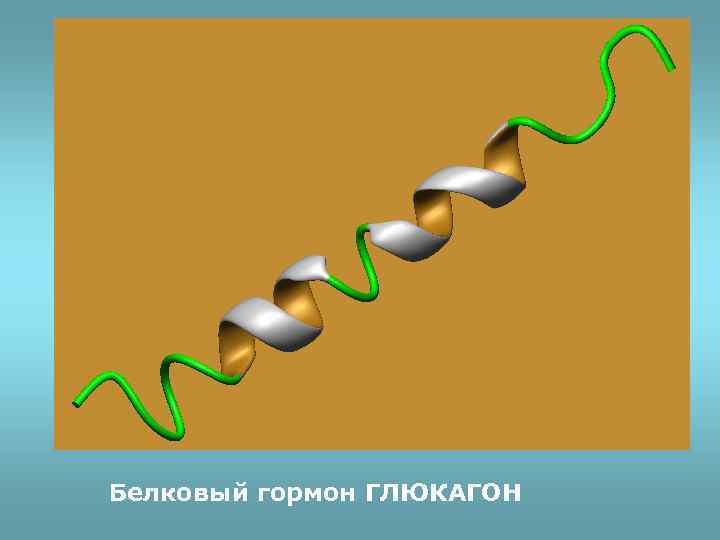
Белковый гормон ГЛЮКАГОН
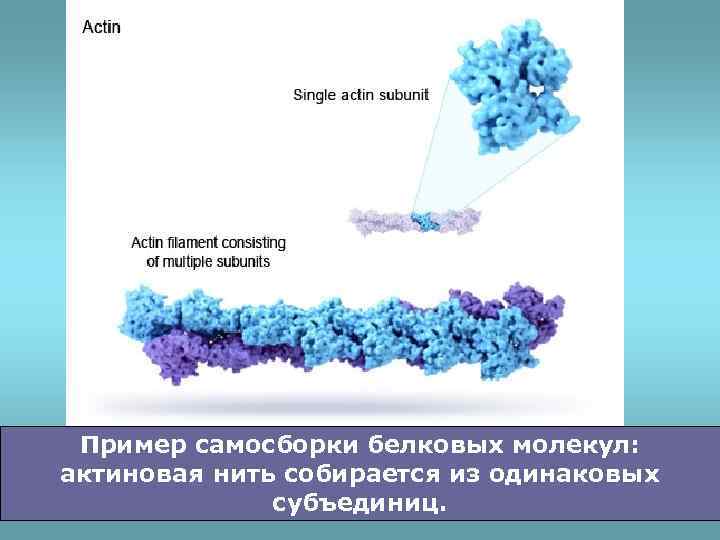
Пример самосборки белковых молекул: актиновая нить собирается из одинаковых субъединиц.
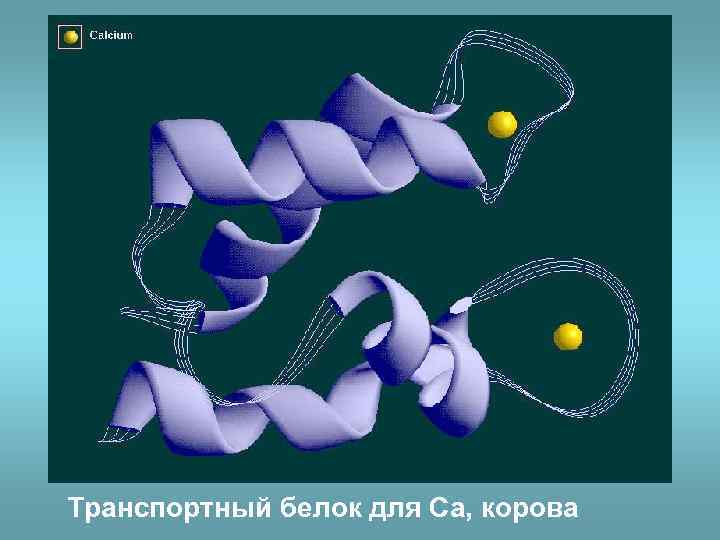
Транспортный белок для Ca, корова
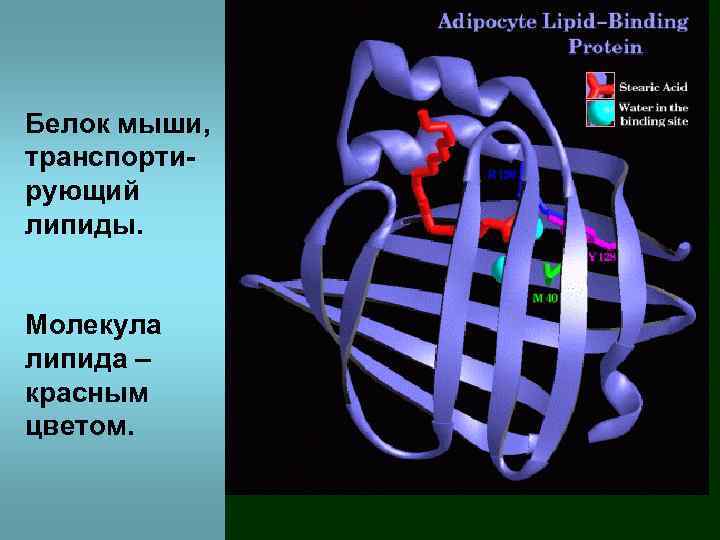
Белок мыши, транспортирующий липиды. Молекула липида – красным цветом.

Коллаген. Структурный белок кожи и хрящей. Фибриллярная III структура
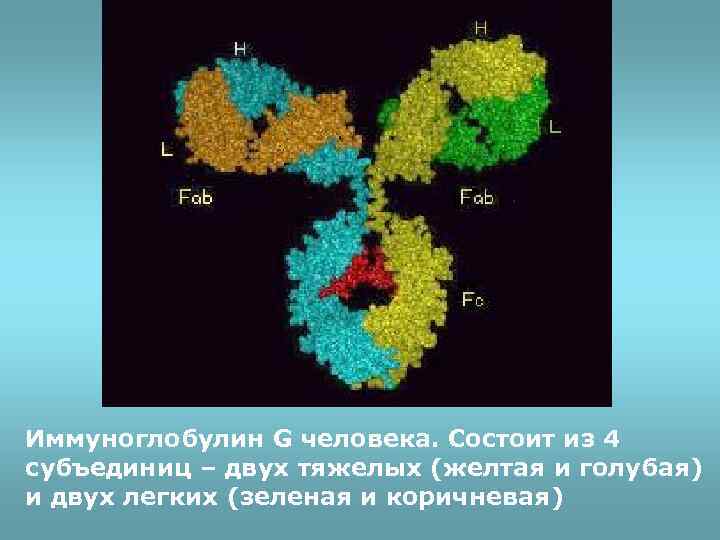
Иммуноглобулин G человека. Состоит из 4 субъединиц – двух тяжелых (желтая и голубая) и двух легких (зеленая и коричневая)
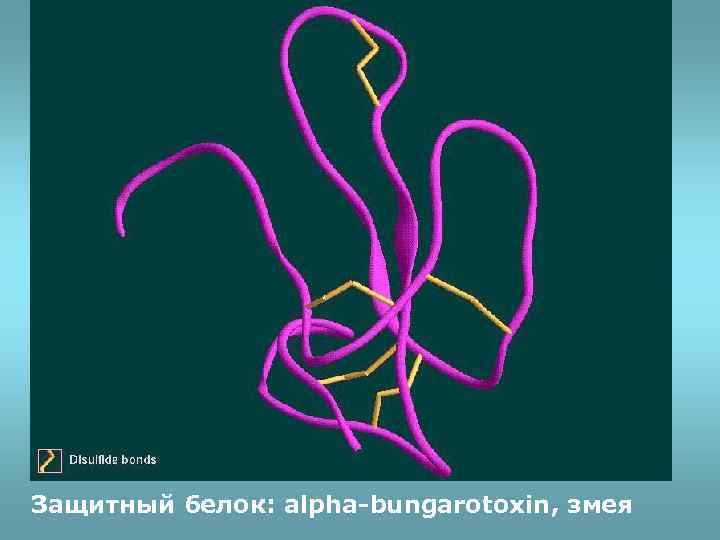
Защитный белок: alpha-bungarotoxin, змея

• Эволюционно родственные белки, выполняющие близкие функции, сохраняют постоянство основных элементов пространственного строения: доменов и их активных центров.
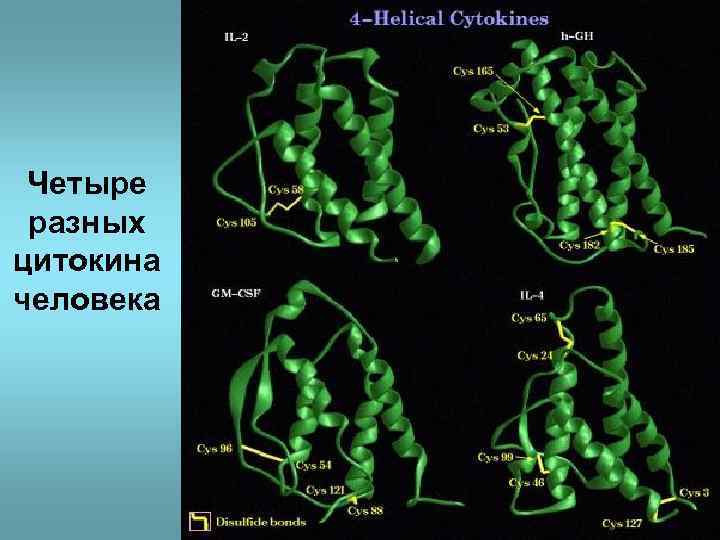
Четыре разных цитокина человека
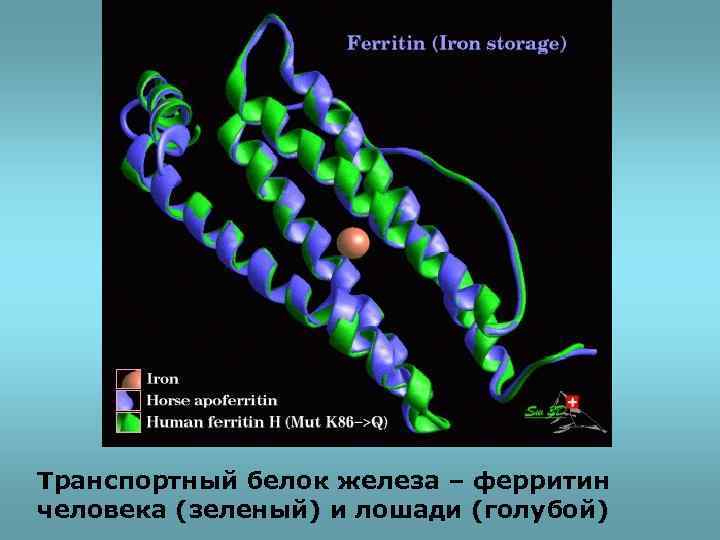
Транспортный белок железа – ферритин человека (зеленый) и лошади (голубой)
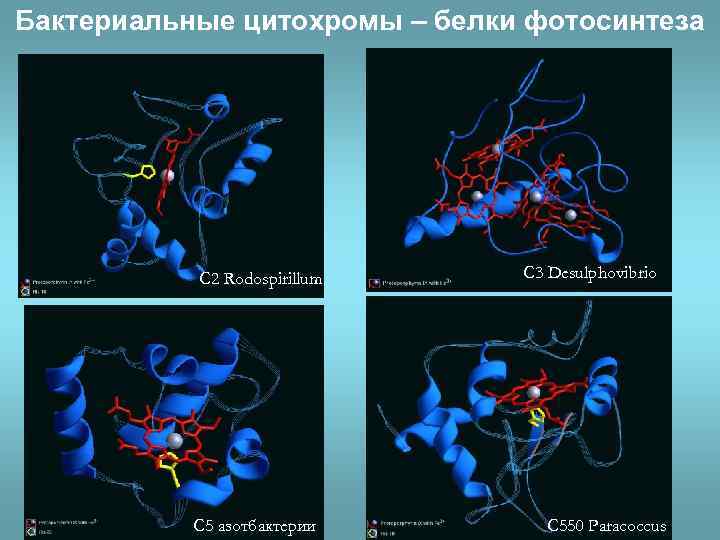
Бактериальные цитохромы – белки фотосинтеза С 2 Rodospirillum С 5 азотбактерии С 3 Desulphovibrio С 550 Paracoccus
Белки.ppt