

Белки (протеи ны , полипепти ды ) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно. Уровни структурной организации белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная структуры.

Первичная структура (последовательность аминокислотных остатков) полипептида определяется структурой его гена и генетическим кодом. Первичную структуру белка можно определить методами секвенирования белков или по первичной структуре его м. РНК, используя таблицу генетического кода. Типы вторичной структуры белков: α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3, 6 аминокислотных остатка, и шаг спирали составляет 0, 54 нм (на один аминокислотный остаток приходится 0, 15 нм), спираль стабилизирована водородными связями. Хотя α-спираль может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0, 34 нм на аминокислотный остаток) в первичной структуре аминокислотами глицин и аланин π-спирали; неупорядоченные фрагменты.

Третичная структура — пространственное строение полипептидной цепи. В стабилизации третичной структуры принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи; гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы. Для определения пространственной структуры белка применяют методы рентгеноструктурного анализа, ядерного магнитного резонанса и некоторые виды микроскопии Четвертичная структура (или доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
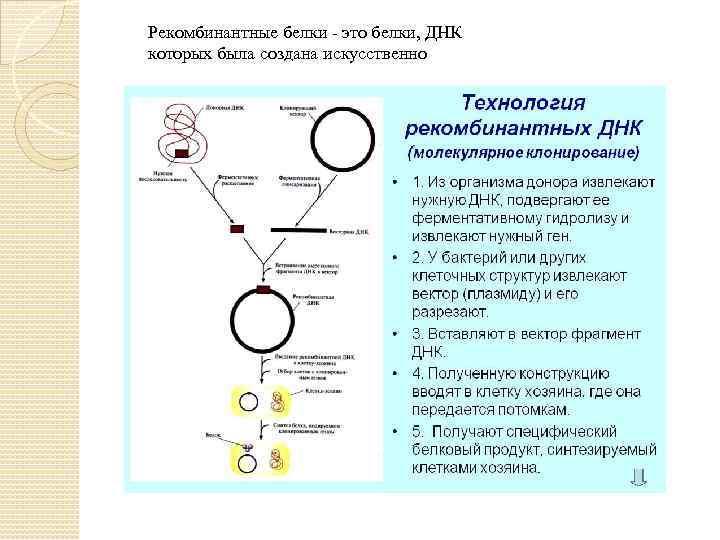
Рекомбинантные белки - это белки, ДНК которых была создана искусственно

Рекомбинантные белки получены с помощью генной инженерии, так же называемой сплайсингом генов или методом рекомбинантных ДНК путем помещения генов человека, животных или растений в генетический материал клеток бактерий, млекопитающих или дрожжей, эти микроорганизмы могут использоваться как продуценты белков для медицинских, научных и исследовательских целей при этом технология рекомбинантной ДНК позволяет их совершенствовать: повышать физиологическую активность, снижать вероятность побочных реакций после введения и так далее. Среди разнообразия рекомбинантных белков, продуцируемых растениями есть белки, используемые в молекулярно-биологических исследованиях (авидин , молочные белки, используемые в качестве пищевых добавок (казеин и белки-полимеры для медицинских и промышленных целей (коллаген и эластин). Ценные биологически активные пептиды можно получать, встраивая их в состав запасных белков семян. Так, последовательность ДНК, кодирующая пентапептидный нейрогормон животных лейэнкефалин была встроена в ген 2 S альбумина запасного белка семян Arabidopsis thaliana Экспрессия этого гена в трансформированных растениях рапса и арабидопсиса позволила получить их семена с высоким содержанием рекомбинантного белка. Целевой пептид легко выделялся из рекомбинантного белка с помощью специфического протеолитического расщепления

Белковая инженерия — раздел биотехнологии, который занимается разработкой полезных или ценных белков. Это относительно новая дисциплина, которая направлена на исследование принципов модификации и создания белков. Технология белковой инженерии используется (часто – в сочетании с методом рекомбинантных ДНК) для улучшения свойств существующих белков (ферментов, антител, клеточных рецепторов) и создания новых, не существующих в природе протеинов. Для получения измененного белка осуществляют направленный мутагенез - внесение специфических изменений в кодирующие последовательности ДНК, приводящие к определенным изменениям в аминокислотных последовательностях Такие белки применяются для создания лекарственных препаратов, при обработке пищевых продуктов и в промышленном производстве. Кроме промышленного применения, белковая инженерия нашла себе достойное место и в медицинских разработках. Исследователи синтезируют белки, способные связываться с вирусами и мутантными генами, вызывающими опухоли, и обезвреживать их; создают высокоэффективные вакцины и изучают белкирецепторы клеточной поверхности, которые часто являются мишенями для фармацевтических препаратов. Ученые, занимающиеся усовершенствованием продуктов питания, используют белковую инженерию для улучшения качеств белков, обеспечивающих сохранность продуктов растительного происхождения, а также желирующих веществ или загустителей.

Познакомимся с некоторыми достижениями генной инженерии белков 1. Замена остатка треонина на остаток пролина в молекуле фермента тирозил-т. РНК-синтетазы повысило каталитическую активность этого фермента в десятки раз: он стал быстрее присоединять тирозин к т. РНК, переносящей эту аминокислоту в рибосому в ходе трансляции. 2. Была показана возможность создания фермента, функционирующего по типу рестриктаз, расщепляющих ДНК в строго определенных местах. Ученые создали гибридный белок, один фрагмент которого узнавал определенную последовательность нуклеотидных остатков в молекуле ДНК, а другой расщеплял ДНК в этом участке. 3. Произведя замену одной аминокислоты в молекуле инсулина, ученые добились того, что при подкожном введении этого гормона больным, страдающим диабетом, изменение концентрации этого гормона в крови было близко к физиологическому, возникающему после приема пищи.

4. Существует три класса интерферонов, обладающих противовирусной и противораковой активностью, но проявляющих разную специфичность. Были созданы гибридные гены, включающие в себя фрагменты природных генов интерферонов нескольких типов. Часть этих генов, будучи встроенными в бактериальные клетки, обеспечивали синтез гибридных интерферонов с большей, чем у родительских молекул, противораковой активностью. 5 Разрабатывая средства против ВИЧ-инфекции, ученые получили гибридный белок, один фрагмент которого обеспечивал специфическое связывание этого белка только с пораженными вирусом лимфоцитами, другой фрагмент осуществлял проникновение гибридного белка внутрь пораженной клетки, а еще один фрагмент нарушал синтез белка в пораженной клетке, что приводило к ее гибели.

Белковая кристаллография стала возможной, после того как биохимики научились выделять достаточно большие количества чистого белка и выращивать качественные кристаллы. К настоящему времени получены кристаллы нескольких тысяч различных белков. Строение белковых кристаллов исследуют в основном, используя явление дифракции рентгеновских лучей. Белковая кристаллография позволяет раскрыть и объяснить механизм узнавания белками субстратов, ингибиторов, регуляторов, гормонов и лекарств; пути ферментативного катализа, процессов переноса электронов; молекулярные механизмы преобразования энергии в живых клетках и многое другое. Первую рентгенограмму кристаллов пепсина получили в 1934 г. английские ученые Джон Бернал и Дороти Хочкин. В нашей стране изучение структуры белков методами рентгеновской кристаллографии и электронной микроскопии было начато Б. К. Вайнштейном с сотрудниками в 1959 -1960 гг. в лаборатории структуры белка, созданной в Институте кристаллографии АН СССР. К настоящему времени в этой лаборатории определена структура 46 белков.

Кристаллизация белков используется: а) как завершающая стадия очистки, б) для доказательства гомогенности белка, в) как метод стабилизации при хранении (многие фирмы продают чистые ферменты в виде суспензии кристаллов, помещенных в раствор сульфата аммония), г) для определения третичной структуры белков методом рентгеноструктурного анализа. Рис. 1. Кристаллы некоторых ферментов (слева) и вирусов, полученные в Институте кристаллографии РАН.

Метод рентгеновской кристаллографии включает выращивание высокоупорядоченных кристаллов исследуемого белка, измерение дифракционных картин рентгеновских лучей на этих Чтобы началась кристаллизация, необходимо создать такие условия, в которых белковый раствор становится перенасыщенным, что приводит к белок-белковой агрегации. Для этой цели используют осадители (вещества, уменьшающие растворимость. Обычно требуется тщательное изучение условий кристаллизации конкретного белка: р. Н, концентрации буфера и осадителя, ионов металлов. Используют следующие приемы:

Диффузия паров летучих веществ Метод «висящей капли» Осадитель помещают на дно стаканчика, капля концентрированного раствора белка находится на внутренней стороне стеклышка, закрывающего этот стакан. За счет диффузии паров происходит медленное возрастание концентрации осаждающего вещества в капле раствора белка. Раствор белка может также содержать следы ионов металлов. Например, известно, что для кристаллизации инсулина необходимы ионы цинка.

Дифрактометры – это приборы для регистрации рентгеновской дифракционной картины с помощью счетчиков. Дифрактометр позволяет полностью автоматизировать процесс измерения интенсивностей, что расширяет возможности структурного анализа Дифрактометр Сименс Источник рентгеновского излучения
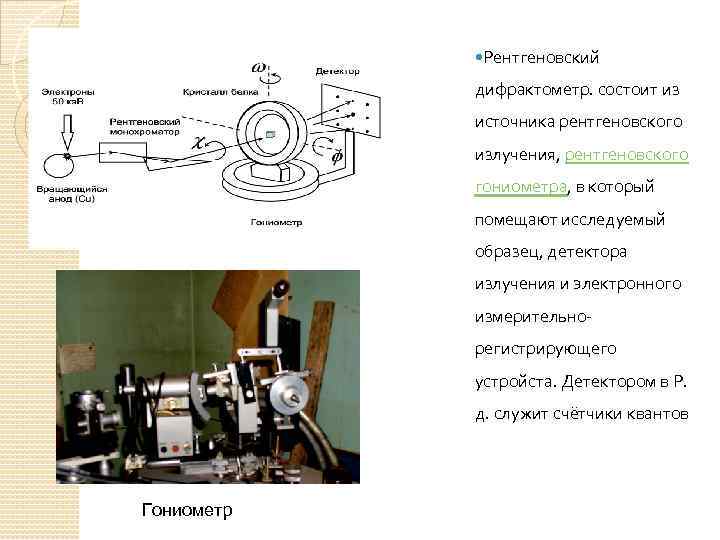
Рентгеновский дифрактометр. состоит из источника рентгеновского излучения, рентгеновского гониометра, в который помещают исследуемый образец, детектора излучения и электронного измерительнорегистрирующего устройста. Детектором в Р. д. служит счётчики квантов Гониометр

Одной из первых в нашей стране была расшифрована структура фермента каталазы. Зная строение активного центра (рис. 5) и способ встраивания в него субстрата, можно понять механизм катализа (превращения двух молекул пероксида водорода в одну молекулу воды и одну молекулу кислорода). Рис. 5. Активный центр каталазы Penicillium vitale с двумя молекулами воды, включающий гем (плоская группа в центре рисунка), аминокислотные остатки гистидина и аспарагина ( вверху), и аминокислотные остатки тирозина и аргинина ( внизу). Рис. 4. Фотография участка модели каталазы. Стержни - химические связи. Шарики на концах стержней - атомы. Красный шарик в центре - атом железа в геме. Красной проволокой обозначен ход полипептидной цепи в a-спирали

Сегодня определение структуры белков входит в практику фармацевтических исследований, причем самые большие фармацевтические компании располагают соответствующим оборудованием для кристаллографии. В продаже уже есть лекарства, созданные так называемым методом драг-дизайн Рис. 1. Пример драг-дизайна, основанного на (конструирование лекарств). К ним знании третичной структуры белка–мишени. относятся препараты против вируса ВИЧ-протеаза представлена в формате полосок, иммунодефицита человека, такие как а ингибитор ампренавир - в виде атомов с радиусами Ван-дер-Ваальса. Выделены цветом аспарагиновые ампренавир (Agenerase) и нелфинавир остатки в активном центре. (Viracept), полученные на основе использования структуры кристаллов ВИЧ-протеазы

В отличие от кристаллографических методов, метод ЯМР не требует приготовления правильных кристаллов исследуемого белка, а также может изучать естественную динамику белка. Также метод ЯМР позволяет исследовать белковые молекулы в средах, максимально близко моделирующих биологическую мембрану (детергенты или липиддетергентные смеси). Работает ЯМР так: на раствор молекул действуют магнитным полем. Параметры, при которых ядра вращаются, зависят от магнитного поля в данной позиции, а это зависит от позиции и химических особенностей других атомов-соседей. Исследователи могут понять по анализу получаемых данных, как разные ядра атомов распологаются друг относительно друга.

Спектроскопи я я дерного магни тного резона нса, ЯМР-спектроскопия — спектроскопический метод исследования химических объектов, использующий явление ядерного магнитного резонанса. Общей задачей является получение 3 -мерной структуры белка в высоком разрешении, подобно изображениям получаемым в рентгеновской кристаллографии. Очень важно и то, что спектроскопия ЯМР позволяет не только получать информацию о структуре — ее довольно успешно получают методом рентгеноструктурного анализа, но можно получить очень ценную информацию о динамических свойствах белковых систем, и здесь метод ЯМР уникален. То есть мы можем до атомного разрешения получить информацию о том, с какими характеристическими частотами, т. е. как быстро, и с какими амплитудами движутся те или иные фрагменты белковой молекулы.

ЯМР-спектрометр с рабочей частотой 900 МГц и индукцией магнитного поля 21. 1 T в HWB-NMR, Бирмингем, Великобритания В зависимости от концентрации образца, на магнитном поле спектрометра, и от типа эксперимента, единственный многомерный ядерный эксперимент магнитного резонанса на образце белка может занять часы или даже несколько дней, чтобы получить подходящее отношение сигнал-шум посредством усреднения сигнала, и учесть достаточное развитие передачи намагничивания через различные измерения эксперимента.

Образец вещества для ЯМР помещается в тонкостенную стеклянную трубку (ампулу). Когда ее помещают в магнитное поле, ЯМР активные ядра (такие как 1 H или 13 C) поглощают электромагнитную энергию. Резонансная частота, энергия абсорбции и интенсивность испущенного сигнала пропорциональны силе магнитного поля. В зависимости от местного электронного окружения разные протоны в молекуле резонируют на слегка отличающихся частотах образуется химический сдвиг. Так как химический сдвиг зависит от химического строения вещества, он применяется для получения структурной информации о молекулах в образце. Эти сигналы вырождаются и формируют пики при том же химическом сдвиге. Программное обеспечение позволяет проанализировать размер пиков.