2 Белки плазмы крови.ppt
- Количество слайдов: 31

Белки плазмы крови Доцент курса клинической лабораторной диагностики Пермской государственной медицинской академии им. ак. Е. А. Вагнера Дмитрий Юрьевич Соснин

Функции белков сыворотки крови § Поддержание осмотического (онкотического) давления, так как белки связывают воду и удерживают её в кровеносном русле. § Белки плазмы образуют важнейшую буферную систему крови и поддерживают р. Н крови в пределах 7, 37 7, 43. § Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки вьполняют транспортную функцию. § Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы. § Белки плазмы крови являются резервом аминокислот для организма. § Иммуноглобулины, белки свёртывающей системы крови, α 1 антитрипсин и белки системы комплемента осуществляют защитную функцию

Концентрация белков в сыворотке крови § Возрастные показатели общего количества белка в сыворотке крови: – – – – – пуповинная кровь 48 80 г/л; недоношенные дети 36 60 г/л; новорожденные 46 70 г/л; 1 нед 44 76 г/л; 7 12 мес 51 73 г/л; 1 2 года 56 75 г/л; старше 3 лет 60 80 г/л; взрослые до 60 лет 64 83 г/л; старше 60 лет 62 81 г/л.
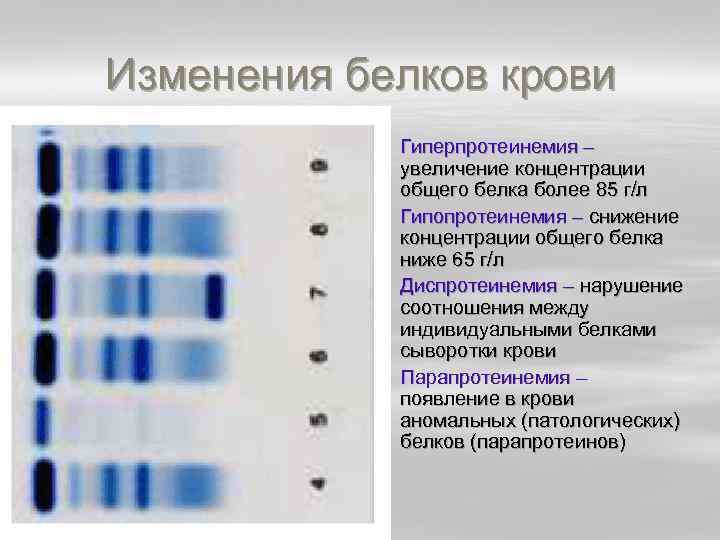
Изменения белков крови § Гиперпротеинемия – увеличение концентрации общего белка более 85 г/л § Гипопротеинемия – снижение концентрации общего белка ниже 65 г/л § Диспротеинемия – нарушение соотношения между индивидуальными белками сыворотки крови § Парапротеинемия – появление в крови аномальных (патологических) белков (парапротеинов)

Методы определения общего белка Среди методов определения концентрации общего белка можно выделить несколько основных групп, основанных на различных принципах: § азотометрические; § гравиметрические (весовые); § «преципитационные» ; § спектрофотометрические; § рефрактометрические; § колориметрические. § Кроме перечисленных выше разработаны также другие методы, например, флюориметрические, поляриметрические, а также методы атомно-абсорбционной спектрофотометрии и аминокислотного анализа белка.

Рефрактометрический метод § Рефрактометрические методы определения общего белка сыворотки основаны на способности растворов белка к преломлению светового потока. При температуре 17, 5 °С показатель преломления воды равен 1, 3332, при той же температуре показатель преломления сыворотки колеблется в пределах 1, 3480– 1, 3505. В связи с тем, что концентрация электролитов и небелковых органических соединений, влияющих на ее преломляющую способность, невелика и достаточно постоянна в сыворотке здорового человека, величина показателя преломления сыворотки крови зависит в первую очередь от содержания в ней белков. Калибровку прибора проводят сывороткой с известной концентрацией белка. Простота делает рефрактометрию удобным методом для определения содержания общего белка в сыворотке крови, хотя при ряде заболеваний, в частности, при сахарном диабете, хронической почечной недостаточности его использование может приводить к существенной ошибке. Рефрактометр лабораторный цифровой Abbe WAY 2 SE

Колориметрические (фотометрические) методы § Колориметрические методы определения общего белка основаны на цветных реакциях белков с хромоген образующими реактивами или на неспецифическом связывании красителя. § Среди колориметрических методов определения концентрации общего белка сыворотки наиболее распространенным считается биуретовый метод, основанный на так называемой «цветной биуретовой реакции» , в ходе которой белки реагируют в щелочной среде с сульфатом меди с образованием соединений, окрашенных в фиолетовый цвет, интенсивность окраски зависит от концентрации общего белка в сыворотке. Биуретовый метод определения общего белка в сыворотке крови был утвержден в качестве унифицированного в 1972 г. § Колориметрические методы определения общего белка сыворотки крови достаточно просты и относительно дешевы. К недостатку метода относится интерферирующее действие некоторых веществ (в том числе лекарств).

Альбумины § Альбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 к. Да, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических р. Н. Легко адсорбируют полярные и неполярные молекулы, являются, белком транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот.

Гиперальбуминемия § Истинное повышение концентрации белка в крови обычно не наблюдается. § Относительная гиперальбуминемия вызывается потерями внутрисосудистой жидкости в результате профузных поносов (например, холере), усиленном потоотделении, неукротимой рвоте, несахарном диабете, при тяжелых и обширных ожогах и генерализованных перитонитах.

Гипоальбуминемия § Истинная (абсолютная) гипоальбуминемия связана: – с недостаточным потреблением белка с пищей – заболевания желудочно кишечного тракта, сужение пищевода при опухолях, частичное или полное голодание; – со снижением синтеза белка в печени – несбалансированный аминокислотный состав пищи, хронические паренхиматозные гепатиты, интоксикации, злокачественные новообразования, лечение кортико стероидами; – с усиленным распадом белка – кахексия, тяжелые инфекции, длительные воспалительные процессы, лихорадочные состояния, тиреотоксикозы; – с потерей белка – нарушения проницаемости капиллярных стенок, кровоизлияния, ожоги, острые и хронические кровотечения, нефротический синдром. § Относительная гипоальбуминемия связана с нарушением водного баланса – гипергидратация при гиперальдостеронизме, при почечной недостаточности со снижением экскреции солей, при использовании для питья морской воды, при неадекватных инфузиях солевых растворов.

Глобулины Группа разнообразных белков плазмы крови с молекулярной массой до 100 к. Да, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в "осадочных" пробах (тимоловая, Вельтмана). Часто содержат углеводные компоненты. § При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α 1 глобулины, α 2 глобулины, β глобулины и γ глобулины.
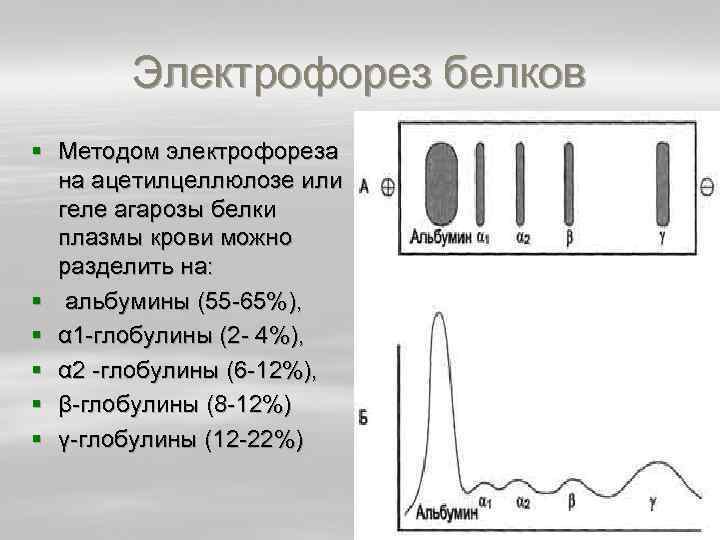
Электрофорез белков § Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на: § альбумины (55 65%), § α 1 глобулины (2 4%), § α 2 глобулины (6 12%), § β глобулины (8 12%) § γ глобулины (12 22%)

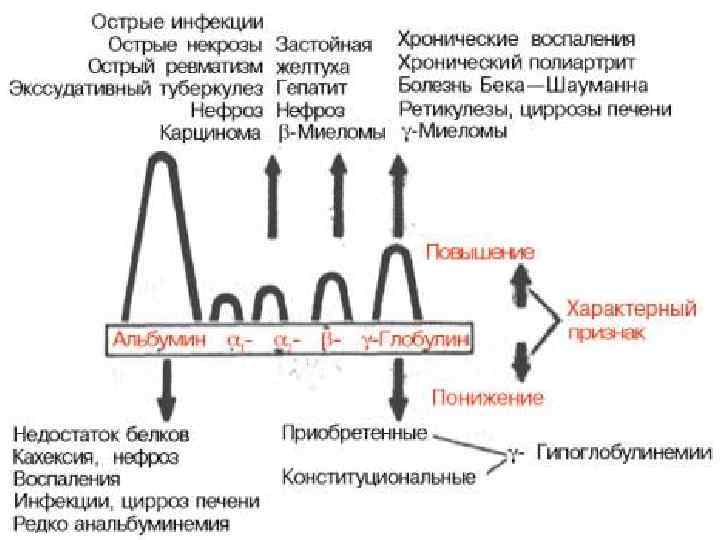
Типичные протеинограммы § Протеинограммы белков сыворотки крови: § а в норме; § б при нефротическом синдроме; § в при гипогаммаглобулинемии; § г при циррозе печени; § д при недостатке α 1 антитрипсина; § е при диффузной гипергаммаглобулинемии


Аппаратура для электрофореза

Характеристика индивидуальных белков фракций § § Альбумин. Концентрация альбумина в крови составляет 40 50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т 1/2 этого белка примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 к. Д. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са 2+, Cu 2+, Zn 2+. Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза. Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренинангиотензинальдрстерон, обеспечивающей восстановление объёма крови (см. раздел 11). Однако при недостатке альбумина, который должен удерживать Na+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки.

Альфа 1 глобулины включают большинство белков острой фазы § Во фракции глобулинов наиболее исследованными являются α 1‑антитрипсин, α 1‑липопротеин α 1‑ и α 1‑гликопротеин, α 1‑фетопротеин, α 1‑антихимотрипсин. Другими белками фракции ‑ ‑ ‑ α 1 α 1 являются транскортин, протромбин, антиплазмин, витамин. В 12 связывающий белок. § 1. α 1‑Антитрипсин (α 1‑протеиназный ингибитор) является преобладающим белком данной α 1‑ (α 1‑ фракции, гликопротеин, образуется в печени, белок острой фазы. Белок является ингибитором сериновых протеиназ (трипсина, химотрипсина, калликреина, плазмина, эластазы лейкоцитов) и обуславливает 92‑ 94% от общей антипротеолитической функции крови. 92‑ концентрация возрастает при воспалительных процессах, злокачественных образованиях, при действии гормонов (беременность, стероидная терапия), системной красной волчанке. снижается количество белка при эмфиземе легких, хроническом аутоиммунном гепатите (ювенильный цирроз). § § 2. α 1‑Антихимотрипсин (ранее α 1‑гликопротеин Шульца) является одним из реагирующих α 1‑ первыми белков острой фазы (уровень в сыворотке может удваиваться в течение нескольких часов), представляет собой слабый специфический ингибитор химотрипсина, вместе с тем отмечена его активность по отношению и к другим протеазам. увеличение концентрации белка обусловлено острофазовыми реакциями: воспаление, травма после хирургической операции, инфаркт миокарда, бактериальные инфекции.

Альфа 1 глобулины включают § § § 3. Орозомукоид (кислый α 1 гликопротеин) является белком острой фазы и синтезируется в печени. Функцией является связывание стероидов (прогестерон, тестостерон) и лекарств (пропранолол и лидокаин). повышение уровня белка в крови отмечается при лихорадке, острых и хронических воспалительных процессах, ревматоидном артрите, злокачественных опухолях, травмах, инфаркте миокарда, беременности. Вместе с гаптоглобином является хорошим индикатором гемолиза. снижение уровня белка при нефротическом синдроме без воспаления. 4. α 1‑Фетопротеин – синтезируется в печени и желудочно кишечном тракте плода. Функцией белка является поддержание осмотического давления крови, связывание материнских эстрогенов и предохранение плода от ее иммунной системы, участие в развитии печени. Диагностическое значение имеет, в первую очередь, для оценки правильного развития плода и срока беременности. увеличивается при многоплодной беременности, пороках развития и смерти плода. У взрослых количество белка нарастает при раке печени, также при онкологии яичек и, реже, других органов. 5. α‑Липопротеины, также называемые липопротеинами высокой плотности (ЛПВП)

Альфа – 1 антитрипсин § α 1 Антитрипсин относят к α 1 глобулинам. Он ингибирует ряд протеаз, в том числе фермент эластазу, освобождающийся из нейтрофилов и разрушающий эластин альвеол лёгких. При недостаточности α 1 антитрипсина могут возникнуть эмфизема лёгких (см. раздел 15) и гепатит, приводящий к циррозу печени. Существует несколько полиморфных форм α 1 антитрипсина, одна из которых является патологической. У людей, гомозиготных по двум дефектным аллелям гена антитрипсина, в печени синтезируется α 1 антитрипсин, который образует агрегаты, разрушающие гепатоциты. Это приводит к нарушению секреции такого белка гепатоцитами и к снижению содержания α 1 антитрипсина в крови.

§ Альфа 2 глобулины содержат ингибиторы протеаз и транспортные белки являются Во фракции α 2‑глобулинов наиболее важными для диагностики α 2‑макроглобулин, гаптоглобин, церулоплазмин. Также к этой фракции относятся ангиотензиноген, α 2‑гликопротеин связанный с беременностью, α 2‑HS‑гликопротеин, α 2‑антиплазмин, белок A связанный с беременностью. § 1. α 2‑макроглобулин – цинксодержащий белок острой фазы, содержит 4 идентичных субъединицы и включает углеводный компонент. Белок синтезируется в печени и в иммунокомпетентных клетках. Белок контролирует развитие инфекций и воспалительных процессов, является ингибитором протеиназ (как свертывающей системы крови, так и других) – плазмина, пепсина, трипсина, химотрипсина, эндопептидаз, катепсина D, тромбина, калликреина. – повышение его количества выявляется при циррозе печени, остром и хроническом гепатите, эндокринных заболеваниях (сахарный диабет, микседема), при беременности и лечении эстргенами, нефротическом синдроме. – снижение – при ревматическом полиартрите, потере белка или недостаточности его в питании, диссеминированном свертывании крови, фибринолитической терапии.

§ 2. Гаптоглобин – типичный представитель белков острой фазы, синтезируется в печени и в низких концентрациях присутствует во многих жидкостях организма – ликворе, лимфе, синовиальной жидкости, желчи. Белок обладает следующими функциями: – – – § § § связывает α и β димеры гемоглобина плазмы и предохраняет организм от потери железа, данный комплекс разрушается в клетках РЭС и печени, выполняет неспецифическую защитную функцию, комплексируясь с белковыми и небелковыми веществами, появляющимися при распаде клеток, участвует в транспорте витамина В 12. Концентрация белка неспецифически повышается в ответ на повреждение ткани, воспаление, опухолевый процесс (особенно с метастазами). Высокие показатели наблюдаются при сахарном диабете, пиелонефрите, ожогах, острых и хронических воспалительных состояниях, некрозе тканей, инфаркте миокарда, активных аутоиммунных заболеваниях, механической желтухе. снижение количества белка отмечено при поражении паренхимы печени, гемолизе и гемолитических анемиях, беременности, при использовании эстрогенов. При нефротическом синдроме уровень белка может изменяться влюбую сторону в зависимости от генотипа пациента, т. е. от преобладания тех или иных изоформ. 3. Церулоплазмин (ферроксидаза), содержит 8 атомов меди. Это белок острой фазы, содержит 90% всей меди плазмы, способствует взаимодействию железа и апотрансферрина, участвует в обмене биогенных аминов (адреналина, норадреналина, серотонина) и аскорбиновой кислоты, регулирует уровень симпатических медиаторов мозга, как сывороточный антиоксидант ликвидирует супероксидные радикалы кислорода, восстанавливает О 2 до воды и предотвращает окисление ненасыщенных жирных кислот. Отчасти церулоплазмин транспортирует ионы меди из печени в другие органы. – повышенные концентрации выявляются при хронических воспалительных процессах, холестазе, ревматоидном артрите, системной красной волчанке, гепатите, циррозе печени, инфаркте миокарда, острых инфекциях, злокачественных новообразованиях с метастазами, при беременности и использовании эстрогенов. – уменьшение показателя выявлено при снижении синтеза фермента (болезнь Вильсона‑Коновалова), повышенной потере (заболевания ЖКТ, нефротический Вильсона‑ синдром), уменьшении абсорбции меди в кишечнике (нарушения всасывания, недостаточность питания).

Гаптоглобин § Гаптоглобин составляет примерно четверть всех α 2 глобулинов. Гаптоглобин при внутрисосудистом гемолизе эритроцитов образует комплекс с гемоглобином, который разрушается в клетках РЭС. Если свободный гемоглобин, имеющий молекулярную массу 65 к. Д, может фильтроваться через почечные клубочки или агрегировать в них, то комплекс гемоглобин гаптоглобин имеет слишком большую молекулярную массу (155 к. Д), чтобы пройти через гломерулы. Следовательно, образование такого комплекса предотвращает потери организмом железа, содержащегося в гемоглобине. Определение содержания гаптоглобина имеет диагностическое значение, например, снижение концентрации гаптоглобина в крови наблюдают при гемолитической анемии. Это объясняют тем, что при Т 1/2 гаптоглобина, составляющем 5 дней, и Т 1/2 комплекса гемоглобин гаптоглобин (около 90 мин) увеличение поступления свободного гемоглобина в кровь при гемолизе эритроцитов вызовет резкое снижение содержания свободного гаптоглобина в крови. § Гаптоглобин относят к белкам острой фазы, его содержание в крови повышается при острых воспалительных заболеваниях

Бета глобулины это чаще транспортные белки § § § Фракция β‑глобулинов содержит трансферрин, гемопексин, компоненты комплемента. В свежей сыворотке эта β‑ фракция часто разделена, меньшая β 2‑фракция в основном обусловлена b‑липопротеинами. β 2‑ b‑ 1. Трансферрин – гликопротеин плазмы, имеет два центра связывания железа, присоединяет только трехвалентное железо вместе с анионом гидрокарбоната, синтезируется в печени и ретикуло эндотелиальной системой. Функции белка заключаются в связывании железа, превращении его в деионизированную форму и транспорте между тканями, в основном, между печенью и костным мозгом. накопление трансферрина вызывают эстрогены и дефицит железа, снижается показатель при хроническом воспалении, злокачественных опухолях. 2. Гемопексин – гемсвязывающий гликопротеин, синтезируется в гепатоцитах, также связывает порфирин, гемсодержащие хромопротеины (гемоглобин, миоглобин, каталазу), доставляя их в печень, где происходит распад гема и связывание железа с ферритином. уровень белка повышается при беременности, опухолях (особенно меланоме), сахарном диабете, мышечной дистрофии. снижение выявляется при гемолизе (более чувствительный тест по сравнению с гаптоглобином, так гаптоглобином, как гемопексин не является белком острой фазы), гемолитических анемиях, заболеваниях печени, недостаточности белка в пище. 3. Стероид‑связывающий β‑глобулин синтезируется в печени, связывает половые гормоны тестостерон, Стероид‑ β‑ эстрадиол, другие 17‑β‑гидроксистероиды, что регулирует долю свободной (активной) фракции гормонов. 17‑ Синтез белка стимулируется эстрадиолом, подавляется андрогенами. увеличение выявляется при беременности, приеме гормональных контрацептивов, гиперэстрогенемии. уменьшение концентрации белка отмечено при заболеваниях печени и нефротическом синдроме, гормональных нарушениях – гиперандрогенемии, инсулинорезистентности, акромегалии, синдроме Кушинга, гипотиреозе и гиперпролактинемии. 4. β‑ и преβ‑липопротеины (Липопротеины сыворотки крови). β‑ преβ‑

Гамма глобулины защитные белки § Данная фракция белков содержит иммуноглобулины G, A, M, Е, D. Иммуноглобулины часто упрощенно называют антителами. § Иммуноглобулины G – основные иммуноглобулины сыворотки, осуществляют гуморальную защиту организма от бактерий и вирусов и их растворимых токсинов (антигенов). Активно транспортируются через плаценту. У детей должная концентрация достигается только к 1, 5‑ 2 годам. § Иммуноглобулины А осуществляют местный иммунитет на слизистых поверхностях дыхательных путей (носовой и бронхиальный секрет) и кишечного тракта. Они присутствуют в женском молозиве, слезе, слюне. После рождения количество секреторного Ig. A (на слизистых) достигает уровня взрослых уже на 2 3 неделе жизни, сывороточного Ig. A – только к 14 15 годам. § Иммуноглобулины М появляются в процессе формирования иммунного ответа, являясь первичными антителами. Вскоре после рождения их уровень нарастает, достигает максимума к 9 месяцу жизни, после чего снижается и восстанавливается только к 20 30 годам. § Иммуноглобулины Е вырабатываются плазматическими клетками и участвуют в аллергических реакциях организма. § Иммуноглобулины D не имеют четкой сформированной функции. Предполагается, что они регулируют активность других иммуноглобулинов.
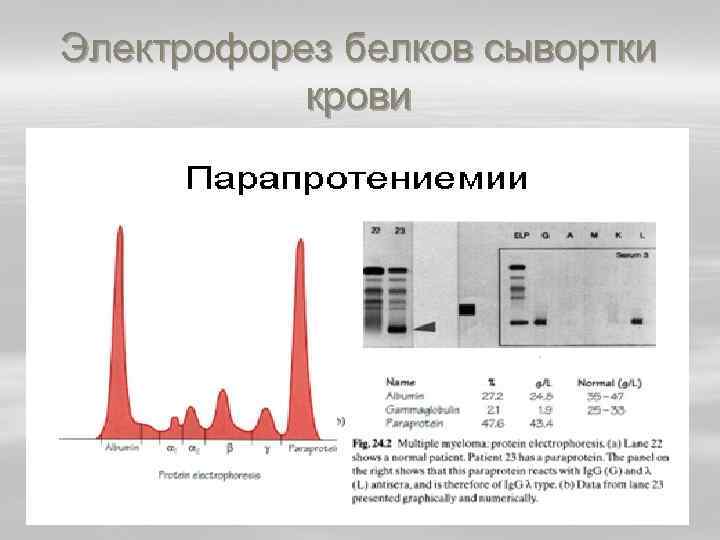
Электрофорез белков сывортки крови

Serum Electrophoresis Myeloma § Electrophoresis of serum from a patient with multiple myeloma (an immunoglobulin secreting tumor) shows an abnormally narrow gamma globulin band, indicating the presence of a monoclonal (and therefore abnormal) immunoglobulin. In this example the concentration of this protein is about 18 milligrams per ml, and the "+" on the printout indicates that this value is higher than normal for gamma globulin (range 6 17 mg/ml). In other cases such a monoclonal protein may be present at much higher concentrations.

Характерные варианты сдвигов содержания белковых фракций: § Острофазный ответ (изменения, связанные с воспалением и некрозом тканей) повышение содержания альфа 1 и альфа 2 глобулинов, наблюдающееся при острой пневмонии, остром бронхите, острой вирусной инфекции, остром пиелонефрите, инфаркте миокарда, травмах (включая хирургические), новообразованиях. § Хроническое воспаление увеличение содержания гамма глобулинов(ревматоидный артрит, хронический гепатит). § Нефротический синдром повышение концентрации в крови альфа 2 глобулинов (связано с накоплением альфа 2 макроглобулина на фоне потери альбумина и других белков при фильтрации в почечных клубочках). § Цирроз печени значительное увеличение белков гамма фракции, слияние бета и гамма фракций на электрофореграмме, уменьшение концентрации альбумина § Моноканальные гаммапатии – появление в зоне гамма глобклиновой фракции или в зоне бета глобулиновой фракции яркого компактного белкового пятна

Белки сыворотки крови с коротким периодом полураспада § К ним относятся: – тироксинсвязывающий преальбумин (ТСПА) – ретинол связывающий белок (РСБ). § Короткий период полураспада (2 су ток и 12 ч соответственно), незначительность их пула во внесосу дистом пространстве и быстрота синтеза в печени позволяют рекомендовать их в качестве маркеров ранней диагностики белко вой недостаточности. К этим белкам может быть отнесена: – и сывороточная холинэстераза – и трансферрин.

Транстиретин § Транстиретин (преальбумин) называют тироксинсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом до двух молекул тироксина и трийодтиронина.

Благодарю за внимание
2 Белки плазмы крови.ppt