белки.ppt
- Количество слайдов: 79


Белки • Классификация • уровни структурной организации • биологическая роль

Почему белков так много ? Из 20 -ти АК можно составить 20! ~ 2. 1018 при условии, что каждая АК не повторяется. Живущие сейчас на Земле виды составляют ~ 0, 001 всех видов, существовавших ранее на нашей планете
Многообразие белков В настоящее время число известных белков исчисляется тысячами
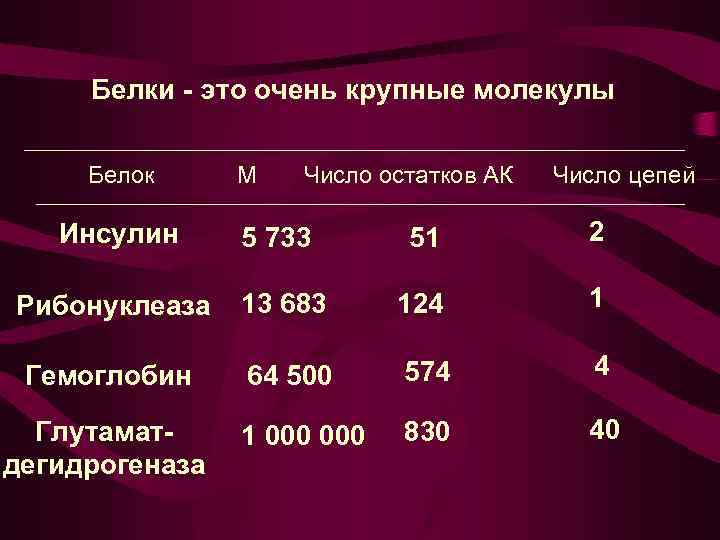
Белки - это очень крупные молекулы Белок М Число остатков АК Число цепей Инсулин 5 733 51 2 Рибонуклеаза 13 683 124 1 Гемоглобин 64 500 574 4 1 000 830 40 Глутаматдегидрогеназа
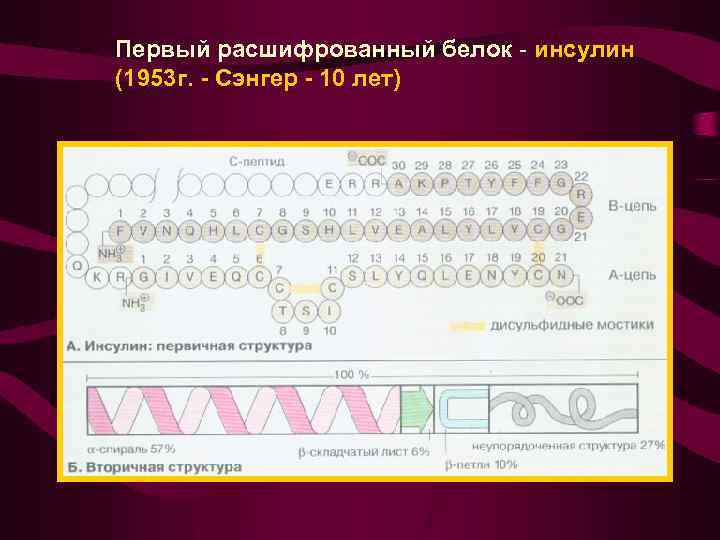
Первый расшифрованный белок - инсулин (1953 г. - Сэнгер - 10 лет)

Классификация белков: • по составу - простые и сложные • по функциям - по биологической роли • по структуре - пространственному устройству полипептидной цепи

Классификация белков по функциям

Классификация белков по составу Сложные(коньюгированные) содержат простетическую (небелковую) группу: Простые (неконьюгированные) содержат только белок • гликопротеины • липопротеины • флавопротеины • фосфопротеины • металлопротеины

Сложные белки

ГЕМ - простетическая группа гемоглобина

Сократительные и двигательные белки наделяют клетку или организм способностью сокращаться, изменять форму или передвигаться • Актин и миозин функционируют в сократительной системе скелетных мышц; • Тубулин - белок, обеспечивающий перемещение клеток;

Транспортные белки плазмы крови связывают и переносят молекулы или ионы из одного органа в другой: • гемоглобин, содержащийся в эритроцитах, связывает кислород и доставляет его к периферическим тканям; • липопротеины осуществляют перенос липидов из печени в другие органы; • мембранные белки переносят АК, глюкозу и др. вещества через мембрану внутрь клетки

Ферменты: белки, обладающие каталитической активностью. Самый многообразный класс белков В настоящее время открыто >3000 различных ферментов. Каждый фермент служит катализатором определенной химической реакции в клетке

Структурные белки - выполняют опорную функцию, скрепляя биологические структуры и придавая им прочность • Коллаген - главный компонент хрящей и сухожилий; • Эластин - белок, содержащийся в связках, способный растягиваться в двух измерениях; • Кератин - белок, из которого почти исключительно состоят волосы и ногти

Защитные белки предохраняют организм от повреждений или защищают его от вторжения других организмов • Иммуноглобулины или антитела - белки, вырабатываемые в лимфоцитах, способные распозновать чужие белки и нейтрализовать их • Фибриноген и тромбин - участвуют в процессе свертывания крови, предохраняя организм от потери крови

Регуляторные белки регулируют клеточную или физиологическую активность (белковые гормоны) Инсулин - регулирует обмен глюкозы;
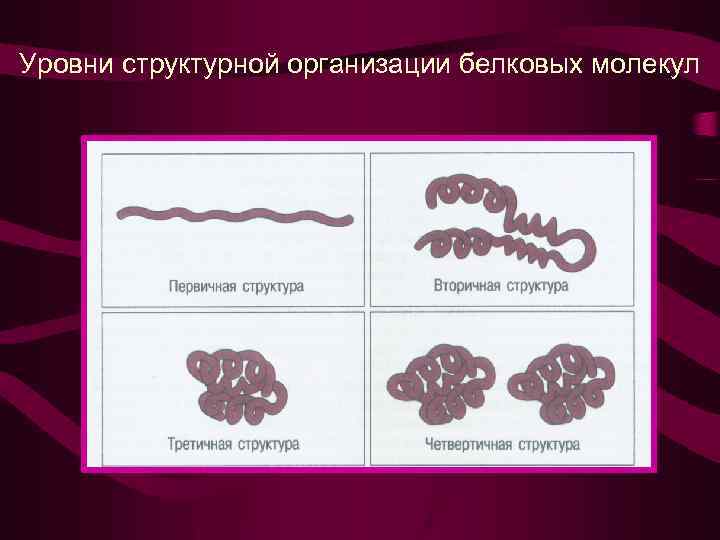
Уровни структурной организации белковых молекул
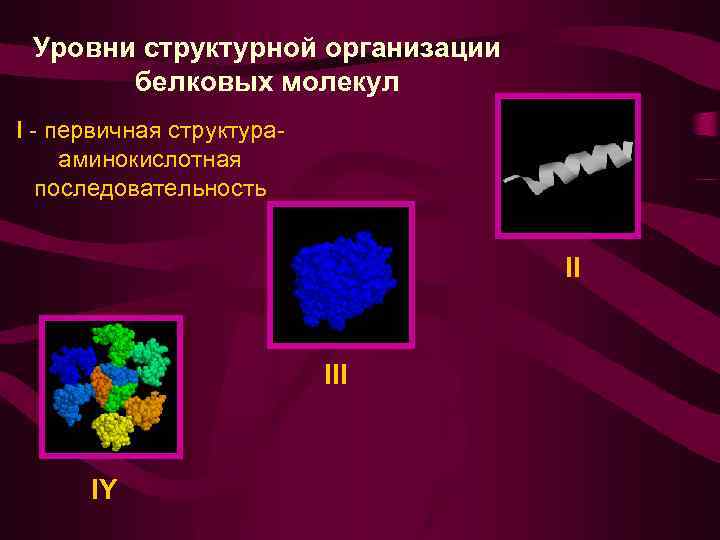
Уровни структурной организации белковых молекул I - первичная структурааминокислотная последовательность II IY
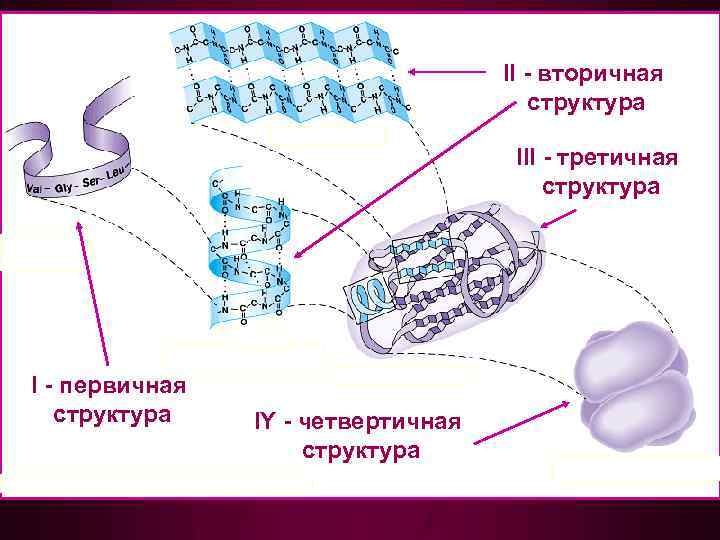
II - вторичная структура III - третичная структура I - первичная структура IY - четвертичная структура

Первичная структура определяется: • природой входящих в молекулу АК • относительным количеством каждой АК • строго определенной последовательностью АК в полипептидной цепи • cоставом и количеством простетических групп

Пептидная связь возникает при взаимодействии аминокислот, благодаря чему образуется полипептидная цепь - первичная структура белка

Вторичная структура - пространственная ориентация основной полипептидной цепи без учета боковых радикалов
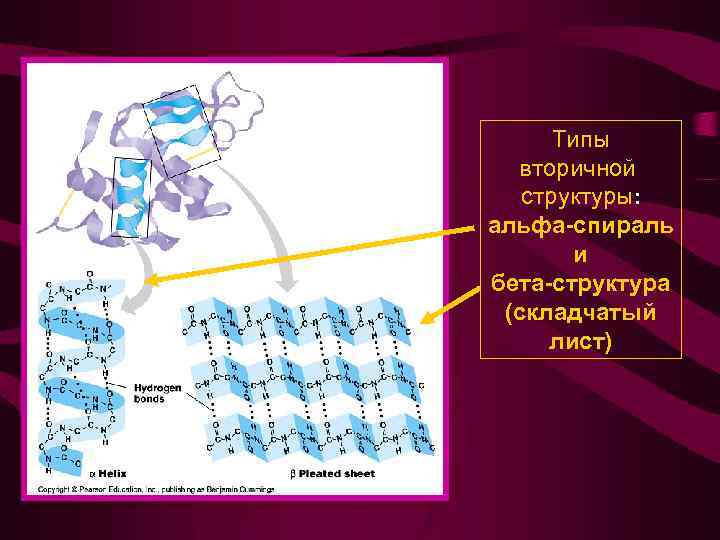
Типы вторичной структуры: альфа-спираль и бета-структура (складчатый лист)
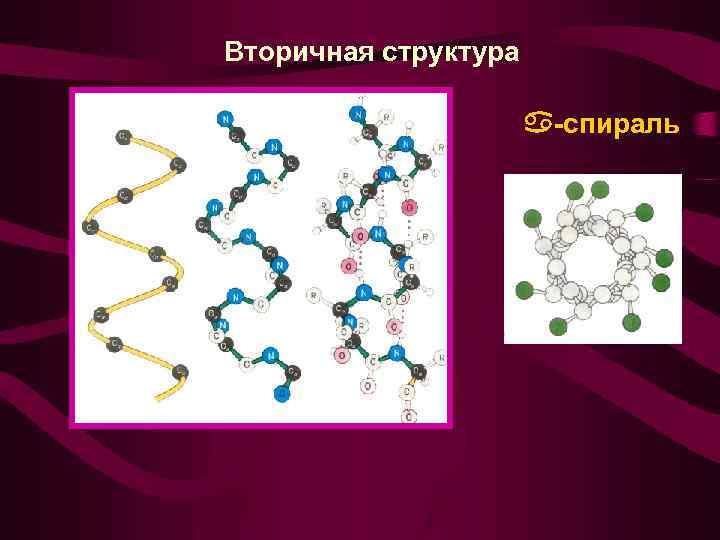
Вторичная структура -спираль


Характеристика - спирали: 1. На один виток спирали приходится 3, 7 АК остатка 2. Шаг спирали - 0, 54 нм, диаметр - 0, 5 нм 3. Плоскости двух соседних групп располагаются под углом 1080 4. Боковые заместители R находятся на наружной стороне спирали
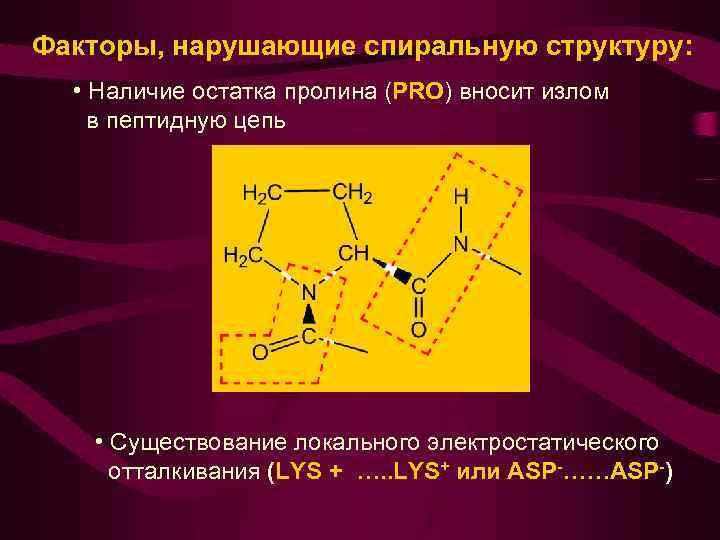
Факторы, нарушающие спиральную структуру: • Наличие остатка пролина (PRO) вносит излом в пептидную цепь • Существование локального электростатического отталкивания (LYS + …. . LYS+ или ASP-……ASP-)

-структура (складчатый лист)

структура (складчатый лист) параллельное направление полипептидных цепей
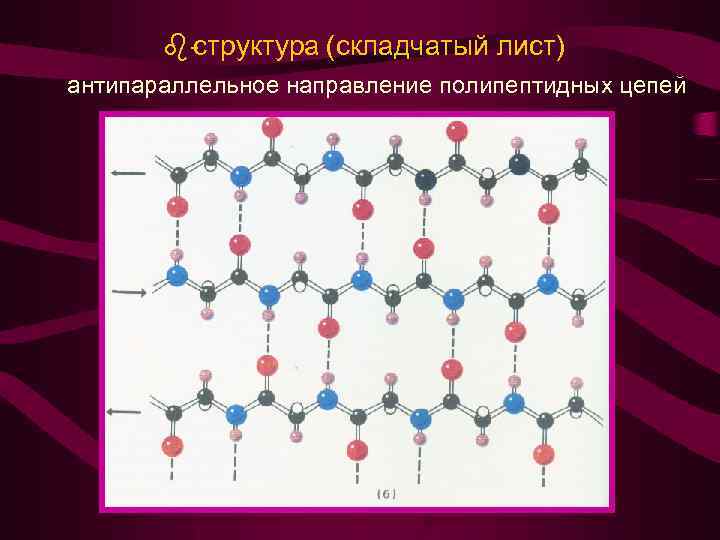
структура (складчатый лист) антипараллельное направление полипептидных цепей
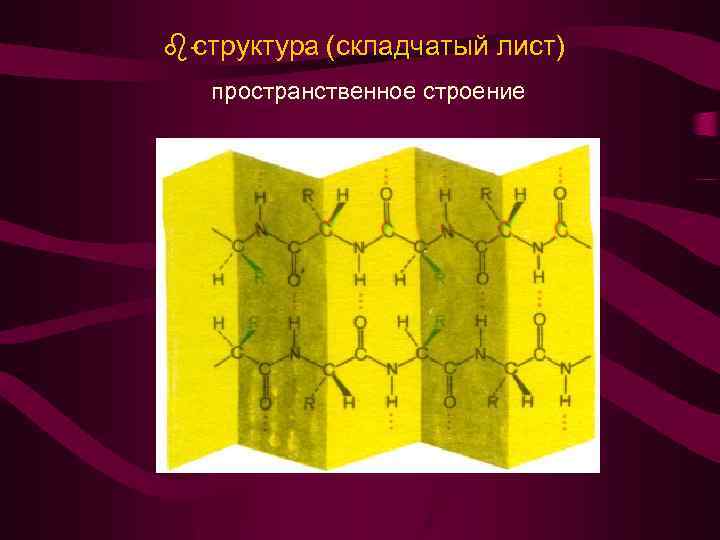
структура (складчатый лист) пространственное строение

Способность к образованию α-спиралей и β-структур различна для различных АК • Спиралеобразующие АК: Ala, Glu, Gln, Leu, Lys, Met, His • АК, образующие β-слои: Val, Ile, Trh, Tyr, Phe • АК, образующие неупорядоченные фрагменты: Gly, Ser, Asp, Asn, Pro
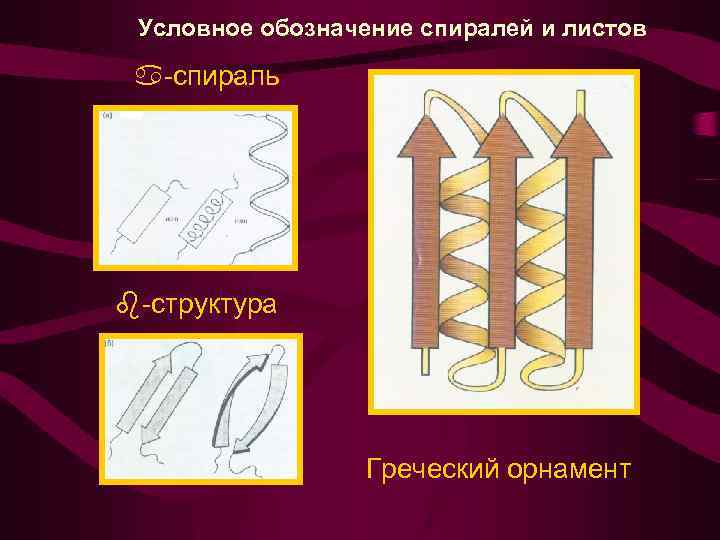
Условное обозначение спиралей и листов -спираль -структура Греческий орнамент



триозофосфатизомераза алкогольдегидрогеназа

Надвторичная структура: • Закономерности возникновения в процессе свертывания полипептидных цепей элементарных структур, представленных β-слоями ( β , β структура), с сочетанием α-спиралей (α, αструктура) или тех и других одновременно. • Преобладающей надвторичной структурой является топология т. н. греческого орнамента

NEWS!! • При формировании третичной структуры участвуют особые белки – шапероны, контролирующие ход образования вторичных и надвторичных структур, а также их взаимную пространственную укладку

α, β α, α β, β
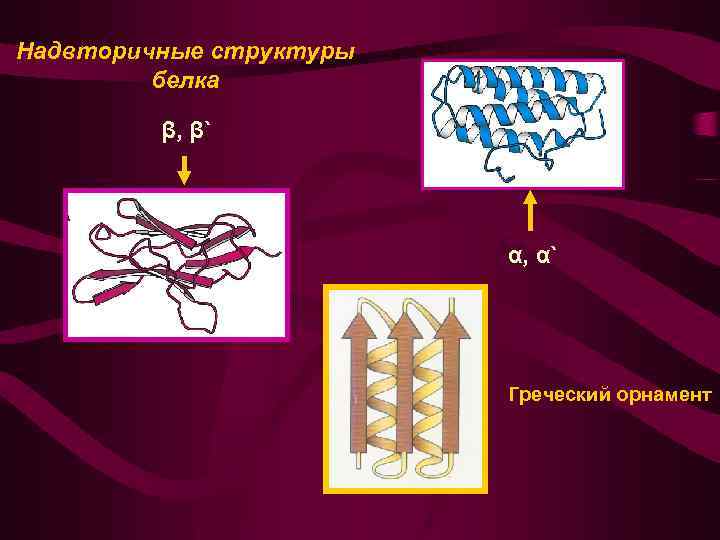
Надвторичные структуры белка β, β` α, α` Греческий орнамент

Третичная структура полная трехмерная «архитектура» белка, в том числе и ориентация простетических групп

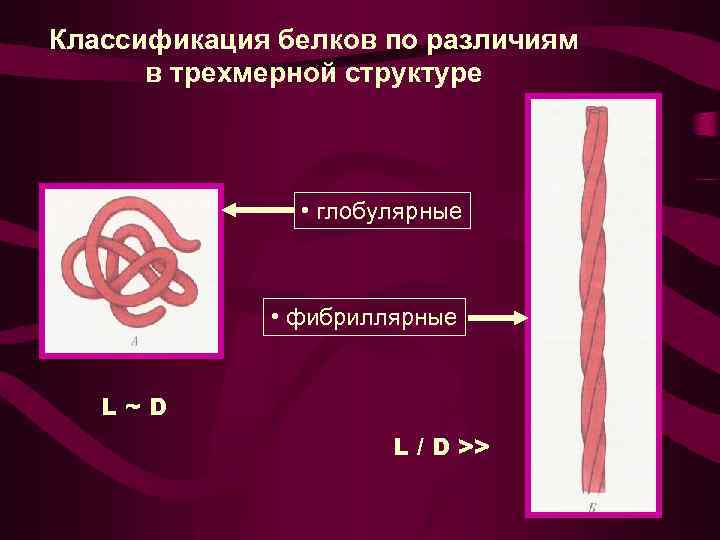
Классификация белков по различиям в трехмерной структуре • глобулярные • фибриллярные L~D L / D >>

Тип белка Ориентация полипептидноц цепи Фибриллярный белок Только спираль или только складчатый лист Глобулярный белок Часть структуры спираль (до 80%), часть складчатый лист и часть статистический клубок

Для каждого белка характерны разные степени спирализации • Белок Доля спирализованной конфигурации, % гемоглобин альбумин а куриного яйца л ь б пепсин у м 75 45 28
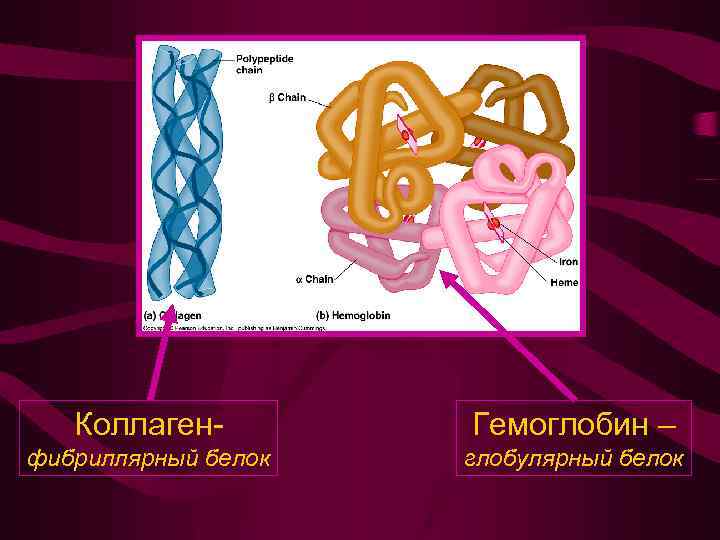
Коллаген- Гемоглобин – фибриллярный белок глобулярный белок
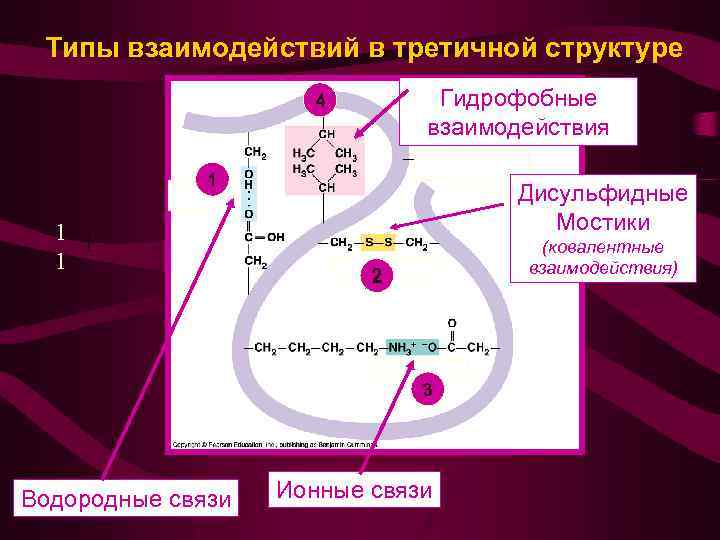
Типы взаимодействий в третичной структуре Гидрофобные взаимодействия 4 1 1 Дисульфидные Мостики (ковалентные взаимодействия) 2 3 Водородные связи Ионные связи
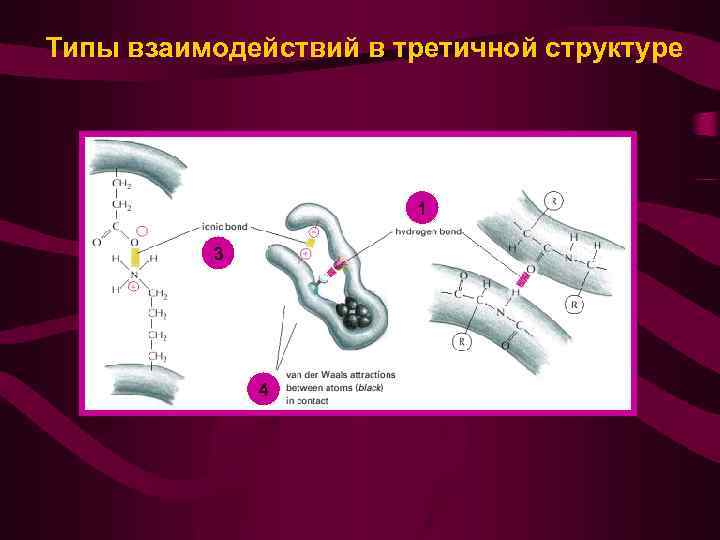
Типы взаимодействий в третичной структуре 1 3 4


Водородные связи в полипептидной цепи
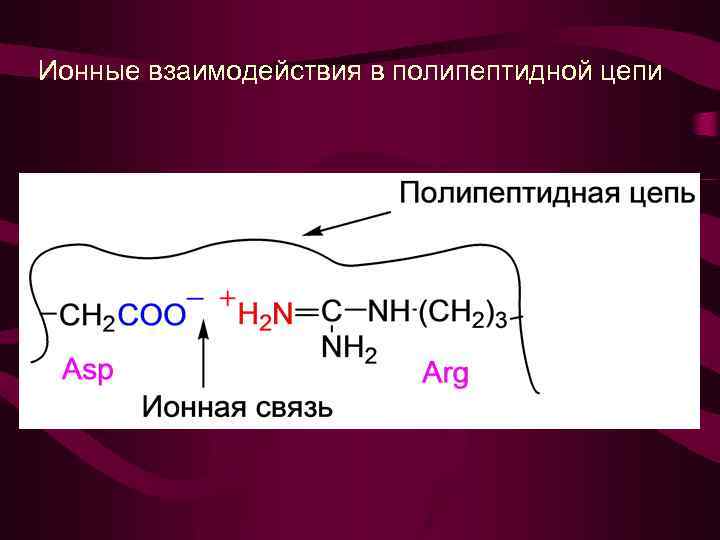
Ионные взаимодействия в полипептидной цепи
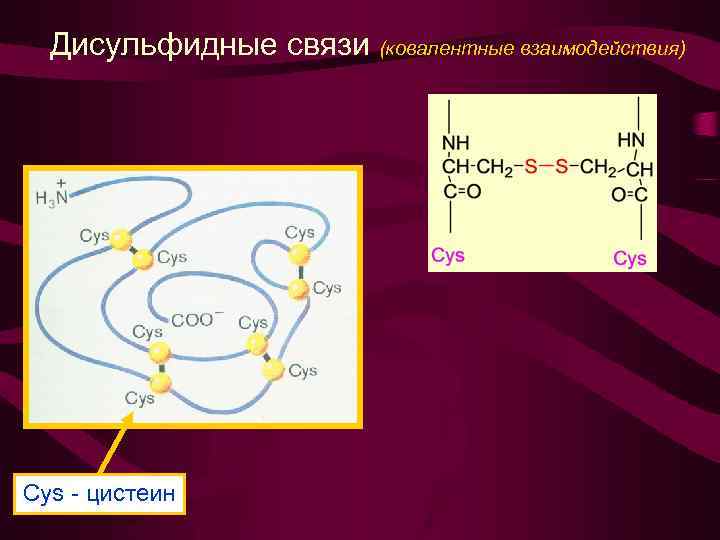
Дисульфидные связи (ковалентные взаимодействия) Cys - цистеин
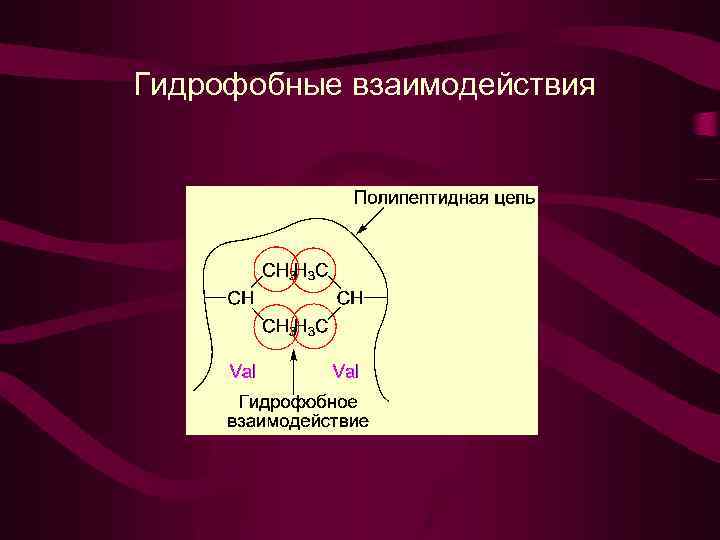
Гидрофобные взаимодействия
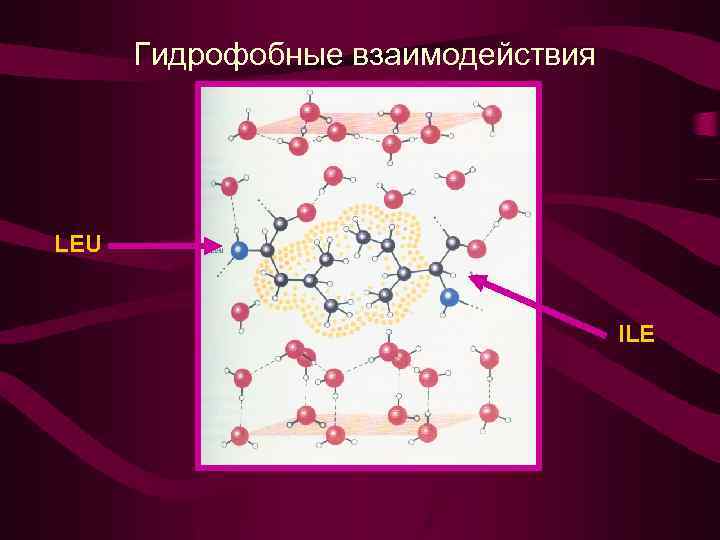
Гидрофобные взаимодействия LEU ILE

Доменный принцип построения белка • Домен – обособленная область молекулы белка, обладающая в определенной степени структурной и функциональной автономией У ферментов чаще всего обособлены коферментсвязывающие домены
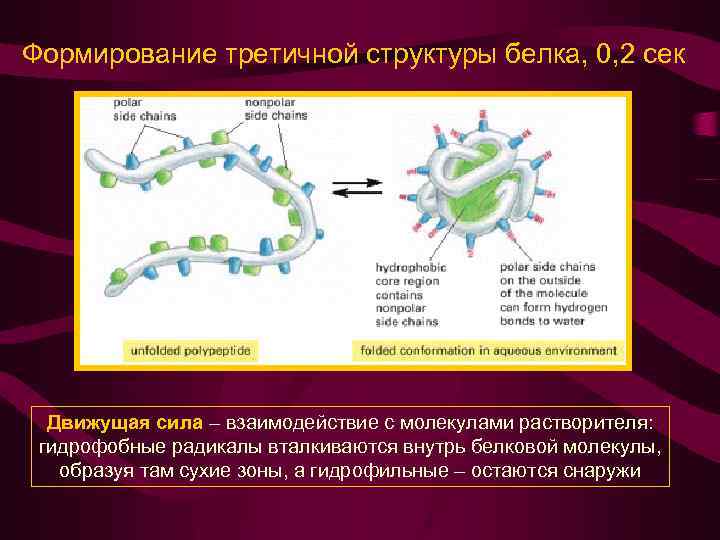
Формирование третичной структуры белка, 0, 2 сек Движущая сила – взаимодействие с молекулами растворителя: гидрофобные радикалы вталкиваются внутрь белковой молекулы, образуя там сухие зоны, а гидрофильные – остаются снаружи

коллаген Составляет 30% массы белковой части тела и 6% общей массы тела М ~ 300 000, длина молекулы ~ 300 нм Прочный структурный белок: нить толщиной 1 мм выдерживает нагрузку в 10 000 раз больше собственной массы
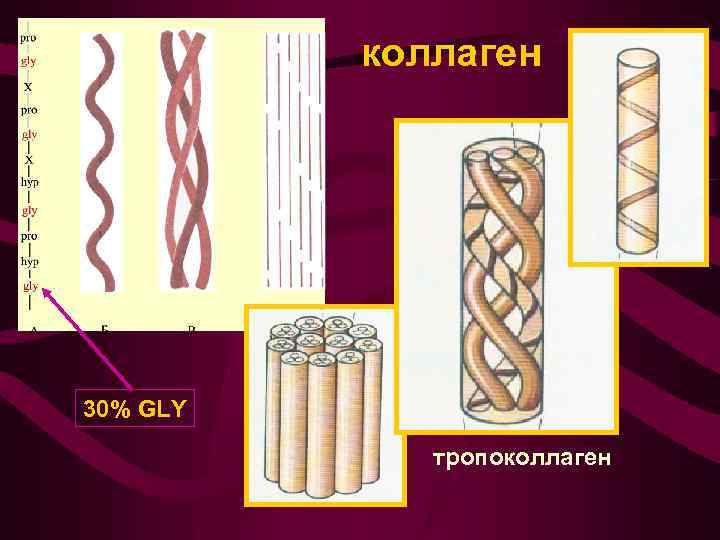
коллаген 30% GLY тропоколлаген

Модифицирование АК в коллагене

Образование поперечных «сшивок» в коллагене

Четвертичная структура нековалентное агрегирование двух или более полипептидных цепей

Тетрамер гемоглобина

Четвертичная структура белка • Крупные молекулы белков состоят из субъединиц • Такие белки называют мультимерами • Сотавляющие элементы этих белков (субъединицы) - протомеры Объединение протомеров в молекулу мультимера происходит самопроизвольно
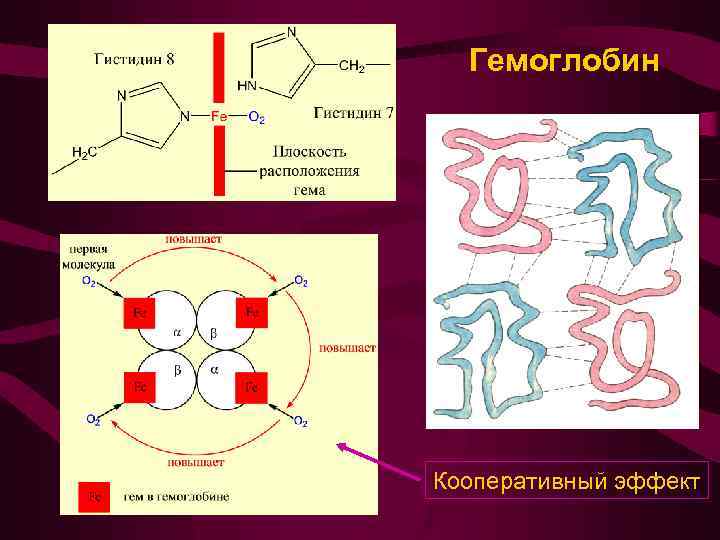
Гемоглобин Кооперативный эффект
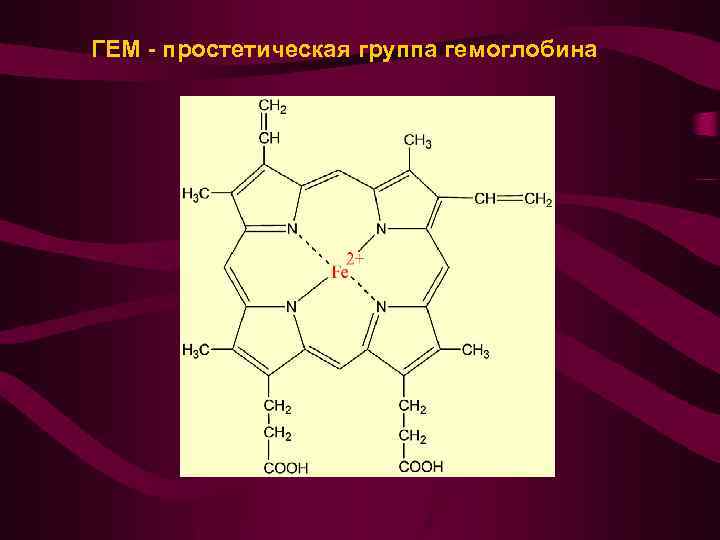
ГЕМ - простетическая группа гемоглобина

Гемоглобин - олигомерный белок, состоит из двух альфа-цепей: 1 2 и двух бета-цепей: 1 2 Гемоглобин артериальной крови насыщен кислородом на 96%. Гемоглобин венозной крови - лишь на 64% Каждые 100 мл крови, проходящие через ткань, оставляют в ней около 1/3 содержащегося в них кислорода или ~ 6, 5 мл О 2

Нативная конформация белка • индивидуальное структурное свойство данного белка, определяющее его функциональную специализацию; • определяется инструкциями, заключенными в аминокислотной последовательности; • конформация с минимальной энергией, т. е. максимально стабильная конформация

Основной принцип: последовательность определяет конформацию (вторичная и третичная структура белка предопределена его аминокислотной последовательностью, т. е. первичной структурой)

• При замене в β-цепи гемоглобина шестого остатка Glu на остаток Val возникает аномальный гемоглобин S. • Это приводит к образованию эритроцитов серповидной формы, результатом чего является тяжелое наследственное заболевание – серповидно-клеточная анемия (гемоглобинопатия S)

Факторы денатурации: • Изменение р. Н • Действие химических реагентов: мочевины, ПАВ, гуанидина • Изменение температуры • Встряхивание

Денатурация белка

Расшифровка белка Предварительные исследования: 1. Определение молекулярной массы ( ультрацентрифугирование, гель-фильтрация, электрофорез и пр. ) 2. Определение числа и типа простетических групп 3. Обнаружение и расщепление дисульфидных «мостиков»

Последовательность операций при установлении первичной структуры белка • Раскрытие дисульфидных мостиков • Селективный гидролиз в присутствии ферментов • Разделение пептидов методом электрофореза • Определение последовательности АК в пептидах секвенированием по Эдману • Создание пептидных карт • Воссоздание первичной структуры белка
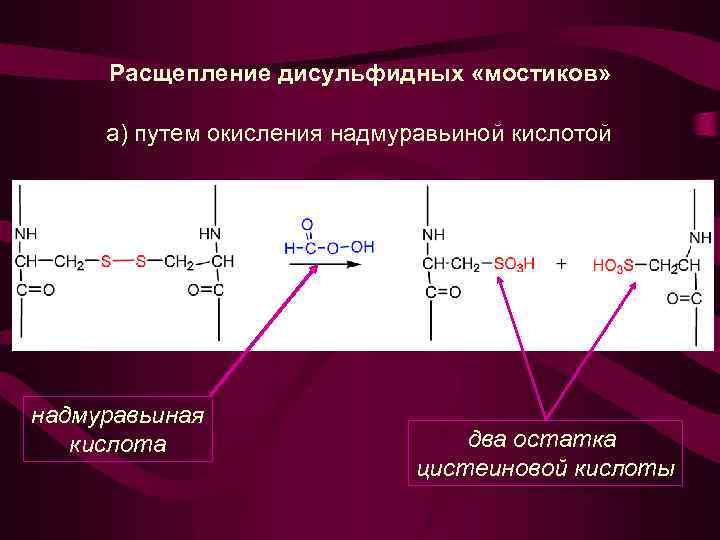
Расщепление дисульфидных «мостиков» а) путем окисления надмуравьиной кислотой надмуравьиная кислота два остатка цистеиновой кислоты
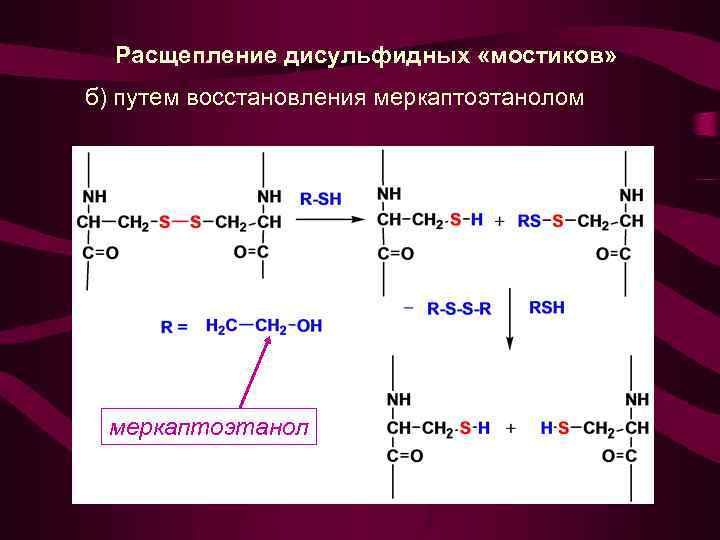
Расщепление дисульфидных «мостиков» б) путем восстановления меркаптоэтанолом меркаптоэтанол

Гомология белков: человек обезьяна курица лягушка насекомые дрожжи фасоль

Литература: 1. Ю. Б. Филиппович и др. - Биохимические основы жизнедеятельности человека, М. , Изд. ВЛАДОС, 2005, с. 47 – 75. 2. В. П. Комов, В. Н. Шведова. – Биохимия, Изд. ДРОФА, 2004, с. 28 – 40. М. , 3. Н. А. Тюкавкина, Ю. И. Бауков. – Биоорганическмя химия, М. , изд. ДРОФА, с. 357 -369.

Взаимодействия в пептидной цепи
белки.ppt