2-Белки как лиганды (50).ppt
- Количество слайдов: 59

Белки как лиганды

БИОЛОГИЧЕСКИЕ ФУНКЦИИ БЕЛКОВ Белки – медиаторы биологических функций Ферменты (рибонуклеаза катализирует гидролиз РНК) Регуляторные белки (инсулин регулирует уровень сахара в крови) Транспортные белки (гемоглобин доставляет O 2 в ткани) Структурные белки (коллаген является компонентом соединительных тканей) Сократительные белки (актин и миозин содержатся в мускулах) Запасные белки (ферритин депонирует Fe в селезенке) Scaffolding proteins & modules: (доставляют белки к необходимому участку) Экзотические белки (белки-антифризы у рыб)

Функциональные группы в белках, которые обеспечивают их функционирование Группа, с которой белок «сопряжен» , и без которой его функционирование невозможно, называется простетической группой Нуклеопротеины – белки с компонентами нуклеиновых кислот (рибосомы) Гликопротеины – белки, связанные с углеводами за счет ковалентных связей (рецепторы клеток) Липопротеины – белки, ковалентно связанные с липидами (мембранно-связанные белки) Металлопротеины – белки, для функционирования которых необходим ион металла (гемоглобин)
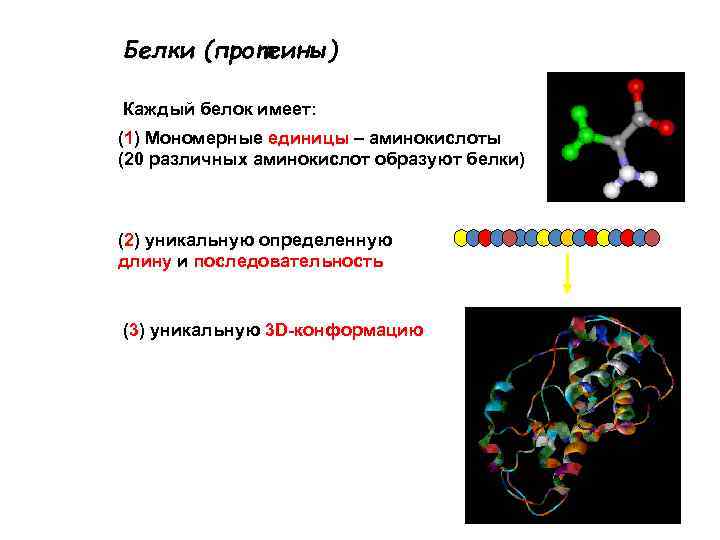
Белки (протеины) Каждый белок имеет: (1) Мономерные единицы – аминокислоты (20 различных аминокислот образуют белки) (2) уникальную определенную длину и последовательность (3) уникальную 3 D-конформацию

РОЛЬ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ В БЕЛКАХ Met-Ala-Cys. …. . . Ala-Thr-Arg-Leu … Вся информация, необходимая для свертывания белковой цепи в его «нативную» структуру, содержится в первичной структуре пептида (последовательности аминокислот)….
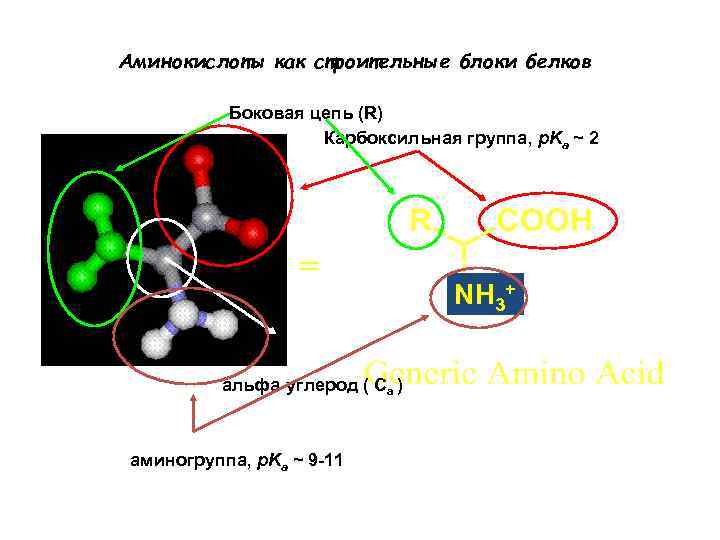
Аминокислоты как строительные блоки белков Боковая цепь (R) Карбоксильная группа, p. Ka ~ 2 = альфа-углерод ( Ca ) аминогруппа, p. Ka ~ 9 -11 NH 3+
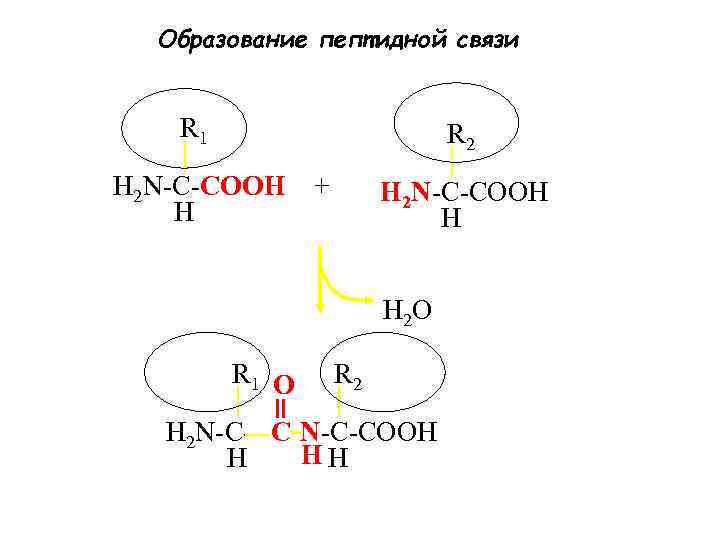
Образование пептидной связи R 1 R 2 H 2 N-C-COOH H + H 2 N-C-COOH H H 2 O R 1 O R 2 H 2 N-C---C N-C-COOH HH H

Нобелевская премия по химии. 2009. Векатраман Томас Стайц Ада Йонат Рамакришнан Кембридж (Великобритания) Йельский Университет (США) Институт Вейцмана (Израиль) Исследования структуры и функции рибосомы Рибосомы нуклеопротеины, в составе которых отношение РНК/белок составляет 1: 1 у высших животных. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой РНК. Этот процесс называется трансляцией. В эукариотических клетках рибосомы располагаются на мембранах эндоплазматического ретикулума, но могут быть локализованы и в цитоплазме. (Рибосомы также являются мишенью для новых антибиотиков)
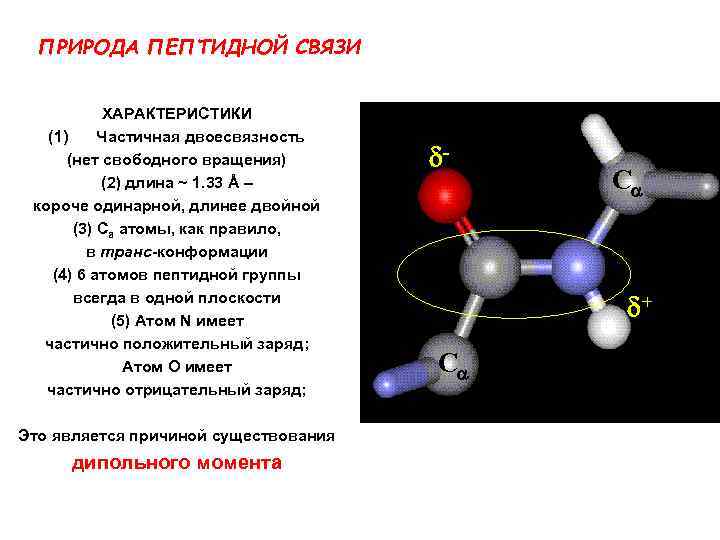
ПРИРОДА ПЕПТИДНОЙ СВЯЗИ ХАРАКТЕРИСТИКИ (1) Частичная двоесвязность (нет свободного вращения) (2) длина ~ 1. 33 Å – короче одинарной, длинее двойной (3) Ca атомы, как правило, в транс-конформации (4) 6 атомов пептидной группы всегда в одной плоскости (5) Атом N имеет частично положительный заряд; Атом O имеет частично отрицательный заряд; Это является причиной существования дипольного момента d- Ca d+ Ca

Функциональные группы в аминокислотах Протеиногенные аминокислоты – 20 аминокислот, которые кодируются генетическим кодом Незаменимые аминокислоты – это аминокислоты, которые не могут синтезироваться в организме человека, а поступают с пищей
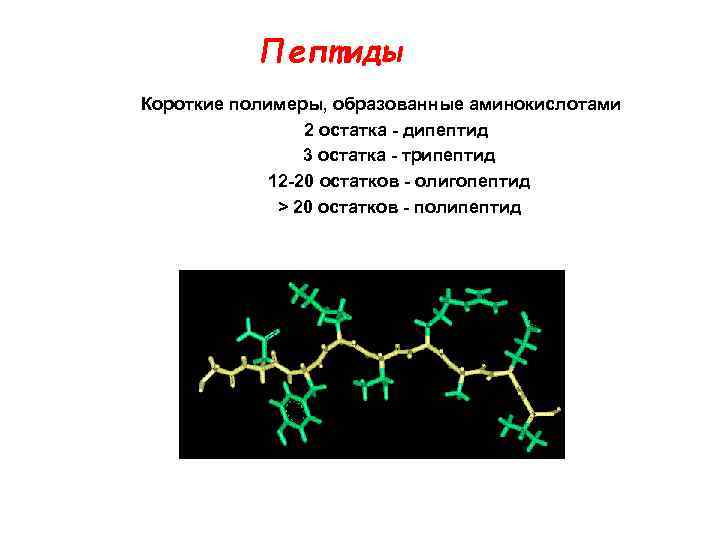
Пептиды Короткие полимеры, образованные аминокислотами 2 остатка - дипептид 3 остатка - трипептид 12 -20 остатков - oлигопептид > 20 остатков - полипептид
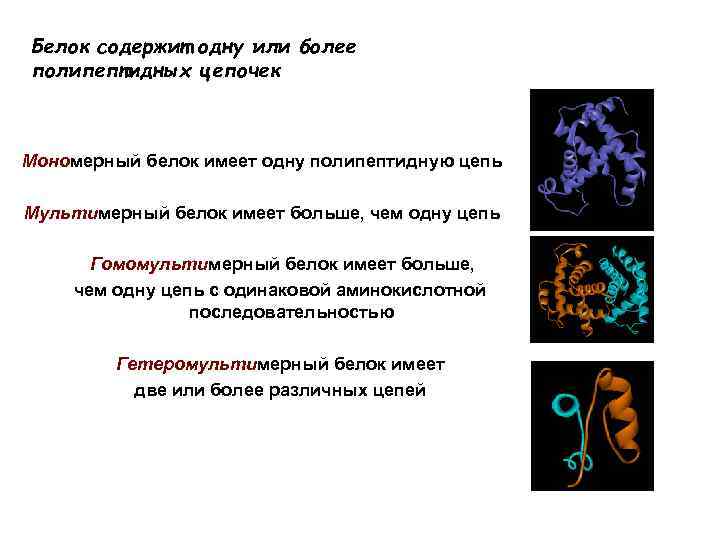
Белок содержит одну или более полипептидных цепочек Мономерный белок имеет одну полипептидную цепь Мультимерный белок имеет больше, чем одну цепь Гомомультимерный белок имеет больше, чем одну цепь с одинаковой аминокислотной последовательностью Гетеромультимерный белок имеет две или более различных цепей
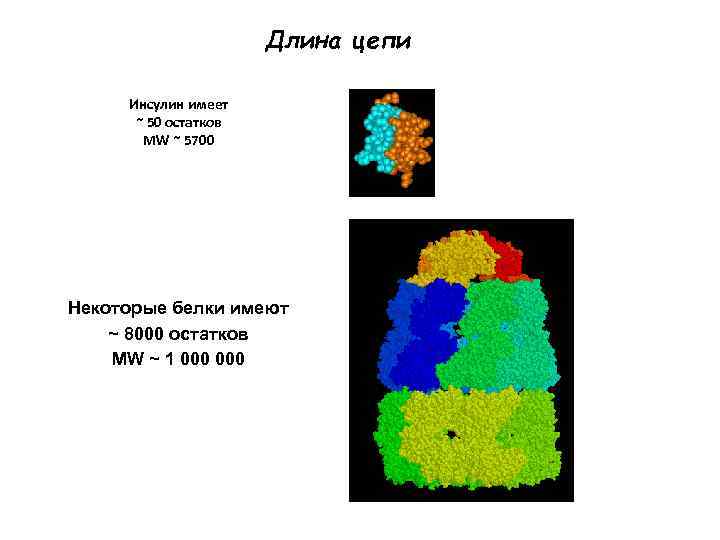
Длина цепи Инсулин имеет ~ 50 остатков MW ~ 5700 Некоторые белки имеют ~ 8000 остатков MW ~ 1 000
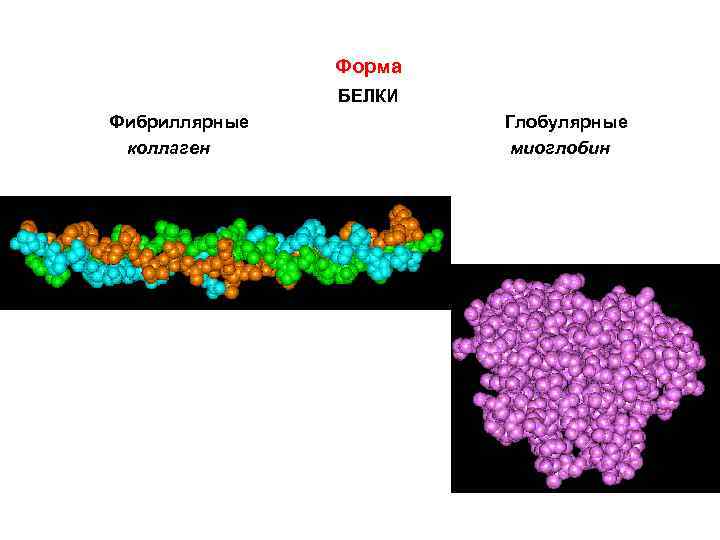
Форма БЕЛКИ Фибриллярные коллаген Глобулярные миоглобин
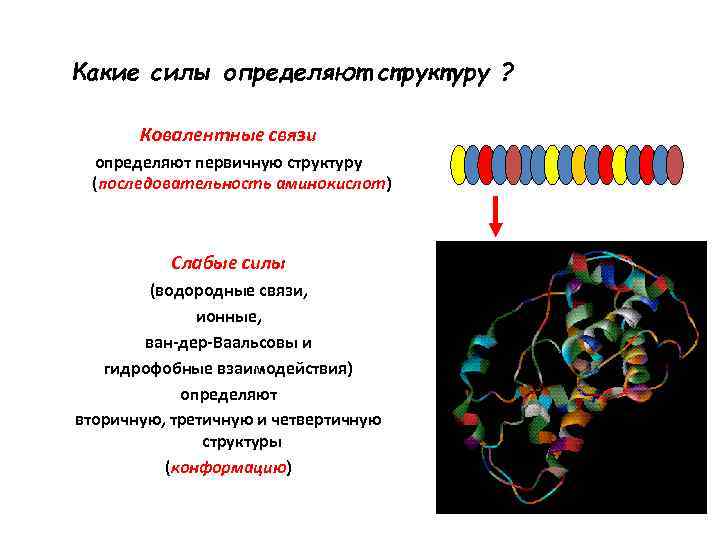
Какие силы определяют структуру ? Ковалентные связи определяют первичную структуру (последовательность аминокислот) Слабые силы (водородные связи, ионные, ван-дер-Ваальсовы и гидрофобные взаимодействия) определяют вторичную, третичную и четвертичную структуры (конформацию)

Альфа-спираль C Правозакрученная спираль (α-спираль) (вторичная структура) Стабилизирована водородными связями между атомом O карбонильной группы и атомом N амидной группы Остатков на виток 3. 6 Рост цепи на остаток 1. 5 Å Рост цепи на виток (pitch): 3. 6 x 1. 5Å = 5. 4 Å N
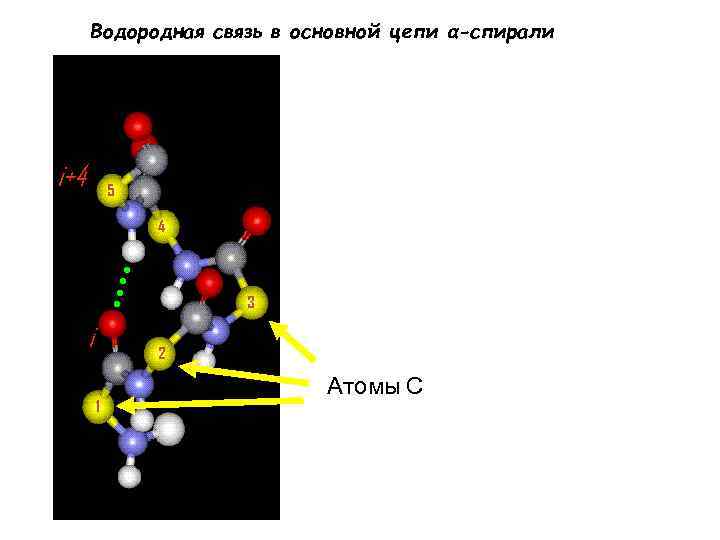
Водородная связь в основной цепи α-спирали i+4 5 4 3 i 2 1 Атомы С

СПОСОБЫ ИЗОБРАЖЕНИЯ α-СПИРАЛИ
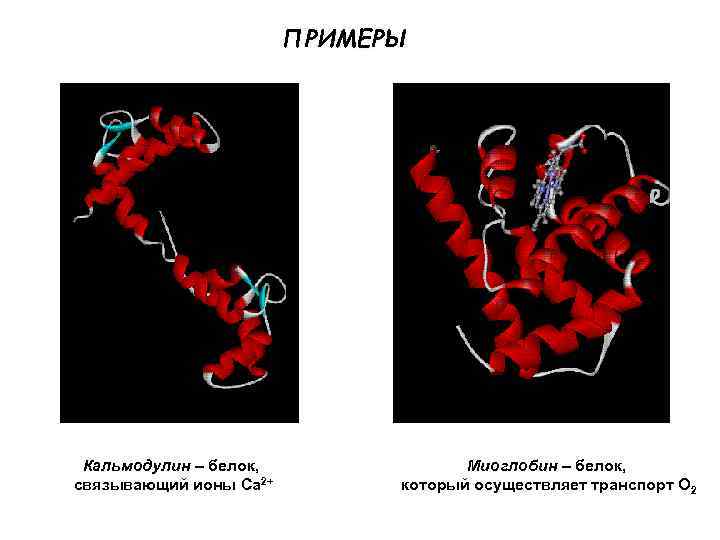
ПРИМЕРЫ Кальмодулин – белок, связывающий ионы Ca 2+ Миоглобин – белок, который осуществляет транспорт О 2
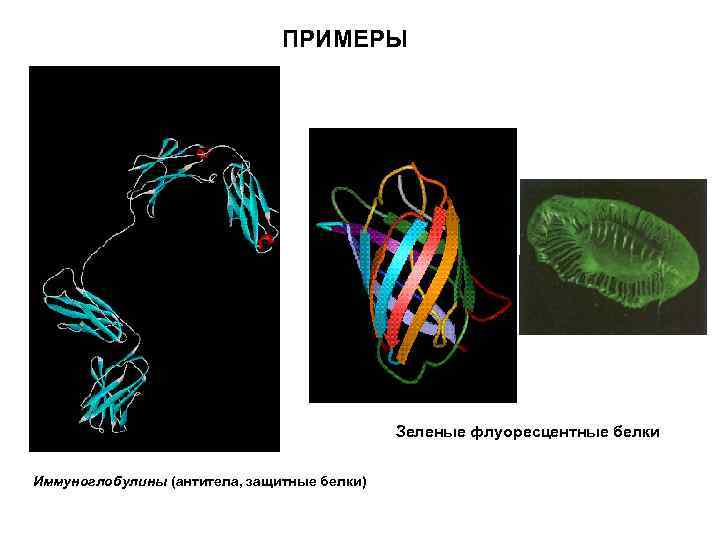
ПРИМЕРЫ Зеленые флуоресцентные белки Иммуноглобулины (антитела, защитные белки)

Нобелевская премия по химии. 2008. Осаму Шимомура, Мартин Чалфи и Роджер Циен (США) Принстон Колумбийский университет Калифорнийский университет (Сан-Диего) Зеленые флуоресцентные белки (green fluorescent protein, GFP) флуорофор зелёного флуоресцентного белка Флуоресцирующие белки используются в качестве светящихся меток при изучении клеток, тканей и живых организмов. Модификации белка применяются в биосенсорах

Белки как лиганды Функциональные группы в аминокислотах, которые могут образовывать связи с ионами металлов
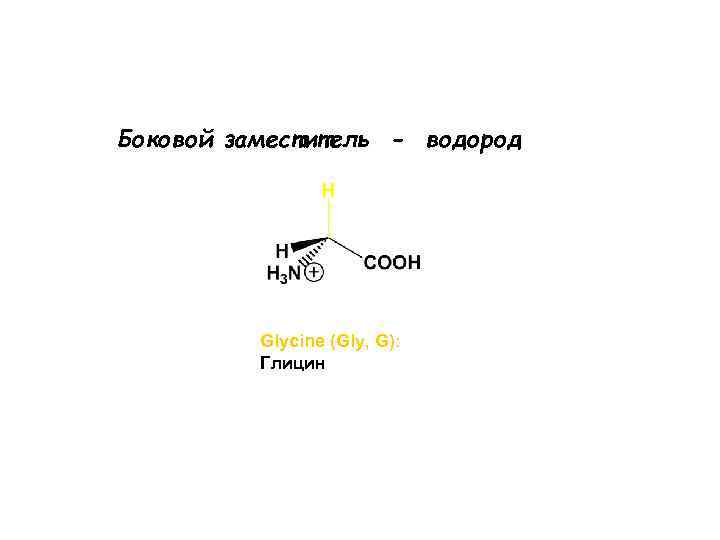
Боковой заместитель - водород Glycine (Gly, G): Глицин
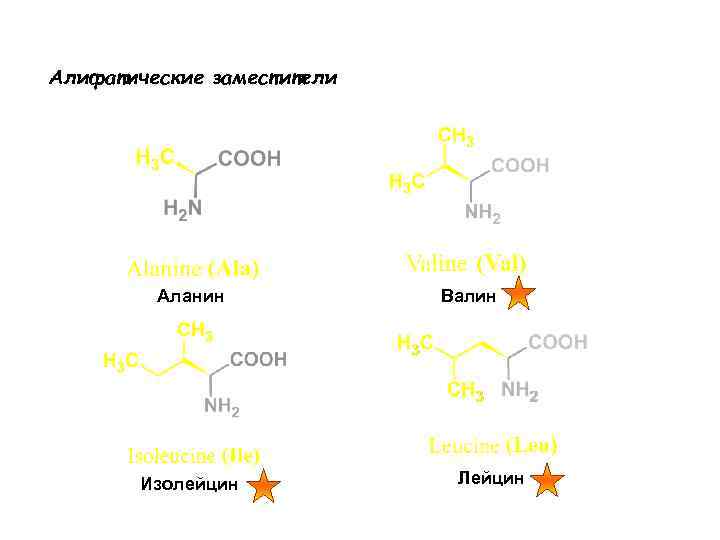
Алифатические заместители Аланин Изолейцин Валин Лейцин
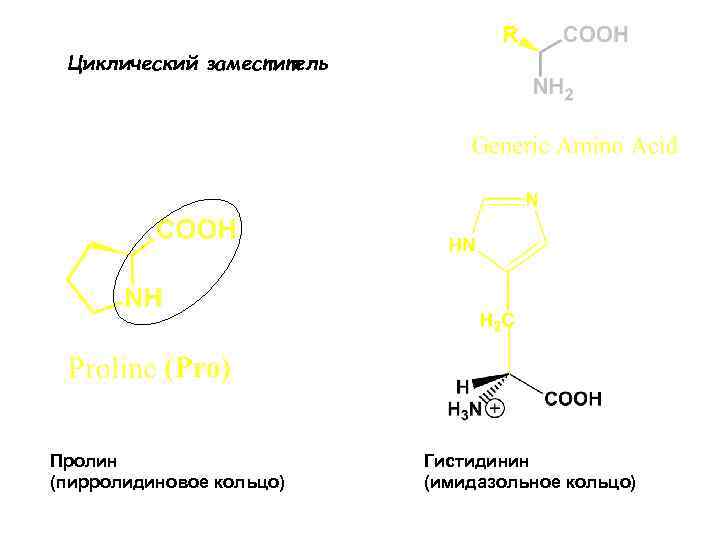
Циклический заместитель Пролин (пирролидиновое кольцо) Гистидинин (имидазольное кольцо)
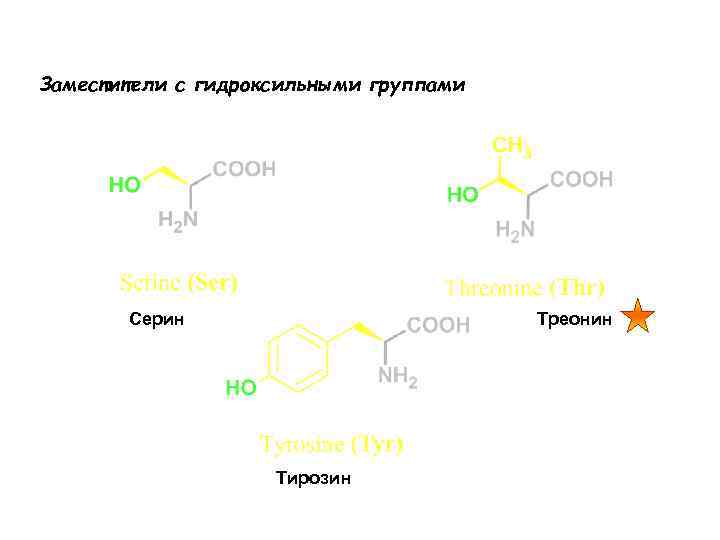
Заместители с гидроксильными группами Серин Треонин Тирозин
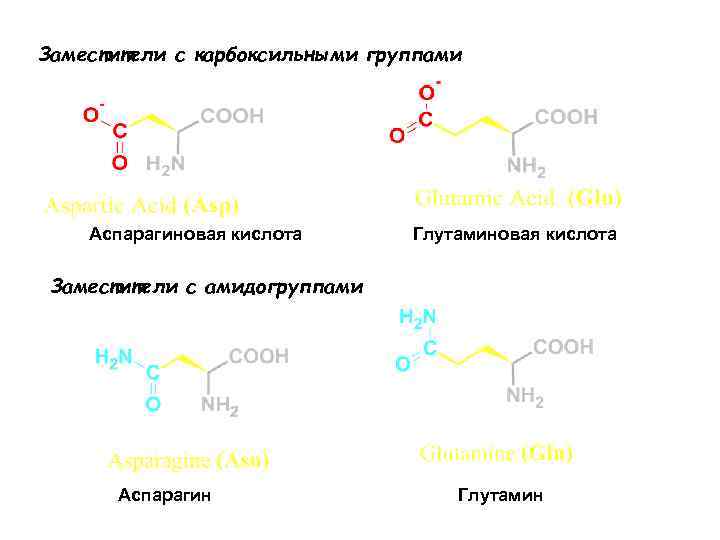
Заместители с карбоксильными группами Аспарагиновая кислота Глутаминовая кислота Заместители с амидогруппами Аспарагин Глутамин
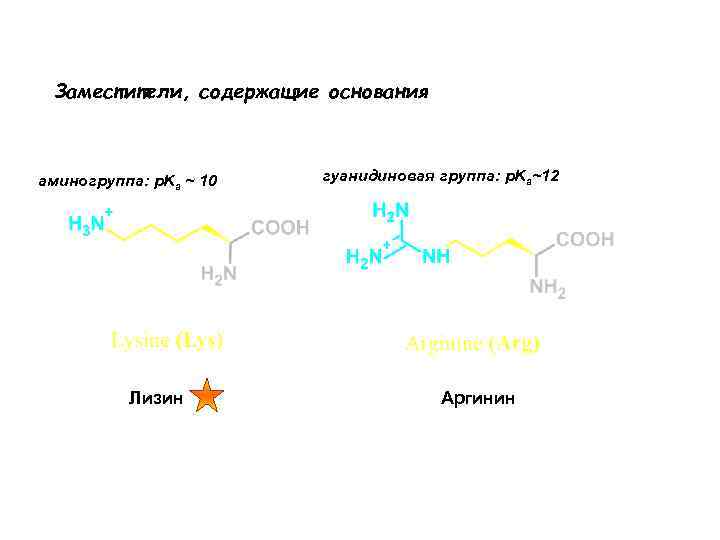
Заместители, содержащие основания аминогруппа: p. Ka ~ 10 Лизин гуанидиновая группа: p. Ka~12 Аргинин
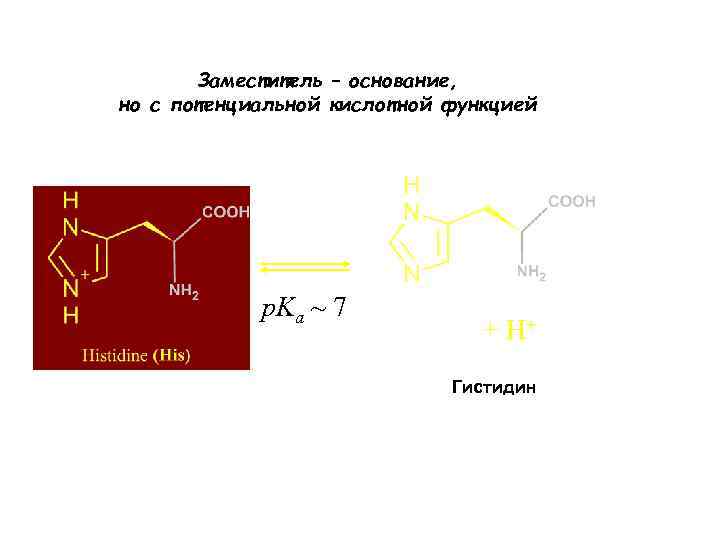
Заместитель – основание, но с потенциальной кислотной функцией p. Ka ~ 7 + H+ Гистидин
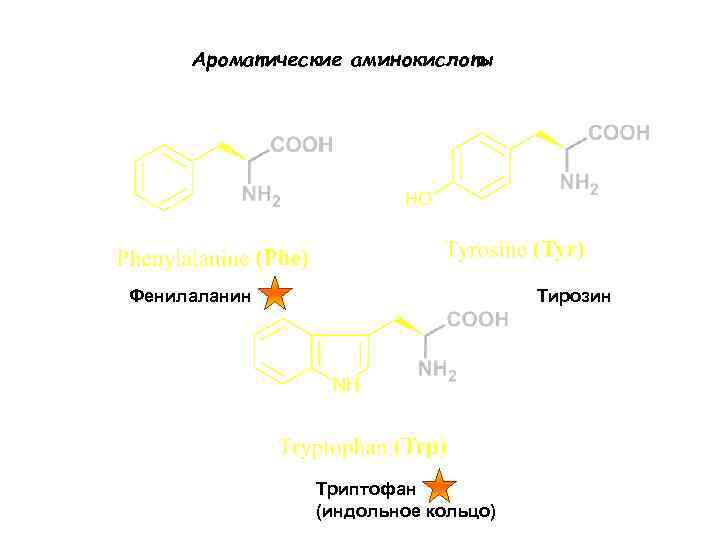
Ароматические аминокислоты Фенилаланин Тирозин Триптофан (индольное кольцо)
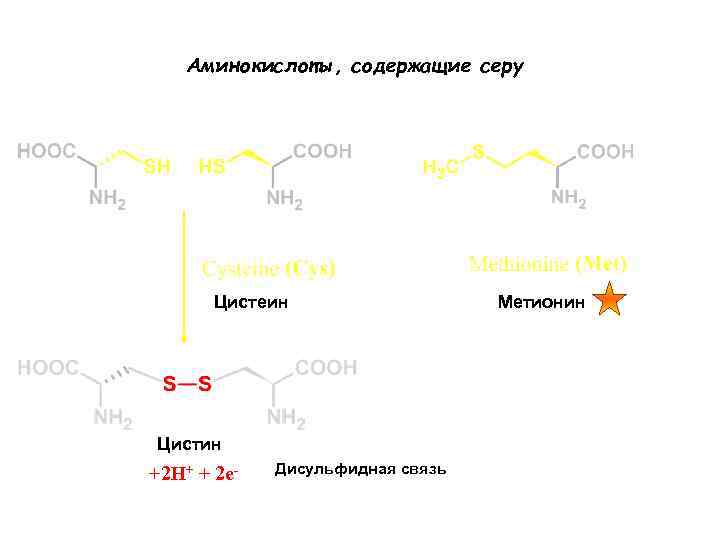
Аминокислоты, содержащие серу Цистеин Цистин +2 H+ + 2 e- Дисульфидная связь Метионин

ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ПЕПТИДАМИ И БЕЛКАМИ
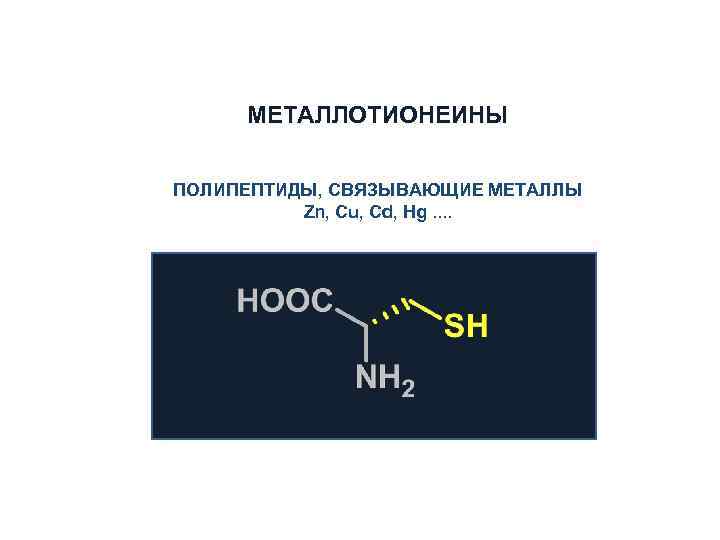
МЕТАЛЛОТИОНЕИНЫ ПОЛИПЕПТИДЫ, СВЯЗЫВАЮЩИЕ МЕТАЛЛЫ Zn, Cu, Cd, Hg. .
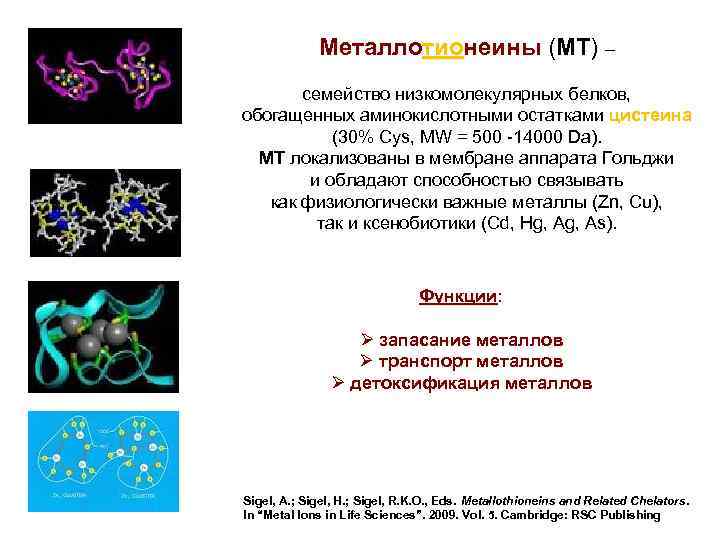
Металлотионеины (MT) – MT семейство низкомолекулярных белков, обогащенных аминокислотными остатками цистеина (30% Cys, MW = 500 -14000 Dа). МТ локализованы в мембране аппарата Гольджи и обладают способностью связывать как физиологически важные металлы (Zn, Cu), так и ксенобиотики (Cd, Hg, As). Функции: Ø запасание металлов Ø транспорт металлов Ø детоксификация металлов Sigel, A. ; Sigel, H. ; Sigel, R. K. O. , Eds. Metallothioneins and Related Chelators. In “Metal Ions in Life Sciences”. 2009. Vol. 5. Cambridge: RSC Publishing

Дополнения Образование комплексов металлов с пептидами (artificial)
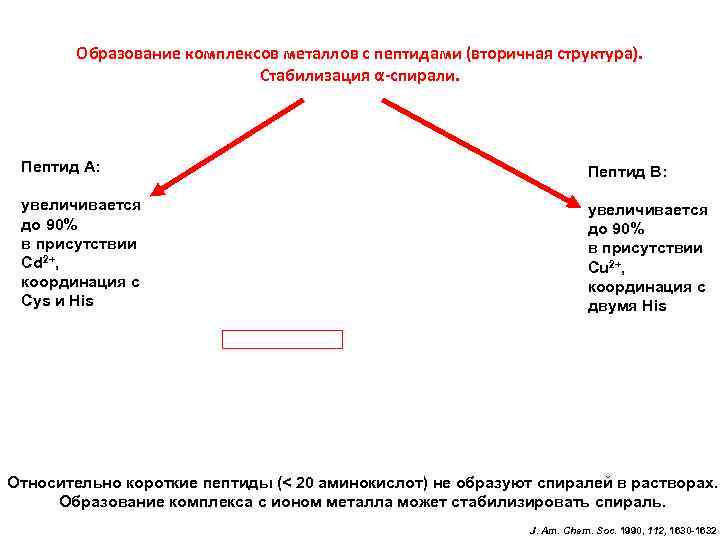
Образование комплексов металлов с пептидами (вторичная структура). Стабилизация α-спирали. Пептид A: Пептид В: увеличивается до 90% в присутствии Cd 2+, координация с Cys и His увеличивается до 90% в присутствии Cu 2+, координация с двумя His Относительно короткие пептиды (< 20 аминокислот) не образуют спиралей в растворах. Образование комплекса с ионом металла может стабилизировать спираль. J. Am. Chem. Soc. 1990, 112, 1630 -1632
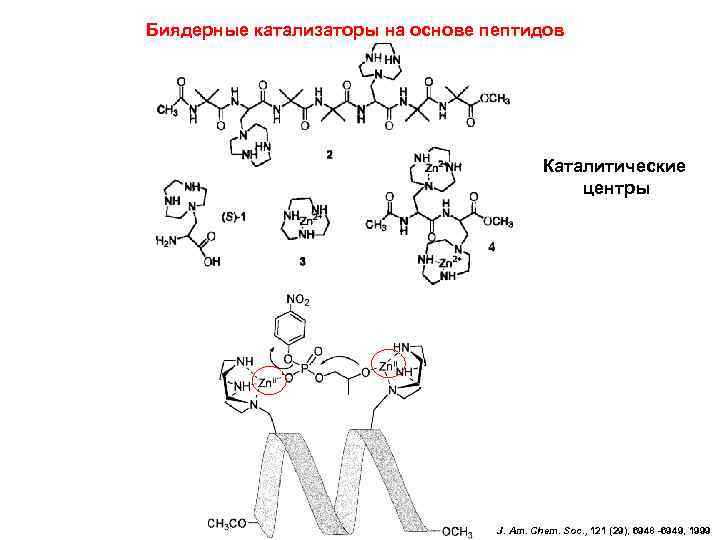
Биядерные катализаторы на основе пептидов Каталитические центры J. Am. Chem. Soc. , 121 (29), 6948 -6949, 1999
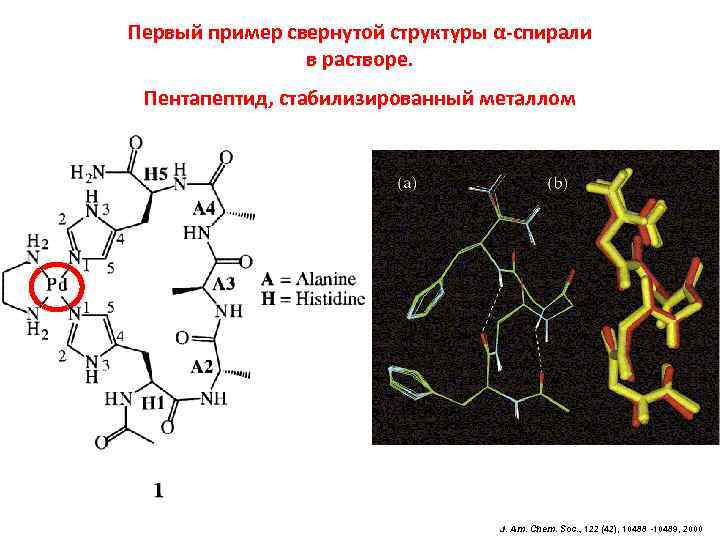
Первый пример свернутой структуры α-спирали в растворе. Пентапептид, стабилизированный металлом J. Am. Chem. Soc. , 122 (42), 10488 -10489, 2000


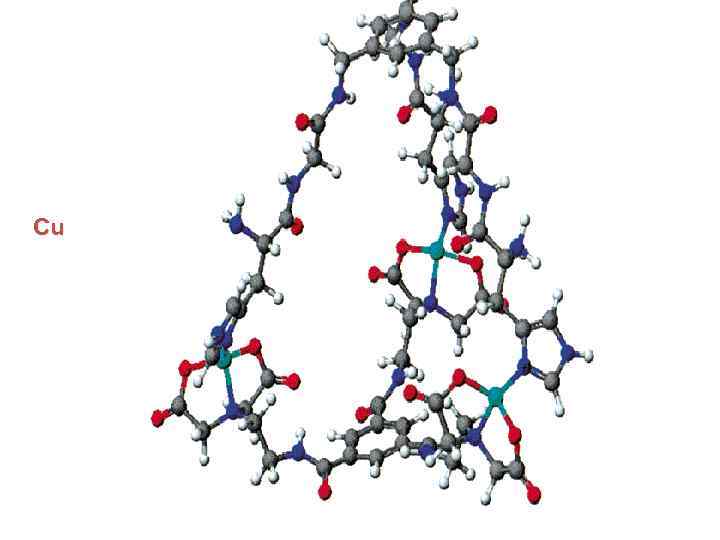
Cu
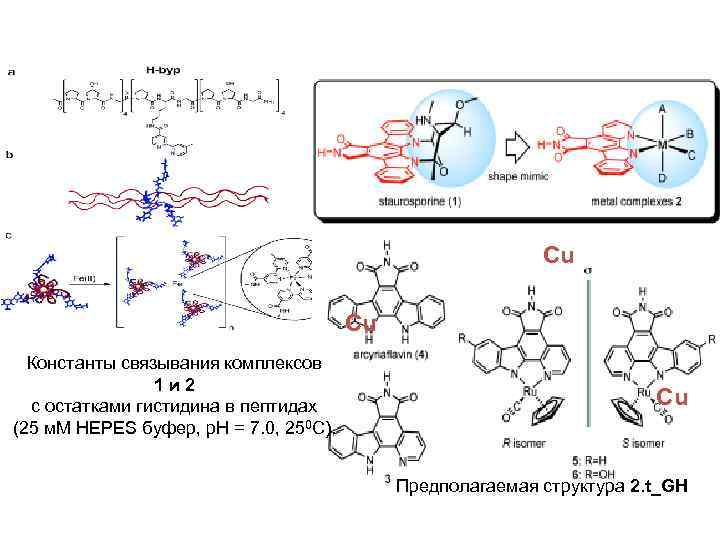
Cu Cu Константы связывания комплексов 1 и 2 с остатками гистидина в пептидах (25 м. M HEPES буфер, p. H = 7. 0, 250 C). Cu Предполагаемая структура 2. t_GH
Stabilizing turns with the help of metal ion complexation






Metal-Triggered Radial Self-Assembly of Collagen Peptide Fibers Collagen-mimetic peptide, triple helix, and metal-triggered assembly: (a) amino acid sequence of H-byp; (b) side view of H-byp after triple helix formation (peptide, red; bipyridine modification, blue); (a) top view of a single triple helix followed by metal-triggered assembly. J. Am. Chem. Soc. , 130 (38), 12610– 12611, 2008

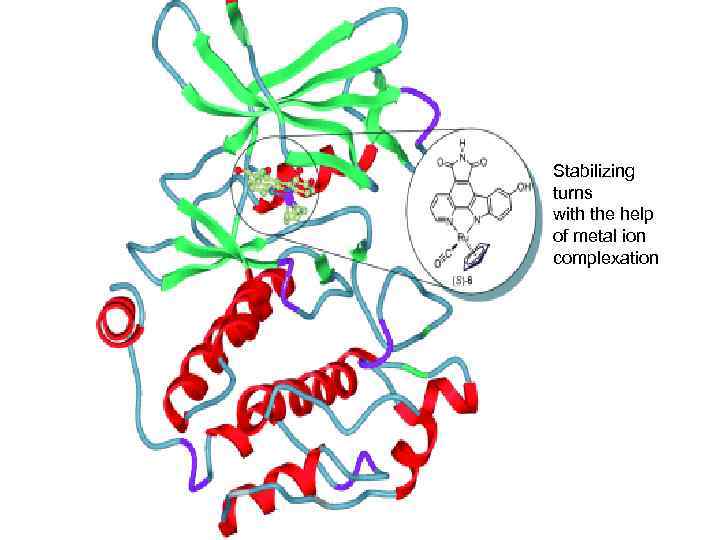
Ruthenium Half-Sandwich Complexes Bound to Protein Kinase Pim-1 Crystal structure of Pim-1 with the enantiomerically pure Ru complex ( S)-6 bound to the ATP-binding site. Angew. Chem. Int. Ed. Engl. 45, 1580 -1585 (2006)




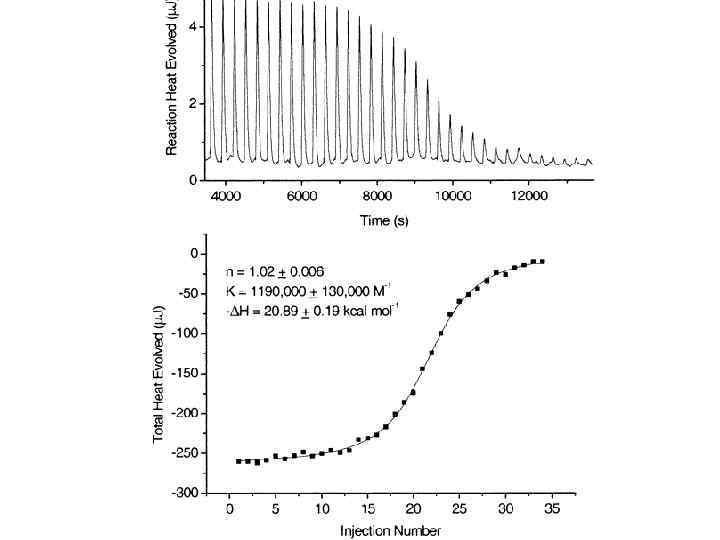
Isothermal Titration Calorimetry (ITC) Experiments Figure 2 Raw and processed data for the titration of t_GH with complex 2 Copper complexes were studied. Recognition is due to Cu(II) – His complexation


Figure 2. (a) UV−vis titration of H-byp (54 μM) with Fe(II); (b) dynamic light scattering of H-byp (1 m. M), in 10 m. M HEPES p. H 7. 0 (black), with Fe(II) (500 μM) (red), and with Fe(II) (500 μM) and EDTA (100 m. M) (green).

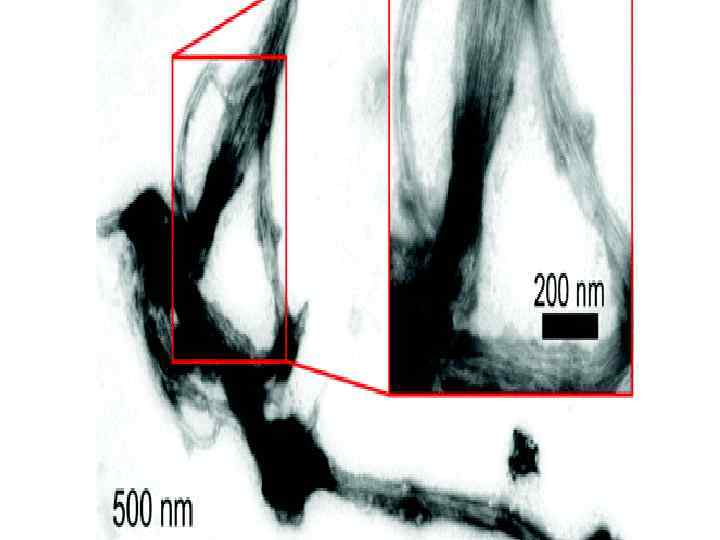
Metal-Triggered Radial Self-Assembly of Collagen Peptide Fibers J. Am. Chem. Soc. , 130 (38), 12610– 12611, 2008 Figure 3. TEM image of H-byp (2 m. M), Fe(II) (0. 3 m. M), in HEPES (10 m. M p. H 7. 0).
2-Белки как лиганды (50).ppt