Белки 2.ppt
- Количество слайдов: 29

Белки. История изучения. Структура. Свойства. Функции. Выполнили: Валеева А. Гилазиева З. Гильмутдинов А. Журавлева Е. Зарипова А. Сергеева Ю. Старостин О. Фазлеева И.

Выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных. Исследованы такие белки, как альбумин, фибрин и глютен. История изучения.

Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Определил продукты разрушения белков — аминокислоты и для одной из них определил молекулярную массу — 131 Да. В 1836 предложил первую модель химического строения белков. История изучения.

Термин «протеин» для обозначения подобных молекул был предложен в 1838 году шведским химиком Якобом Берцелиусом. История изучения.

К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков. История изучения.

В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Осуществил первый анализ аминокислотной последовательности белка. Объяснил явление протеолиза. История изучения.

1926 год. Американский химик Джеймс Самнер показал, что фермент уреаза является белком. История изучения.

В конце 1950 -х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных. История изучения.

Лайнус Полинг смог успешно предсказать вторичную структуру белков. Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. История изучения.

В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина Первые структуры белков были получены в 1960 -х годах. История изучения.

Протеомика — наука, основным предметом изучения которой являются белки и их взаимодействия в живых организмах, в том числе — в человеческом. С помощью методов биоинформатики стало возможно предсказать структуру белка, основываясь на его аминокислотной последовательности. XXI век.
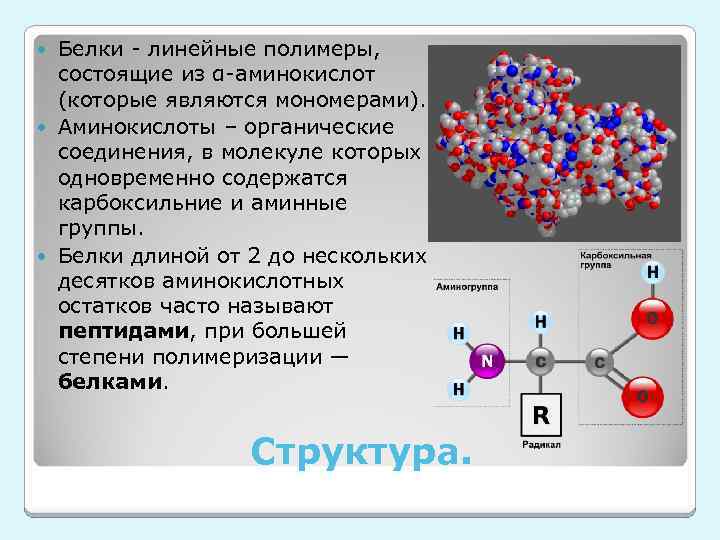
Белки - линейные полимеры, состоящие из α-аминокислот (которые являются мономерами). Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильние и аминные группы. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками. Структура.

Первичная структура - представляет собой последовательность аминокислотных остатков, соединенных друг с другом пептидными связями (связи между карбоксильными и аминогруппами разных аминокислот). Именно в таком виде белок образуется на рибосомах. Первичная структура.
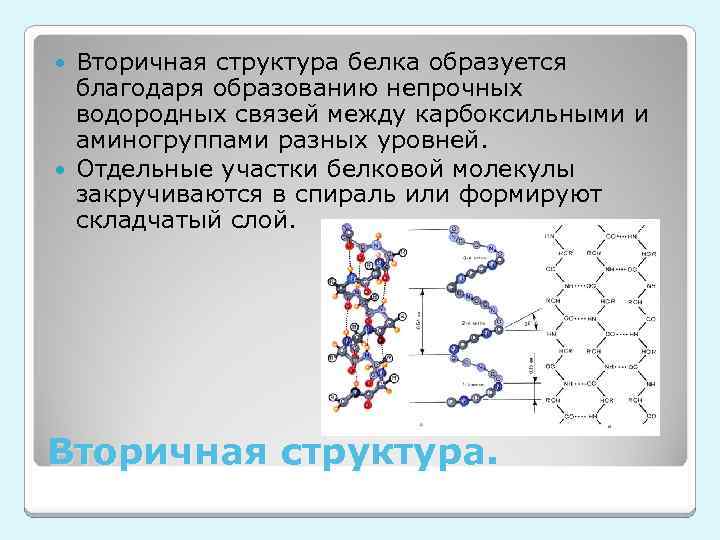
Вторичная структура белка образуется благодаря образованию непрочных водородных связей между карбоксильными и аминогруппами разных уровней. Отдельные участки белковой молекулы закручиваются в спираль или формируют складчатый слой. Вторичная структура.
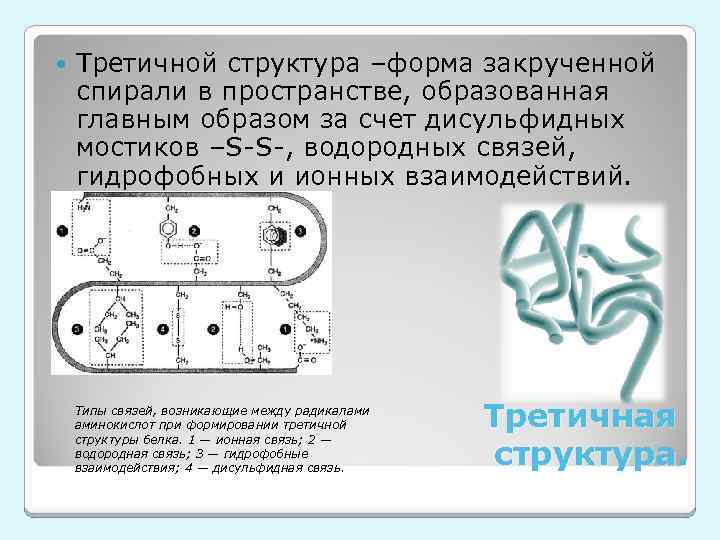
Третичной структура –форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков –S-S-, водородных связей, гидрофобных и ионных взаимодействий. Типы связей, возникающие между радикалами аминокислот при формировании третичной структуры белка. 1 — ионная связь; 2 — водородная связь; 3 — гидрофобные взаимодействия; 4 — дисульфидная связь. Третичная структура.

Четверичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Четвертичная структура.

Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса). Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов. Свойства белков. Миофибрилл. Выделенный участок с титином (красный).

Сравнительный размер белков. Слева направо: антитело (Ig. G), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)

В составе белков всегда имеются свободные кислые (СОО–) и основные (NH 3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т. е. способность поддерживать неизменным р. Н крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании. Амфотерность белков.

Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется: наличием заряда и взаимоотталкиванием заряженных молекул белка, наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. К нерастворимым относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п. ) и фиброин, который входит в состав шёлка и паутины. Растворимость белков.

Потеря белком структуры называется денатурацией. Денатурация может быть полной или частичной, обратимой или необратимой. Самый известный случай необратимой денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация белков.

Защитная Регуляторная Сигнальная Каталитическая Структурная Функции белков. Транспортная

Ферменты — группа белков, обладающая специфическими каталитическими свойствами. Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из них взаимодействует с субстратом, и ещё меньшее количество напрямую участвуют в катализе Каталитическая функция.

Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Коллаген и эластин — основные компоненты межклеточного вещества соединительной ткани, а из кератина состоят волосы, ногти, перья птиц и некоторые раковины. Структурная функция.

Физическая защита (фибриногены и тромбины, участвующие в свёртывании крови). Химическая защита (ферменты печени, расщепляющие яды или переводящие их в растворимую форму). Иммунная защита (антитела, входящие в состав крови и других биологических жидкостей). Защитная функция.

Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют транскрипцию, трансляцию, а также активность других белков и др. Белок-регулятор клеточного деления провоцирует раковую опухоль. Регуляторная функция.

Способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, органами и разными организмами. Сигнальную функцию выполняют белкигормоны, цитокины, факторы роста и др. Гормоны коркового вещества надпочечников. Сигнальная функция.
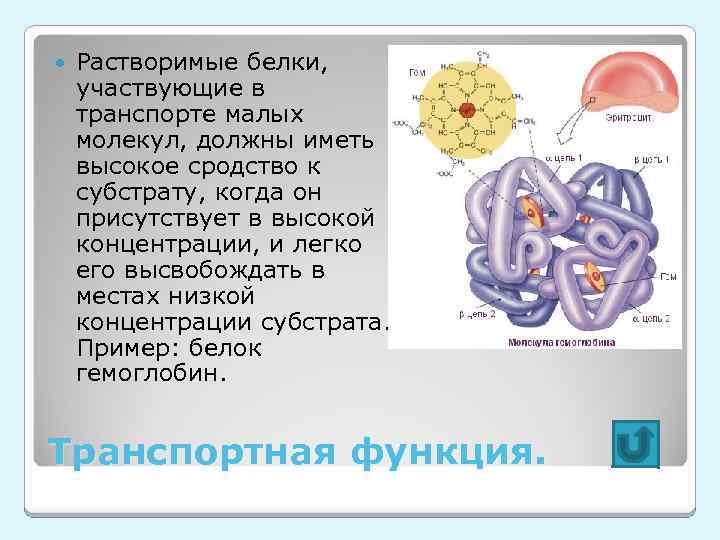
Растворимые белки, участвующие в транспорте малых молекул, должны иметь высокое сродство к субстрату, когда он присутствует в высокой концентрации, и легко его высвобождать в местах низкой концентрации субстрата. Пример: белок гемоглобин. Транспортная функция.

Спасибо за внимание!
Белки 2.ppt