белки и аминокислоты.ppt
- Количество слайдов: 27

Белки и аминокислоты Выполнил: Тарабарин М. В Студент группы 1 Т-45
Содержание: Аминокислоты • Общие химические свойства • Классификация стандартных аминокислот • Альфа-аминокислоты белков Белки • Функции белков в организме • Свойства • Методы количественного определения белков

Аминокислоты Структура аминокислоты с аминогруппой слева и карбоксильной группой справа • Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. • Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.

Общие химические свойства • 1. Аминокислоты могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы COOH, так и основные свойства, обусловленные аминогруппой -NH 2. • Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов.
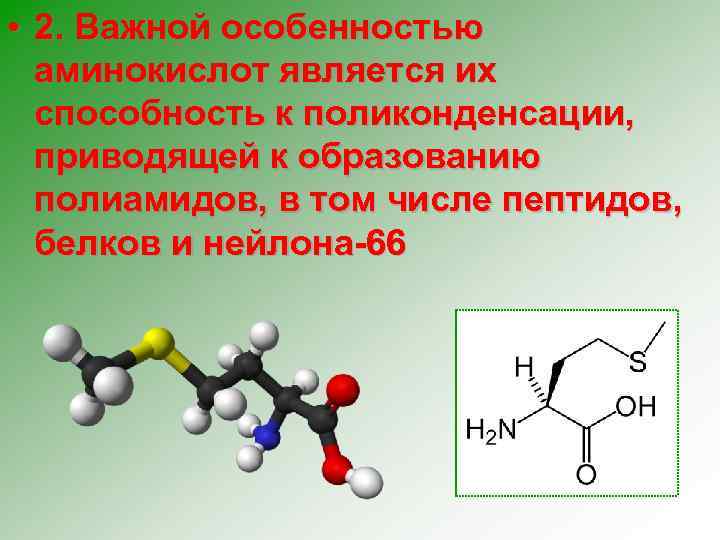
• 2. Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-66

• 3. Изоэлектрической точкой аминокислоты называют значение p. H, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. • При таком p. H аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
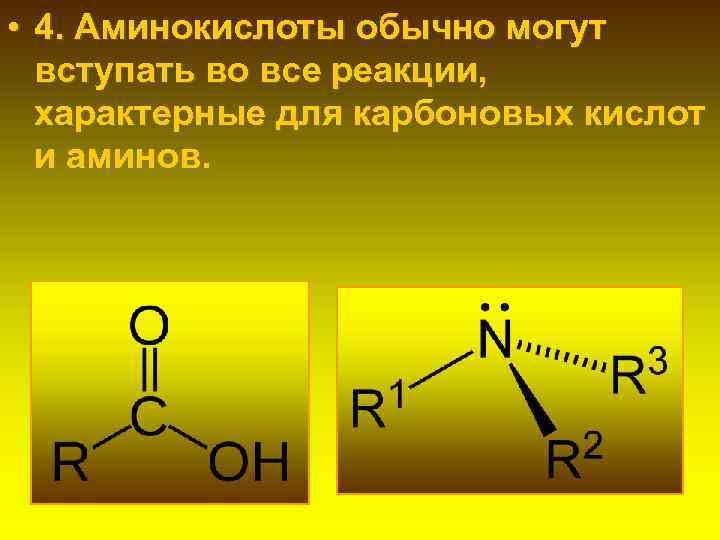
• 4. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.

Классификация стандартных аминокислот По R-группам • Неполярные: аланин, валин, изолейцин, метионин, пролин, триптофан, фенилаланинглицин, • Полярные незаряженные (заряды скомпенсированы)при p. H=7: аспарагин, глутамин, серин, тирозин, треонин, цистеин • Полярные заряженные отрицательно при p. H=7: аспарагиновая кислота, глутаминовая кислота • Полярные заряженные положительно при p. H=7: аргинин, гистидин, лизин

По функциональным группам • Алифатические – Моноаминомонокарбоновые: аланин, валин, глицин, изолейцин, лейцин – Оксимоноаминокарбоновые: серин, треонин – Моноаминодикарбоновые: аспарагиновая кислота, глутаминовая кислота, за счёт второй карбоксильной группы имеют несут в растворе отрицательный заряд – Амиды Моноаминодикарбоновых: аспарагин, глутамин – Диаминомонокарбоновые: аргинин, гистидин, лизин, несут в растворе положительный заряд – Серосодержащие: цистеин (цистин), метионин • Ароматические: фенилаланин, тирозин • Гетероциклические: триптофан, гистидин, пролин (также входит в группу иминокислот) • Иминокислоты: пролин (также входит в группу гетероциклических)

Альфа-аминокислоты белков • В процессе биосинтеза белка в полипептидную цепь включаются 20 важнейших α-аминокислот, кодируемых генетическим кодом. • Помимо этих аминокислот, называемых стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, являющиеся производными стандартных. В последнее время к стандартным аминокислотам иногда причисляют селеноцистеин (Sec, U) и пирролизин (Pyl, O).

Белки • Белки (протеи ны, полипепти ды) — высокомолекулярные органические вещества, состоящие из Кристаллы различных белков, соединённых в выращенные на космической станции «Мир» и во время цепочку пептидной полётов шаттлов НАСА. Высокоочищенные белки при связью низкой температуре образуют кристаллы, которые используют аминокислот. для получения модели данного

• В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот

• Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке.
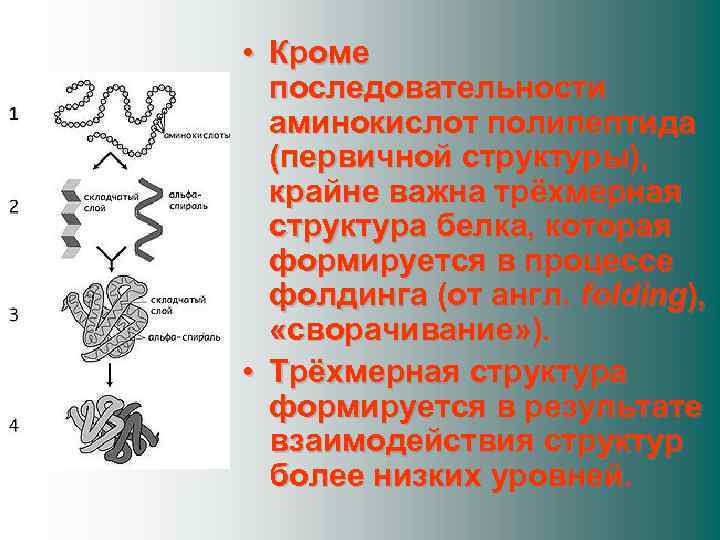
• Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding), «сворачивание» ). • Трёхмерная структура формируется в результате взаимодействия структур более низких уровней.

Функции белков в организме: – Каталитическая функция – Структурная функция – Защитная функция – Регуляторная функция – Транспортная функция – Запасная (резервная) функция белков – Рецепторная функция – Моторная и сократительные функции

• Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине по образованию белка — рибосоме

• Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. • Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.

• Белки — важная часть питания животных и человека, поскольку в их организме не могут синтезироваться Молекулярная модель малой все необходимые (слева) и большой (справа) субъединиц бактериальной аминокислоты и рибосомы — молекулярной машины, синтезирующей часть из них белки. Голубым цветом показаны белки в составе поступает с рибосомы, но основную структурную роль выполняет белковой пищей. р. РНК

Мышиное антитело против холеры, присоединённое к углеводородному антигену (вверху) • В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.

• Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот.

Свойства • Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (к. Да). • Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 к. Да.

• Самый большой из известных в настоящее время белков — титин (другие названия: тайтин, коннектин) — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3 000 до 3 700 к. Да, а общая длина 38 138 аминокислот (в человеческой мышце solius). Сравнительный размер белков. Слева направо: Антитело (Ig. G), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)

• Все белки разделяют на две большие группы — простые и сложные белки. • Простые белки содержат только аминокислоты, сложные белки имеют также неаминокислотные группы. Эти дополнительные группы в составе сложных белков называются «простетическими группами» . Движение молекулы миозина при мышечном сокращении Разные способы изображения трёхмерной структуры белка на примере фермента
Молекулярная модель фермента уреазы бактерии Helicobacter pylori • Примерами простетических групп в составе белков служат гем (в составе гемоглобина), витамины тиамин и биотин. • Неорганические простетические группы состоят из ионов металлов — цинка, магния и молибдена.

Методы количественного определения белков Для определения количества белка в образце используется ряд методик: • • • Биуретовый метод Микробиуретовый метод Метод Бредфорда Метод Лоури Спектрофотометрический метод

Тестовые вопросы Вопрос теста Варианты ответа а б в г 1. При гидролизе белков получаются… Протеины Аминокислоты Пептиды Карбоновые кислоты Понижение растворимости белка Взаимодействие между молекулами белка 2. Денатурация белка Изменение структуры Разрушение молекул – это… белка 3. Изоэлектрическая точка белка – это… Область p. H, где растворимость белка повышается Область p. H, где количество COO–групп равно количеству NH 3+ - групп p. H, при котором молекула белка сворачивается p. H, при котором молекула белка имеет линейную форму 4. Заменимые аминокислоты Глицин Серин Лизин Аргинин 5. Незаменимые аминокислоты Триптофан Аланин Валин Фенилаланин

СПАСИБО ЗА ПРОСМОТР!
белки и аминокислоты.ppt