Biochim_02_r-15.ppt
- Количество слайдов: 39

Белки, ферменты и коферменты 1

Белки Высокомолекулярные органические соединения, построенные из остатков аминокислот. Аминокислотные остатки в полипептидной цепи соединены при помощи пептидной связи. 2

Аминокислоты Органические (карбоновые) кислоты, содержащие, как правило, одну или две аминогруппы (-NH 2). В зависимости от положения аминогруппы в углеродной цепи по отношению к карбоксилу различают α-, β-, γ- и другие аминокислоты. В состав белков входят α-аминокислоты, содержащие 1 или 2 асимметрических атома углерода (представлены L-формой). 3

4

Аминокислоты 5
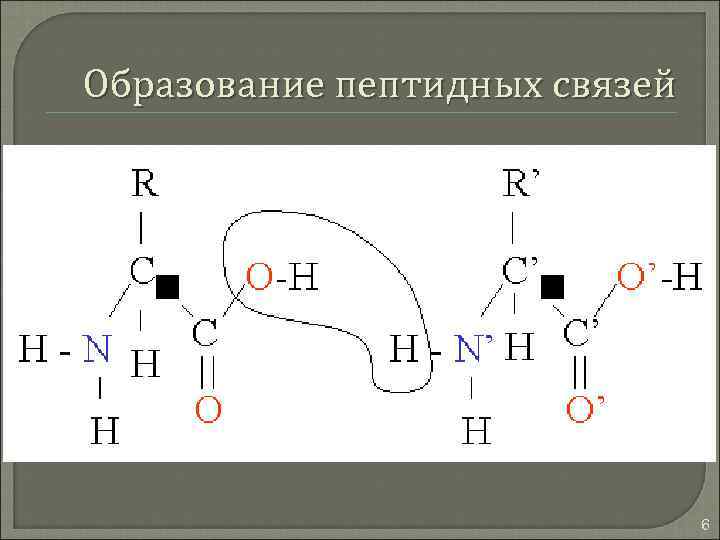
Образование пептидных связей 6

Структура белков 7
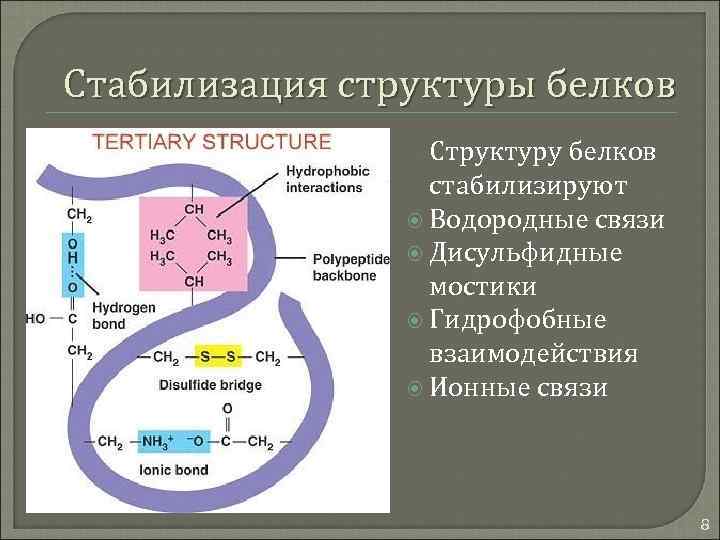
Стабилизация структуры белков Структуру белков стабилизируют Водородные связи Дисульфидные мостики Гидрофобные взаимодействия Ионные связи 8

Первичная структура белка 9
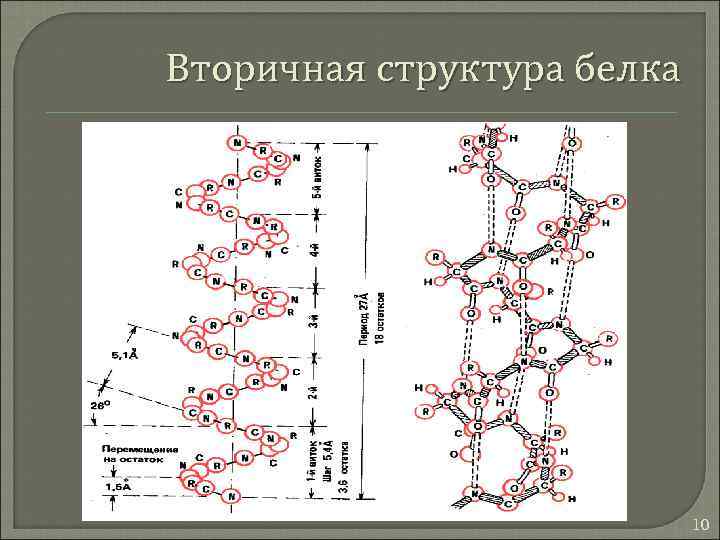
Вторичная структура белка 10

Структура α-спирали 11

Структура складчатого слоя (вариант вторичной структуры) 12
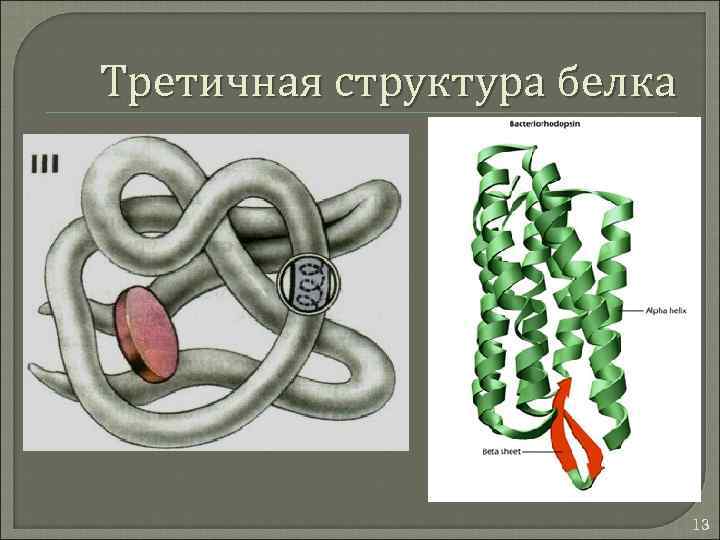
Третичная структура белка 13

Четвертичная структура белка 14

Денатурация - разрушение вторичной, третичной и четвертичной структур белковой молекулы при повышении температуры, изменении р. Н и других воздействиях. 15

Классификация белков по структуре Белки Фибриллярные Глобулярные Промежуточные 16

Фибриллярные белки Белки, образующие длинные волокна или слоистые структуры, состоят из длинных полипептидных цепей. Они нерастворимы в воде, их третичная структура слабо выражена. В организме обычно выполняют структурные функции. 17

Глобулярные белки Белки, полипептидные цепи которых свернуты в виде компактных глобул. Легко растворимы в воде, имеют хорошо выраженную третичную структуру. Выполняют функции ферментов, гормонов, защитных и других типов белков. 18
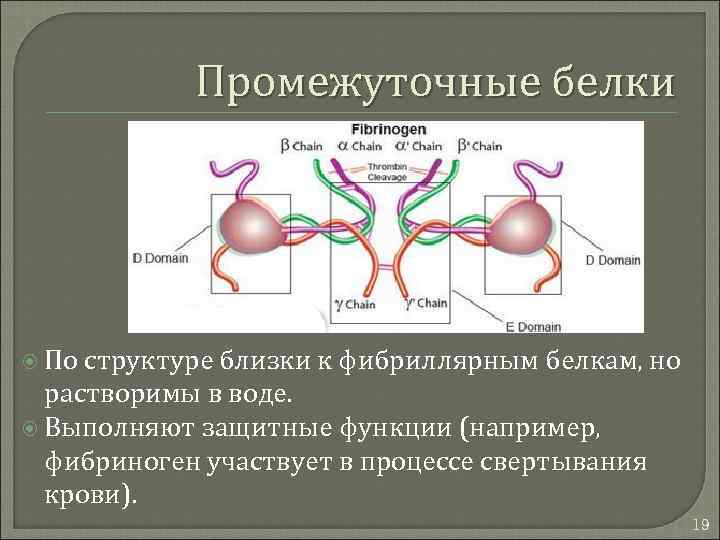
Промежуточные белки По структуре близки к фибриллярным белкам, но растворимы в воде. Выполняют защитные функции (например, фибриноген участвует в процессе свертывания крови). 19

Прионы 20

Группы белков Простые белки гидролизуются (кислотами или щелочами) до аминокислот, но при этом не дают других органических или неорганических соединений. В среднем в их состав входят: 50% С, 7% Н, 23% О, 16% N и 3% S 21

Группы белков Сложные белки (протеиды) при гидролизе дают не только аминокислоты, но также и другие органические или неорганические соединения; в некоторых случаях эти соединения называют простетической группой 22

Сложные белки Гликопротеиды могут содержать нейтральные сахара: галактозу, маннозу и фукозу, а также аминосахара: N-ацетилглюкозамин, Nацетилгалактозамин, сиаловые и уроновые кислоты Липопротеиды содержат триацилглицерины, холестерин и фосфолипиды В состав металлопротеидов входит либо ион металла, как таковой, либо в виде такого комплексного соединения, как гем Нуклеопротеиды являются комплексами белков с ДНК или РНК 23

Ферменты - это биокатализаторы, образующиеся в клетке и представляющие собой либо простые белки, либо сложные, содержащие неаминокислотные компоненты. 24

Действие ферментов 25

Коферменты (коэнзимы) – это малые молекулы небелковой природы, специфически соединяющиеся с определенными белками (апоферментами) и играющие роль активного центра или простетической группы молекулы фермента. 26

Коферменты часто участвуют в переносе электронов или функциональных групп (водородный атом, ацетил, метил, аминогруппы и т. д. ). Коферменты входят в качестве необходимого компонента в пищу и не могут синтезироваться в органах по крайней мере высших организмов 27

Действие коферментов 28

КЛАССИФИКАЦИЯ ФЕРМЕНТОВ В 1972 г. Комиссия по номенклатуре биохимических соединений Международного союза теоретической и прикладной химии (ШРАС) опубликовала новые «Правила номенклатуры ферментов» . Первая цифра в классификации означает главный класс (например, цифра 2 означает трансферазы), следующая цифра относится к некой характеристике реакции (2. 1 указывает на перенос одноуглеродного остатка), последующая цифра предусматривает дальнейшие детали (2. 1. 1 означает перенос метальной группы) 29

Классификация ферментов Оксидоредуктазы - гидрогенизация и дегидрогенизация Трансферазы - перенос функциональных групп Гидролазы - гидролитические реакции Лиазы - присоединение по двойной связи Изомеразы - изомеризация Лигазы - образование связей с использованием АТФ 30

Ферменты, расщепляющие пептидные связи Эндопептидазы являются гидролазами, расщепляющими пептидную связь внутри полипептидной цепи. Экзопептидазы расщепляют пептидную связь на конце белковой молекулы. Аминопептидазы атакуют аминоконец полипептидной цепи белка, карбоксипептидазы атакуют ее карбоксильный конец. Пепсин расщепляет пептидную связь между двумя гидрофобными аминокислотами. 31

Ферменты, расщепляющие пептидные связи Трипсин расщепляет связи, образованные Lys или Arg и другими аминокислотами. Образующийся фрагмент имеет Lys или Arg на С-конце. Химотрипсин расщепляет связи, образованные Phe, Тrр или Туr и другими аминокислотами. Эндопептидазы расщепляют белковые молекулы в желудке и в двенадцатиперстной кишке. Распад до индивидуальных аминокислот, катализуемый экзопептидазами и пептидазами, завершается в тонкой кишке. 32

Расщепление пептидной связи 33

Витамины – это группа низкомолекулярных органических соединений, имеющих относительно простое строение, которые являются абсолютно необходимым компонентом пищи гетеротрофных организмов. Большинство витаминов являются коферментами или их предшественниками 34

Коферменты и связанные с ними витамины 35

НАД и НАДФ Окисление – восстановление одной молекулы требует энергии трех связей АТФ 36
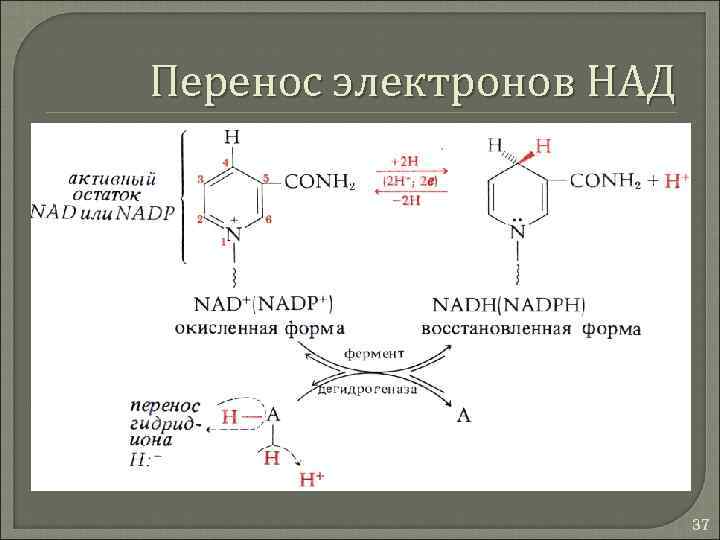
Перенос электронов НАД 37
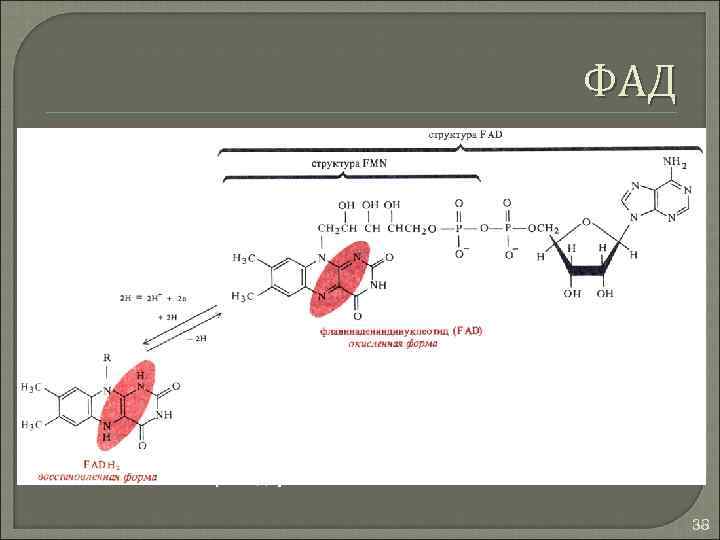
ФАД Окисление – восстановление одной молекулы требует энергии двух связей АТФ 38

Благодарю за внимание! 39
Biochim_02_r-15.ppt