белки.ppt
- Количество слайдов: 32
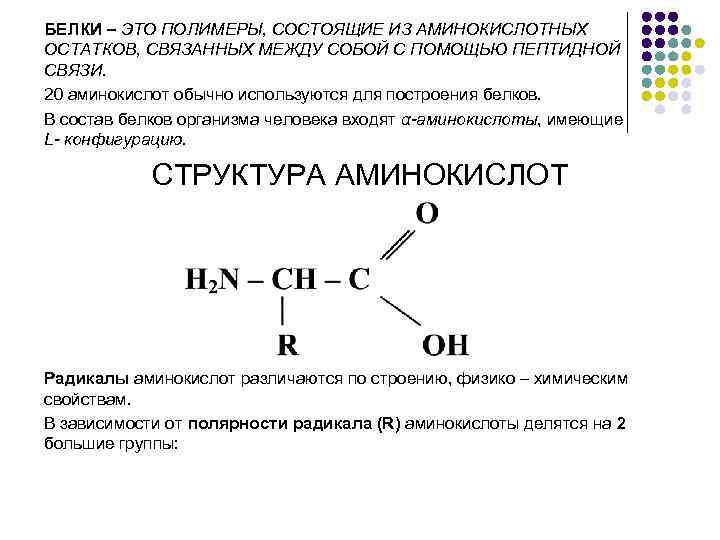
БЕЛКИ – ЭТО ПОЛИМЕРЫ, СОСТОЯЩИЕ ИЗ АМИНОКИСЛОТНЫХ ОСТАТКОВ, СВЯЗАННЫХ МЕЖДУ СОБОЙ С ПОМОЩЬЮ ПЕПТИДНОЙ СВЯЗИ. 20 аминокислот обычно используются для построения белков. В состав белков организма человека входят α-аминокислоты, имеющие L- конфигурацию. СТРУКТУРА АМИНОКИСЛОТ Радикалы аминокислот различаются по строению, физико – химическим свойствам. В зависимости от полярности радикала (R) аминокислоты делятся на 2 большие группы:
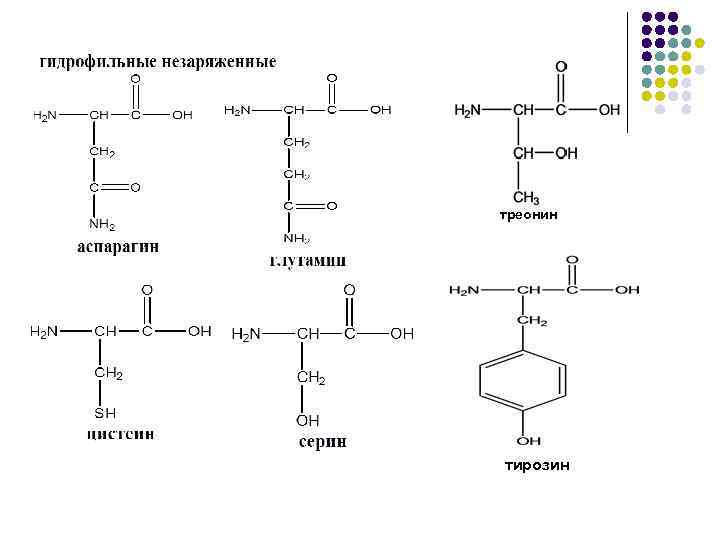
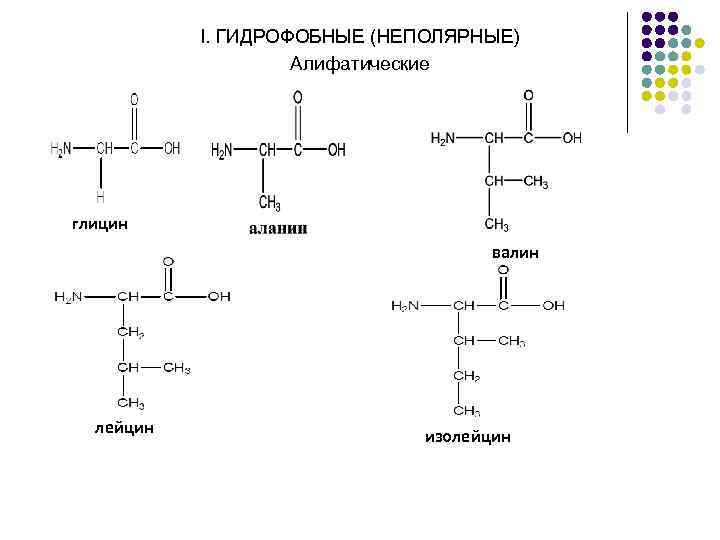
I. НЕПОЛЯРНЫЕ (ГИДРОФОБНЫЕ) II. ПОЛЯРНЫЕ (ГИДРОФИЛЬНЫЕ)
треонин тирозин

I. ГИДРОФОБНЫЕ (НЕПОЛЯРНЫЕ) Алифатические глицин валин лейцин изолейцин


Аминокислоты как лекарственные вещества Аминокислоты широко применяются в медицинской практике: - Глутаминовая кислота используется в психиатрии при эпилепсии, в комплексной терапии язвенной болезни и гипоксии. Так же лекарственным препаратом является производная кислоты – гамма-аминомасляная кислота, или ГАМК тормозит передачу нервного импульса в синапсах ЦНС, влияет на обмен глюкозы, на тканевое дыхание и окислительное фосфорилирование в головном мозге. - Аспаргиновая кислота способствует повышении потребления кислорода сердечной мышцей, обладает антитератогенным действием.

- Метионин имеет в своем составе подвижную метильную группу, которая способна переноситься на другие клеточные структуры в процессах метилирования. Защищает организм при отравлениях бактериальными эндотоксинами и некоторыми и другими ядами. Обладает радиопротекторными свойствами. - Глицин является медиатором торможения в ЦНС. Производное глицина – бетаин – эффективный гепатопротекторный препарат, улучшающий процессы пищеварения. - Валин входит в состав комплексонов, применяющихся для выведения радионуклиодов из организма.

Аминокислоты также используются как пищевые добавки, для улучшения питательной ценности пищевых продуктов и придания оптимальных вкусовых свойств. В сельском хозяйстве аминокислоты применяются в качестве кормовых добавок. Введение в такие аминокислоты, как глутаминовая или аскорбиновая кислота, гидрофобных группировок дает возможность получать поверхостно-активные вещества (ПАВ). Косметические средства с добавками аминокислот более эффективны поддерживают нормальные функции кожи.
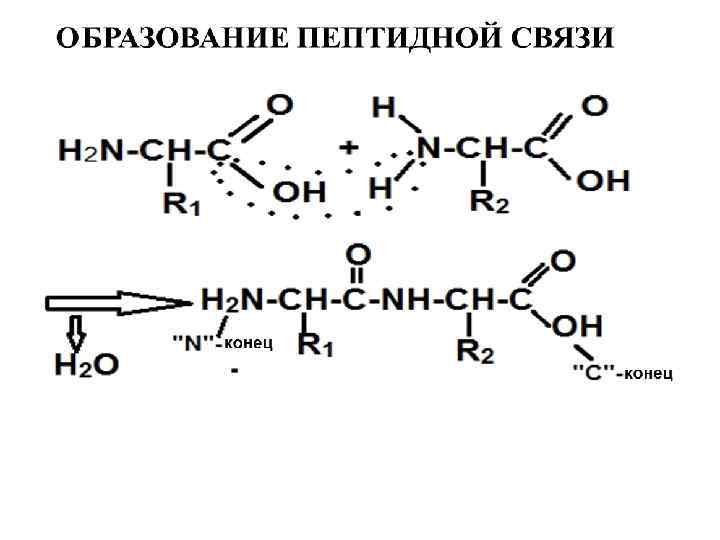
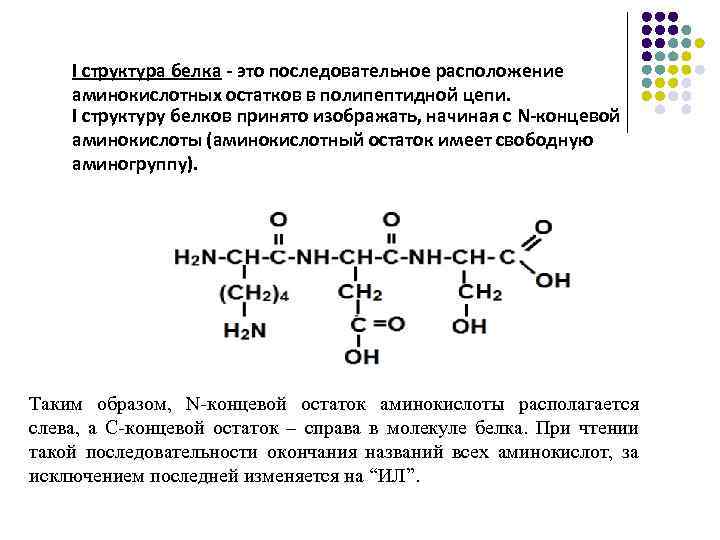
I структура белка - это последовательное расположение аминокислотных остатков в полипептидной цепи. I структуру белков принято изображать, начиная с N-концевой аминокислоты (аминокислотный остаток имеет свободную аминогруппу). Таким образом, N-концевой остаток аминокислоты располагается слева, а С-концевой остаток – справа в молекуле белка. При чтении такой последовательности окончания названий всех аминокислот, за исключением последней изменяется на “ИЛ”.

Многообразие и специфические особенности разных пептидов и белков определяются: а) длиной полипептидной цепи (соответственно и молекулярной массой) б) различиями аминокислотного состава (например: альбумин – преобладание анионных аминокислотных остатков, суммарный заряд - - ; гистоны – преобладание аргинина и лизина в аминокислотной последовательности, суммарный заряд - + в)порядком чередования аминокислотных остатков. Даже идентичные по длине и аминокислотному составу белки с различной последовательностью аминокислотных остатков в полипептидной цепи будут разными веществами. Число вариантов полипептидов, построенных из n разных аминокислотных остатков равно n!. Трипептид (n=3) имеет 6 вариантов – 1× 2× 3=6 При n=20 возможное число вариантов в среднем равно 2× 1018

II структура – это укладка полипептидной цепи в виде α -спирали и β-структуры. Вторичная структура белков обусловлена прежде всего свойствами полипептидного остова. Карбонильная группа и NH-группа способны образовывать водородную связь между собой. Известны два основных типа вторичной структуры пептидных цепей: α-спираль и β-структура (складчатый слой).
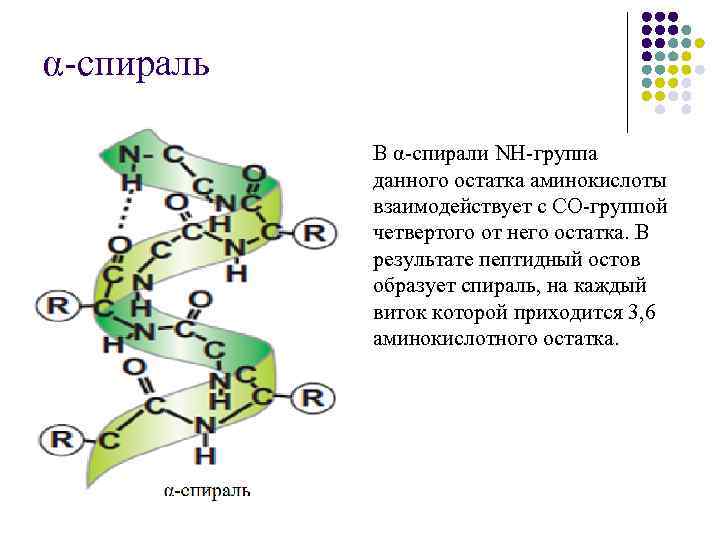
α-спираль В α-спирали NH-группа данного остатка аминокислоты взаимодействует с СО-группой четвертого от него остатка. В результате пептидный остов образует спираль, на каждый виток которой приходится 3, 6 аминокислотного остатка.
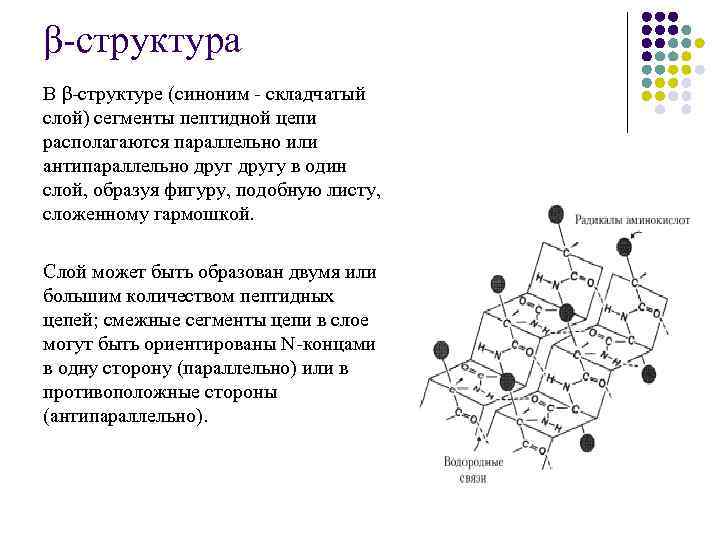
β-структура В β-структуре (синоним - складчатый слой) сегменты пептидной цепи располагаются параллельно или антипараллельно другу в один слой, образуя фигуру, подобную листу, сложенному гармошкой. Слой может быть образован двумя или большим количеством пептидных цепей; смежные сегменты цепи в слое могут быть ориентированы N-концами в одну сторону (параллельно) или в противоположные стороны (антипараллельно).
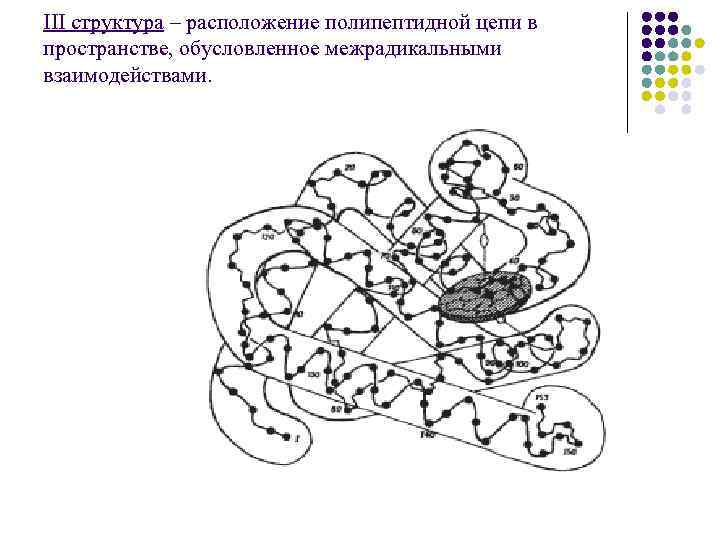
III структура – расположение полипептидной цепи в пространстве, обусловленное межрадикальными взаимодействами.
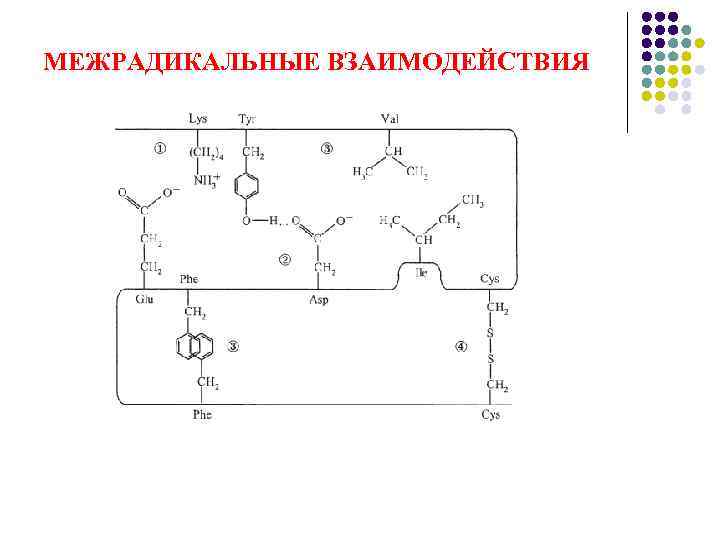
МЕЖРАДИКАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ

IV структура – это количество протомеров, способ их соединения и пространственной укладки относительно друга. Отдельные полипептидные цепи в таком белке называются протомерами или субъединицами. Протомеры соединяются в результате образования гидрофобных, ионных, водородных связей. В олигомерном белке взаимное узнавание протомеров обусловлено комплементарной структурой контактных поверхностей.

l При высоких температурах наступает денатурация белка: l l нарушение межрадикальных связей белка; изменение конформации; потеря биологической активности; уменьшение растворимости.
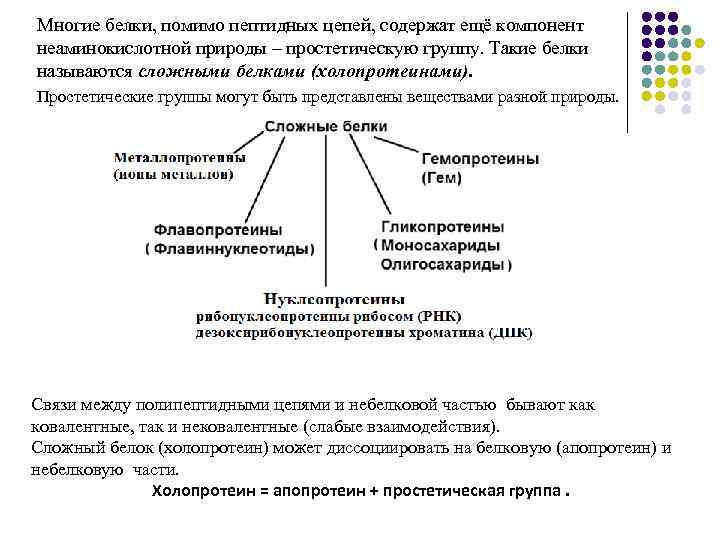
Многие белки, помимо пептидных цепей, содержат ещё компонент неаминокислотной природы – простетическую группу. Такие белки называются сложными белками (холопротеинами). Простетические группы могут быть представлены веществами разной природы. Связи между полипептидными цепями и небелковой частью бывают как ковалентные, так и нековалентные (слабые взаимодействия). Сложный белок (холопротеин) может диссоциировать на белковую (апопротеин) и небелковую части. Холопротеин = апопротеин + простетическая группа.
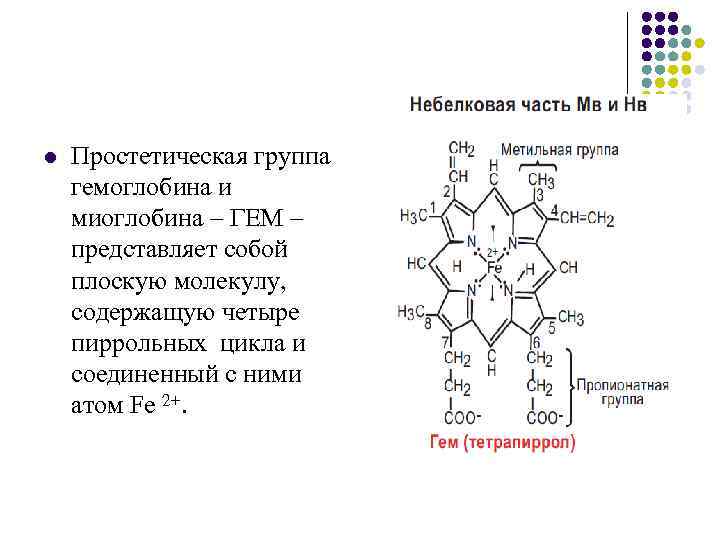
l Простетическая группа гемоглобина и миоглобина – ГЕМ – представляет собой плоскую молекулу, содержащую четыре пиррольных цикла и соединенный с ними атом Fe 2+.
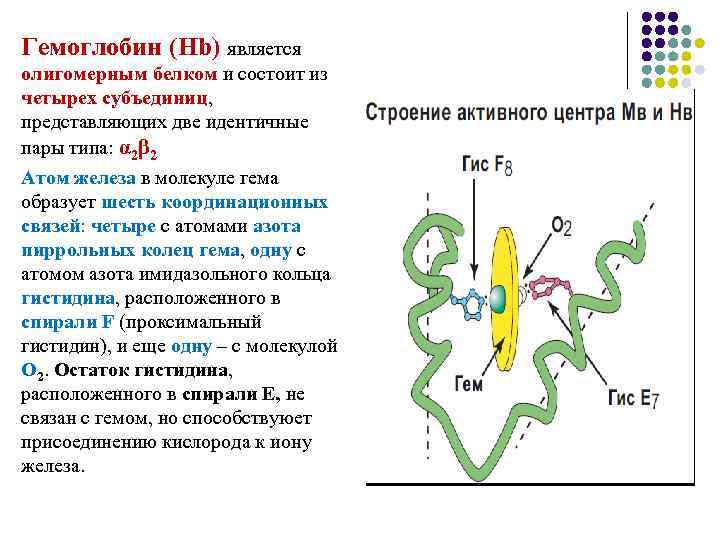
Гемоглобин (Hb) является олигомерным белком и состоит из четырех субъединиц, представляющих две идентичные пары типа: α 2β 2 Атом железа в молекуле гема образует шесть координационных связей: четыре с атомами азота пиррольных колец гема, одну с атомом азота имидазольного кольца гистидина, расположенного в спирали F (проксимальный гистидин), и еще одну – с молекулой О 2. Остаток гистидина, расположенного в спирали Е, не связан с гемом, но способствуюет присоединению кислорода к иону железа.

Способность Hb связывать O 2 зависит от ряда факторов: - р. Н среды содержания CO 2 присутствия 2, 3 -бисфосфоглицерата степени оксигенации Hb

Функционирование олигомерных белков на примере гемоглобина Присоединение О 2 “выпрямляет” молекулу гема: Fe 2+ перемещается в плоскость пиррольных колец. Т. к. Fe 2+ связан с остатком гистидина пептидной цепи, то происходит изменение конформации протомера, к которому присоединяется О 2
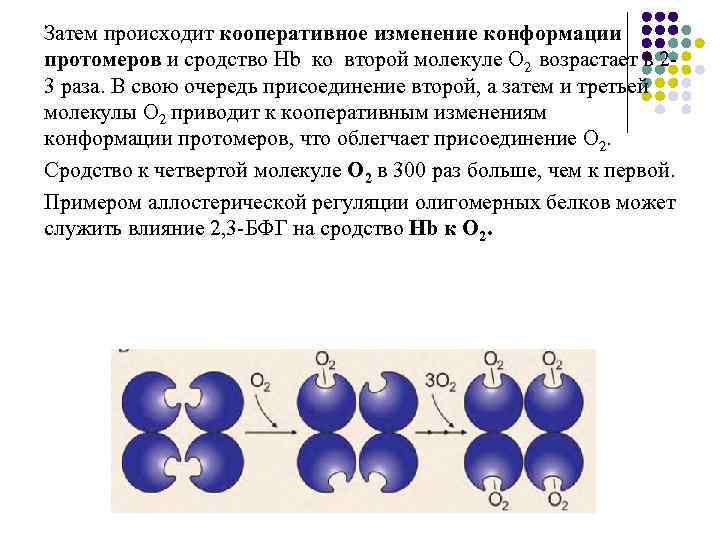
Затем происходит кооперативное изменение конформации протомеров и сродство Hb ко второй молекуле О 2 возрастает в 23 раза. В свою очередь присоединение второй, а затем и третьей молекулы О 2 приводит к кооперативным изменениям конформации протомеров, что облегчает присоединение О 2. Сродство к четвертой молекуле О 2 в 300 раз больше, чем к первой. Примером аллостерической регуляции олигомерных белков может служить влияние 2, 3 -БФГ на сродство Hb к O 2.

H+; CO 2 и 2, 3 -бисфосфоглицерат(2, 3 -БФГ) уменьшают сродство Hb к О 2. 2, 3 -БФГ-вещество, которое синтезируется только в эритроцитах. Концентрация 2, 3 -БФГ близка к концентрации Hb в крови. 2. 3 -БФГ присоединяется к центральной полости дезоксигемоглобина с помощью слабых взаимодействий. 2, 3 -БФГ сдвигает равновесие между окси Hb и дезокси Hb в сторону образования комплекса дезокси Hb с 2, 3 БФГ Hb(O 2)4+2, 3 -БФГ= Hb*БФГ+4 О 2 Концентрация 2, 3 БФГ может изменяться в ответ на нарушение легочной вентиляции (в случае эмфиземы легких) и при подъеме на большие высоты. Возникающая в таких состояниях гипоксия тканей, частично компенсируется увеличением синтеза 2, 3 -БФГ в эритроцитах его концентрация в течение 2 х дней возрастает вдвое. Это приводит к увеличению потребления О 2 тканями.


Методы выделения и очистки белков. Получение индивидуальных белков из биологического материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих: ü ü Дробление биологического материала и разрушение клеточных мембран; Фракционирование органелл , содержащих те или иные белки; Экстракцию белков (перевод их в растворенное состояние); Разделение смеси белков на индивидуальные белки.

Методы очистки белков ü ü ü Высаливание; Гель-фильтрация, или метод молекулярных сит; Ультрацентрифугирование; Электрофорез белков; Ионообменная хроматография ; Аффинная хроматография;

Высаливание – метод очистки белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Гель-фильтрация – метод разделения, основанный на том, что вещества, отличающиеся по молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др). В структуре полисахарида образуются поперечные связи и формируются гранулы с «порами» , через которые легко проходят вода и низкомолекулярные вещества.

Ультрацентрифугирование - метод разделения, основанный на различии молекулярных массах белков. Скорость седиментации веществ в процессе вращения в ультрацентрифуге, где центробежное ускорение достигает 100 000 -500 000 g, пропорционально их молекулярной массе. Электрофорез белков – метод, основанный на том, что при определенном р. Н и ионной силы раствора, белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду, а положительно заряженные белки – к катоду.

Аффинная хроматография – метод, основанный на избирательном взаимодействии белков с лигандами, прикрепленными (иммобилизированными) к твердому носителю.
белки.ppt