
БЕЛКИ

• • Белки, или протеины, – важнейший класс БАВ Жизнь есть способ существования белковых тел Ф. Энгельс

Белки… • ВМС, которые при гидролизе дают набор -аминокислот L-ряда

Особенности белков 1. Разнообразие структур и высокая видовая специфичность 2. Способность к различным внутримолекулярным взаимодействиям, обеспечивающим динамичность структур молекул 3. Способность вступать в разнообразные химические и физические взаимодействия как друг с другом, так и с другими соединениями (липидами, нуклеиновыми кислотами, полисахаридами и др. ), образуя надмолекулярные комплексы

Особенности белков 4. 5. 6. Способность под влиянием воздействий обратимо и закономерно изменять конфигурацию молекул Способность ряда белков ускорять химические реакции в организме Наличие биологической активности, способность выполнять различные функции

Белки (протеины) содержат (%): • • С – 50– 55 Н – 6, 5– 7, 3 N – 15– 18 O – 21– 24 S – до 2, 4 зола – до 0, 5 Cu, I, Fe, Zn, Ca, Mg, Br и др.

Молекулярная масса белков. Форма белковых молекул (самостоятельно)

Аминокислотный состав белков

• Структурные элементы в белках – -аминокислоты, отличающиеся друг от друга строением боковых групп (боковых цепей, радикалов)

Две категории аминокислот 1. 2. Постоянно встречающиеся – 18 аминокислот, амиды аспарагиновой и глутаминовой кислот (аспарагин и глутамин) Иногда встречающиеся: орнитин, -аминоизомасляная, -карбоксиглутаминовая кислоты и ряд других производных постоянно встречающихся аминокислот
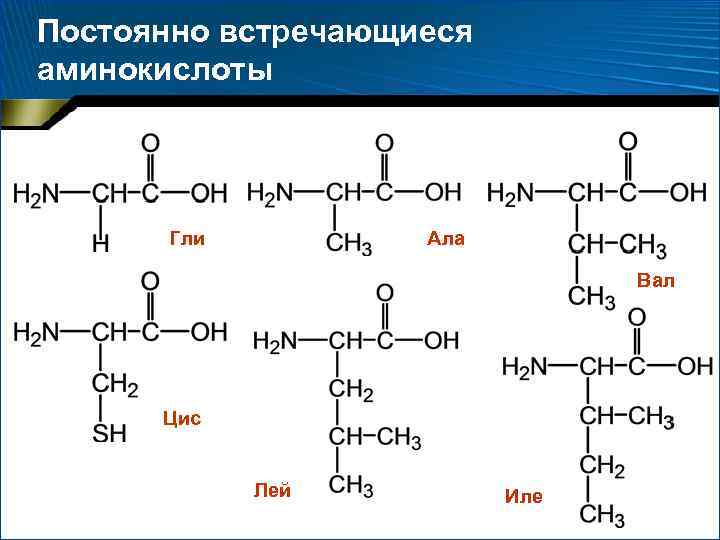
Постоянно встречающиеся аминокислоты Гли Ала Вал Цис Лей Иле
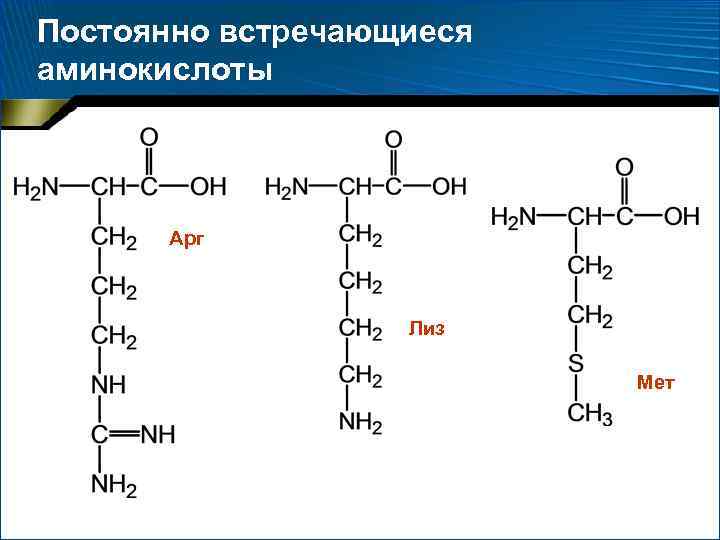
Постоянно встречающиеся аминокислоты Арг Лиз Мет
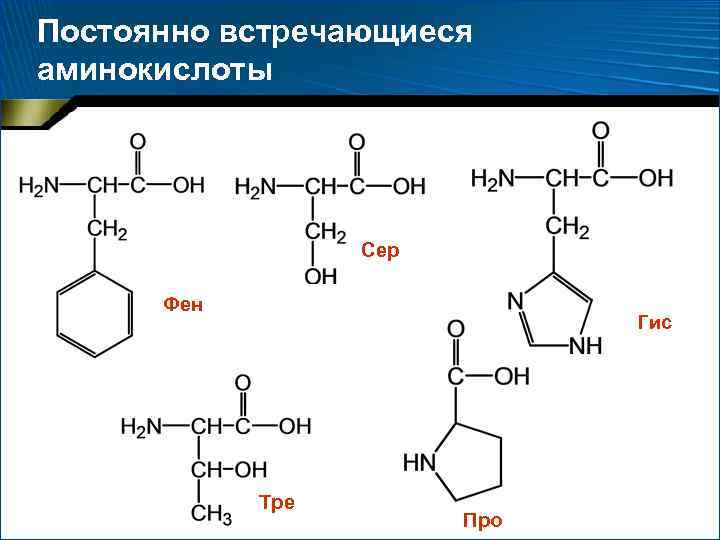
Постоянно встречающиеся аминокислоты Сер Фен Гис Тре Про
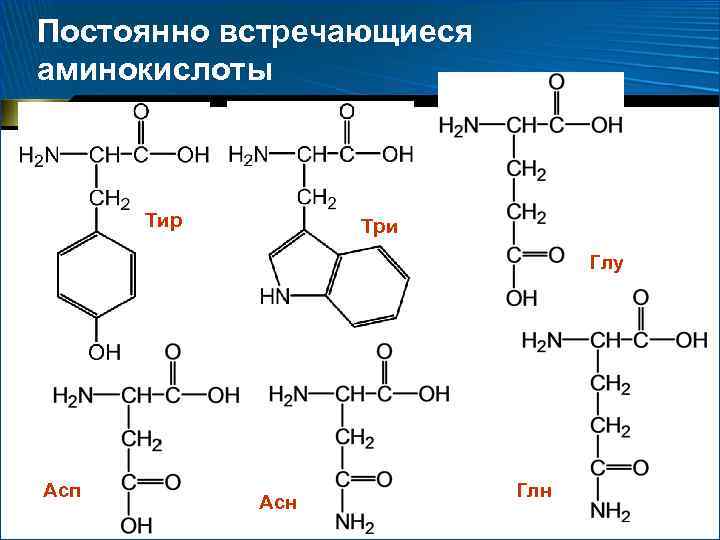
Постоянно встречающиеся аминокислоты Тир Три Глу Асп Асн Глн
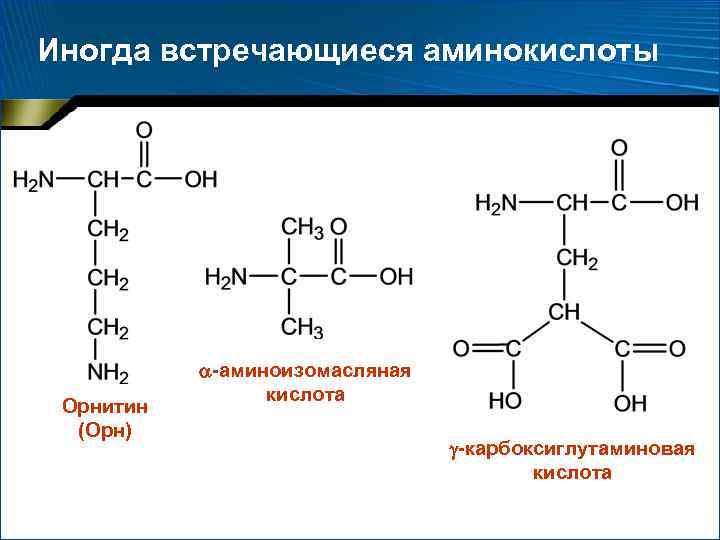
Иногда встречающиеся аминокислоты Орнитин (Орн) -аминоизомасляная кислота -карбоксиглутаминовая кислота

Классификации аминокислот • • • I. По химическому составу Моноаминомонокарбоновые – гли, ала, сер, цис, лей, иле, вал, мет Моноаминодикарбоновые – асп и глу Диаминомонокарбоновые – лиз, орн Ароматические – фен, тир Гетероциклические – три, гис

Классификации аминокислот • • II. По природе радикала Неполярные (гидрофобные) – ала, лей, иле, вал, про, три, мет, фен Полярные, но незаряженные – сер, цис, тир, тре, асн, гли С отрицательными (кислыми) радикалами – асп и глу С положительными (основными) радикалами – лиз, орн, арг, гис

Свойства аминокислот • • Важная особенность – оптическая активность (кроме гли) 7 аминокислот характеризуются правым (+) 10 – левым (–) вращением НО все относятся к L-ряду
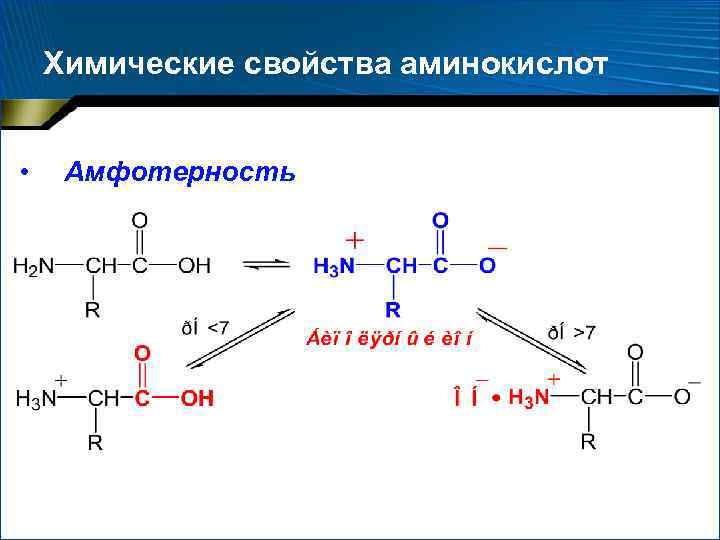
Химические свойства аминокислот • Амфотерность
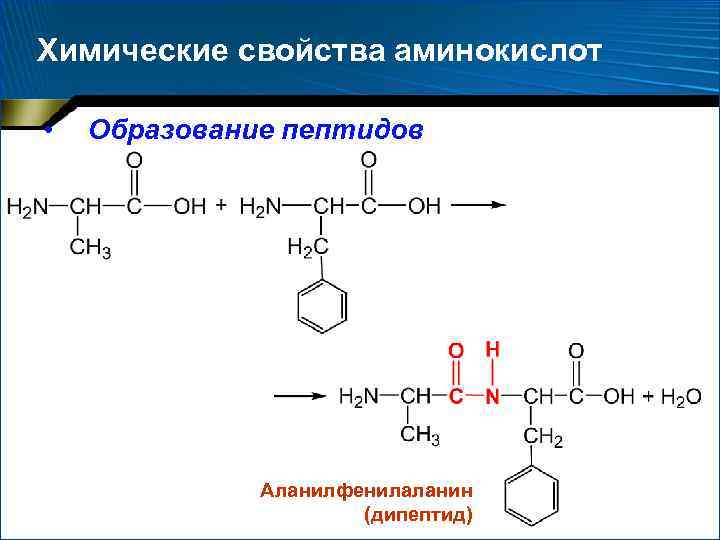
Химические свойства аминокислот • Образование пептидов Аланилфенилаланин (дипептид)

Химические свойства аминокислот • Реакции по карбоксильной группе – Реакции солеобразования – с металлами, основными оксидами, щелочами – Образование сложных эфиров (этерификация) – Образование галогенангидридов – Образование амидов – Декарбоксилирование

Химические свойства аминокислот • Реакции по аминогруппе – Взаимодействие с кислотами – Ацилирование – Алкилирование – Реакция с азотистой кислотой – Дезаминирование (ферментативное) • Гидролитическое H 2 N–СН 2–СООН + Н 2 О HО–СН 2–СООН + NН 3 • Восстановительное H 3 С–СН(NН 2)–СООН + 2 Н H 3 С–СН 2–СООН + NН 3 • Окислительное H 3 С–СН(NН 2)–СООН H 3 С–СО–СООН + NН 3 • Внутримолекулярное H 3 С–СН(NН 2)–СООН H 2 С=СН–СООН + NН 3

Химические свойства аминокислот • Свойства за счет радикалов – солеобразование (NH 2– и –СООН) – окисление и восстановление (НS– и –SS–) – алкилирование, ацилирование и этерификация (NН 2– , ОН–, НО–С 6 Н 4–, –СООН) – амидирование (–СООН) – нитрование и галогенирование (ароматические ядра) – дезаминирование (–NН 2) – декарбоксилирование (–СООН) – фосфорилирование и сульфатирование (–ОН) – азосочетание (ароматические и гетероциклические ядра) – и т. д.

Качественные реакции на отдельные аминокислоты (см. лабораторные занятия) • • • Реакция Миллона – на тир Реакция Сакагучи – на арг Реакция Паули – на гис Реакция Гопкинса–Коле – на три Реакция про с нингидрином

• Радикалы аминокислот (длина, объем, взаимное расположение, химические свойства) определяют объем, форму, рельеф поверхности белковой частицы, степень растворимости белков в различных растворителях • Таким образом, разнообразие аминокислот по химической природе и физическим свойствам связано с полифункциональностью и специфическими особенностями белковых тел
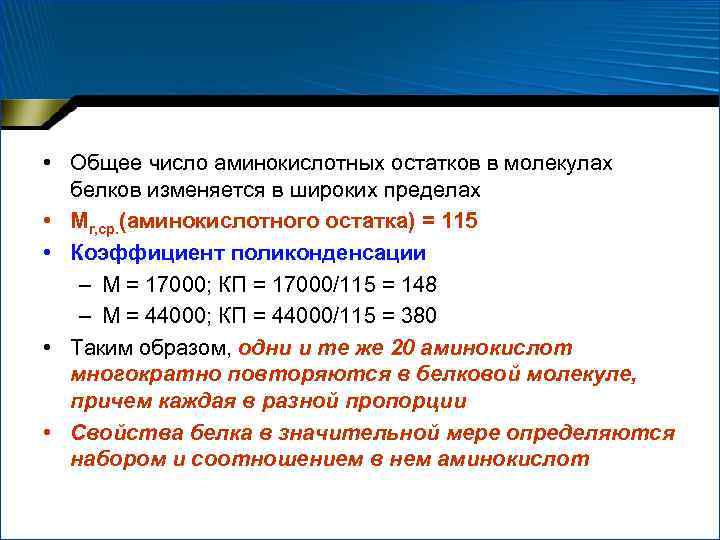
• Общее число аминокислотных остатков в молекулах белков изменяется в широких пределах • Мr, ср. (аминокислотного остатка) = 115 • Коэффициент поликонденсации – М = 17000; КП = 17000/115 = 148 – М = 44000; КП = 44000/115 = 380 • Таким образом, одни и те же 20 аминокислот многократно повторяются в белковой молекуле, причем каждая в разной пропорции • Свойства белка в значительной мере определяются набором и соотношением в нем аминокислот

Пептиды
• Образование пептидных связей в воде термодинамически невыгодно необходимость предварительной активации взаимодействующих групп при химическом синтезе и биосинтезе пептидной связи • Но кинетически пептидная связь достаточно стабильна и ее гидролитическое расщепление происходит лишь при использовании катализаторов (кислот, щелочей или пептидаз) • N-концевой (аминоконцевой) остаток (начало цепи) • С-концевой (карбоксиконцевой) остаток (конец цепи)

Природные пептиды

Глутатион • Трипептид • Ф. Хопкинс (1930), из дрожжей НООС–СН(NН 2)–(СН 2)2–СО–NН–СН(СН 2 SН)–СО–NН–СН 2–СООН -глутамилцистеинилглицин • легко окисляется: 2 R–SН восстановленная (сульфгидрильная) форма ⇄ R–S–S–R + 2 Н окисленная (дисульфидная) форма • входит в состав окислительно-восстановительных ферментов (кофермент), принимает участие в разложении пероксида водорода

Пептидные антибиотики • Многие – циклопептиды • Грамицидин S – циклодекапептид – антимикробный агент широкого спектра действия • Циклоспорин – циклопептид, содержащий Nметилированные и другие небелковые аминокислоты ( -аминомасляную, D-аланин, непредельную оксиаминокислоту) – эффективный иммунодепрессант

Нейропептиды • Обнаружены в мозге и способны влиять на функции цнс – энкефалины и эндорфины (опиоидные пептиды) способны подавлять боль и вызывать состояние эйфории – 1977 г. , М. Монье и Г. Шененбергер, пептид DSIP ( -sleep inducing peptide) – пептид, действующий на сон

Пептидные гормоны • Окситоцин (В. дю Виньо, 1953) • Нонапептид, в котором 1 -я и 6 -я аминокислоты – цис • HS-группы обоих остатков цис связаны S–S-связью (цистин) • Гормон задней доли гипофиза, отвечает за лактацию и стимулирует сокращение матки • Вазопрессин – сходный по строению нонапептид • Гормон задней доли гипофиза, отвечает за водный обмен, подавляет диурез и повышает давление крови
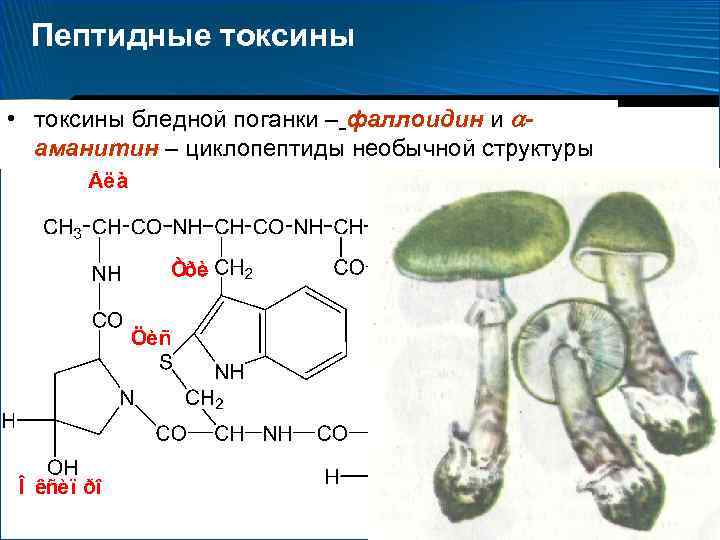
Пептидные токсины • токсины бледной поганки – фаллоидин и аманитин – циклопептиды необычной структуры
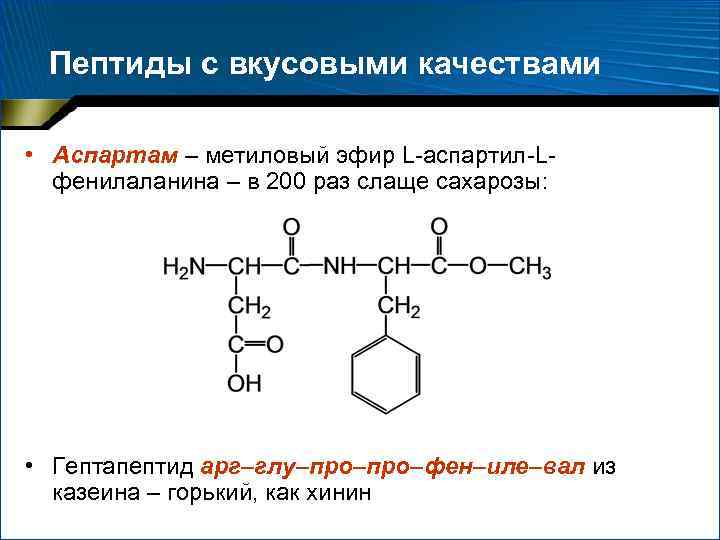
Пептиды с вкусовыми качествами • Аспартам – метиловый эфир L-аспартил-Lфенилаланина – в 200 раз слаще сахарозы: • Гептапептид арг–глу–про–фен–иле–вал из казеина – горький, как хинин

Химические свойства пептидов • Биполярные ионы • Растворимость в воде весьма различна и зависит как от длины пептида, так и от природы образующих его аминокислот

Химические свойства пептидов • Взаимное влияние NH 2 - и COOH- групп в пептидах значительно слабее, чем в -аминокислотах • Карбоксильная группа в пептидах менее кислотна, чем в амино- и карбоновых кислотах • -аминогруппа в пептидах – менее основна, чем в -аминокислотах

Химические свойства пептидов • В остальном химические свойства -амино- и карбоксильной групп пептидов качественно близки свойствам аминокислот (кроме реакций с одновременным участием обеих групп)

Структура белковой молекулы

• Каким образом соединяются между собой многие десятки и сотни аминокислот в белковой молекуле?

Полипептидная теория строения белка • 1902 г. , Эмиль Фишер • Белки – сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными (R–CO–NH–R ) связями, возникающими при взаимодействии карбоксильных и аминогрупп аминокислот

Структурные особенности пептидной цепи
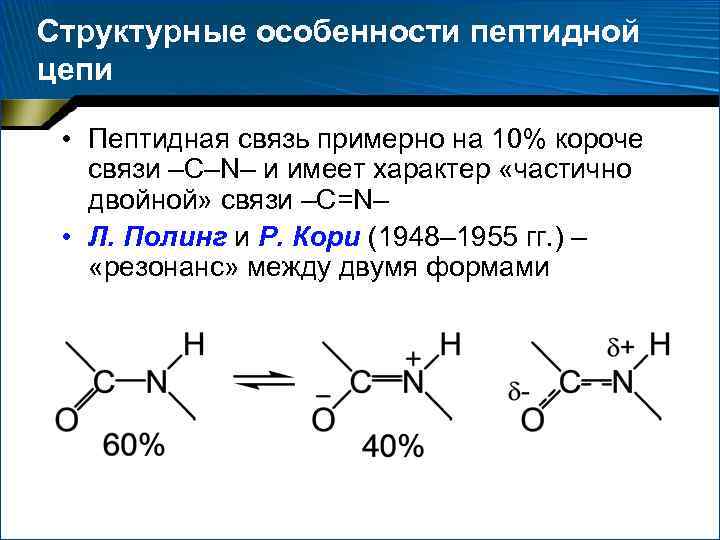
Структурные особенности пептидной цепи • Пептидная связь примерно на 10% короче связи –С–N– и имеет характер «частично двойной» связи –С=N– • Л. Полинг и Р. Кори (1948– 1955 гг. ) – «резонанс» между двумя формами
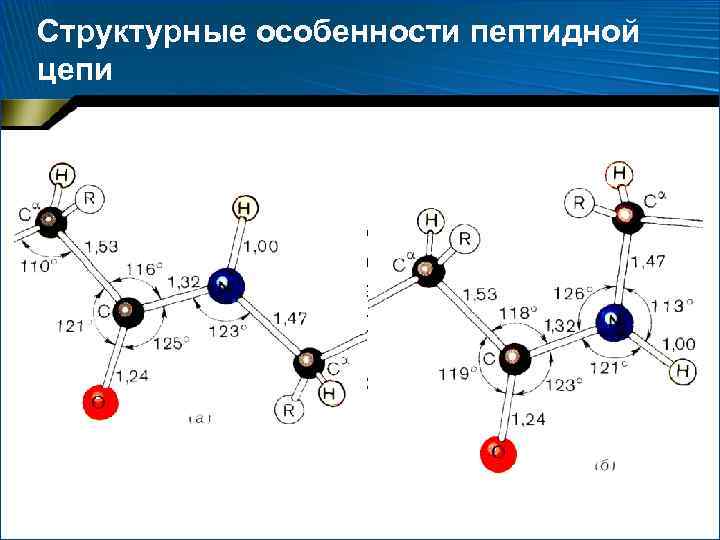
Структурные особенности пептидной цепи • Транс-конфигурация – Выгоднее цис-конфигурации на 2, 6 ккал/моль (10, 878 к. Дж/моль), т. к. сближение -углеродных атомов в цис-конфигурации вызывает пространственные затруднения – Эта разница в значительной мере снимается, если азот пептидной связи принадлежит про
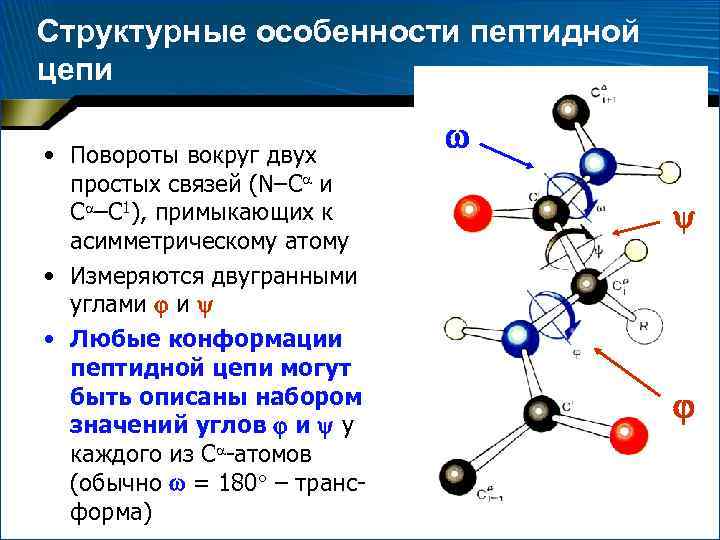
Структурные особенности пептидной цепи • Повороты вокруг двух простых связей (N–С и С –C 1), примыкающих к асимметрическому атому • Измеряются двугранными углами и • Любые конформации пептидной цепи могут быть описаны набором значений углов и у каждого из С -атомов (обычно = 180 – трансформа)
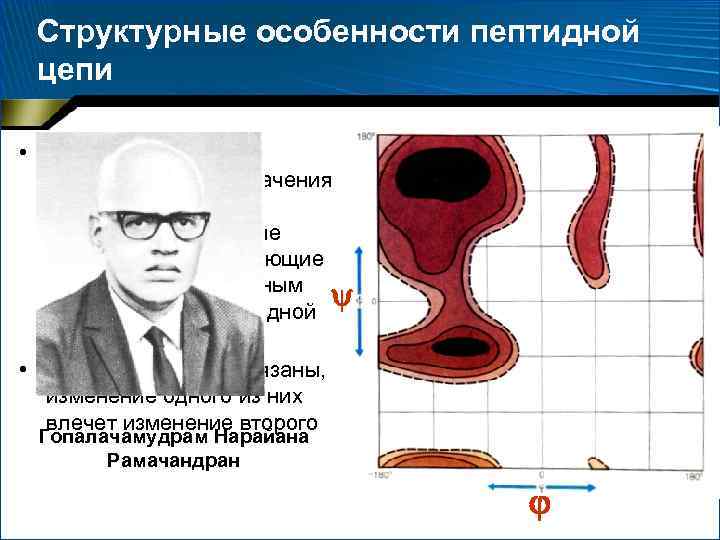
Структурные особенности пептидной цепи • Углы и не могут принимать любые значения – разрешены лишь некоторые дискретные области, соответствующие энергетически выгодным конформациям пептидной цепи • Углы и взаимосвязаны, изменение одного из них влечет изменение второго Гопалачамудрам Нарайана Рамачандран

Уровни организации белковой молекулы

• • К. У. Линдерстрем-Ланг 4 уровня организации белковых молекул – Первичная – Вторичная – Третичная – Четвертичная с т р у к т у р ы

Первичная структура белка

Первичная структура белка • последовательность аминокислотных остатков в полипептидной цепи – кодируется структурным геном данного белка – содержит все необходимое для самоорганизации его пространственной структуры • Все белки различаются по первичной структуре • Потенциально возможное число таких структур неограниченно • НО общее число различных типов белков у всех видов живых организмов ~ 1010– 1012

Почему важно знать первичную структуру? • определение вторичной и третичной структур • выяснение расположения функциональных групп в активном центре, механизма его функционирования • выяснение характера наследственных болезней на молекулярном уровне • установление и проверка таксономических взаимоотношений между различными видами живых организмов и построении схемы биологической эволюции

Невалентные взаимодействия в пептидной цепи
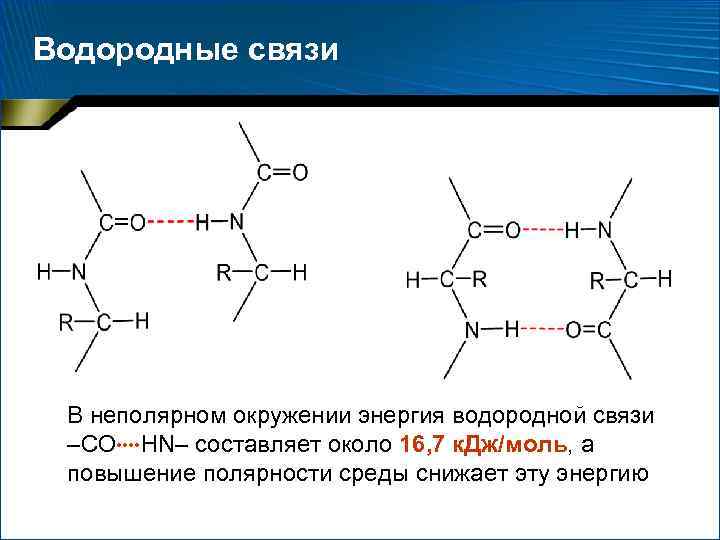
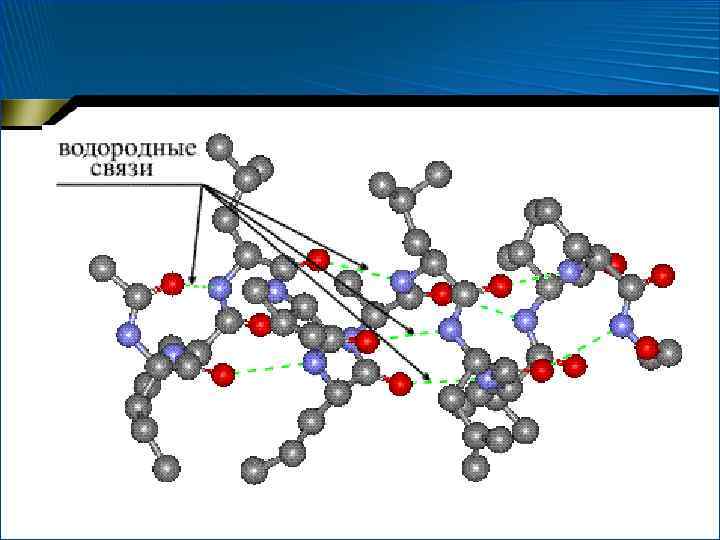
Водородные связи В неполярном окружении энергия водородной связи –СО НN– составляет около 16, 7 к. Дж/моль, а повышение полярности среды снижает эту энергию
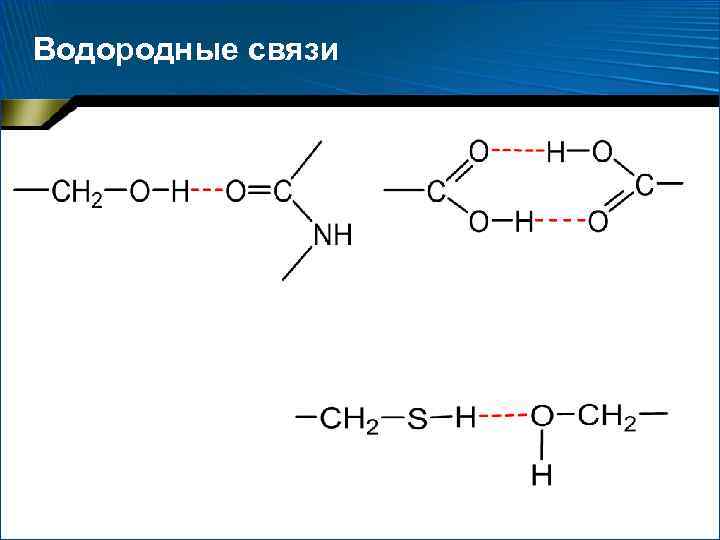
Водородные связи

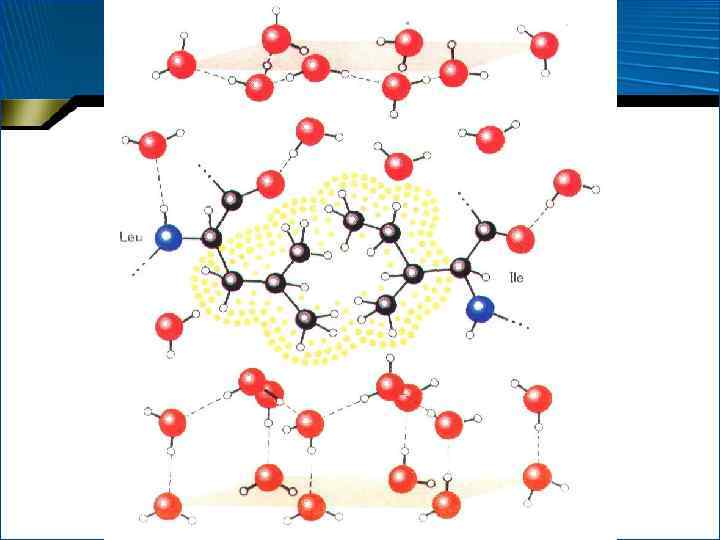
Гидрофобные взаимодействия • Энтропийная природа • Неполярные заместители «выталкиваются» из воды и стремятся ограничить свой контакт с ней • Напротив, вода стремится восстановить свое структурированное состояние и как бы принудительно группирует заместители в кластеры, обладающие минимумом энергии • Вступают в основном неполярные боковые группы аминокислотных остатков

Ван-дер-ваальсовы взаимодействия • Дисперсионные силы притяжения атомов и • Силы взаимного отталкивания их электронных оболочек • Энергетический вклад каждого контакта <0, 42 к. Дж/моль, но ввиду их большого числа вандер-ваальсовы взаимодействия дают основной вклад в суммарную энергию внутримолекулярных невалентных взаимодействий
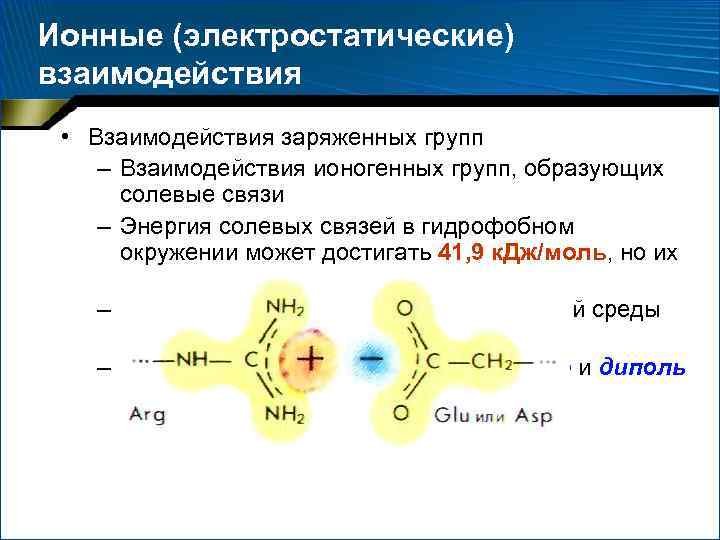
Ионные (электростатические) взаимодействия • Взаимодействия заряженных групп – Взаимодействия ионогенных групп, образующих солевые связи – Энергия солевых связей в гидрофобном окружении может достигать 41, 9 к. Дж/моль, но их число сравнительно невелико – Повышение диэлектрической постоянной среды понижает энергию солевых связей – Во многом аналогичны ион-дипольные и диполь -дипольные взаимодействия
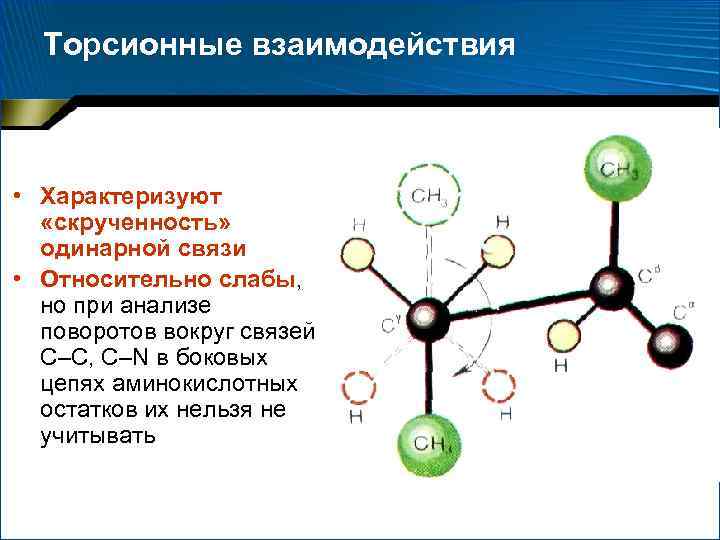
Торсионные взаимодействия • Характеризуют «скрученность» одинарной связи • Относительно слабы, но при анализе поворотов вокруг связей С–С, С–N в боковых цепях аминокислотных остатков их нельзя не учитывать

Вторичная структура белков

Вторичная структура белка… • пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокислот • Образуется за счет водородных связей между пептидными группами как одной цепи, так и разных цепей

Вторичная структура белка • Любой участок молекулы белка имеет вторичную структуру – Иногда рассматривают как вторичную структуру только периодические ее элементы: -спираль и -структуру • 2 вида вторичных структур: регулярные и нерегулярные • Понятие вторичной структуры относится не ко всей белковой молекуле в целом, а к отдельным более или менее протяженным участкам ее полипептидной цепи

Стабилизация вторичной структуры за счет водородной связи • Влияние окружающей белок воды – Влияние воды снижается при формировании компактной пространственной структуры белка, росте содержания пептидных связей, повышении вероятности их взаимодействия • Таким образом, стабильность вторичной структуры зависит от ее включения в компактную третичную структуру

Вторичная структура белков -Спираль

-Спираль • 50 -е годы ХХ в. • Л. Полинг и Р. Кори

-Спираль • • Спиральная структура возникает, когда во всех звеньях полипептидной цепи углы поворота вокруг простых связей ( и ) имеют одинаковую величину и знак (близки к 60 ), что и приводит к постепенному закручиванию цепи При этом радикалы аминокислотных остатков оказываются на периферии образованного спиралью цилиндра и могут, в зависимости от характера их, обеспечивать гидрофобную или гидрофильную природу цилиндрической поверхности
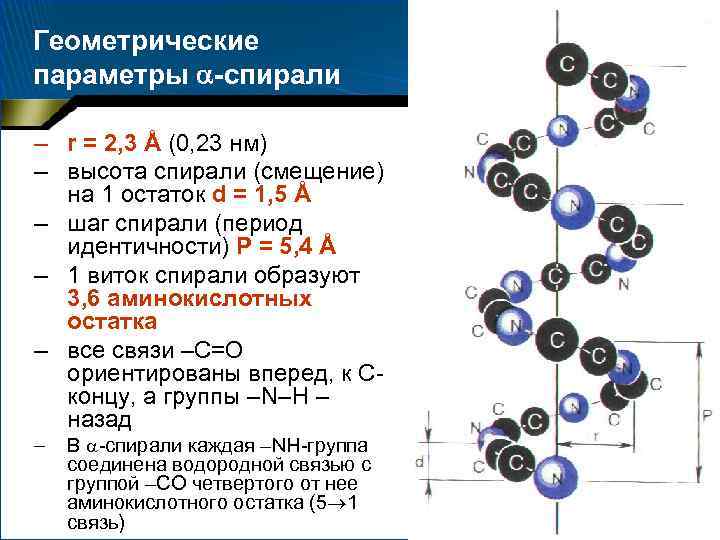
Геометрические параметры -спирали – r = 2, 3 Å (0, 23 нм) – высота спирали (смещение) на 1 остаток d = 1, 5 Å – шаг спирали (период идентичности) Р = 5, 4 Å – 1 виток спирали образуют 3, 6 аминокислотных остатка – все связи –С=О ориентированы вперед, к Сконцу, а группы –N–Н – назад – В -спирали каждая –NН-группа соединена водородной связью с группой –СО четвертого от нее аминокислотного остатка (5 1 связь)

-Спираль • Длина -спиральных участков – – • в глобулярных белках относительно невелика (5– 15 аминокислотных остатков, 3– 4 витка спирали) в фибриллярных белках – гораздо протяженнее Иногда наблюдаются изломы -спирали, обычно в местах включения остатков про, прерывающих системы водородных связей. При этом ось спирали отклоняется на 20– 30

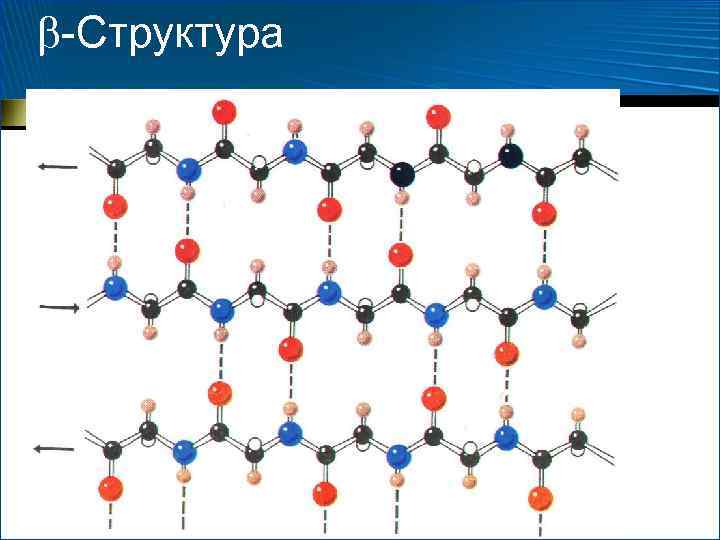
Вторичная структура белков -Структура

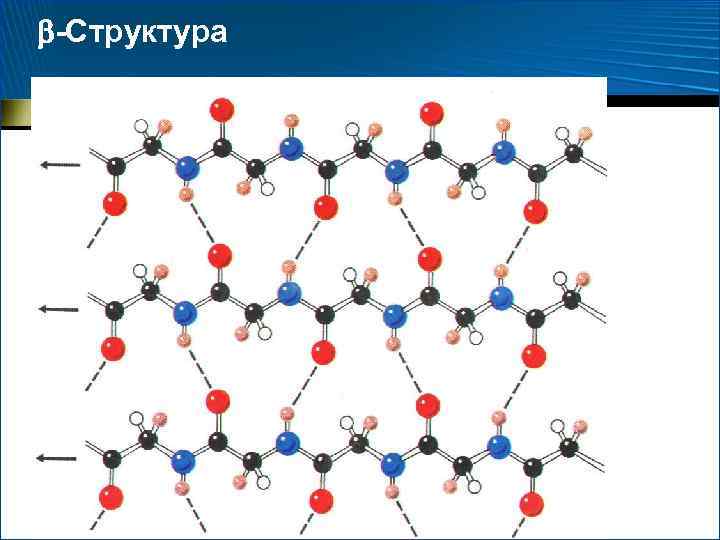
-Структура • У. Т. Астбери, 1941 г. • 1951 г. , Л. Полинг и Р. Кори установили, что структура, или «складчатый лист» , – это стабилизированный межцепочечными водородными связями ассоциат вытянутых, зигзагообразных пептидных цепей
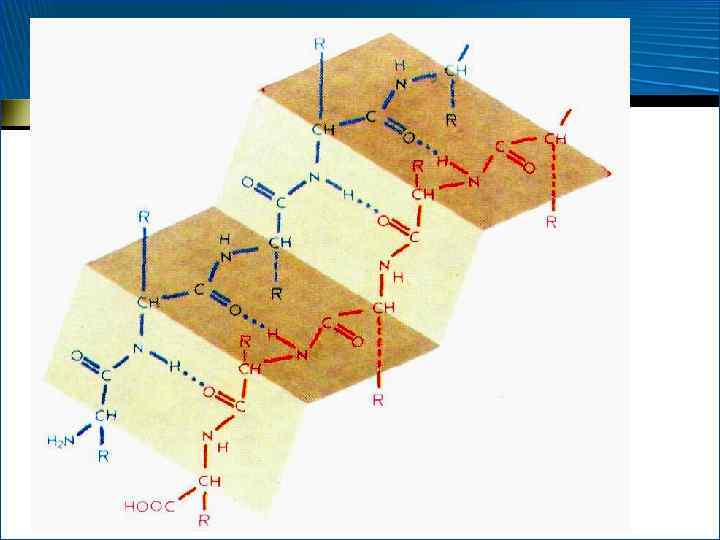
-Структура • параллельная -структура • = 180
-Структура • антипараллельная -структура • – 140 , +135
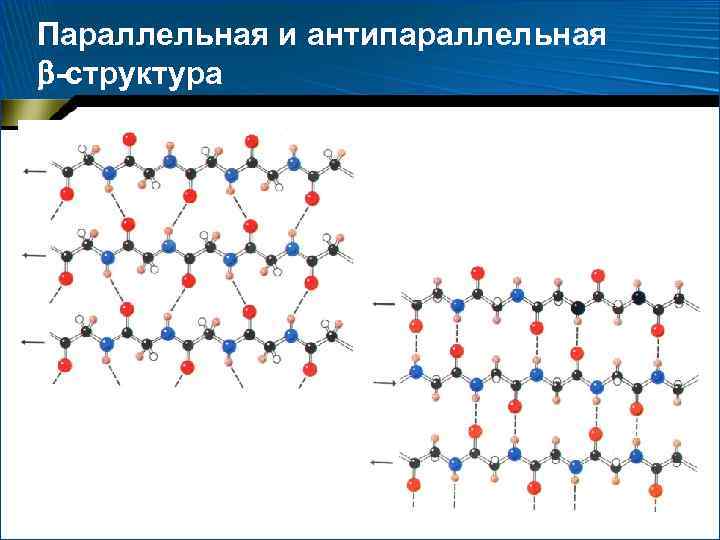
Параллельная и антипараллельная -структура

-Структура • Число аминокислотных остатков в отрезке пептидной цепи, образующем -структуру, обычно от 3 до 8 • Протяженная -структура ( -слой, -складчатый лист) чаще всего состоит из 2– 6 цепей, иногда до 10

-Структура • Боковые группы аминокислотных остатков оказываются по разные стороны ее поверхности • Поверхность имеет складчатую форму • Отходящие от них боковые группы – гребни • Это позволяет формировать довольно протяженные поверхности, насыщенные однотипными (например, гидрофобными) боковыми радикалами • Гидрофобные поверхности -складчатого слоя, взаимодействуя между собой или с гидрофобными гребнями -спиралей, участвуют в построении внутримолекулярных гидрофобных ядер, стабилизирующих пространственную структуру белка

Вторичная структура белков -Изгиб

-Изгиб • Петли, позволяющие изменить направление пептидной цепи • Наиболее экономно – -изгиб • Стабилизируется одной водородной связью • Практически всегда оказывается на поверхности белковой глобулы, поэтому нередко играет существенную роль в ее взаимодействии с другими молекулами
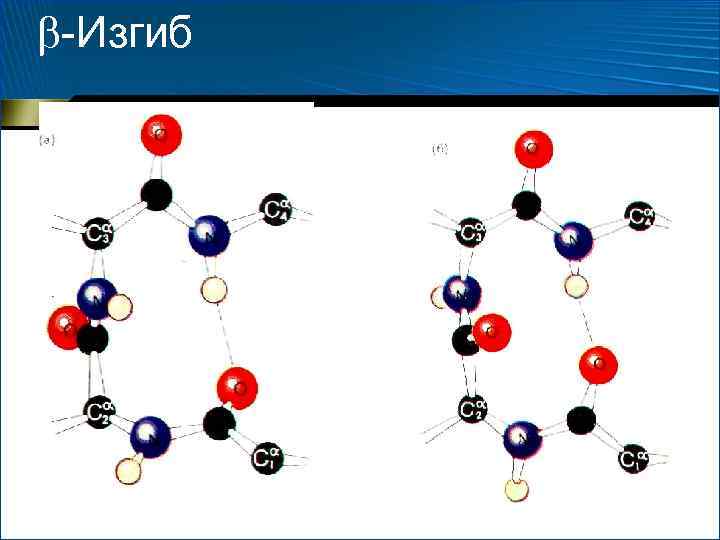
-Изгиб

Вторичная структура белков Зависимость от аминокислотной последовательности

• Способ укладки молекулы белка определяется его аминокислотной последовательностью – -спираль – ала, лей, глу – -структура – мет, вал, иле – изгиб цепи – гли, про, асн • Если из 6 сгруппированных остатков аминокислот 4 способствуют образованию спирали, – центр спирализации • Если 3 остатка из 5 сгруппированных способствуют образованию -структуры, – затравка для -слоя

Сверхвторичная (надвторичная) структура белков

Сверхвторичная (надвторичная) структура белков • Пространственное строение ансамблей взаимодействующих между собой вторичных структур

Сверхвторичная (надвторичная) структура белков Типы сверхвторичных структур

Суперспирализованная -спираль • Образуется при скручивании нескольких -спиралей в протофибриллы ( -кератин), которые объединяются в микрофибриллы • -Спирали удерживаются силами Ван-дер-Ваальса

• две антипараллельно упакованные -спирали

• два антипараллельных отрезка -структуры

х • звено, состоящее из двух параллельных -слоев с сочленением между ними в виде (х): – неупорядоченного клубка – с

х • звено, состоящее из двух параллельных -слоев с сочленением между ними в виде (х): – -спирали – – укладка цепи по Россману – Два последовательно соединенных участка образуют структуру «греческий орнамент» –
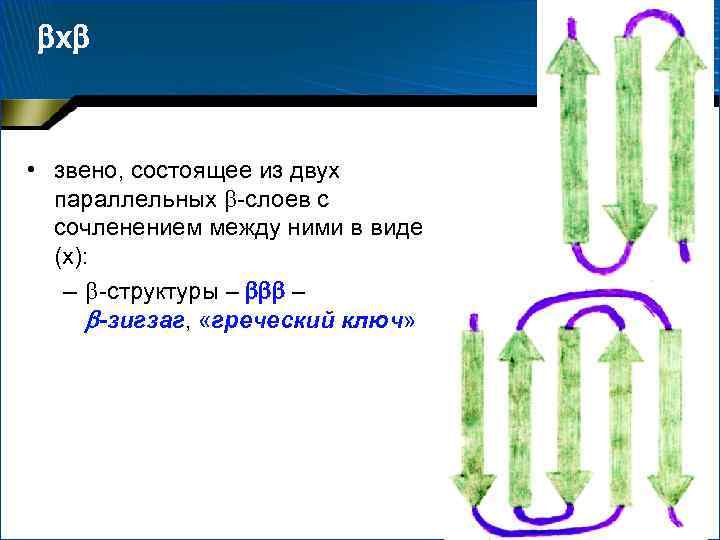
х • звено, состоящее из двух параллельных -слоев с сочленением между ними в виде (х): – -структуры – – -зигзаг, «греческий ключ»

Домены
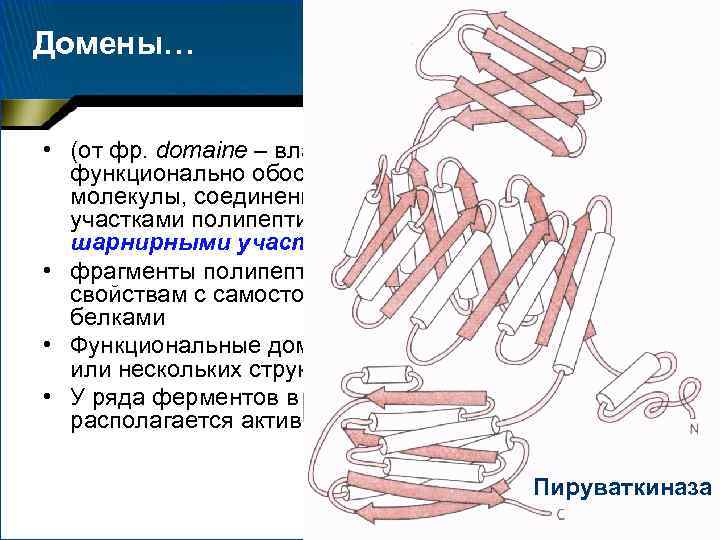
Домены… • (от фр. domaine – владение) – структурно и функционально обособленные области (субобласти) молекулы, соединенные друг с другом короткими участками полипептидной цепи, которые называются шарнирными участками • фрагменты полипептидной цепи, сходные по своим свойствам с самостоятельными глобулярными белками • Функциональные домены могут состоять из одного или нескольких структурных доменов • У ряда ферментов в углублениях между доменами располагается активный центр Пируваткиназа

Домены Классификация структурных доменов и белков по организации пространственной структуры полипептидной цепи
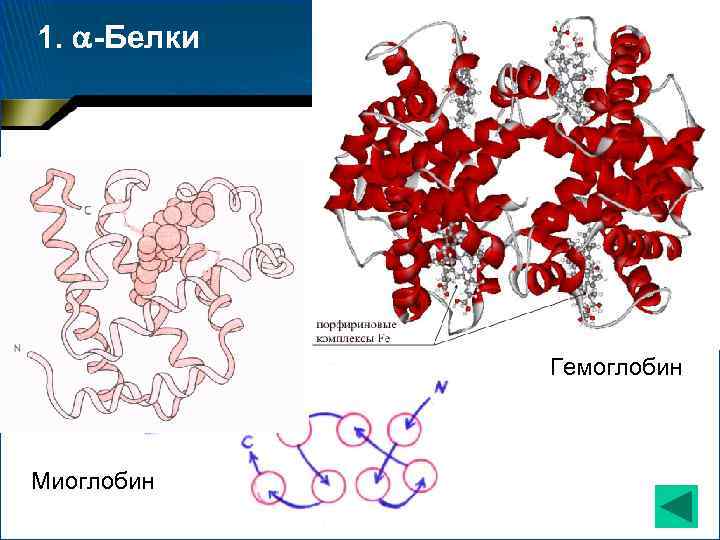
1. -Белки Гемоглобин Миоглобин
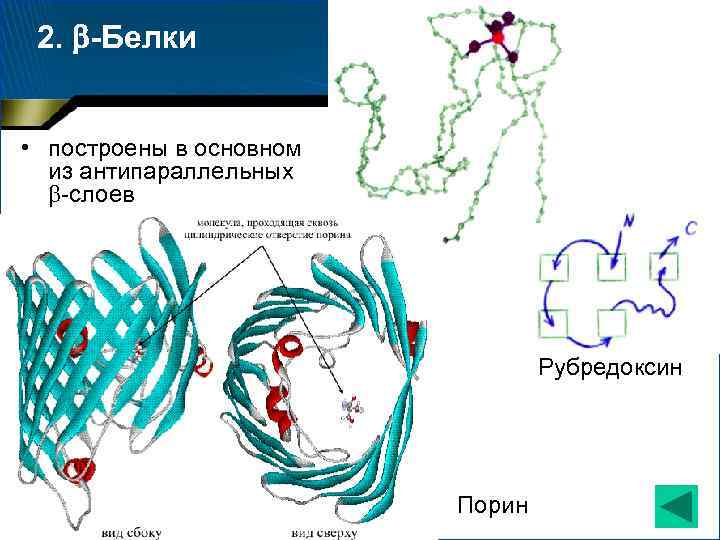
2. -Белки • построены в основном из антипараллельных -слоев Рубредоксин Порин
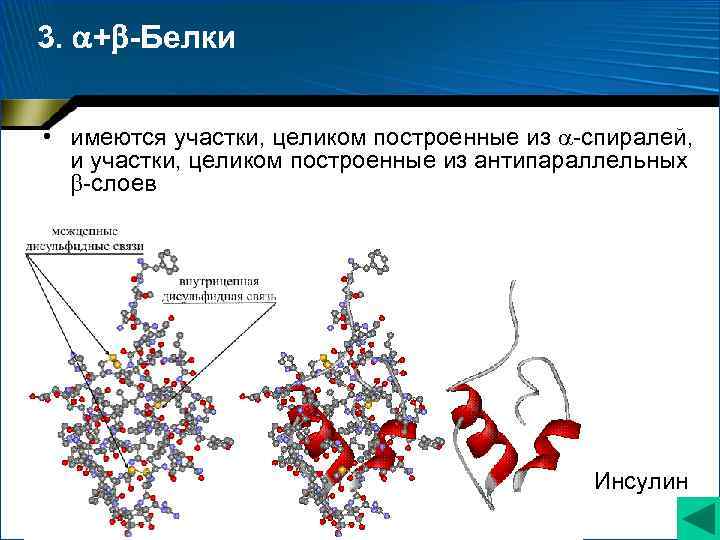
3. + -Белки • имеются участки, целиком построенные из -спиралей, и участки, целиком построенные из антипараллельных -слоев Инсулин
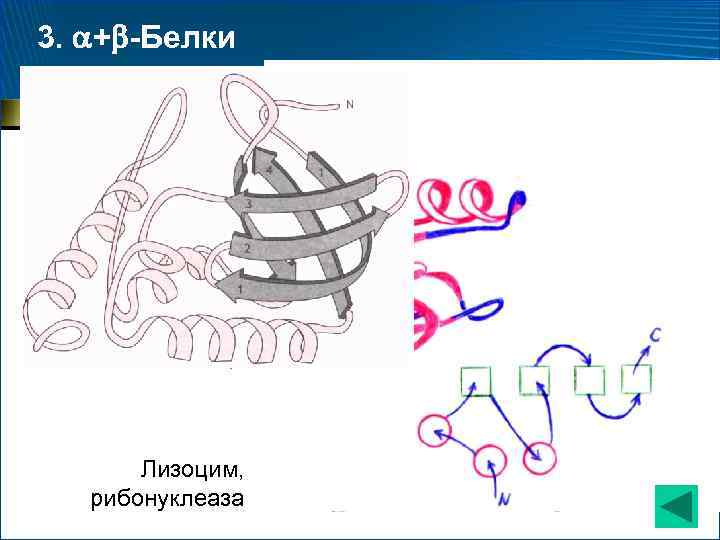
3. + -Белки Лизоцим, рибонуклеаза

4. / -Белки • -Спирали и -структуры чередуются по ходу цепи • Большинство -структур (параллельные) оказываются локализованными в центральной части молекулы, где эти структуры изгибаются в виде пропеллера ( «твист» -структуры), образуя жесткую «основу» , с которой связаны остальные участки молекулы
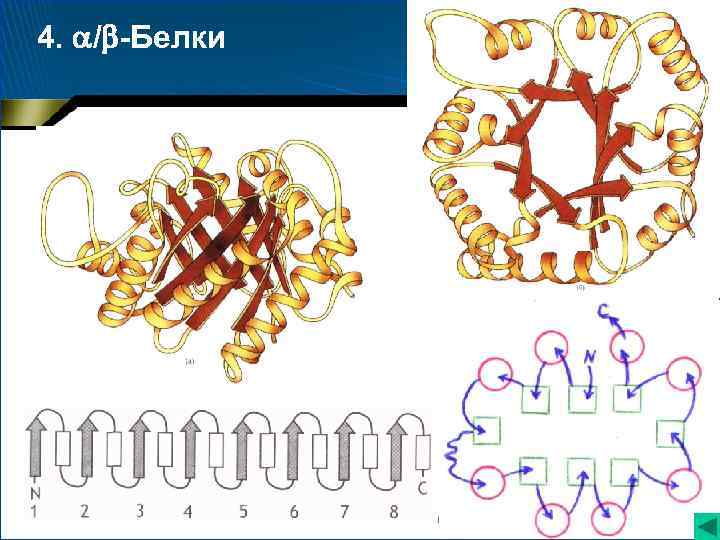
4. / -Белки Триозофосфатизомераза

5. Домены и белки без выраженной вторичной структуры

Третичная структура белка

Третичная структура белка… • характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации • Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью • Имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной
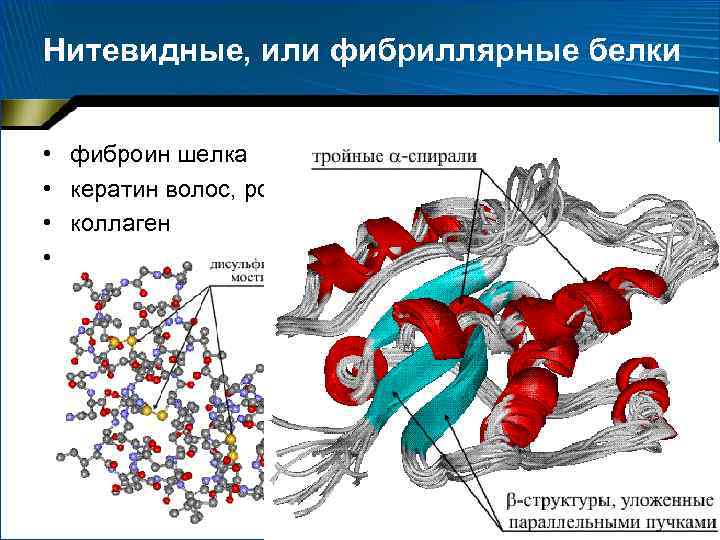
Нитевидные, или фибриллярные белки • • фиброин шелка кератин волос, рогов, копыт коллаген и др.

Шаровидные, или глобулярные белки

Третичная структура белка • основа функциональности белка, которая требует точной пространственной организации больших ансамблей, построенных из множества аминокислотных остатков • Такие ансамбли (домены) формируют: – активные центры ферментов – зоны связывания других биологических молекул – эффекторные центры белков и т. д. , • поэтому нарушение третичной структуры белка (денатурация) неизменно приводит к утрате им способности функционировать

Четвертичная структура белка

Четвертичная структура белка… • Олигомерные белки • Четвертичная структура – размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка • Взаимодействие между субъединицами достаточно сильно, так что их ансамбль (ансамбль глобул) выступает как единая молекула, в то же время каждая из объединившихся глобул сохраняет значительную автономность
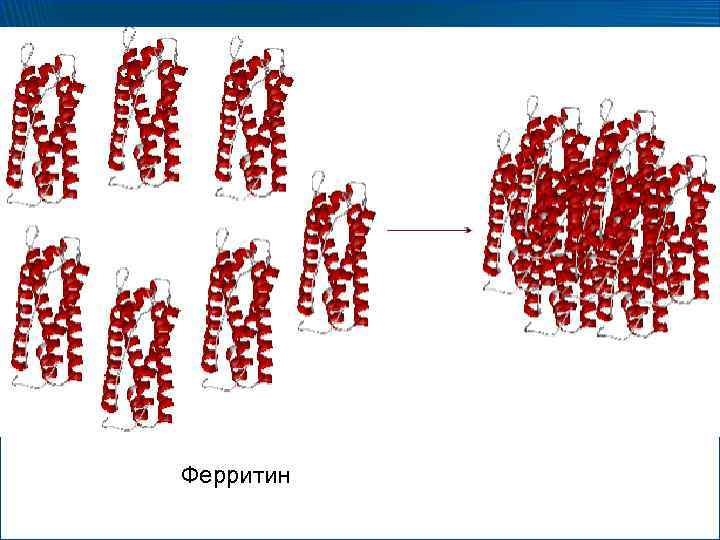
Ферритин

Четвертичная структура белка • гомомерные белки • гетеромерные белки – Объединение в одной структуре несколько взаимосвязанных функций, создание полифункциональной молекулы • Протеинкиназа: С-субъединица отвечает за ферментативную активность, R-субъединица – регуляторная

Четвертичная структура белка • Межсубъединичные контакты – система нековалентных взаимодействий – гидрофобные взаимодействия (контактные площадки) – водородные связи – электростатические взаимодействия между боковыми группами • Четвертичная структура менее прочная, чем третичная, т. к. меньше вклад гидрофобных контактов

Четвертичная структура белка Функциональное значение

Функции четвертичной структуры 1. Объединение нескольких взаимосвязанных функций в единой структуре 2. Архитектурная функция – Формирование пространственных образований весьма сложной конфигурации, обеспечивающих специфические функциональные возможности белка (ферритин) – Суммарное проведение последовательных реакций ферментами – Формирование функциональных центров (активных центров ферментов)

Функции четвертичной структуры 3. Обеспечение множественных взаимодействий белка с протяженными структурами – ДНК-связывающие белки – димеры (? ) 4. Регуляторная функция. Передача эффекта (нарушение третичной структуры при взаимодействии с субстратом) от одной субъединицы к другой, что приводит к перестройке всей четвертичной структуры
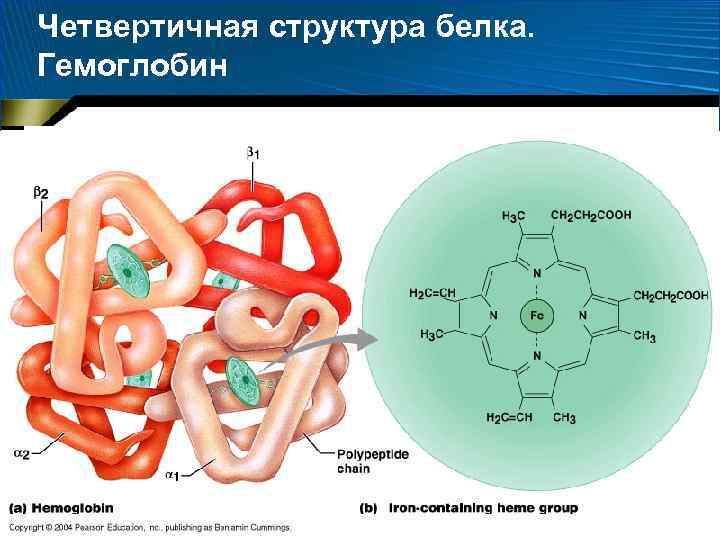
Четвертичная структура белка. Гемоглобин

• Каждый индивидуальный белок характеризуется уникальной структурой, обеспечивающей уникальность его функций • Поэтому выяснение структуры разнообразных белков может служить ключом к познанию природы живых систем и, соответственно, сущности жизни

Свойства белков

1. Амфотерные свойства белков • Кислотно-основные свойства НООС–R–NН 2 ⇄ –ООС–R–NН 3+ • Большая часть полярных гидрофильных групп – на поверхности белковых глобул. Они определяют кислотно-основные свойства белковой молекулы • Кислотные свойства – остатки глу и асп • Основные свойства – остатки лиз, арг, гис, орн • Кислотные радикалы преобладают молекула электроотрицательна • Преобладают основные радикалы электроположительна

1. Амфотерные свойства белков • Изменение р. Н приводит к перераспределению электрических зарядов на поверхности молекул • Изоэлектрическая точка (ИЭТ, р. I) • р. I – характерная константа белков – ИЭТ большинства белков животных тканей – 5, 5– 7, 0 – НО р. I пепсина – 1, р. I сальмина – около 12

1. Амфотерные свойства белков • р. Н < р. I суммарный заряд белковой молекулы + • р. Н > р. I – • р. Н = р. I 0 – белки легко осаждаются

2. Растворимость белков • Подавляющее большинство гидрофильны • Растворимость определяется природой групп, оказывающихся на поверхности молекулы • Большая часть поверхности молекулы образована группами, способными гидратироваться • Гидратная оболочка предохраняет молекулы белка от склеивания и выпадения в осадок • Величина ее зависит от структуры белка

2. Растворимость белков • Устойчивость водного раствора белка определяется: – наличием электрического заряда молекул – водной оболочкой • При удалении этих факторов белок выпадает в осадок

Обратимое осаждение (высаливание) • выпадение белка в осадок под действием веществ, после удаления которых он вновь возвращается в свое исходное состояние – Na 2 SO 4, (NH 4)2 SO 4 – удаляют водную оболочку и снимают заряд – Чем меньше гидратная оболочка, тем меньше требуется соли (различие глобулинов и альбуминов)

Необратимое осаждение • связано с глубокими внутримолекулярными изменениями структуры белка, что приводит к потере ими нативных свойств • Денатурированный белок • Денатурация

3. Денатурация белка • существенное изменение третичной и вторичной структуры белка, т. е. нарушение, разупорядочение системы нековалентных взаимодействий, не затрагивающее его ковалентной (первичной) структуры • как правило, сопровождается утратой белком функциональных свойств, его инактивацией

Что вызывает денатурацию? • Повышение температуры возрастание вклада энтропийного фактора тепловая денатурация (скачкообразно) • Температура денатурации различна – термолизин до 80 С сохраняет активность

Что вызывает денатурацию? • Воздействие реагентов, нарушающих нековалентные взаимодействия, прежде всего систему водородных связей
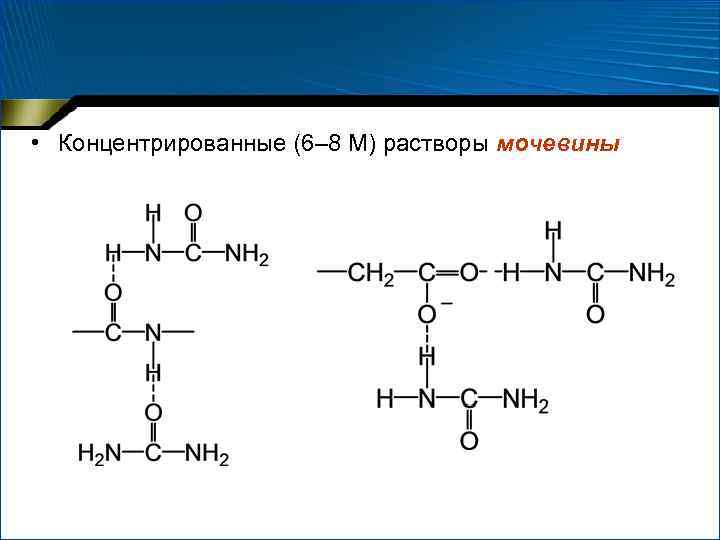
• Концентрированные (6– 8 М) растворы мочевины

Что вызывает денатурацию? • Органические растворители способны устанавливать контакты с гидрофобными аминокислотными остатками белка, лишая гидрофобное ядро его стабилизирующей роли • Одновременно многие растворители (спирты, формамид, муравьиная кислота) «переключают» на себя водородные связи, поддерживающие третичную структуру • При повышении концентрации растворителя может нарушаться и структура воды

Что вызывает денатурацию? • Эффективные денатурирующие агенты – ионные детергенты (додецилсульфат натрия [СН 3–(СН 2)11–ОSО 3]– Nа+) • Гидрофобная цепь его образует контакты с гидрофобными остатками белка, приводящие при концентрации детергента 0, 5 м. М к полному развертыванию третичной структуры

Что вызывает денатурацию? • Экстремальные значения р. Н • В сильно кислых растворах – протонируются карбоксильные группы, сохраняются только положительные заряды, взаимное отталкивание которых приводит к развертыванию глобулы • В щелочных растворах – утрачивают положительные заряды аминогруппы и приобретают отрицательные заряды фенольные группы тир, что также ведет к развертыванию глобулы

3. Денатурация белка • Ренатурация • Где можно наблюдать денатурацию белка? – при варке яиц – при свертывании молока – при гниении (хранении семян, уменьшается процесс набухания и интенсивность прорастания) – приготовлении консервов – и т. д.

4. Коллоидные свойства растворов белка • Размер белковых частиц – от 1 мкм до 1 нм • Растворы белков проявляют коллоидные свойства (? ), но гомогенны • Растворы белков могут при определенных условиях образовывать гели – под действием ферментов микроорганизмов (образование кефира, простокваши из молока) – при подготовке растений к зиме • Синерезис (образование творога при стоянии кефира)

5. Белки-эмульгаторы • Благодаря гидрофильным и гидрофобным группировкам – В организме человека и животных в эмульгированном состоянии находятся жиры в крови и лимфе – Молоко – эмульгированные казеиногеном капельки жира в воде

6. Оптические свойства растворов белков • Белки поглощают свет в УФ части спектра (спектрофотометрия) • Окрашенные белки (хромопротеины) способны поглощать свет в видимом диапазоне • Все белки поглощают свет в ИК области (ИКспектроскопия для определения относительного содержания -, - и аморфных участков в молекуле белка) • Оптически активны • Оптическая анизотропия • Флуоресценция • Эффект Тиндаля

7. Гидролиз белков • образуется набор соответствующих аминокислот

8. Цветные реакции на белки (см. лабораторные занятия) • • Биуретовая реакция Нингидриновая реакция Ксантопротеиновая реакция Реакция Сакагучи Реакция Миллона Реакция Адамкевича Реакция Паули Реакция Фоля

Классификация белков

По степени сложности • простые белки (протеины) дают при гидролизе только аминокислоты – Альбумины – Глобулины – Проламины – Глютелины – Гистоны – Склеропротеины – Протамины – Протеиноиды

По степени сложности • сложные белки (протеиды) = протеин + добавочная группа, по составу которой: – Хромопротеины (гемоглобин, цитохромы, каталаза, хлорофилл) – Липопротеины (компонент мембран, липопротеины крови, сфинголипиды в сером веществе мозга) – Гликопротеины (кутикулярный гликопротеин – структурный материал покровных тканей насекомых, муцин – компонент слюны, протеогликановые агрегаты в хрящевых тканях)

По степени сложности • сложные белки (протеиды): – Нуклеопротеины (вирусы, хроматин, рибосомы) – Металлопротеины (цитохромоксидаза, церулоплазмин крови – Cu; лактоферрин молока, трансферрин крови, ферритин селезенки – Fe) – Фосфопротеины (казеин молока, вителлин и фосфитин яичного желтка, ихтулин икры рыб) – Флавопротеины, добавочная группа – ФАД или ФМН (компонент дыхательной цепи)

По форме частиц • фибриллярные (волокнистые) белки (фиброин шелка, кератин волос, коллаген кожи) • глобулярные (корпускулярные) белки

По растворимости • протеиноиды (склеропротеины) – нерастворимы в обычных растворителях – почти все фибриллярные белки • альбумины – хорошо растворимы в воде и крепких растворах солей (50%-ном сульфате аммония), содержат, как правило, много гли – альбумины крови, яиц, молока

По растворимости • глобулины – нерастворимы в воде, но растворимы в солевых растворах умеренных концентраций – белки семян (легумин гороха, фазеолин фасоли), антитела, фибрин • проламины – растворимы в 60– 80%-ном растворе этанола, содержат, как правило, много глу и про – семена злаков (глиадин ржи и пшеницы, гордеин ячменя, зеин кукурузы)

По аминокислотному составу • протамины – содержат 80– 90% арг, простейшие белки, растворяются в слабых кислотах – белки половых клеток (сальмин молок семги) • гистоны – высокое содержание арг, лиз и гис (не < 30%), растворяются в слабых кислотах, 0, 2 н. HCl, осаждаются спиртом и аммиаком – содержатся в ядрах клеток • глютелины – много глу, растворяются в щелочных растворах (0, 2– 2%-ном Na. OH) – содержатся в семенах злаков (клейковина), зеленых частях растений

По выполняемым функциям • структурные белки – компоненты клеточных мембран, органелл; коллаген соединительной ткани; кератин волос, ногтей; эластин в сосудистых стенках и др. • каталитически активные белки (ферменты) • сократительные белки: миксомиозин; белки микротрубочек; миозино- и актомиозиноподобные белки фибриллярного аппарата амебы; белки микрофибрилл, жгутиков и ресничек простейших, жгутиков сперматозоидов

По выполняемым функциям • транспортные белки – сывороточный альбумин; церулоплазмин; трансферрин; -липопротеин; гемоглобин; транспортные белки мембран • защитные белки: антитела (иммуноглобулины); белки системы свертывания крови (фибриноген, тромбин, фибрин, факторы свертывания); интерфероны и др.

По выполняемым функциям • токсические белки: токсины змей, скорпионов, пчел, ос и др. – в основном нейротоксины; токсины микроорганизмов и растений (дифтерийный, холерный, токсин шигеллы и др. ); • белки-гормоны (инсулин, глюкагон, АКТГ и др. ) • регуляторные белки (гистоны; негистоновые белки хроматина; белковые факторы репликации ДНК, транскрипции РНК, синтеза белка; стрессовые белки и др. )

По выполняемым функциям • резервные белки (овальбумины яиц, белки молока – казеин) • рецепторные белки: рецептор ацетилхолина; фоторецепторный белок опсин; сладкочувствительный белок вкусовых рецепторов; обонятельный белок дубового шелкопряда; холинорецепторные белки звуковых рецепторов • белки-ингибиторы ферментов • белки вирусных оболочек (вирус табачной мозаики, бактериофаги и др. ) • белки с иными функциями (гемоглобины, фибриллярные белки, рибосомальные белки и т. п. )

По выполняемым функциям • Все белки выполняют энергетическую функцию: • при окислении 1 г белка выделяется 17, 2 к. Дж энергии

По особенностям вторичной и третичной структур (см. выше)

Литература • • • Березов Т. Т. , Коровкин Б. Ф. Биологическая химия. – М. : Медицина, 1983 Грин Н. , Стаут У. , Тейлор Д. Биология. В 3 -х т. – Т. 1. – М. : Мир, 1990 Ермолаев М. В. , Ильичева Л. П. Биологическая химия. – М. : Медицина, 1989 Мецлер Д. Биохимия. Химические реакции в живой клетке. В 3 -х т. – Т. т. 1, 2. – М. : Мир, 1980 Неницеску К. Д. Органическая химия: Т. 2. – М. : Издво иностр. лит-ры. , 1963

Литература • • • Овчинников Ю. А. Биоорганическая химия. – М. : Просвещение, 1987 Основы биохимии / Пол ред. А. А. Анисимова. – М. : Высшая школа, 1986 Рис Э. , Стренберг М. От клеток к атомам. Иллюстрированное введение в молекулярную биологию. – М. : Мир, 1988 Степанов В. М. Молекулярная биология. Структура и функции белков. – М. : Высшая школа, 1996 Филиппович Ю. Б. Основы биохимии. – М. : Высшая школа, 1993