Б Е Л К И - 2.pptx
- Количество слайдов: 53

БЕЛКИ - 2

Стереохимия аминокислот

Повороты полипептидной цепи
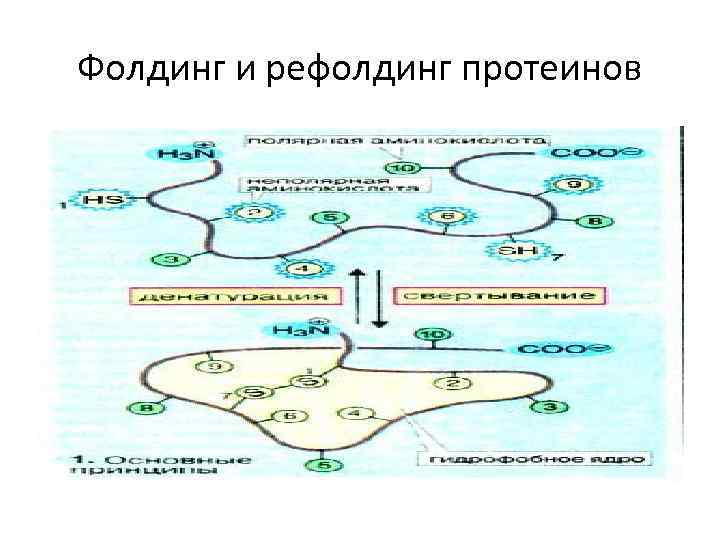
Фолдинг и рефолдинг протеинов

КОЛЛАГЕН Пример нерастворимого белка Много (6% массы тела, 30% общего белка) Крупный (виден в микроскоп) Фибриллярен ( 1: 20) Из многих волокон, структурная единица – тропоколлаген (289 тыс. ) • Треть аминокислот – глицин, еще треть – пролин, много гидроксилизина • Внеклеточный белок • Содержится: кожа, кости, роговица, сосуды, стекловидное тело • • •
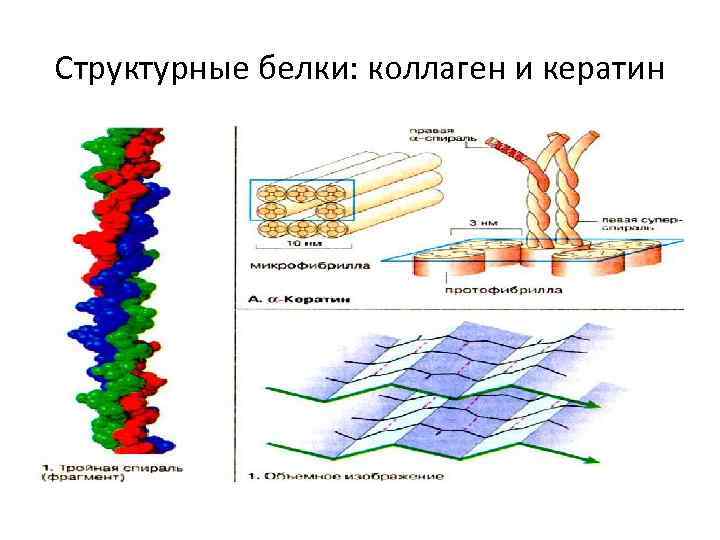
Структурные белки: коллаген и кератин
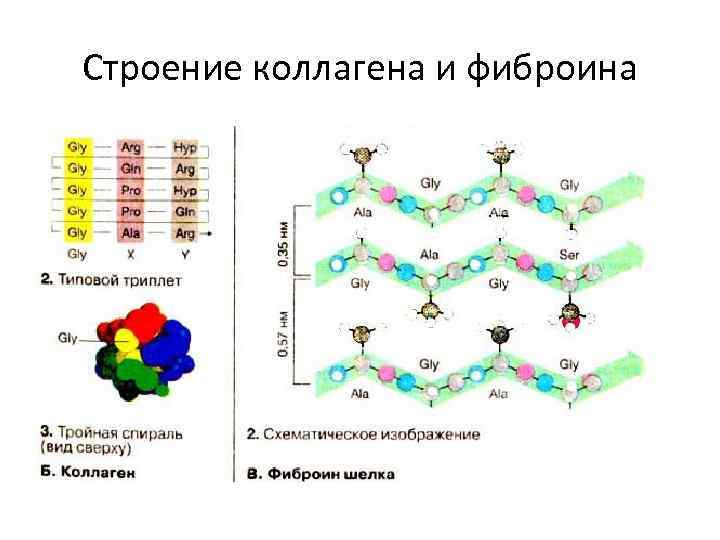
Строение коллагена и фиброина

Структура коллагена
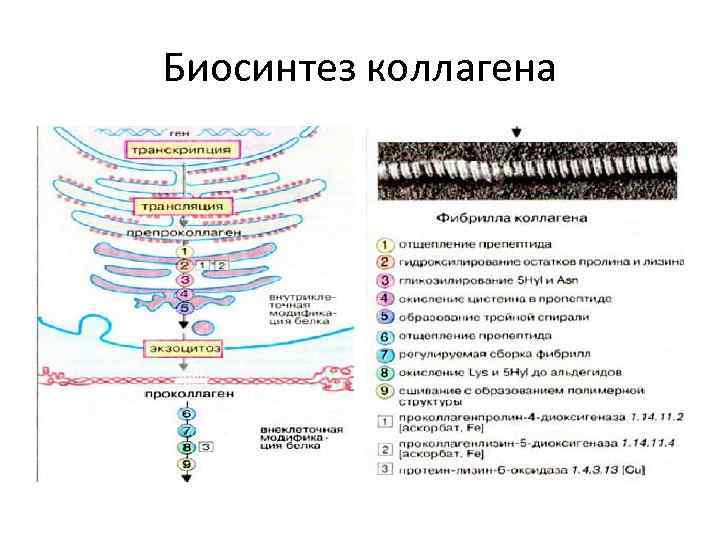
Биосинтез коллагена

ЭЛАСТИН • Основной белок эластических веществ • Отличается от коллагена по составу и структуре (больше валина, аланина, меньше аргинина) • Как и в коллагене много глицина и пролина, мало метионина, нет совсем триптофана и цистеина • Только у эластина обнаружен десмозин, который сообщает ему эластичность во всех направлениях • Синтезируется сначала тропоэластин – предшественник, без поперечных связей

Альбумины и глобулины • Широко распространены (кровь, молоко, яйца, мышцы) • Много (7% в составе крови) • Альбумины – масса - 40 -70 тыс. , глобулины – 150 тыс. и более • Кислый характер их растворов • Отрицательный заряд молекул • Функции: осмос крови, транспорт других веществ (липидов, железа, меди), иммунитет (антитела)

ПРОТАМИНЫ И ГИСТОНЫ • • Небольшая молекулярная масса Выраженные основные свойства Хорошая растворимость в воде Много лизина и аргинина в составе Много в ядерном материале Источники – икра рыб и проч. Представители – сальмин (из семги), клупеин (из сельди)

Реакции определения аминокислот и белков реакция реактив Ксантопротеиновая Кислота HNO 3 на что? Фенилалан Тирозин окраска Желтая

Природные пептиды • Гормональная активность (окситоцин, глюкагон, вазопрессин и др. ) • Пишеварение (гастрин, секретин) • Пептиды крови (брадикинин, ангиотензин, каллидин) • Нейропептиды (пептид сна, эндорфины) Часто синтезируются сначала как неактивные предшественники. • Искусственный пептид – аспартам – заменитель сахара

Методы выделения и очистки белков Гомогенизация (измельчение) тканей с разрушением клеток Экстракция (извлечение) белков из их комплексов с липидами и др. (детергенты, этанол, ацетон) Фракционирование (разделение) белков на индивидуальные а) высаливание (добавление нейтральных солей) б) тепловая денатурация в) осаждение органическими растворителями г) хроматография (множество видов) д) кристаллизация е) электрофорез (разные способы) Очистка от низкомолекулярных примесей (диализ) Определение гомогенности (однородности, индивидуаль-ности белка)

СЛОЖНЫЕ БЕЛКИ • • • Липопротеины Гликопротеины Фосфопротеины Металлопротеины Нуклеопротеины Хромопротеины

НУКЛЕОПРОТЕИНЫ • Именно с белками и нуклеиновыми кислотами связано многообразие форм жизни • С ними связаны митоз, эмбриональный рост, злокачественный рост, функции ферментов и другие • Широкий диапазон соотношений нуклеинового компонента и белка (от 2% до 65% нуклеиновой кислоты) • Белковый компонент: гистоны(много лизина, аргинина, глицина), негистоновые белки • Всегда положительный заряд • Конкретные представители: хромосома, рибосома, ферменты (ЛДГ, дегидрогеназы), вирусы
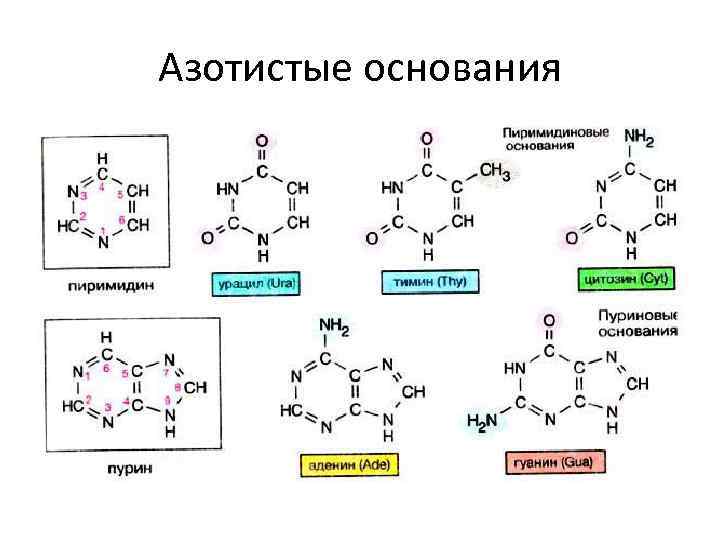
Азотистые основания
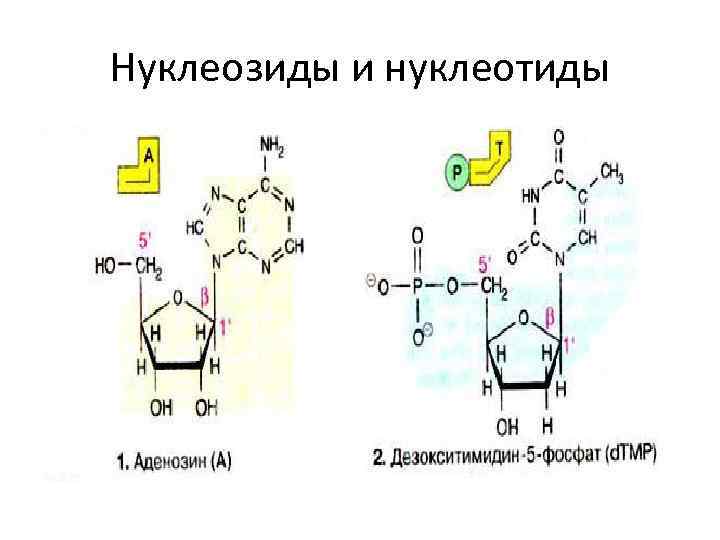
Нуклеозиды и нуклеотиды
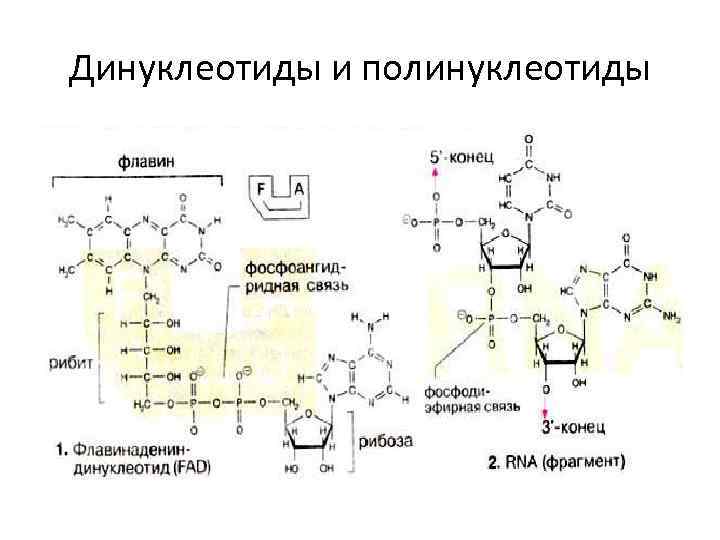
Динуклеотиды и полинуклеотиды

Спаривание комплементарных оснований
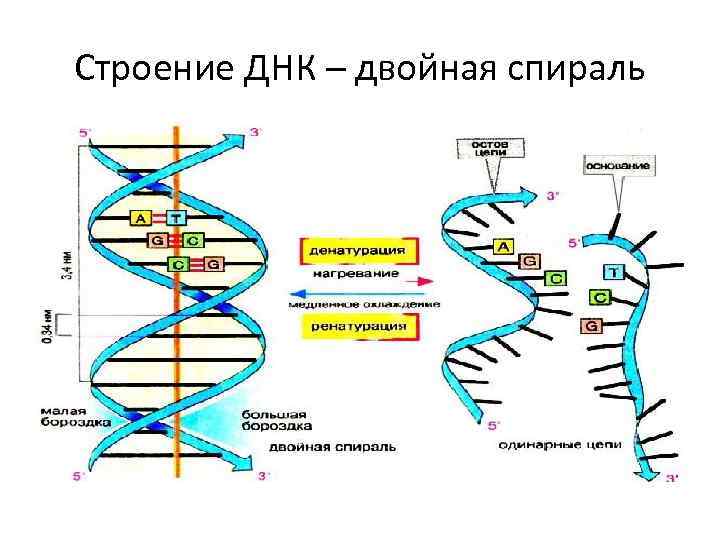
Строение ДНК – двойная спираль
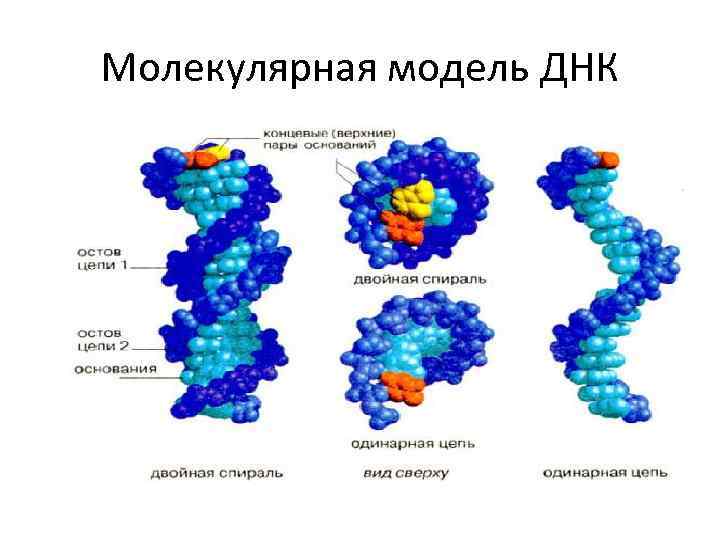
Молекулярная модель ДНК
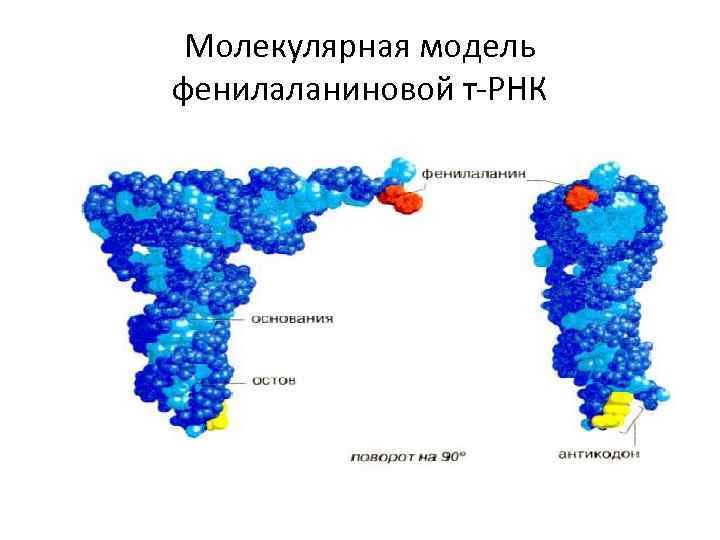
Молекулярная модель фенилаланиновой т-РНК

Типы РНК

Структура фенилаланиновой т-РНК
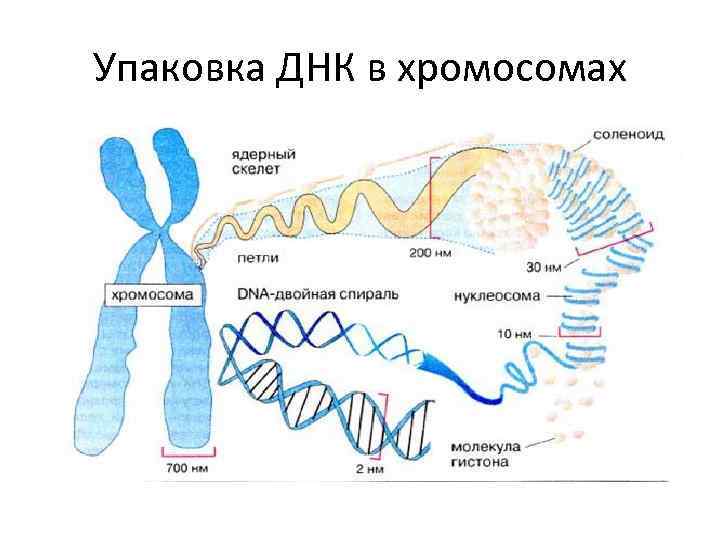
Упаковка ДНК в хромосомах

Формирование хроматина

Сравнение первичных структур гистона Н 4

Структура рибосом
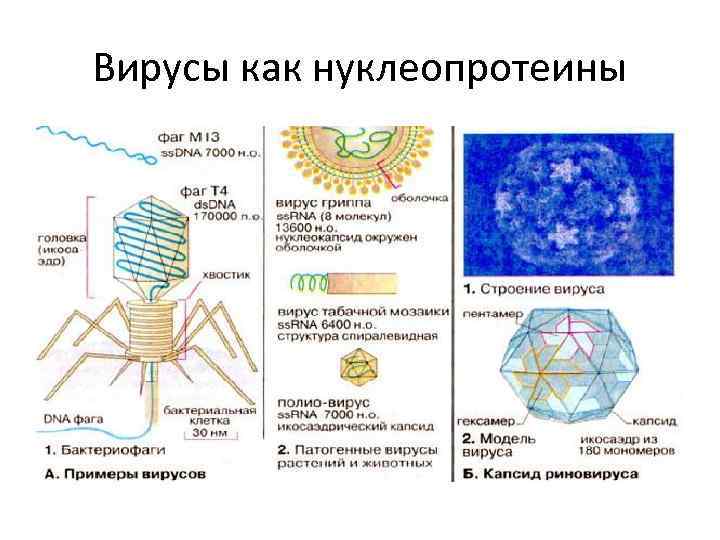
Вирусы как нуклеопротеины

ЛИПОПРОТЕИНЫ • Состав: белок и простетическая группа (жир, жирные кислоты, фосфолипиды, холестериды) • Распространение: растения, ткани челевека, кровь, молоко, белок яиц, структура митохондрий, микро-сом, ядер, сетчатка • Структура: гидрофобное липидное ядро и оболочка из белков • Место синтеза: печень и слизистая кишечника • Основные группы: хиломикроны, липопротеины крови (ЛПОНП, ЛПВП). Чем больше белка, тем выше плотность фракции) • Часто включают и углевод (глюкозу, галактозу, гексозамин, фукозу) • Участвуют в развитии склероза и др. патологии

СОСТАВ ЛИПОПРОИНОВЫХ КОМПЛЕКСОВ • Это шаровидные агрегаты, состоящие из ядра (неполярные липиды, ацилхолестерин) и оболочки толщиной 2 нм. Наружняя сторона оболочки полярна и потому липопротеин растворим. • Комплексы делятся на 5 групп: - хиломикроны – самые легкие и крупныеобеспечивают транспорт пищевых липидов от кишечника к тканям. Разрушаются липазой мышц и жировой ткани.

• Липопротеиды очень низкой плотности, липопротеиды промежуточной плотности и липопротеиды низкой плотности транспортируют жиры, холестерин и фосфолипиды от печени к тканям • Различие плотности в этих группах объясняется разным соотношением белка и липидов: чем выше содержание белка, тем выше плотность этой группы. • Липопротеиды высокой плотности возвращают избыточный холестерин, образующийся в тканях, обратно в печень. В процессе транспорта холестерин ацилируется жирными кислотами

ГЛИКОПРОТЕИНЫ • Имеют отношение к развитию рака, артритов, астмы, иммунодефицита … • Сложно и неоднотипно построены. Часто включают еще и аминосахара, и серную кислоту • Разновидности: иммуноглобулины, гормоны, мембранные белки, интерфероны, белки крови, молока, рецепторные, некоторые ферменты, муцин слюны, овомукоид, гликопротеины хрящей и костной ткани • Углеводные компоненты (галактоза, фукоза, манноза, ксилоза) • Синтезируются на рибосомах, гликозилируются, затем в аппарат Гольджи и транспорт к месту назначения
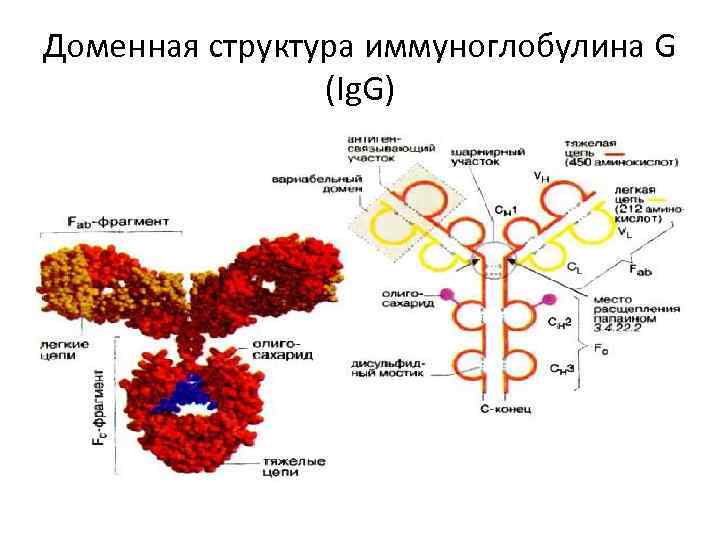
Доменная структура иммуноглобулина G (Ig. G)


О БЕЛКАХ ПЛАЗМЫ КРОВИ • Кроме альбумина почти все белки плазмы крови являются гликопротеинами. Они включают олигосахариды • Концентрация белков плазмы в норме поддерживается на постоянном уровне • При заболеваниях органов меняется концентрация этих белков. Например, повреждение тканей цитокинами увеличивает образование белков острой фазы, в частности С-реактивного белка, гаптоглобина, фибриногена
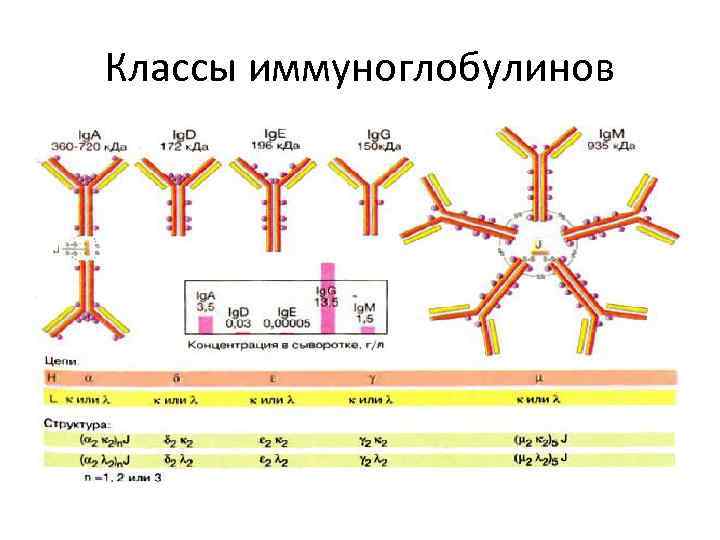
Классы иммуноглобулинов

КЛАССЫ ИММУНОГЛОБУЛИНОВ • Иммуноглобулины всех 5 классов являются секретируемыми белками. Анти тела имеют различные функции. • Иммуноглобулины М образуются первыми при контакте с чужеродным антигеном. Эти антитела особенно активны против микроорганизмов. • Иммуноглобулинов G (джи) в количественном отношении больше всех. Они могут переходить в плаценту, т. Е. от матери к плоду.

• Иммуноглобулины А обнаруживаются преимущественно в кишечном тракта и секретах • Иммуноглобулины Е присутствуют в плазме здорового человека лишь в незначительных концентрациях и возрастают при аллергичесих реакциях и паразитарных инфекциях • Иммуноглобулинов Д очень мало, функция их не выяснена

МЕТАЛЛОПРОТЕИНЫ • Белки с негемовым железом (ферритин, трансферритин, гемосидерин). Содержание железа соответственно 20%, 43% и 30% соответственно. Трансферрин одновременно и металло- и гликопротеин сыворотки крови. Гемосидерин – металло-, нуклео- и гликопротеин. • Металлоферменты (цитохромоксидаза – медь, аргиназа, декарбоксилазы – марганец, пептидазы, фосфатазы – магний, кальций, пероксидаза - железо

МЕТАЛЛОПРОТЕИНЫ • Ферритин – в селезенке, печени, мозге. Масса 400 тыс. , содержит 20% железа, белковая часть – апаферритин, водорастворим, депо железа • Трасферрин – белок крови, глобулин, гликопроотеин, 0, 13% железа, водорастворим • Гемосидерин – в печени, селезенке, масса 400 тыс. , содержит 37% железа, нерастворим. Накапливается в тканях (гемахроматоз) – причина цирроза, диабета, сердечной недостаточности. Лечат кровопусканием, связыванием железа (фарм. )

• Металлоферменты – там металл не временный, не адсорбированный, не отщепляется при выделении. Без металла – нет каталитической функции • Марганец – в аргиназе, декарбоксилазах, фосфотрансферразах • Магний, кальций, цинк – пептидазы, фосфотазы • Калий, натрий, магний – Атфаза, фосфокиназа (транспорт фосфатных групп) • Кобальт - трансферразы


ХРОМОПРОТЕИНЫ окрашенные белки • Гемопротеины (гем, железо) – гемоглобин, каталаза, пероксидаза, миоглобин • Магнийпорфирины – хлорофилл, растения берут лишь 1% энергии падающего света • Флавопротеины, входят в состав оксиредуктаз, участвуют в биоэнергетике, входят в состав ФАД, ФМН

ГЛИКОПРОТЕИНЫ И ПРОТЕОПЛИКАНЫ • Белка от 5% до 95% • Иммуноглобулины, интерфероны, гормоны, ферменты, структурные белки • Кроме того: формируют тургор тканей, межклеточные фильтры (препятствуют распространению микробов), рессорная функция (в хрящах), прозрачность роговицы, стекловидного тела, антикоагуляция (гепарин), рецепторы и другие функции

Заболевания, связанные с незаменимыми жирными кислотами • Гистидин – анемия, дерматиты, снижение умственных способностей • Изолейцин- поражение почек, анемия, функции щитовидной железы • Лейцин – сходные патологии • Лизин – анемия, миодистрофия, остеопороз • Аргинин – снижение сперматогенеза

• Метионин – ожирение, некрозы, облысения, атеросклероз, анемия (то же для цистеина) • Фенилаланин и тирозин – нарушение функции щитовидной железы и надпочечников • Триптофан – катаракта, помутнение роговицы. Облысение, анемия, атрофия семенников • Валин – нарушение координации движения




ВЫВОД • Сложные, особенно олигомерные белки обладают новыми по сравнению с мономерными белками свойствами. • Присоединение регуляторных молекул в удаленных участках (аллостерических) может вызвать конформационные изменения во всем белке • Эти воздействия приспрсабливают конформацию и функцию белков к изменениям окружающей среды
Б Е Л К И - 2.pptx