Белки 20102017.ppt
- Количество слайдов: 82

БЕЛКИ 1

Белки (или белковые вещества) составляют основу и структуры и функции как одной клетки так многоклеточных живых организмов. Соматропин – гормон роста, выделяемый гипофизом головного мозга. Инсулин – гормон поджелудочной железы, ответственный за глюкозный обмен 2

ФУНКЦИИ БЕЛКОВ это разносторонние роли белков в живом организме, решающей из которых являются их способность строго избирательно, специфически соединяться с широким кругом разнообразных веществ. Реализуется зта способность через «биоспецифическое узнавание» , приводит к связыванию молекулы субстрата с белком и в итоге обеспечивает протекание химической реакции. Высокой специфичностью обладают также белки, которые участвуют в таких процессах, как деление, дифференцировка клеток и развитие живых организмов, определяя их биологическую индивидуальность.

ФУНКЦИИ БЕЛКОВ К главным, и в некотором смысле уникальным биологическим функциям белков, несвойственным или лишь частично присущим другим классам биополимеров относятся следующие функции. § Структурная (опорная) функция § Ферментативная (каталитическая) функция § Рецепторная и гормональная функция § Транспортная функция § Резервная (питательная) функция § Сократительная функция § Защитная функция § Функции белков крови

ФУНКЦИИ БЕЛКОВ СТРУКТУРНАЯ (ОПОРНАЯ) ФУНКЦИЯ Белки, выполняющие структурную функцию, преобладают среди других белков тела человека. Фибриллярные белки формируют вещество соединительной ткани — коллаген, эластин (в сосудистой стенке сосудов эластического типа), кератин (в коже и её производных элементах), протеогликаны. Большое значение имеют комплексы белков с углеводородами в формировании ряда секретов: мукоидов, муцина и т. д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток. Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) — спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин A (интегральный, фиксирует спектрин на поверхности). Также к данной функции можно отнести участие белка в создании таких органелл, как рибосомы.

ФУНКЦИИ БЕЛКОВ ФЕРМЕНТАТИВНАЯ (КАТАЛИТИЧЕСКАЯ) ФУНКЦИЯ Все ферменты являются белками, которые определяет скорость химических реакций в биологических системах. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, то есть рибонуклеиновой кислоты, обладающей каталитической активностью, и абзимов — и моно- и поликлональных антител.

ФУНКЦИИ БЕЛКОВ РЕЦЕПТОРНАЯ И ГОРМОНАЛЬНАЯ ФУНКЦИЯ Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками или полипептидами, например, инсулин и глюкагон. Однако, некоторые гормоны являются производными аминокислот.

ФУНКЦИИ БЕЛКОВ ТРАНСПОРТНАЯ ФУНКЦИЯ Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы. Транспорт веществ через мембраны осуществляют белки — Na+, К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са 2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.

ФУНКЦИИ БЕЛКОВ РЕЗЕРВНАЯ (ПИТАТЕЛЬНАЯ) ФУНКЦИЯ Эту функцию выполняют так называемые резервные протеины. В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина (овальбумина). У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. Основной белок молока (казеин) также выполняет главным образом питательную функцию.

ФУНКЦИИ БЕЛКОВ СОКРАТИТЕЛЬНАЯ ФУНКЦИЯ Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл. Главную роль в процессах движения играют актин и миозин — специфические белки мышечной ткани, и белок цитоскелета тубулин, что обеспечивает тончайшие процессы жизнедеятельности клеток — расхождение хромосом в процессе митоза.

ФУНКЦИИ БЕЛКОВ ЗАЩИТНАЯ ФУНКЦИЯ Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента, пропердин, при повреждении тканей работают белки свертывающей системы крови — например, фибриноген, протромбин, антигемофильный глобулин. В результате свертывания образуется сгусток крови, предохраняющий от потери крови при ранениях. Механическую защиту и поддержку клеток осуществляют протеогликаны.

ФУНКЦИИ БЕЛКОВ КРОВИ Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% общего белка составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах. В регуляции содержания белков плазмы на определенном уровне большое значение имеет печень, которая полностью синтезирует фибриноген и альбумины крови, большую часть α- и βглобулинов, клетки ретикулоэндотелиальной системы костного мозга и лимфатических узлов.

ФУНКЦИИ БЕЛКОВ КРОВИ Белки плазмы крови выполняют несколько важных функций: • поддерживают постоянство коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств — в первую очередь, альбумины; • Белковая буферная система участвует в поддержании кислотноосновного состояния — альбумины, гемоглобин; • удерживают в связанном состоянии и транспортируют ионы кальция, магния, железа, меди и другие ионы, препятствуя их потере с мочой — альбумины и специфические транспортные белки; • связывают и транспортируют органические вещества (углеводы, липиды, гормоны, лекарства, витамины, токсины) — альбумины и другие белки;

ФУНКЦИИ БЕЛКОВ КРОВИ • определяют вязкость крови и сохраняют устойчивость эритроцитов и лейкоцитов в кровотоке, обеспечивают нормальный кровоток в капиллярах (реологические свойства крови) — белки свертывающей системы; • являются резервом аминокислот; • специализированные белки, участвующие в свертывании крови (фибриноген, протромбин, антигемофильный глобулин и др. ); • обеспечивают иммунную защиту организма — иммуноглобулины, факторы системы комплемента, трансферрин и пропердин; • обеспечивают неспецифическую защиту организма при повреждении тканей — белки острой фазы.

ФУНКЦИИ БЕЛКОВ НАРИСОВАТЬ СХЕМУ СТРУКТУРНАЯ (ОПОРНАЯ) ФУНКЦИЯ ФЕРМЕНТАТИВНАЯ (КАТАЛИТИЧЕСКАЯ) ФУНКЦИЯ РЕЦЕПТОРНАЯ И ГОРМОНАЛЬНАЯ ФУНКЦИЯ ТРАНСПОРТНАЯ ФУНКЦИЯ РЕЗЕРВНАЯ (ПИТАТЕЛЬНАЯ) ФУНКЦИЯ СОКРАТИТЕЛЬНАЯ ФУНКЦИЯ ЗАЩИТНАЯ ФУНКЦИИ БЕЛКОВ КРОВИ

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ Для подробного исследования физико-химических и биологических свойств белков, а также для изучения их химического состава и структуры непременным условием является получение белков из природных источников в химически чистом, гомогенном состоянии. Последовательность операций по выделению белков обычно состоит в следующем: измельчение биологического материала (гомогенизация); извлечение белков, точнее, перевод белков в растворенное состояние (экстракция); выделение исследуемого белка из смеси других белков, т. е. очистка и получение индивидуального белка.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ Белковые вещества весьма чувствительны к повышению температуры и действию многих химических реагентов (органические растворители, кислоты, щелочи). Поэтому обычные методы органической химии, применяемые для выделения того или иного вещества из смеси (нагревание, перегонка, возгонка, кристаллизация и др. ), в данном случае неприемлемы. Белки в этих условиях подвергаются денатурации, т. е. теряют некоторые существенные природные (нативные) свойства, в частности растворимость, биологическую активность. Разработаны эффективные методы выделения белков в «мягких» условиях, при низкой температуре (не выше 4°С), с применением щадящих нативную структуру химических реагентов.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ГОМОГЕНИЗАЦИЯ БИОЛОГИЧЕСКОГО МАТЕРИАЛА Перед выделением белков из биологических объектов (органы и ткани животных, микроорганизмы, растения) исследуемый материал тщательно измельчают до гомогенного состояния, т. е. подвергают дезинтеграции вплоть до разрушения клеточной структуры. Эту процедуру, называемую гомогенизацией. Проводят её при помощи ножевых гомогенизаторов типа Уорринга или пестикового гомогенизатора Поттера – Эльвегейма. Для выделения ряда белков из плотных животных и растительных объектов часто используют валковые или шаровые мельницы. Успешно применяется также метод попеременного замораживания и оттаивания ткани, в основе действия которого лежит разрушение клеточной оболочки, вызванное кристаллами льда.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ГОМОГЕНИЗАЦИЯ БИОЛОГИЧЕСКОГО МАТЕРИАЛА а – пестиковый ручной гомогенизатор: 1 – пестик; 2 – корпус; 3 – мотор; 4 – штатив; б – механический гомогенизатор: 1 – корпус с электродвигателем и пусковым устройством; 2 – камера для измельчения материала; в – шаровая мельница: 1 – корпус с электродвигателем и пусковым устройством; 2 – камера для измельчения материала.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ГОМОГЕНИЗАЦИЯ БИОЛОГИЧЕСКОГО МАТЕРИАЛА Для дезинтеграции тканей используют также ультразвук, пресс-методы (замороженный биоматериал пропускают через мельчайшие отверстия стального пресса под высоким давлением) и метод «азотной бомбы» , при котором клетки (в частности, микробные) сначала насыщают азотом под высоким давлением, затем резко сбрасывают давление – выделяющийся газообразный азот как бы «взрывает» клетки.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ЭКСТРАКЦИЯ БЕЛКОВ Современные методы измельчения тканей обычно сочетают с одновременной экстракцией белков из гомогенатов тканей. Большинство белков тканей хорошо растворимо в 8 – 10%-ных растворах солей. При экстракции белков широко применяют различные буферные смеси с определенными значениями р. Н среды, органические растворители, а также неионные детергенты – вещества, разрушающие гидрофобные взаимодействия между белками и липидами и между белковыми молекулами. Из органических соединений широко используют растворы глицерина (давно) и слабые растворы сахарозы (особенно для солюбелизации). На растворимость белков при экстракции большое влияние оказывает р. Н среды, поэтому в белковой химии применяют фосфатные, цитратные, боратные буферные смеси со значениями р. Н от кислых до слабощелочных, которые способствуют как растворению, так и стабилизации белков.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ЭКСТРАКЦИЯ БЕЛКОВ Особенно широкое распространение получили трис-буферные системы, представляющие собой смеси 0, 2 М раствора трис-(оксиметил)аминометана (HOCH 2)3 CNH 2 (сокращенно обозначают «трис» ) с 0, 1 М раствором хлороводородной кислоты в разных соотношениях. Для выделения белков сыворотки крови используют способы их осаждения этанолом (метод Кона), ацетоном, бутанолом и их комбинации. Почти все органические растворители разрывают белоклипидные связи, способствуя лучшей экстракции белков. Для получения из биологического материала белков в чистом, гомогенном, состоянии применяют различные детергенты, способствующие расщеплению белок-липидных комплексов и разрыву белок-белковых связей. В частности, для освобождения белков (ферментов), прочно связанных с биомембранами митохондрий или других субклеточных структур, применяют тритон Х 100, додецилсульфат натрия и дезоксихолат натрия.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ЭКСТРАКЦИЯ БЕЛКОВ тритон Х-100 дезоксихолат натрия додецилсульфат натрия

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ После достижения полной экстракции белков, т. е. перевода белков в растворенное состояние, приступают к разделению – фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: высаливание, тепловую денатурацию, осаждение органическими растворителями, хроматографию, электрофорез, распределение в двухфазных системах, кристаллизацию и др.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Растворение белков в воде связано с гидратацией каждой молекулы, что приводит к образованию вокруг белковой глобулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. По химическим и физическим свойствам вода, входящая в состав гидратной оболочки, отличается от чистого растворителя. В частности, температура замерзания ее составляет – 40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы белков отличаются крайней неустойчивостью, и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солейщелочных металлов), а также под влиянием физических факторов (нагревание, облучение и др. ) наблюдаются дегидратация молекул белка и их выпадение в осадок.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Высаливание. При добавлении растворов солей щелочных и щелочноземельных металлов происходит осаждениебелков из раствора. Обычно белок не теряет способности растворяться вновь в воде после удаления солей методами диализа или гельхроматографии. Высаливанием белков обычно пользуются в клинической практике при анализе белков сыворотки крови и других биологических жидкостей, а также в препаративной энзимологии для предварительного осаждения и удаления балластных белков или выделения исследуемого фермента. Различные белки высаливаются из растворов при разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок при 50% насыщении) и альбуминов (выпадают при 100% насыщении).

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ На величину высаливания белков оказывают влияние не только природа и концентрация соли, но и р. Н среды и температура. Считают, что главную роль при этом играет валентность ионов. Действие разных ионов принято сравнивать не по молярной концентрации соли, а по так называемой ионной силе (μ), которая равна половине суммы произведений концентрации каждого иона (с) на квадрат его валентности (V): .

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Более тонкое разделение белков плазмы крови человека на фракции достигается при использовании различных концентраций этанол а при низкой температуре (от – 3 до – 5°С) по методу Кона. В этих условиях белкисохраняют свои нативные свойства. Указанным методом часто пользуются для получения отдельных фракций крови, используемых в качестве кровезаменителей. В последнее время наибольшее распространение получили хроматографические и электрофоретические методы разделения белков. Диаграмма фракционирования белков плазмы крови человека этанолом (по методу Кона).

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Хроматография. Принцип хроматографии, разработанный в 1903 г. русским ученым М. С. Цветом, основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке. В результате происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают подходящие элюенты, которые ослабляют силы адсорбции и выносят с током раствора индивидуальные вещества. Последние последовательно собирают в коллекторе фракций (принцип сорбции-десорбции).

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Чрезвычайно эффективным средством фракционирования белков из смеси оказалась колоночная хроматография с гидроксилапатитом, различными ионообменными смолами и производными целллюлозы в качестве носителей. При выделении и очистке белков используют четыре основных типа хроматографии: адсорбционную, распределительную, ионообменную и аффинную (хроматография по сродству) – в соответствии с разными физическими и химическими механизмами, лежащими в основе каждого из них. Хроматография широко применяется не только для выделения белков, но и для разделения множества других органических и неорганических веществ, входящих в состав живых организмов.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Адсорбционная хроматография. Разделение компонентов смеси (образца) основано на их различной сорбируемости на твердом адсорбенте. В качестве адсорбентов используют активированный древесный уголь, гель фосфата кальция, оксиды алюминия или кремния. Адсорбент в виде суспензии с растворителем (чаще всего буферным раствором) вносят в стеклянную вертикальную трубку (колонку) и равномерно в ней упаковывают. Образец в небольшом объеме растворителя наносят на колонку – аппаратура рассматриваются в практических руководствах по биохимии).

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Абсорбционная хроматография (схема). Разделение двух разных веществ (А и В), перемещающихся по колонке с разной скоростью. 1 - нанесение образца на колонку; 2 -середина опыта; 3 - окончание опыта.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Компоненты разделяемой смеси адсорбируются на адсорбенте. Затем приступают к стадии освобождения – десорбции компонентов из колонки, применяя подходящие элюенты. Сбор фракций осуществляют при помощи автоматического коллектора фракций.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Распределительная хроматография. В отличие от адсорбционной твердая фаза служит только опорой (основой) для стационарной жидкой фазы. Один из типов распределительной хроматографии, как и адсорбционная, осуществляется на колонках, в которых в качестве стационарной фазы применяют влажный крахмал или силикагель. Образец растворяют в подходящем растворителе, затем наносят на колонку; разделяемые вещества, подвергающиеся многократному распределению между неподвижной стационарной фазой (водный слой) и движущейся фазой органического растворителя, с разной скоростью перемещаются ко дну колонки. Собранные при помощи коллектора фракции пробы, содержащие одно вещество, соединяют для выделения этого вещества в чистом виде.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Разновидностью распределительной хроматографии является хроматография на бумаге, широко используемая в биохимических лабораториях, в том числе клинических, для разделения пептидов, аминокислот и других веществ. В качестве стационарной фазы при этом служит вода, адсорбированная целлюлозными цепями фильтровальной бумаги. Образец помещают на одном конце бумажной полосы, этим же концом бумагу погружают в подходящую смесь органических растворителей (например, бутанол–уксусная кислота–вода в определенных соотношениях). При движении растворителя по бумаге благодаря силе капиллярности происходит разделение компонентов смеси. Проявленную хроматограмму высушивают, а местоположение каждого из разделяемых веществ определяют химическими или физико-химическими методами.
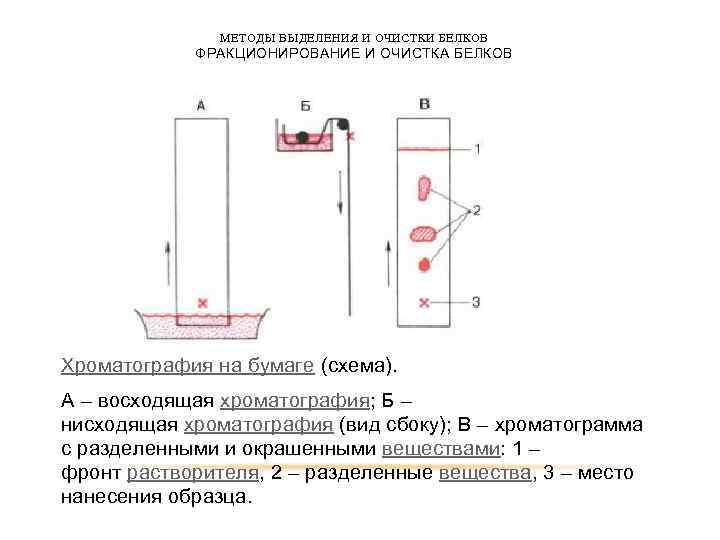
МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Хроматография на бумаге (схема). А – восходящая хроматография; Б – нисходящая хроматография (вид сбоку); В – хроматограмма с разделенными и окрашенными веществами: 1 – фронт растворителя, 2 – разделенные вещества, 3 – место нанесения образца.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Ионообменная хроматография. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен. Различают положительно заряженные анионообменники, представленные органическими основаниями и аминами, и отрицательно заряженные катионообменники, содержащие фенольные, сульфо- или карбоксильные группы. Из сильно- и слабоосновных анионообменников чаще используют производные полистирола и целлюлозы, несущие функциональные группы:

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Аналогичные функциональные группы содержат триэтиламиноэтил (ТЭАЭ)- и аминоэтил (АЭ)-целлюлозы. Катионообменники представлены сульфонированными полистиролами (производные винилбензола илидивинилбензола) и карбоксиметилцеллюлозой, имеющими следующие функциональные группы:

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ В зависимости от заряда разделяемых белков используют подходящую ионообменную смолу, с функциональными группами которой обменивается и задерживается на колонке часть белков, в то время как другие белкибеспрепятственно элюируются с колонки. «Осажденные» на колонке белки снимают с колонки, применяя более концентрированные солевые растворы или изменяя р. Н элюента. Новейшие методы ионообменной хроматографии, в частности высокоэффективная жидкостная хроматография (ВЭЖХ), широко используются в фармакологии (при создании и определении лекарственных веществ), в клинической биохимии (при определении биологически активных веществ в физиологических жидкостях), в биотехнологических процессах и производствах и других областях: они позволяют определять вещества в нано-, пико- и фемтаграммных количествах.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Аффинная хроматография (хроматография по сродству). Основана аффинная хроматография на принципе избирательного взаимодействия белков (или других макромолекул) с закрепленными (иммобилизованными) на носителе специфическими веществами – лигандами, которыми могут быть субстраты или коферменты (когда выделяют какой-либо фермент), антигены (или антитела), гормоны или рецепторы и т. д. Благодаря высокой специфичности белков к иммобилизованному лиганду, связанному с носителем (которым заполняют хроматографическую колонку), присоединяется только один какой-либо белок из смеси. Снятие с колонки этого белкаосуществляют элюированием буферными смесями с измененным р. Н или измененной ионной силой, а также введением в состав элюента детергентов, ослабляющих связи между белками и лигандами. Несомненным достоинством метода является возможность одноэтапно выделить заданный белок или другой биополимер высокой степени чистоты. При помощи аффинной хроматографии, например, удалось сравнительно легко выделить очищенные препараты аминоацил-т. РНК-синтетаз на полиакрилгидразидагаровом геле, к которому в качестве лигандов были присоединены определенные т. РНК (транспортные РНК).

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Гель-хроматография. В препаративных целях, особенно при очистке белков от примесей, широко используют метод молекулярных сит, или гель-хроматографию. При обработке эпихлоргидрином полисахарида декстрана образуются различной степени выраженности поперечные связи, приводящие к формированию крупных гидрофильных зерен, нерастворимых в воде и называемых сефадексами. Благодаря большому сродству к воде зерна сильно набухают в водной среде с образованием геля, которым заполняют хроматографическую колонку. Разделение веществ этим методом основано на том, что большие молекулы не проникают во внутреннюю водную фазу геля, являющуюся стационарной, и остаются снаружи, двигаясь вместе с подвижной фазой вниз вдоль колонки; небольшие молекулы, напротив, свободно диффундируют внутрь зерен, образуя равновесную систему между подвижной и стационарной фазами, и соответственно с меньшей скоростью двигаются вдоль колонки. Обычно момент появления веществ в вытекающем из колонки с сефадексом элюенте выражают формулой: V=V 0+KVi

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ где V – объем элюирующей жидкости вещества с данным К, мл; V 0 – свободный объем колонки или общий объем внешнего растворителя (вне зерен геля), мл; Vi – объем растворителя внутри геля, мл; K – коэффициент распределения для растворенного вещества между растворителем внутри зерен геля и окружающим растворителем. Если анализируемую пробу, содержащую одно растворенное вещество с К = 1 и второе с К = 0, внести в колонку с сефадексом, то второе вещество появится в элюирующей жидкости сразу после выхода из колонки V 0 , а первое – только после выхода объема V 0+ Vi. Поскольку молекулы белков, обладающие большими молекулярной массой и размерами, не диффундируют внутрь зерен сефадекса, они первыми вымываются из колонки после выхода свободного объема колонки V 0, в то время как все остальные вещества (включая низкомолекулярные примеси) вымываются после выхода объема, равного V 0+ К • Vi. Метод нашел широкое применение в препаративной энзимологии. С помощью сефадекса можно разделить белки с разной молекулярной массой.
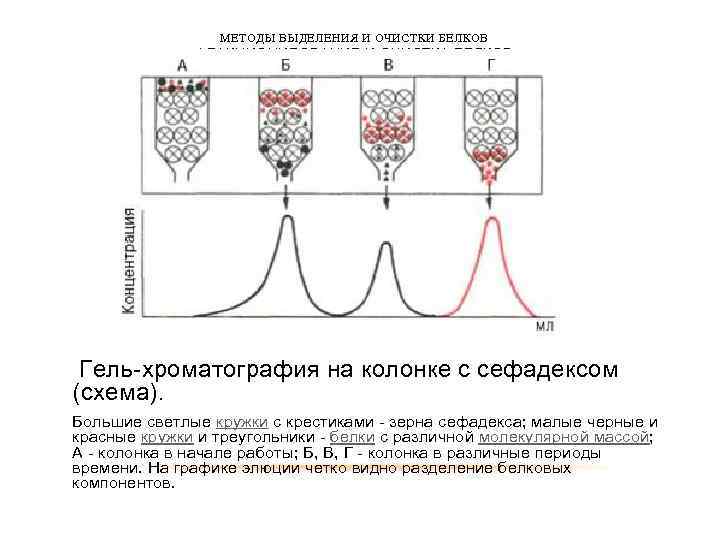
МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Гель-хроматография на колонке с сефадексом (схема). Большие светлые кружки с крестиками - зерна сефадекса; малые черные и красные кружки и треугольники - белки с различной молекулярной массой; А - колонка в начале работы; Б, В, Г - колонка в различные периоды времени. На графике элюции четко видно разделение белковых компонентов.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Электрофорез. Метод свободного электрофореза, детально разработанный лауреатом Нобелевской премии А. Тизелиусом, основан на различии в скорости движения (подвижности) белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях р. Н и ионной силы раствора. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества их по сравнению с методом свободного электрофореза состоят в том, что исключается размывание границы белок-растворитель в результате диффузии и конвекции, не требуется налаживания сложной аппаратуры для определения положения границы, а для анализа необходимо небольшое количество белка (подробно эти методы и соответствующая аппаратура рассматриваются в практических руководствах по биохимии).

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Одним из наиболее распространенных методов фракционирования белков (как и методов оценки гомогенности) является диск-электрофорез (от англ. discontinuous – прерывистый, перемежающийся) в полиакриламидном геле, при котором используют пары буферных растворов с различными значениями р. Н и разной степени пористости гель. Следует отметить высокую разрешающую способность гель-электрофореза. Если при электрофорезе белков сыворотки крови человека на бумаге открываются всего 6 фракций, то при электрофорезе в крахмальном геле – 10, а в полиакрил-амидном геле – до 18 разных белковых фракций.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Для выявления белков при электрофорезе в гелях их обрабатывают одним из следующих красителей: бромфеноловым синим, амидо черным 10 В, кислотным синим 83, кумасси бриллиантовым голубым R-250 и др. Интенсивность окраски и соответственно относительное содержание каждой белковой фракции обычно определяют денситометрически путем прямого сканирования на денситометре. В последние годы стали применять методы электрофореза белков с градиентом концентрации геля, что значительно повышает разрешающую способность, особенно при фракционировании белков с высокой молекулярной массой, превышающей 50000– 100000.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ Весьма перспективными методами разделения белков (как и определения ряда физико-химических свойств) оказались разные варианты метода изоэлектрического фокусирования – изотахофореза, основанные на проведении электрофореза в поддерживающих средах (на колонке или в тонком слое) с градиентом р. Н. Точное местоположение на колонке каждого белка из смеси определяется значением его изоэлектрической точки, т. е. состоянием, при котором суммарный электрический заряд белковой частицы при данном значении р. Н равен нулю. При использовании метода изоэлектрического фокусирования применяют смеси синтетических полиаминополикарбоновых кислот (амфолины) для создания градиента р. Н в диапазоне от 3, 0 до 10, 0. В последние годы широкое распространение для фракционирования белков получили различные сочетания изоэлектрофокусирования и диск-электрофореза в полиакриламидном геле – методы двухмерного электрофореза, которые позоляют параллельно анализировать сотни и даже тысячи белковых фракций.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ ОТ НИЗКОМОЛЕКУЛЯРНЫХ ПРИМЕСЕЙ Применение в определенной последовательности ряда перечисленных методов позволяет получить белок в очищенном состоянии, не лишенный, однако, некоторых примесей солей. Для полного освобождения белков от низкомолекулярных примесей в настоящее время используют методы диализа, гельхроматографии, кристаллизации, ультрафильтрации. При диализе применяют полупроницаемые мембраны (целлофан, коллодийная пленка), диаметр пор которых варьирует в широких пределах. Белки, как правило, не диффундируют через такую мембрану, в то время как низкомолекулярные вещества легко проникают через нее в окружающую среду.

МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ ФРАКЦИОНИРОВАНИЕ И ОЧИСТКА БЕЛКОВ ОТ НИЗКОМОЛЕКУЛЯРНЫХ ПРИМЕСЕЙ Метод кристаллизации белков основан на достижении критической точки начала осаждения белка из раствора сульфата аммония при медленном повышении температуры. Уже получены сотни кристаллических белков. Однако не всякий кристаллический белок является гомогенным, поскольку при одной и той же концентрации раствора сульфата аммония могут кристаллизоваться близкие по размерам и массе разные белки. Наилучшие результаты при освобождении белков от низкомолекулярных примесей получают с помощью гельхроматографии и ультрафильтрации. Последняя основана на продавливании растворов белка через специальные мембраны, задерживающие белковые молекулы, что позволяет не только освободить белковые растворы от низкомолекулярных примесей, но и концентрировать их.

БЕЛКИ Белками, или белковыми веществами, называют высокомолекулярные органические соединения, молекулы которых построены из остатков αаминокислот, связанных между собой пептидными связями. Природные белки формируются исходя из 21 аминокислоты. В состав молекул большинства белков входит по 300 – 500 аминокислотных остатков, может достигать иногда и нескольких тысяч. Белки можно рассматривать как биополимеры. Эти полимеры не регулярны по своему составу. 50

α-аминокислоты участвуют в синтезе белка. В состав белковых тел входят и такие аминокислоты, которые кроме аминогрупп содержат и другие функциональные группы. По своей значимости для организма все аминокислоты делятся на: § Заменимые (синтезируются в организме) § Не заменимые (запас пополняется только с пищей) 51

Формула Название По номенклатуре тривиальное Усл. Об. α-аминоуксусная Глицин гли α-аминопропионовая Аланин Ала α-аминоизовалериановая Валин вал α-аминоизокапроновая Лейцин лей Втор. бутил –αаминоуксусная Изолейцин иле 52

α-аминоянтарная Аспарагиновая кислота аспарагин α-аминоглутаровая асп асн Глутаминовая кислота глутамин глн 53

α, εдиаминока проновая кислота лизин лиз α-амино-δгуанидовал ериановая аргинин АРГ α-амино-βоксипропио новая серин сер α-амино-βоксимаслян ая треонин тре β-тио-αаминопропи оновая цистеин цис 54

α-амино-γметилтио масляная метионин α-амино-βфенилпропи Фенилалан оновая ин кислота β-поксифенил-α аминопропа новая тирозин мет фен тир 55

β-имидозолил αаланин гистидин гис β-индолил-αаланин триптофан три пролин про αпиролидинкарбо нова кислота селеноцисте ин 56

Помимо наличия в большинстве природных белков двадцати аминокислот, в некоторых белках обнаружены производные аминокислот: - Оксипролин и оксилизин содержатся в белке соединительной ткани коллагене; -Дийодтирозин является основой структуры гормонов щетовидной железы: - Фосфосерин и фосфотреонин входят в состав сложных белков – фосфопротеинов; - ε-N-метиллизин обнаружен в составе мышечного белка – миозина. Кроме того в состав некоторых белков типа кератина входит цистин.

цистин цин оксипролин оксилизин 3, 5 дийодтирозин 58
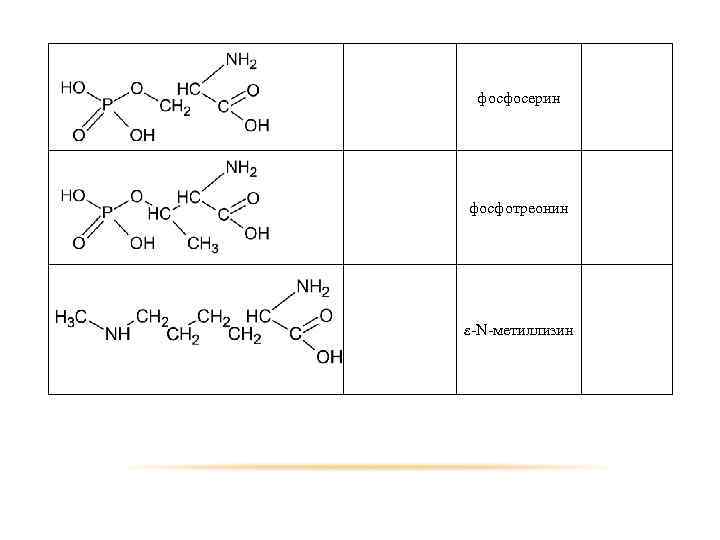
фосфосерин фосфотреонин ε-N-метиллизин 59

БЕЛКИ Структура белков очень сложная. Аминокислотные остатки в молекуле белка связаны пептидными связями и образуют пептидные цепи. 60

БЕЛКИ Следует отметить, что почти все α-аминокислоты (кроме глицина) оптически активны и имеют по меньшей мере по одному ассиметрическому атому углерода. При гидролизе природных белков, в условиях исключающих рацемизацию, образуются L-аминокислоты. L- аминокислоты, биологически активны (горькие на вкус), D-аминокислоты не принимают участия в построении белка, (сладкие на вкус) 61

БЕЛКИ Отдельные пептидные цепи или их участки могут быть связаны между собой дисульфидными , солевыми или водородными связями. Солевые связи образуются между свободными аминогруппами (например, концевая аминогруппа, расположенная на одном конце полипептидной цепи или ε-аминогруппа лизина) и свободными карбоксильными группами (концевая карбоксильная группа цепи или свободные карбоксильные группы двухосновных аминокислот); Водородные связи могут возникать между атомом кислорода карбонильной группы и атомом водорода аминогруппы, а также за счет гидроксогрупп оксиаминокислот и кислорода пептидных групп. 62

БЕЛКИ Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул. Первичная структура - определенная последовательность аминокислотных остатков в полипептидной цепи. Связи между аминокислотами ковалентные, а следовательно очень прочные 63

БЕЛКИ Вторичная структура - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. • Модели вторичной структуры - a-спираль (левозакрученные и правозакрученные), а также β-листы. 64

ФИЗИЧЕСКИЕ ПОКАЗАТЕЛИ ΑСПИРАЛИ

ФИЗИЧЕСКИЕ ПОКАЗАТЕЛИ ΑСПИРАЛИ

Β-СТРУКТУРЫ (СЛОИ)

Β-СТРУКТУРЫ (СЛОИ)

БЕЛКИ Третичная структура – это пространственное строение, включая конформацию, всей молекулы белка, состоящей из единой цепи. Особое свернутое состояние молекулы белка. 69

БЕЛКИ 70

СВЯЗИ, ПОДДЕРЖИВАЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ БЕЛКОВОЙ МОЛЕКУЛЫ • Ковалентные связи между двумя остатками цистеина – дисульфидные мостики; • Ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; • Водородные связи; • Гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированными от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.

1 - ИОННЫЕ СВЯЗИ; 2 - ВОДОРОДНЫЕ СВЯЗИ; 3 - ГИДРОФИЛЬНО-ГИДРОФОБНЫЕ ВЗАИМОДЕЙСТВИЯ; 4 - ДИСУЛЬФИДНЫЕ МОСТИКИ.

БЕЛКИ Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы) 73

БЕЛКИ Все белки, независимо от того к какой группе они относятся и какие функции выполняют, построены из относительно небольшого набора (обычно 20 (21)) аминокислот, которые расположены в различной, но всегда строго определенной для данного вида белка последовательности. Белки подразделяют на протеины и протеиды. Ø Протеины – простые белки, состоящие только из остатков аминокислот. ü Альбумины – обладают сравнительно небольшой молекулярной массой, хорошо растворимы в воде, при нагревании свертываются. 74

БЕЛКИ ü Глобулины – не растворимы в чистой воде, но растворимы в теплом 10%-ном растворе Na. Cl. ü Проламины – незначительно растворимы в воде, но растворимы в 60÷ 80%-ном водном этиловом спирте. ü Глютелины – растворимы только в 0, 2%-ной щелочи. ü Протамины – совершенно не содержат серы. ü Пртеиноиды – нерастворимые белки. ü Фосфопротеины – содержат фосфорную кислоту (козеин). 75

БЕЛКИ Ø Пртеиды – сложные белки, в состав которых наряду с аминокислотами входят углеводы, липиды, гетероциклические соединения, нуклеиновые кислоты, фосфорная кислота. ü Липопротеиды – гидролизуются на простой белок и липиды. (зерна хлорофила, протоплазма клеток). ü Гликопротеиды – гидролизуются на простые белки и высокомолекулярные углеводы. (слизистые выделения животных). ü Хромопротеиды – гидролизуются на простые белки и красящие вещества (гемоглобин) ü Нуклеопротеиды – гидролизуются на простые белки (обычно протамины) и нуклеиновые кислоты 76

ГОМОЛОГИЧЕСКИЙ РЯД 2 -аминоэтановая α-аминоуксусная глицин 2 -аминопропановая α-аминопропионовая α-аланин 3 -аминопропановая β-аминопропионовая β-аланин 2 -аминобутановая α-аминомасляная 3 -аминобутановая β-аминомасляная 4 -аминобутановая γ-аминомасляная 77
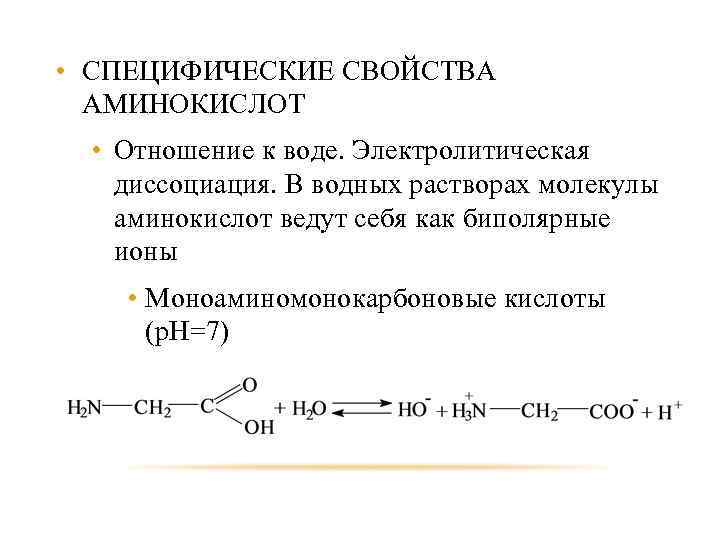
• СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ • Отношение к воде. Электролитическая диссоциация. В водных растворах молекулы аминокислот ведут себя как биполярные ионы • Моноаминомонокарбоновые кислоты (р. Н=7) 78

• СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ • Отношение к воде. • Диаминомонокарбоновые кислоты (р. Н>7) 79

• СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ • Отношение к воде. • Моноаминодикарбоновые кислоты (р. Н<7) 80

В кристаллическом виде α-аминокислоты прибывают в состоянии цвиттериона 81

Белок можно создать искусственно. Чтобы соединить две аминокислоты пептидной связью, необходимо: а) защитить карбоксильную группу одной кислоты (например: превратив её в эфирную) и аминогруппу другой кислоты (ацелированием); б) образовать пептидную связь; в) снять защитные группы, обычно реакцией гидролиза, но в таких условиях, что бы не пострадала пептидная связь. 82
Белки 20102017.ppt